2. 410031 长沙,中南大学生命科学学院分子生物学研究中心;
3. 410028 长沙,中南大学湘雅公共卫生学院;
4. 400013 重庆,重庆市人民医院甲状腺乳腺外科
2. Center of Molecular Biology, School of Life Sciences of Central South University, Changsha, Hunan Province, 410031;
3. Xiangya School of Public Health, Central South University, Changsha, Hunan Province, 410028;
4. Department of Thyroid and Breast Surgery, Chongqing People's Hospital, Chongqing, 400038, China
卵巢癌(ovarian cancer,OC)是一种常见的妇科恶性肿瘤,其发病率仅较子宫体癌低,位于第2位。2020年全球有313 959例女性患卵巢癌,其中207 252例病死[1]。由于早期诊断困难,易复发且耐药,其病死率在妇科恶性肿瘤中列首位[2]。手术和化疗是卵巢癌的传统治疗手段。即使手术技巧和化疗方案不断改进,其5年生存率仍低于50%。为改善这一现状,研究人员一直致力于探寻能有效提高卵巢癌患者生存率的治疗方法。
蛋白的翻译后修饰在蛋白功能的调节中发挥着至关重要的作用。蛋白激酶作为最大的与进化相关蛋白家族,通过磷酸化其下游目的蛋白的特定氨基酸位点,进而调控包括细胞生长、分化、增殖和凋亡等一系列复杂的生物过程[3]。其异常引起了包括肿瘤在内的多种疾病,因此,激酶成为治疗肿瘤等多种疾病的重要靶点。丝氨酸/苏氨酸激酶(serine threonine kinase,STK)作为调节细胞生物过程的最大一组激酶,是潜力巨大的治疗癌症的靶点,MAPK、MER、AKT等激酶在内的STK在包括卵巢癌等多种肿瘤中过度活化。国内外STK抑制剂治疗卵巢癌的多项研究已成为研究热点。但是现有STK抑制剂的副作用较大且效果不理想[4-5]。探寻有效的STK治疗靶点或许能给卵巢癌患者带来新的生机。
WNK(with no lysine kinases)激酶是近20余年才被发现的一类STK,其特征是结构域Ⅱ中缺乏赖氨酸。此前研究发现,激酶结构域Ⅱ中的赖氨酸是结合腺嘌呤核苷三磷酸(adenosine triphosphate, ATP)的位点,此赖氨酸突变会导致激酶活性的散失。而WNK激酶的赖氨酸缺失不仅没有影响WNK激酶的活性,反而有研究表明该激酶调控多种生物过程[6]。WNK激酶通过调节Wnt、MEKK2/3、β-catenin、TGF-β、PI3K-AKT、NF-κB和AKT5信号传导途径促进肿瘤发生发展[7-9]。WNK2是位于染色体9q22.31上的一个具有多个结构域的细胞质蛋白, 其相对分子质量为243×103[10]。在结肠癌、胰腺癌、脑膜瘤等肿瘤发生发展中起着举足轻重的作用。研究人员不仅在多种肿瘤中发现表观遗传学修饰导致的WNK2沉默,而且该激酶可以抑制细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)等重要通路影响肿瘤细胞的恶性生物学行为[11-13]。然而,其在卵巢癌中的功能和调控机制研究仍为空白。为了探究该激酶在卵巢癌中的作用,本研究借助蛋白质磷酸化修饰组学质谱技术,分析WNK2在卵巢癌中调控的靶标及生物过程,从而为卵巢癌的治疗提供新的靶点。
1 材料与方法 1.1 实验试剂人卵巢癌细胞株SKOV3购自ATCC官网;RPMI-DMEM细胞培养基,胎牛血清购自Gibico公司;双抗(链霉素+青霉素)购自重庆衍庆生物技术有限公司;WNK2、vimentin、p-vimentin一抗购自Abcam公司;抗兔二抗自于CST公司;TRIzol试剂购自TaKaRa公司;RIPA、Cocktail、Loading buffer等购自碧云天公司;RT-PCR试剂盒购自诺维赞公司;转染试剂lipo3000由赛默飞世尔科技有限公司提供;sh-WNK2由广州锐博生物科技有限公司构建合成,序列为CAAGGACAATGGAGCCATA;慢病毒由擎科生物技术有限公司包装合成;WNK2过表达质粒由上海吉凯基因科技有限公司提供。
1.2 实验仪器荧光显微镜为日本东京生产的奥林巴斯BX53;Bio-Rad PCR仪CFX96产于美国伯乐公司;VILBER荧光化学发光成像系统购自博康美华生物科技有限公司。
1.3 实验方法 1.3.1 细胞培养配置完全培养基:在DMEM中加入10%的胎牛血清、1%双抗(链霉素+青霉素)。用于培养卵巢癌细胞株SKOV3、CAOV3。并且保证细胞培养箱是恒温37 ℃、CO2比例为5%的湿润环境。
1.3.2 si-RNA转染CAOV3、SKOV3细胞培养于6孔板中,培养24 h后细胞密度约为50%。分别取5 μL siRNA (20 μmol/L)或5 μL Lipo3000加入500 μL的Optimem培养基中,轻轻混匀静置5 min后,将转染试剂和siRNA混合,静置20 min后,将混合液加入6孔板中。
1.3.3 质粒转染CAOV3、SKOV3细胞培养于6孔板中,培养24 h后细胞密度约为50%,换无血清培养基。分别取3 μg质粒或5 μL lipo3 000加入500 μL的optimem培养基中,轻轻混匀静置5 min后,将转染试剂和质粒混合,静置20 min后,将混合液加入6孔板中,6 h后换完全培养基培养。
1.3.4 建立稳定转染株将慢病毒加入6孔板培养的SKOV3细胞中,保证MOI大于30。48 h后换加入2 μg/mL嘌呤霉素的新鲜培养基进行药筛。24 h后,细胞出现死亡。随后将嘌呤霉素浓度调至1 μg/mL。待细胞生长约14 d左右,对照组和WNK2敲低的稳转株建成,荧光显微镜下观察感染效率>90%。
1.3.5 RT-qPCR用TRIzol试剂提取RNA后进行逆转录和RNA检测。PCR扩增步骤如下:95 ℃ 3 min,95 ℃ 10 s,57 ℃ 30 s(39个循环),65 ℃ 5 s,95 ℃ 0.5 s。WNK2和GAPDH的引物由擎科生物技术有限公司合成,引物序列见表 1。
| 基因名称 | 引物序列(5′-3′) | 产物长度/bp |
| WNK2 | 上游:5′-TGGTTCATCATCTGTCCG-3′ | 149 |
| 下游:5′-AAGCTGGGTTGTTCCTT-3′ | ||
| GAPDH | 上游:5′-AGCCACATCGCTCAGACAC-3′ | 91 |
| 下游:5′-TTAAAAGCAGCCCTGGTGAC-3′ |
1.3.6 Western blot
蛋白样品定量后,取40 μg总蛋白进行电泳(浓缩胶:恒压80 V,分离胶:恒压130 V)。待蛋白样品跑至最底部,提前用甲醇活化PVDF膜,采用湿转方法将蛋白转至PVDF膜上。5%脱脂牛奶封闭PVDF膜2 h后,4 ℃,孵育1抗(1∶1 000)过夜。次日,用TBST洗膜3次,每次10 min。再于室温下孵育二抗1 h。TBST洗膜3次,每次5 min,最后显影。GAPDH作为内参。根据条带灰度值,对目的蛋白的表达进行定量分析。
1.3.7 磷酸化修饰组学测序分析磷酸化修饰组学测序及生物信息学分析均由杭州景杰生物科技股份有限公司完成。
1.3.8 细胞骨架染色细胞转染过表达质粒48 h后,用罗丹明标记鬼笔环肽进行细胞骨架染色。PBS清洗细胞2次,甲醇固定细胞10 min。接着Triton X-100透化处理细胞5 min,室温避光孵育鬼笔环肽30 min,最后用DAPI染细胞核3 min。每步间隙用PBS清洗细胞3次,每次10 min。最后荧光显微镜下进行拍摄。
1.4 统计学分析采用SPSS 22.0统计软件进行分析,两个样品均值比较采用t检验,检验水准α=0.05。
2 结果 2.1 干扰WNK2的稳转细胞株建立干扰WNK2的SKOV3稳转细胞株建成之后,荧光显微镜下观察到对照组和干扰组细胞均有绿色荧光(图 1), 代表稳转株构建成功。

|
| 图 1 WNK2干扰稳转株绿色荧光蛋白表达 |
2.2 mRNA和蛋白水平验证WNK2的敲降效果
为了确保测序分析的有效性,采用RT-qPCR和Western blot实验检测样品中WNK2的敲降效果。如图 2所示,实验组相比对照组,WNK2被成功敲降。

|
| A: RT-qPCR检测WNK2在mRNA水平的敲降效果;B: Western blot检测WNK2在蛋白水平的敲降效果 图 2 稳转株中WNK2干扰效果的验证 |
质谱结果符合HCD碎裂方式和trypsin酶解的一般规律。大部分肽段由7~20个氨基酸组成。绝大多数谱图的一级质量误差在10以内,符合轨道阱质谱或飞行时间质谱的高精度特性。通过对肽段长度分布、母离子质量容差分布等指标质控来保证结果符合要求。本研究中质谱鉴定到的肽段长度分布符合质控要求。
2.3 数据质控样品重复性检测:蛋白定量重复性分析采用了皮尔森相关性(Pearson’s correlation coefficient)、相对标准差(RSD)和主成分分析(PCA),重复性分析结果表明样本符合统计学的一致性。
2.4 鉴定肽段和蛋白数总体情况经过数据过滤后,质谱检测产生的总谱图数为197 092个;有效谱图数为106 184个;鉴定出24 120个肽段,15 688个磷酸化修饰位点和12 768个修饰肽段的磷酸化发生变化,通过特异性肽段解析出了4 246个差异的磷酸化修饰蛋白。定量到3 814个差异的磷酸化修饰蛋白(图 3)。

|
| 图 3 WNK2干扰后差异肽段及蛋白数总体情况 |
鉴定出WNK2敲降后,1 078个磷酸化修饰位点和745个磷酸化修饰蛋白的磷酸水平显著下降,415个磷酸化磷酸化修饰位点和328个磷酸化修饰蛋白磷酸化水平显著上升(图 4)。

|
| 图 4 WNK2干扰后磷酸化差异蛋白热图 |
2.5 差异蛋白功能分类
将差异表达蛋白进行功能分类统计,从不同角度阐释差异蛋白的生物学作用。如图 5A所示,KOG功能分类表明,差异表达蛋白主要参与转录、RNA加工和修饰、信号传导、细胞骨架形成、胞间信号传递等过程。如图 5B示,GO分类表明,蛋白主要富集于细胞过程、生物调节、代谢过程、细胞组成、蛋白结合及催化等活动。亚细胞结构分类分析蛋白主要参与细胞核(62.36%)、细胞质(15.87%)构成。提示WNK2可能通过这些生物过程调控卵巢癌的发展。

|
| A: 差异蛋白功能COG/KOG分类;B:差异蛋白功能GO分类 图 5 差异蛋白功能分类 |
2.6 差异表达蛋白功能富集分析
通过富集分析发现差异表达蛋白有显著性的富集趋势,对进行差异蛋白显著富集的功能分类(图 6)。在生物过程中,差异蛋白主要富集在细胞骨架、超分子纤维形成等过程;并且主要参与胞质区、细胞壁超结构纤维、超结构聚合物、细胞结合、黏附连接处的形成;在分子功能方面,差异蛋白主要富集在骨架蛋白间的结合、Ras-GTPase结合、肌动蛋白结合等生物过程,并主要参与激酶结构域、PH域等结构域的形成。

|
| A: 差异表达蛋白富集的生物过程;B: 差异表达蛋白富集的结构域 图 6 磷酸化质谱测序差异表达蛋白富集分析 |
2.7 聚类分析
为了找出差异蛋白功能的相关性将差异表达的蛋白,根据其磷酸化差异表达倍数大小分成了4个部分,即Q1~Q4(图 7A)。分别对不同Q组的差异蛋白进行分子功能、细胞组成的富集,并进行聚类分析。

|
| A: 差异倍数分组(Q1~Q4); B: 差异蛋白细胞组成聚类分析;C: 差异蛋白分子功能聚类分析 图 7 磷酸化质谱测序差异蛋白的聚类分析 |
结果显示Q1区的蛋白主要富集于细胞微管、细胞外区的形成。Q2区的蛋白富集于胞质区、细胞极化生长区、细胞生长中心、细胞骨架,细胞间连接点等的形成。Q3区的蛋白富集于细胞核、细胞质运输膜、转移酶复合物、细胞质膜、细胞器膜等的形成(图 7B)。
分子功能聚类分析表明Q1区的差异蛋白主要参与真核起始因子结合、磷脂酰肌醇三磷酸结合、丝氨酸/苏氨酸激酶活性等分子过程。Q2区的蛋白富集于肌丝蛋白结合、骨架蛋白结合、cAMP反应元件结合等过程。Q3区的蛋白主要参与RNA聚合酶结合、GTP酶结合、核苷三磷酸酶结合、逆转录复合物结合等包括遗传物质复制在内的一系列生理活动。Q4区蛋白通过影响染色质DNA结合、蛋白磷酸酶1结合、Rho、Ras鸟苷酸交换因子活性等过程,参与了细胞功能的调控(图 7C)。
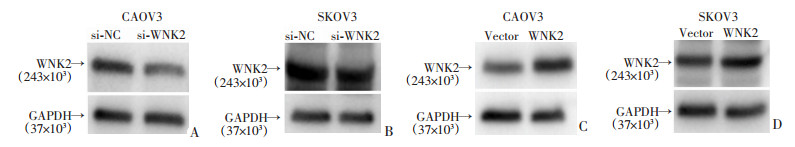
2.8 鬼笔环肽细胞骨架染色富集分析表明磷酸化差异蛋白主要参与细胞骨架的形成,故用罗丹明标记鬼笔环肽验证WNK2过表达对细胞骨架形成的影响。Western blot验证了在卵巢癌细胞系CAOV3和SKOV3中,WNK2被成功干扰和过表达(图 8)。WNK2结果显示,干扰WNK2后,卵巢癌细胞CAOV3、SKOV3细胞骨架断裂,排列杂乱无章。过表达WNK2引起细胞骨架重构,骨架排列有序(图 9)。细胞骨架的荧光染色表明了WNK2可能通过调节细胞骨架影响卵巢癌的发展。
|
| A: WNK2在CAOV3细胞中被成功敲降;B: WNK2在SKOV3细胞中被成功敲降;C: WNK2在CAOV3细胞中过表达;D: WNK2在SKOV3细胞中过表达 图 8 Western blot验证CAOV3、SKOV3中WNK2敲降和过表达的效果 |

|
| A: 敲降或过表达WNK2对CAOV3细胞骨架的影响;B敲降或过表达WNK2对SKOV3细胞骨架的影响 图 9 鬼笔环肽染色探究WNK2对CAOV3、SKOV3细胞骨架的影响 |
2.9 细胞骨架蛋白磷酸化水平变化
如图 10所示,Western blot实验证明WNK2的敲降导致了vimentin位点的磷酸化降低。WNK2的过表达引起vimentin位点的磷酸化增强。因此WNK2可能调控细胞骨架蛋白的磷酸化影响卵巢癌细胞的恶性生物学行为。

|
| A:在CAOV3细胞中WNK2的敲降引起p-vimentin(Ser 56)磷酸水平下降;B:在SKOV3细胞中WNK2的敲降引起p-vimentin(Ser 56)磷酸水平下降;C: 在CAOV3细胞中WNK2的过表达引起p-vimentin(Ser 56)磷酸水平上升;D: 在SKOV3细胞中WNK2的过表达引起p-vimentin(Ser 56)磷酸水平上升 图 10 Western blot验证WNK2对p-vimentin(Ser 56)磷酸水平的影响 |
3 讨论
由于卵巢癌恶性程度较高且进展迅速,大部分患者就诊时已是晚期[14]。为了改善这一现状,研究人员不断探寻新的治疗方法,但其病死率仍无明显改善。因此,研究卵巢癌的发病机制,寻找有效的治疗靶点,仍旧是国内外研究的热点问题。
WNK2是WNK激酶家族的一员,属于STK,它广泛表达于人体的多个组织器官。研究表明,WNK2的表观遗传沉默引起了脑膜瘤、肝癌等的发展,且进一步证明该激酶通过影响信号通路,如ERK-MAPK、Wnt/β-catenin通路的活化,影响肿瘤细胞的功能[15-16]。经过不断的探索,WNK2有望成为多个肿瘤的治疗靶点,然而面对卵巢癌的治疗现状,WNK2是否有潜力成为卵巢癌治疗靶点?针对这些问题,本课题组展开了研究。
本研究将卵巢癌细胞系SKOV3中的WNK2成功干扰后,进行蛋白质磷酸化修饰组学质谱分析。分析鉴定出24 120个肽段,15 688个蛋白磷酸化修饰位点和12 768个修饰肽段的磷酸化发生变化,解析出了4 246个,定量到3 814个差异的磷酸化修饰蛋白。其中,1 078个蛋白磷酸化修饰位点和745个磷酸化修饰蛋白的磷酸水平显著下降,415个蛋白磷酸化修饰位点和328个磷酸化修饰蛋白磷酸化水平显著上升。GO分类和KOG功能分类表明,磷酸化差异蛋白主要富集于细胞过程、生物调节等过程。参与转录、RNA加工和修饰、信号传导、细胞骨架形成、细胞间信号传递等活动。富集分析表明,WNK2敲降后,参与细胞骨架形成、超分子纤维等细胞成分形成和激酶结构域,PH域等形成的蛋白磷酸化水平降低。聚类分析表明,磷酸化差异蛋白组成细胞骨架、细胞生长中心、细胞间连接点等结构的形成。这些结构与肿瘤细胞的增殖和肿瘤恶性进程密不可分[17-19]。分子功能聚类分析表明,磷酸化差异蛋白参与肌丝蛋白结合、骨架蛋白结合、真核起始因子结合、磷脂酰肌醇三磷酸结合、逆转录复合物结合等包括遗传物质复制在内的一系列生理过程。这些分子功能与细胞肿瘤的发展密切相关[20-22]。
富集分析表明WNK2调控的磷酸化差异蛋白主要参与细胞骨架形成。研究表明细胞骨架的重建与细胞的增殖、侵袭等功能密不可分[23]。细胞骨架可通过影响细胞周期、细胞形态发生和细胞迁移,在肿瘤细胞的发生发展中起着至关重要的作用[24]。波形蛋白vimentin是调节细胞骨架形成的关键蛋白,该蛋白通过影响微管生长和肌动蛋白细胞骨架重组来调节细胞迁移。Vimentin的功能受复杂的磷酸化修饰调节[25-26],例如,vimentin位点的磷酸化增强促进了细胞的侵袭[27]。为了探索WNK2对卵巢癌细胞的影响,本研究用罗丹明标记鬼笔环肽进行肿瘤细胞骨架染色。实验结果显示,WNK2干扰导致细胞骨架断裂;WNK2过表达促进细胞骨架重排。Western blot实验进一步证实WNK2促进调控细胞骨架形成的vimentin位点的磷酸化。因此推断WNK2可能通过影响细胞骨架的形成,调控卵巢癌细胞的增殖和侵袭。
综上所述,通过蛋白质磷酸化修饰组学质谱技术,发现WNK2影响的磷酸化差异蛋白富集于细胞骨架形成、遗传物质复制、肿瘤发生发展、肿瘤细胞生长,侵袭等生物学过程。细胞骨架染色及相关蛋白磷酸化实验表明,WNK2可能通过影响细胞骨架的形成,调控卵巢癌细胞的恶性生物学行为。因此,WNK2可能为卵巢癌的治疗提供新的思路。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. |
| [2] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. |
| [3] |
LAHIRY P, TORKAMANI A, SCHORK N J, et al. Kinase mutations in human disease: interpreting genotype-phenotype relationships[J]. Nat Rev Genet, 2010, 11(1): 60-74. |
| [4] |
MAOZ A, CICCONE M A, MATSUZAKI S, et al. Emerging serine-threonine kinase inhibitors for treating ovarian cancer[J]. Expert Opin Emerg Drugs, 2019, 24(4): 239-253. |
| [5] |
CICCONE M A, MAOZ A, CASABAR J K, et al. Clinical outcome of treatment with serine-threonine kinase inhibitors in recurrent epithelial ovarian cancer: a systematic review of literature[J]. Expert Opin Investig Drugs, 2016, 25(7): 781-796. |
| [6] |
XU B, ENGLISH J M, WILSBACHER J L, et al. WNK1, a novel mammalian serine/threonine protein kinase lacking the catalytic lysine in subdomain Ⅱ[J]. J Biol Chem, 2000, 275(22): 16795-16801. |
| [7] |
GALLOLU KANKANAMALAGE S, KARRA A S, COBB M H. WNK pathways in cancer signaling networks[J]. Cell Commun Signal, 2018, 16(1): 72. |
| [8] |
MONIZ S, JORDAN P. Emerging roles for WNK kinases in cancer[J]. Cell Mol Life Sci, 2010, 67(8): 1265-1276. |
| [9] |
SATO A, SHIMIZU M, GOTO T, et al. WNK regulates Wnt signalling and β-Catenin levels by interfering with the interaction between β-Catenin and GID[J]. Commun Biol, 2020, 3(1): 1-10. |
| [10] |
JUN P, HONG C, LAL A, et al. Epigenetic silencing of the kinase tumor suppressor WNK2 is tumor-type and tumor-gradespecific[J]. Neuro Oncol, 2009, 11(4): 414-422. |
| [11] |
DUTRUEL C, BERGMANN F, ROOMAN I, et al. Early epigenetic downregulation of WNK2 kinase during pancreatic ductal adenocarcinoma development[J]. Oncogene, 2014, 33(26): 3401-3410. |
| [12] |
XU T, WU K, ZHANG L, et al. Long non-coding RNA LINC00858 exerts a tumor-promoting role in colon cancer via HNF4α and WNK2 regulation[J]. Cell Oncol (Dordr), 2020, 43(2): 297-310. |
| [13] |
MONIZ S, MARTINHO O, PINTO F, et al. Loss of WNK2 expression by promoter gene methylation occurs in adult gliomas and triggers Rac1-mediated tumour cell invasiveness[J]. Hum Mol Genet, 2013, 22(1): 84-95. |
| [14] |
ZAMARAEV A V, VOLIK P I, SUKHIKH G T, et al. Long non-coding RNAs: a view to kill ovarian cancer[J]. Biochim Biophys Acta Rev Cancer, 2021, 1876(1): 188584. |
| [15] |
MONIZ S, VERÍSSIMO F, MATOS P, et al. Protein kinase WNK2 inhibits cell proliferation by negatively modulating the activation of MEK1/ERK1/2[J]. Oncogene, 2007, 26(41): 6071-6081. |
| [16] |
SERYSHEVA E, BERHANE H, GRUMOLATO L, et al. Wnk kinases are positive regulators of canonical Wnt/β-catenin signalling[J]. EMBO Rep, 2013, 14(8): 718-725. |
| [17] |
ALVARADO-KRISTENSSON M, ROSSELLÓ C A. The biology of the nuclear envelope and its implications in cancer biology[J]. Int J Mol Sci, 2019, 20(10): 2586. |
| [18] |
SHORT C A, SUAREZ-ZAYAS E A, GOMEZ T M. Cell adhesion and invasion mechanisms that guide developing axons[J]. Curr Opin Neurobiol, 2016, 39: 77-85. |
| [19] |
MA X D, DANG Y M, SHAO X W, et al. Ubiquitination and long non-coding RNAs regulate actin cytoskeleton regulators in cancer progression[J]. Int J Mol Sci, 2019, 20(12): 2997. |
| [20] |
JUNG H, YOON S R, LIM J, et al. Dysregulation of rho GTPases in human cancers[J]. Cancers, 2020, 12(5): 1179. |
| [21] |
ALLEN A, GAU D, FRANCOEUR P, et al. Actin-binding protein profilin1 promotes aggressiveness of clear-cell renal cell carcinoma cells[J]. J Biol Chem, 2020, 295(46): 15636-15649. |
| [22] |
JIU Y, PERÄNEN J, SCHAIBLE N, et al. Vimentin intermediate filaments control actin stress fiber assembly through GEF-H1 and RhoA[J]. J Cell Sci, 2017, 130(5): 892-902. |
| [23] |
YILMAZ M, CHRISTOFORI G. EMT, the cytoskeleton, and cancer cell invasion[J]. Cancer Metast Rev, 2009, 28(1/2): 15-33. |
| [24] |
HALL A. The cytoskeleton and cancer[J]. Cancer Metast Rev, 2009, 28(1/2): 5-14. |
| [25] |
LANIER M H, KIM T, COOPER J A. CARMIL2 is a novel molecular connection between vimentin and actin essential for cell migration and invadopodia formation[J]. Mol Biol Cell, 2015, 26(25): 4577-4588. |
| [26] |
潘燕, 韩婧, 张晔, 等. Vimentin在肿瘤转移中的作用及药物研究进展[J]. 生理科学进展, 2010, 41(6): 413-416. PAN Y, HAN J, ZHANG Y, et al. Role ofvimentin in tumor metastasis and drug research[J]. Prog Physiol Sci, 2010, 41(6): 413-416. |
| [27] |
LIAO G, WANG R, REZEY A C, et al. MicroRNA miR-509 regulates ERK1/2, the vimentin network, and focal adhesions by targeting Plk1[J]. Sci Rep, 2018, 8(1): 12635. |






