尿路感染(urinary tract infection, UTI)是指病原体直接侵入尿路,在尿液中生长繁殖并侵犯尿路黏膜或组织而引起的炎症反应,是院内感染的常见病症,主要包括肾盂肾炎、输尿管炎、膀胱炎和尿道炎。近年来,国外研究报道大肠埃希菌(Escherichia coli,E. coli)作为尿路感染的常见病原菌,在社区获得性尿路感染中占70%~95%,在医院获得性尿路感染中占50%,是尿路感染最重要的致病菌[1-2]。临床上,部分尿路感染反复发作,不易治愈,患者反复就医,长期交替服用各类抗菌药物,可导致耐药菌及高致病菌的感染增多,从而增加感染的治疗难度。比对从尿道分离的E. coli与实验室标准菌株MG1655的基因序列发现,其主要毒力因子包括α溶血素、细胞坏死因子、脂多糖以及多种黏附因子等[3-5]。
本研究以临床分离E. coli为研究对象,观察不同病源(反复性尿路感染和急性单纯性尿路感染)E. coli耐药性及毒力的表达差别,为临床预防和治疗E. coli造成的尿路感染提供理论依据,以更有效地解决临床反复性尿路感染这一难题。
1 材料与方法 1.1 实验材料 1.1.1 实验菌株及来源E. coli临床菌株来自本院2014-2015年住院患者临床送检标本,共15株(其中F1~F15)为反复性尿路感染分离菌株(反复性组),共11株(D1~D11)为急性单纯性尿路感染分离菌株(急性单纯性组)。E. coli药敏质控菌株ATCC25922和标准菌株MG1655为本院国家药物临床试验机构保存菌株。反复性尿路感染诊断标准:本次尿路感染前,有过半年内至少2次尿路感染发作,出现尿频、尿急、尿痛等症状,伴有尿常规白细胞升高,尿培养大肠埃希菌计数>105 CFU/mL,无发热等全身症状者。急性单纯性尿路感染包括既往无尿路感染发作,具有尿路刺激症状,出现尿常规白细胞升高,尿培养大肠埃希菌计数>105CFU/mL。
1.1.2 实验细胞5637膀胱癌细胞购自中科院上海细胞库。
1.1.3 试剂及设备BSA、1640(Gibco公司)、血琼脂平板、营养培养基(重庆庞通医疗器械有限公司),胰蛋白胨、酵母提取物(英国Oxoid公司),氯化钠(重庆川东化工集团有限公司),琼脂粉(北京鼎国昌盛生物技术有限公司),LDH试剂盒(美国Thermo公司),酶标仪(美国Thermo公司),孵箱(美国Thermo公司),VITEK-2 Compact型全自动细菌分析仪(法国生物梅里埃公司)。
1.2 实验方法 1.2.1 菌株的鉴定采用VITEK-2 Compact型全自动细菌分析仪进行细菌鉴定。
1.2.2 药敏试验采用MH琼脂平板倍比稀释法测定菌株最低抑菌浓度(minimal inhibitory concentration,MIC)。将临床分离E. coli用MH肉汤过夜培养然后稀释至0.5麦氏单位,约108 CFU/mL,用多点接种仪接种至不同浓度梯度的药物MH琼脂平板上,药物梯度为256、128、64、32、16、8、4、2、1、0.5、0.25、0 μg/mL。37 ℃孵育20 h判断结果。以质控菌株ATCC25922作为对照,试验结果判读参照2014版CLSI标准(结果用耐药率代替MIC表示细菌对抗菌药物的敏感程度)。
1.2.3 细菌黏附能力的检测采用细菌平板计数法。E. coli划线接种于血琼脂平板培养过夜。挑取单菌落至10 mL LB肉汤,37 ℃,160 r/min培养18 h,然后稀释至0.5麦氏单位。实验分为临床菌株组和标准菌株组。临床菌株组在24孔板中加入500 μL临床菌株菌液和500 μL LB培养基,标准菌株组加入500 μL MG1655菌液和500 μL LB培养基。37 ℃孵育6 h后,用无菌的PBS缓冲液轻柔冲洗2次,去除浮游的细菌。然后将PBS缓冲液加入培养皿中超声10 min,以使黏附的细菌脱落。将细菌悬浮液稀释至适当的浓度后,取100 μL菌液涂布于营养琼脂培养基,37 ℃培养24 h后计数。每个样本设置3个平行组,实验重复3次。
1.2.4 细菌运动能力检测采用泳动力试验检测。配制LB半固体泳动培养基(胰蛋白胨1.5%、酵母提取物1%、氯化钠1%、琼脂粉0.4%)。E. coli划线接种于血琼脂平板培养过夜。然后用无菌的牙签挑取单菌落至泳动培养基正中间,37 ℃培养24 h后测量菌落直径。每个样本设置3个平行组,实验重复3次。
1.2.5 细菌溶血能力采用血凝实验[6-7]。2%兔红细胞悬液制备:取SPF级兔,采10 mL血于抗凝血收集管中。2 000 r/min离心5 min,去血浆层。在管中加入2倍生理盐水洗涤,反复吹打混匀,再2 000 r/min离心5 min,弃上清液,重复2次。取压积红细胞2滴,加入新鲜无菌等渗生理盐水4 mL,轻轻摇动,即成所需的2%红细胞悬液。E. coli划线接种于血琼脂平板培养过夜。挑取单菌落至10 mL LB肉汤,37 ℃,160 r/min培养18 h,然后稀释至0.5麦氏单位,为1号浓度,然后取100 μL 1号浓度菌液至900 μL无菌PBS中,如此进行倍比稀释8次,得到1~9号浓度菌液。在96孔板各加入25 μL无菌PBS,然后吸取稀释好的25 μL各浓度菌液加入相应的1~9号孔中,10号孔加入25 μL无菌PBS作为对照。菌液加入完毕之后再每孔加入25 μL 2%红细胞悬液。37 ℃反应3 h,观察结果用96孔板跳孔孔数表示其溶血能力。
1.2.6 细菌细胞毒性检测采用乳酸脱氢酶(lactate dehydrogenase, LDH)法检测细菌对细胞的毒性[8]。将5637细胞接种在96孔细胞培养板中,根据细胞的生长速度,使待检测时细胞密度不超过80%。待检测前用无菌的PBS润洗细胞培养板1次,然后加入新鲜的细胞培养液(1%BSA的1640培养液),将培养孔分为3组:无细胞的培养液孔(空白对照孔)、未经菌液处理的后续裂解的细胞孔(样品最大酶活性对照孔)以及菌液处理细胞孔(MOI 1:100)。在培养箱中(5% CO2,90 %湿度,37 ℃)孵育细胞4 h后按照试剂盒说明书处理检测样本。3 h时,需提前在样品最大酶活性对照孔加入试剂盒提供的LDH释放试剂。
1.3 统计学分析采用SPSS 17.0统计软件。计量数据以x±s表示,细菌耐药性差异采用χ2检验,例数小于40时采用Fisher确切概率法;毒力因子差异性比较采用t检验。P<0.05为差异有统计学意义。
2 结果 2.1 药敏试验结果药敏实验结果见表 1。26株临床分离E. coli对庆大霉素、哌拉西林、头孢呋辛、环丙沙星的耐药率均超过50%,说明耐药程度高。但由于本次实验的总例数过少,采用Fisher确切概率法双侧检验,P值均大于0.05,说明现有资料尚不能认为反复发作尿路感染分离菌株和急性单纯性膀胱炎分离菌株的耐药性有显著差异。
| 菌株 | n | 庆大霉素 | 哌拉西林 | 头孢他啶 | 头孢呋辛 | 亚胺培南 | 环丙沙星 | 氨曲南 |
| 反复性尿路感染菌株 | 15 | 66.7(10) | 86.7(13) | 40.0(6) | 73.3(11) | 13.3(2) | 73.3(11) | 40.0(6) |
| 急性单纯性尿路感染菌株 | 11 | 54.5(6) | 81.8(9) | 36.3(4) | 54.5(6) | 9.1(1) | 63.6(7) | 54.5(6) |
2.2 细菌黏附能力的检测
临床分离尿路E. coli黏附能力见图 1。反复性组的E. coli黏附能力为(4.95×107±1.21×106) CFU/mL,比急性单纯性组强[(2.57×107±1.63×106)CFU/mL,F=19.144,P<0.001]。
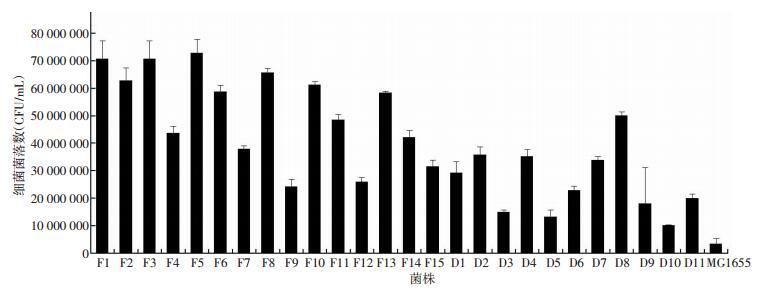
|
| 图 1 临床分离菌株黏附能力检测 |
2.3 细菌运动能力检测
临床分离的尿路E. coli运动能力见图 2。反复性组的E. coli运动能力与急性单纯性组比较,差异无统计学意义[(8.84±0.80)mm vs (8.48±0.74)mm,F=0.083,P=0.776]。

|
| 图 2 临床分离菌株运动能力检测 |
2.4 细菌溶血能力检测
临床分离的尿路E. coli溶血能力见图 3。反复性组的E. coli溶血能力为(7.30±0.58),比急性单纯性组强[(6.03±0.73),F=25.059,P<0.001]。
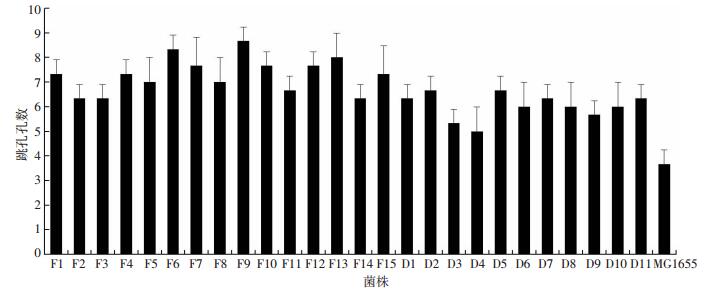
|
| 图 3 临床分离菌株溶血能力检测 |
2.5 细菌细胞毒性检测
临床分离的尿路E. coli毒性见图 4。反复性组的E. coli细胞毒性为(76.66±3.65)%,比急性单纯性组强[(64.14±8.85)%,F=6.386,P=0.019]。
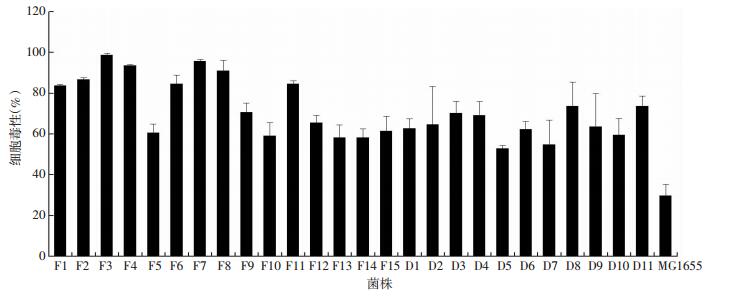
|
| 图 4 临床分离菌株毒性检测 |
3 讨论
E. coli是医院内感染常见病原菌之一,为革兰阴性杆菌。患者在机体抵抗力下降时,E. coli极易致泌尿系统等感染,反复的抗感染治疗可致细菌耐药的发生,为治疗增加了难度,也增加了患者的负担。因此,研究急性单纯性和反复性尿路感染E. coli致病力的差异、耐药性的区别以及细菌毒力表达的差异,可为临床相关感染的治疗提供理论依据,为反复性尿路感染的规范治疗奠定基础。
E. coli侵入组织后主要通过Ⅰ型菌毛等黏附在膀胱上皮细胞,进而发生定植,导致炎症的发生[9-10]。前期研究报道显示,反复发作尿路感染菌株相较于急性单纯性尿路感染菌株而言,其毒力基因(如papA、papG、fyuA、iut等)的表达更强,黏附能力更强,耐药率更高,并且反复发作的E. coli较急性的E. coli菌株易形成胞内生物膜样菌落(intracellular bacterial communities,IBC),使其在体内定植更稳定[11-12]。本研究中,虽然两种分离菌株耐药率差异无统计学意义,但反复性尿路感染菌株除氨曲南外,对其他实验用抗菌药物耐药率均高于急性单纯性尿路感染分离株,且均高于前期研究报道[13-15]。这提示抗菌药物广泛应用导致目前急性和反复性尿路感染的致病菌均具有较高的耐药率。
虽然两者运动能力未见显著差异,但反复性尿路感染菌株比急性单纯性尿路感染菌株的黏附能力、溶血能力以及菌株对5637细胞的毒性均更强。说明反复性尿路感染菌株比急性单纯性尿路感染菌株的毒性更强,与文献[16-17]报道一致,提示高致病力的E. coli更易引起反复性尿路感染症状,可能导致严重后果。在临床治疗反复发作的尿路感染过程中,应更关注其致病因子导致的症状及并发症。有报道造成尿路感染反复发作的主要原因是在各种黏附因子的介导下,E. coli入侵宿主细胞,黏附宿主细胞上皮,定植后在胞内形成生物膜样菌落,大量繁殖,从而躲避宿主细胞释放的炎症因子,逃避宿主的自身免疫反应[18-20]。E. coli成为胞内菌后,对抗菌药物的敏感性显著下降,同时免疫原性降低,而在人体内存活时间较长,并在免疫力下降或外界抗菌药物停止使用后重新感染,使感染反复发作,迁延难愈。反复性尿路感染菌株具有更强的黏附性,提示其可能具有更强的IBC形成能力,可能是尿路感染反复发作的重要因素。
本研究发现高黏附能力的细菌更容易导致复杂性尿路感染的发生,形成IBC,形成的黏附因子包括1型、P型、S型菌毛以及Afa/Dr黏附因子家族[21]。IBC形成后,细菌免受体内免疫反应的影响,造成感染的反复发生,在反复的抗生素治疗后,细菌的耐药性也会随之升高, 导致耐药的出现。而目前相关的研究较少, 且在细菌感染的过程中,IBC的形成也受到宿主免疫力的影响,进一步研究其在IBC形成及反复性尿路感染中的作用及机制,可能成为解决反复性尿路感染反复发作的重要因素。
| [1] | NICOLLE L E. The prevention of hospital-acquired urinary tract infection[J]. Clin Infect Dis, 2008, 46(2): 251–253. DOI:10.1086/524663 |
| [2] | CHEN L F, CHIU C T, Lo J Y, et al. Clinical characteristics and antimicrobial susceptibility pattern of hospitalized patients with community acquired urinary tract infections at a regional hospital in Taiwan[J]. Healthc Infect, 2013, 19(1): 20–25. DOI:10.1071/HI13033 |
| [3] | BIEN J, SOKOLOVA O, BOZKO P. Role of uropathogenic Escherichia coli virulence factors in development of urinary tract infection and kidney damage[J]. Int J Nephrol, 2012, 2012: 681473. DOI:10.1155/2012/681473 |
| [4] | NAGAMATSU K, HANNAN T J, GUEST R L, et al. Dysregulation of Escherichia coli α-hemolysin expression alters the course of acute and persistent urinary tract infection[J]. Proc Natl Acad Sci U S A, 2015, 112(8): E871–E880. DOI:10.1073/pnas.1500374112 |
| [5] | HANNAN T J, MYSOREKAR I U, Hung C S, et al. Early severe inflammatory responses to uropathogenic E. coli predispose to chronic and recurrent urinary tract infection[J]. PLoS Pathog, 2010, 6(8): e1001042. DOI:10.1371/journal.ppat.1001042 |
| [6] | HULTGREN S J, SCHWAN W R, SCHAEFFER A J, et al. Regulation of production of type 1 pili among urinary tract isolates of Escherichia coli[J]. Infect Immun, 1986, 54(3): 613–620. |
| [7] | GONEAU L W, HANNAN T J, MACPHEE R A, et al. Subinhibitory antibiotic therapy alters recurrent urinary tract infection pathogenesis through modulation of bacterial virulence and host immunity[J]. Mbio, 2015, 6(2): pii: e00356-15. DOI:10.1128/mbio.00356-15 |
| [8] | ZHANG X, LI Y, LI B, et al. Three supplementary methods for analyzing cytotoxicity of Escherichia coli O157:H7[J]. J Microbiol Methods, 2016, 120: 34–40. DOI:10.1016/j.mimet.2015.11.011 |
| [9] | BERGSTEN G, WULLT B, SVANBORG C. Escherichia coli, fimbriae, bacterial persistence and host response induction in the human urinary tract[J]. Int J Med Microbiol, 2005, 295(6/7): 487–502. DOI:10.1016/j.ijmm.2005.07.008 |
| [10] | SUBASHCHANDRABOSE S, HAZEN T H, BRUMBAUGH A R, et al. Host-specific induction of Escherichia coli fitness genes during human urinary tract infection[J]. Proc Natl Acad Sci USA, 2014, 111(51): 18327–18332. DOI:10.1073/pnas.1415959112 |
| [11] | BLANGO M G, MULVEY M A. Persistence of uropathogenic Escherichia coli in the face of multiple antibiotics[J]. Antimicrob Agents Chemother, 2010, 54(5): 1855–1863. DOI:10.1128/aac.00014-10 |
| [12] | EJRNAES K. Bacterial characteristics of importance for recurrent urinary tract infections caused by Escherichia coli[J]. Dan Med Bull, 2011, 58(4): B4187. |
| [13] | BRYCE A, HAY A D, LANE I F, et al. Global prevalence of antibiotic resistance in paediatric urinary tract infections caused by Escherichia coli and association with routine use of antibiotics in primary care: systematic review and meta-analysis[J]. BMJ, 2016, 352: i939. DOI:10.1136/bmj.i939 |
| [14] | ABDUZAIMOVIC A, ALJICEVIC M, REBIC V, et al. Antibiotic resistance in urinary isolates of Escherichia coli[J]. Mater Sociomed, 2016, 28(6): 416–419. DOI:10.5455/msm.2016.28.416-419 |
| [15] | OLSON R P, HAITH K. Antibiotic resistance in urinary tract infections in college students[J]. J Am Coll Health, 2012, 60(6): 471–474. DOI:10.1080/07448481.2012.681410 |
| [16] | SALEHZADEH A, ZAMANI H. Characterization of (Uropathogenic) E. coli isolated from urinary tract infections: phylogenetic typing and distribution of virulence-associated traits[J]. Br J Biomed Sci, 2017, 75(1): 1–3. DOI:10.1080/09674845.2017.1336834 |
| [17] | QIN X, HU F, WU S, et al. Comparison of adhesin genes and antimicrobial susceptibilities between uropathogenic and intestinal commensal Escherichia coli strains[J]. PLoS ONE, 2013, 8(4): e61169. DOI:10.1371/journal.pone.0061169 |
| [18] | FLOYD K A, MOORE J L, EBERLY A R, et al. Adhesive fiber stratification in uropathogenic Escherichia coli biofilms unveils oxygen-mediated control of type 1 pili[J]. PLoS Pathog, 2015, 11(3): e1004697. DOI:10.1371/journal.ppat.1004697 |
| [19] | ROSEN D A, PINKNER J S, WALKER J N, et al. Molecular variations in klebsiella pneumoniae and Escherichia coli fimh affect function and pathogenesis in the urinary tract[J]. Infect Immun, 2008, 76(7): 3346–3356. DOI:10.1128/iai.00340-08 |
| [20] | WRIGHT K J, SEED P C, HULTGREN S J. Development of intracellular bacterial communities of uropathogenic Escherichia coli depends on type 1 pili[J]. Cell Microbiol, 2007, 9(9): 2230–2241. DOI:10.1111/j.1462-5822.2007.00952.x |
| [21] | BISOGNANO C, VAUDAUX P, ROHNER P, et al. Induction of fibronectin-binding proteins and increased adhesion of quinolone-resistant staphylococcus aureus by subinhibitory levels of ciprofloxacin[J]. Antimicrob Agents Chemother, 2000, 44(6): 1428–1437. DOI:10.1128/aac.44.6.1428-1437.2000 |





