肺癌的发病率或死亡率均占所有恶性肿瘤首位,而其主要组织学亚型——肺腺癌患者5年生存率只有15.9%[1-2]。研究证实肿瘤微环境中的肿瘤相关巨噬细胞对肺腺癌发生、发展起重要作用。其主要通过两种亚型发挥作用,包括:① 促进炎症发生和抑制肿瘤活性的M1型肿瘤相关巨噬细胞,表面标志物有HLA-DR、CD197等;② 发挥免疫抑制和促进肿瘤生长作用的M2型,表面标志物有CD209、CD163等[3]。而CD68则是用于区分巨噬细胞与其他类型细胞。因此,针对不同亚型肿瘤相关巨噬细胞表面标志物的标记是鉴定和研究的重要手段[3-5]。在基础实验和临床病理形态学研究中,免疫组织化学双重或多重标记染色能同时在一张组织切片或一个细胞内证实多种抗原存在[6-7]。目前免疫双重标记(双标)实验中较多采用碱性磷酸酶和辣根过氧化物酶双酶显色系统[7-10]。碱性磷酸酶的底物常选用5-溴-4-氯-3-吲哚-磷酸盐/硝基四唑氮蓝(BCIP/NBT),辣根过氧化酶的底物则多选用3-氨基-9-乙基咔唑(AEC)[8-10]。底物BCIP/NBT与AEC的呈色反应存在一定程度的相互干扰;并且BCIP/NBT呈色反应与细胞核苏木精复染亦存在干扰。因此,建立一种获取高质量结果的免疫组化双重标记方法具有重要的应用价值。本研究将对既往免疫组化双标实验方法中双酶显色系统的反应底物进行改进,并进一步利用改进的双标实验方法研究肺腺癌中不同亚型肿瘤相关巨噬细胞的分布情况。
1 资料与方法 1.1 病例样本肺腺癌标本选取2012年在西南医院进行外科手术的肺腺癌患者。入选标准:① 常规病理HE组织切片需得到至少2名有经验的病理学医师的一致诊断;② 诊断必须符合2017 UICC TNM分类(第8版)的组织学诊断标准[11]。研究共纳入20例标本。本研究于2015年6月得到西南医院伦理委员会批准。
1.2 试剂材料CD68(产品编号:ZM-0060;巨噬细胞表面标志物)、HLA-DR(产品编号:ZM-0163;M1型肿瘤相关巨噬细胞表面标志物)、CD163(产品编号:ZM-0428;M2型肿瘤相关巨噬细胞表面标志物)、生物素标记的羊抗鼠/兔IgG(产品编号:SP-9000)、碱磷酶底物AP-Red试剂盒(产品编号:ZLI-9042) 购自北京中杉金桥生物技术有限公司。链霉菌抗生物素蛋白-过氧化酶、链霉菌抗生物素蛋白-碱性磷酸酶购自福州迈新生物技术开发有限公司,产品编号:KIT-9999。其他化学试剂均购自生工生物工程(上海)股份有限公司。
1.3 免疫组化双标染色步骤石蜡切片脱蜡水化,组织内源性过氧化物酶灭活,抗原高温高压酸修复(pH=6.0),正常山羊血清封闭液阻断非特异性结合。第一标抗体孵育:滴加终浓度为2.5 μg/mL CD68抗体工作液,4 ℃孵育16 h;阴性对照PBS代替抗体,其余相同。生物素标记羊抗鼠/兔IgG(简称二抗,下同)孵育,链霉菌抗生物素蛋白-碱性磷酸酶链接二抗,AP-Red呈色反应。碱性磷酸酶液洗脱液洗脱抗体和碱性磷酸酶[12],第二次非特异性阻断。第二标抗体孵育:滴加第二标抗体(终浓度为2.5 μg/mL CD163抗体或HLA-DR抗体)4 ℃孵育16 h。生物素标记的二抗孵育,辣根过氧化物酶链接二抗,DAB呈色反应。苏木精复染细胞核,甘油封片剂封片,显微镜下及时观察采图。
1.4 统计学分析采用SPSS 21.0统计软件,数据以x±s表示,组内比较行配对样本t检验,检验水准α=0.05。
2 结果 2.1 病例的临床病理特点筛选20例肺腺癌患者,其中男性12例,女性8例,年龄(58.1±2.5) 岁,TNMⅠ~Ⅲ期分别为7例、6例和7例,吸烟者12例,没有病例术前进行放化疗等特殊处理。
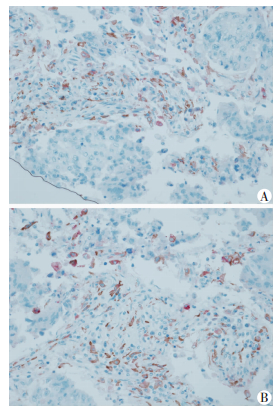
2.2 免疫双标改进既往的免疫组化双标染色底物BCIP/NBT与AEC的呈色反应存在一定程度的相互干扰,使染色结果反差变小,并且底物BCIP/NBT的显色与苏木精复染的细胞核有相互干扰(图 1)。

|
| A:辣根过氧化酶与底物3-氨基-9-乙基咔唑呈色反应,显示为红色;B:碱性磷酸酶与底物5-溴-4-氯-3-吲哚-磷酸盐/硝基四唑氮蓝呈色反应,显示为蓝紫色;C:连续切片同一位置双标染色显示结果 图 1 既往免疫组化双标染色观察肺腺癌组织中肿瘤相关巨噬细胞(S-P×400) |
经过探索,通过替换呈色反应的作用底物,能产生清晰高反差的双标结果,建立起一种清晰、高对比度的免疫组织化学双标方法。免疫组化双标分别使用二抗链接的碱性磷酸酶和辣根过氧化物酶,底物选用Fast Red和DAB分别显示红色与棕黄色。第一标Fast Red的红色与第二标DAB的棕黄色反差大,背景低,易于分辨。此外,两种颜色标记的同一部位呈现砖红色,易于各单色分辨。另外,染色背景较浅,无弥散的非特异性信号,背景呈灰白色(图 2)。

|
| A:×200;B:×400;红色为CD68;棕色为CD163;砖红色表示双染 图 2 改进的免疫组化双标染色观察肺腺癌组织中肿瘤相关巨噬细胞(S-P) |
2.3 不同亚型肿瘤相关巨噬细胞在肺腺癌组织中的分布
利用改进的免疫组织化学双标染色方法对20例肺腺癌患者标本进行染色分析。在CD68+的巨噬细胞中,以HLA-DR+为代表的M1型肿瘤相关巨噬细胞比例为14.6%~43.2%,平均28.5%(图 3A);CD163+的M2型比例为67%~93%,平均83.9%(图 3B)。通过统计分析发现,在肺腺癌间质中M1型与M2型数量差异明显,巨噬细胞约80%,是M2型肿瘤相关巨噬细胞。
|
| A:M1型肿瘤相关巨噬细胞,CD68棕色,HLA-DR红色;B:M2型肿瘤相关巨噬细胞,CD68棕色,CD163红色 图 3 改进的免疫组化双标染色观察不同亚型肿瘤相关巨噬细胞在肺腺癌组织中的分布(S-P×200) |
3 讨论
既往免疫双标实验均采用双酶显色系统,然而底物的选择会影响显色效果[7]。传统方法经常使用的商品化双标试剂盒:碱性磷酸酶与底物5-溴-4-氯-3-吲哚-磷酸盐/硝基四唑氮蓝(BCIP/NBT)反应呈蓝紫色,辣根过氧化酶与底物3-氨基-9-乙基咔唑(AEC)反应呈红色。两种颜色既存在相互干扰,同时又与苏木精复染的细胞核不好辨认[13]。因此,迫切需要改变已有的显色系统,解决免疫组化双标实验难控制、不稳定的窘境。
本实验对既往免疫组织化学显色系统进行了改进。分别使用二抗链接的碱性磷酸酶和辣根过氧化物酶,底物选用Fast Red和DAB分别显示红色与棕黄色。两种颜色反差大、背景低、易于分辨。该方法试剂易得,操作简便。如果正确操作,则染色结果质量高、稳定可靠。由于本方法不需要特殊的试剂与设备,将可为临床工作和基础研究提供一定的便利。
采用改进的免疫组织双标染色观察肺腺癌组织标本,可较容易地区分不同亚型的肿瘤相关巨噬细胞的分布及数量。为进一步研究不同亚型的肿瘤相关巨噬细胞在肺腺癌发生、发展中的作用提供了实验基础。
尽管通过对显色底物的改进,可以获得清晰、易于分辨的图像,但是本方法仍然存在一些不足:① 碱性磷酸酶与AP-Red反应产生的红色沉淀,可溶于有机溶剂,故不能采用常规酒精梯度脱水,以及封片时不能采用二甲苯透明和中性树胶封片等步骤,只能采用甘油封片剂。然而使用甘油封片剂存在降低显微镜观察的清晰度、切片无法长期保存等缺点。② 碱性磷酸酶与AP-Red反应时间过长,而辣根过氧化酶与DAB反应时间又极短,两者反应的强度与反应时间的控制并不一致。尤其是碱性磷酸酶与AP-Red长达十几分钟的反应,显色始终处在由浅至深的变化之中,何时终止反应并无明确标准。③ AP-Red的红色与DAB的棕黄色本身也有一定干扰,需要适当延长显色反应时间以便加强每个颜色的深度,减少两种颜色的交叉,但这又会影响实验的背景。因此,需要在正式实验前进行反复预实验,摸索最佳实验条件。
综上所述,本研究改进的免疫组化双标方法虽然存在一定的不足,但因其适用面广,冰冻和石蜡切片均可采用,适当加以改变还可以进一步提高灵敏度或发展成三标甚至多标方法,可广泛地应用于临床病理诊断和基础实验研究。
| [1] | Torre L A, Bray F, Siegel R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87–108. DOI:10.3322/caac.21262 |
| [2] | Davidson M R, Gazdar A F, Clarke B E. The pivotal role of pathology in the management of lung cancer[J]. J Thorac Dis, 2013, 5(Suppl 5): S463–S478. DOI:10.3978/j.issn.2072-1439.2013.08.43 |
| [3] | Remark R, Becker C, Gomez J E, et al. The non-small cell lung cancer immune contexture.A major determinant of tumor characteristics and patient outcome[J]. Am J Respir Crit Care Med, 2015, 191(4): 377–390. DOI:10.1164/rccm.201409-1671PP |
| [4] | Ohri C M, Shikotra A, Green R H, et al. Macrophages within NSCLC tumour islets are predominantly of a cytotoxic M1 phenotype associated with extended survival[J]. Eur Respir J, 2009, 33(1): 118–126. DOI:10.1183/09031936.00065708 |
| [5] | Ma J, Liu L, Che G, et al. The M1 form of tumor-associated macrophages in non-small cell lung cancer is positively associated with survival time[J]. BMC Cancer, 2010, 10: 112. DOI:10.1186/1471-2407-10-112 |
| [6] | Ramos-Vara J A, Miller M A. When tissue antigens and antibodies get along: revisiting the technical aspects of immunohistochemistry-the red, brown, and blue technique[J]. Vet Pathol, 2014, 51(1): 42–87. DOI:10.1177/0300985813505879 |
| [7] |
崔白苹, 高璀乡, 熊存全, 等. 一种简便、可靠的免疫组化双重标记新方法[J].
中国药理学通报, 2015, 31(3): 436–442.
Cui B P, Gao C X, Xiong C Q, et al. A novel, convenient and reliable method for immunohistochemical double labeling[J]. Chinese Pharmacological Bulletin, 2015, 31(3): 436–442. DOI:10.3969/j.issn.1001-1978.2015.03.028 |
| [8] | Sarrazy V, Desmoulière A. Double immunohistochemistry with horseradish peroxidase and alkaline phosphatase detection systems[J]. Methods Mol Biol, 2010, 611: 59–71. DOI:10.1007/978-1-60327-345-9_5 |
| [9] | Waiser J, Schwaar S, Böhler T, et al. Immunohistochemical double-staining of renal allograft tissue: critical assessment of three different protocols[J]. Virchows Arch, 2002, 440(6): 648–654. DOI:10.1007/s00428-001-0559-8 |
| [10] | Fonseca-Alves C E, Bento D D, Torres-Neto R, et al. Ki67/KIT double immunohistochemical staining in cutaneous mast cell tumors from Boxer dogs[J]. Res Vet Sci, 2015, 102: 122–126. DOI:10.1016/j.rvsc.2015.08.007 |
| [11] | Rusch V W, Chansky K, Kindler H L, et al. The IASLC Mesothelioma Staging Project: Proposals for the M Descriptors and for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Mesothelioma[J]. J Thorac Oncol, 2016, 11(12): 2112–2119. DOI:10.1016/j.jtho.2016.09.124 |
| [12] | Ervine A J, McBride H A, Kelly P J, et al. Double immunohistochemistry enhances detection of lymphatic and venous invasion in early-stage colorectal cancer[J]. Virchows Arch, 2015, 467(3): 265–271. DOI:10.1007/s00428-015-1792-x |
| [13] | Pirici D, Mogoanta L, Kumar-Singh S, et al. Antibody elution method for multiple immunohistochemistry on primary antibodies raised in the same species and of the same subtype[J]. J Histochem Cytochem, 2009, 57(6): 567–575. DOI:10.1369/jhc.2009.953240 |





