2421002 湖南 衡阳,解放军169医院泌尿外科;
3400037 重庆,第三军医大学新桥医院:超声科
2Department of Urology,No.169 Hospital of PLA,Hengyang,Hunan Province,421002,China;
3Department of Ultrasonography,Xinqiao Hospital,Third Military Medical University,Chongqing,400037
世界范围内约90%男性在其生命过程中存在隐性或显性泌尿系统炎性疾病,其中前列腺炎(bactarial prostatitis,BP)是最为常见的疾病之一[1]。前列腺炎通常是诱发良性前列腺增生及恶性病变的重要因素之一,其防治越来越受到重视。鉴于临床前列腺炎病因学的复杂性及前列腺屏障的存在,目前临床上最核心的治疗手段——抗生素治疗往往不能取得理想的治疗效果,前列腺炎反复发作、迁延不愈情况比较普遍。因此,急需开发新的有效药物以及新的治疗手段。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是一种具有快速增殖、多向分化、低免疫原性、抑制炎症反应及组织修复能力的干细胞群[2]。在过去的十余年中,BMSCs已应用于临床多种疾病治疗,最早出现在成骨不连的治疗中,随后在溶酶体贮积症、移植物抗宿主病、Crohn肠炎的治疗中也得到应用。早期研究表明BMSCs通过抑制T细胞、B细胞、抗原递呈细胞增殖以及抑制促炎因子的产生而发挥抑制炎症反应的作用[3]。目前国内外尚少见BMSCs抑制前列腺炎的相关报道。本研究在大肠埃希菌致SD大鼠BP模型基础上,静脉注射BMSCs,观察超声复合微泡(microbubble-enhanced therapeutic ultrasound,MEUS)介导的BMSCs向前列腺内归巢的变化情况,探讨BMSCs对前列腺炎的治疗作用。
1 材料与方法 1.1 主要试剂与仪器标准致病大肠埃希菌(ATC25922,新桥医院实验室提供),微泡造影剂(新桥医院超声科制备),逆转录试剂盒(美国Promega公司),大鼠TNF-α、IL-1β ELISA试剂盒(武汉博士德公司),小动物超声影像系统vevo2100(VisualSonics公司),活体成像仪(美国Bruker公司),超声声孔仪(深圳威尔德),酶标仪(Thermo公司)。
1.2 实验动物及分组雄性SD大鼠50只,清洁级,体质量220~250 g,由第三军医大学实验动物中心提供,按随机数字表法分为5组,分别为慢性细菌性前列腺炎(chronic bacterial prostatitis,CBP)组、CBP+BMSCs组、CBP+MEUS组、CBP+MEUS+BMSCs组和正常对照组,每组10只。
1.3 动物模型建立按照Elkahwaji等[4]报道的方法,腹腔注射3%戊巴比妥钠注射液(30 mg/kg)麻醉大鼠,备下腹部皮肤,正常对照组大鼠在小动物超声引导下向前列腺内注射无菌PBS缓冲液50 μL。其余4组大鼠在小动物超声引导下,用1 mL无菌注射器向前列腺两侧叶内注射浓度为1×108/mL的大肠埃希菌50 μL。注射细菌后4~12周为慢性炎症期。
1.4 BMSCs分离、培养、鉴定及标记无菌条件下脱颈法处死3周龄雄性SD大鼠,完整分离双侧股骨,收集骨髓悬液,离心后制成单细胞悬液。接种于含DMEM/F-12及体积分数10%胎牛血清的25 cm2塑料培养瓶,放置于37 ℃、5% CO2温湿培养箱内培养,24 h后换液,去除未贴壁细胞,以后2~3 d换液,细胞铺满瓶壁80%~90%时传代培养,如此反复,传代扩增细胞至P3代[5]。取P3代细胞,分别用成骨、成脂诱导分化培养基进行成骨、成脂分化诱导培养。取P3代细胞,分别加入抗大鼠CD44、CD45、CD29单克隆抗体,进行流式细胞鉴定。用携带GFP和luc报告基因的慢病毒转染BMSCs,利用荧光显微镜检查BMSCs转染效率。
1.5 BMSCs注射、活体成像观察及取材注射细菌28 d后,正常对照组及CBP组尾静脉注射PBS缓冲液300 μL,CBP+BMSCs组脉注射含有1×107 BMSCs[6, 7]的PBS缓冲液300 μL,CBP+MEUS 组注射微泡造影剂(0.1 mL/kg)+PBS缓冲液300 μL,即刻行超声辐照,超声探头频率1.0 MHz。以大鼠下腹部区域为声窗,待屏幕中显示大鼠前列腺影像后固定超声切面,辐照时间均为5 min,声压250 kPa,发射占空比为1%,平均声强0.023 W/cm。CBP+MEUS+BMSCs组注射微泡造影剂(0.1 mL/kg)后,即刻行超声辐照,再注射含有1×107 BMSCs的PBS缓冲液300 μL。活体成像仪观察CBP+BMSCs组和CBP+MEUS+BMSCs组前列腺内BMSCs向前列腺归巢情况。2周后处死全部大鼠取材。所有大鼠饲养环境相同,各组取出的前列腺组织样本分为两份,一份于-80 ℃ 保存,另一份用4%多聚甲醛固定。
1.6 观察指标 1.6.1 活体成像观察超声辐照后1 d,向CBP+BMSCs组和CBP+MEUS+BMSCs组大鼠腹腔内注射荧光素酶底物,上机观察活体成像情况。
1.6.2 病理形态观察用4%多聚甲醛固定取出的前列腺组织24 h后,常规石蜡包埋、切片,HE染色。光镜下观察前列腺管腔上皮层结构改变情况、间质炎症细胞浸润程度和纤维组织增生的变化。前列腺组织炎症反应病理评分按Yoon等[8]的方法计算:每张切片随机选取5个视野,镜下计算病变所占的面积比,即无病变计0分,<10%计1分,10%~<25%计2分,25%~50%计3分,<50%~75%计4分,>75%计5分。
1.6.3 RT-PCR检测IL-1β和TNF-α mRNA的表达样本用TRIzol法提取RNA,反转录为cDNA,扩增目的基因TNF-α和IL-1β,使用DL2000 marker,引物设计采用Primer Primier 5.0软件,扩增内参β-肌动蛋白,得出目的基因与内参比值,统计分析各组差异。以逆转录的cDNA为模板进行PCR反应,检测炎症因子TNF-α和IL-1β的表达。PCR反应条件:94 ℃变性5 min,循环温度为94 ℃ 30 s,57 ℃ 30 s,72 ℃ 30 s,对目的基因扩增32个循环,72 ℃延伸10 min。PCR产物在1%琼脂糖凝胶中电泳后,在Bio-Rad凝胶成像系统(Gel Doc2000)上成像和进行条带分析。经内参校正后进行统计分析。
1.6.4 炎症因子IL-1β和TNF-α蛋白水平测定样品组织制成匀浆,取上清液。按ELISA试剂盒操作程序进行实验,样品稀释液作为标准浓度0 pg/mL,标准品按2 000、1 000、500、250、125、62.5、31.25 pg/mL浓度,酶标仪在波长450 nm处测定光密度值[D(450)],绘制标准曲线及方程。再依据步骤测定样品中IL-1β和TNF-α的D(450)值,计算出对应浓度,进行统计分析。
1.7 统计学分析采用SPSS 18.0统计软件,实验数据为正态分布,方差齐同性。计量资料以x±s表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验的方法。
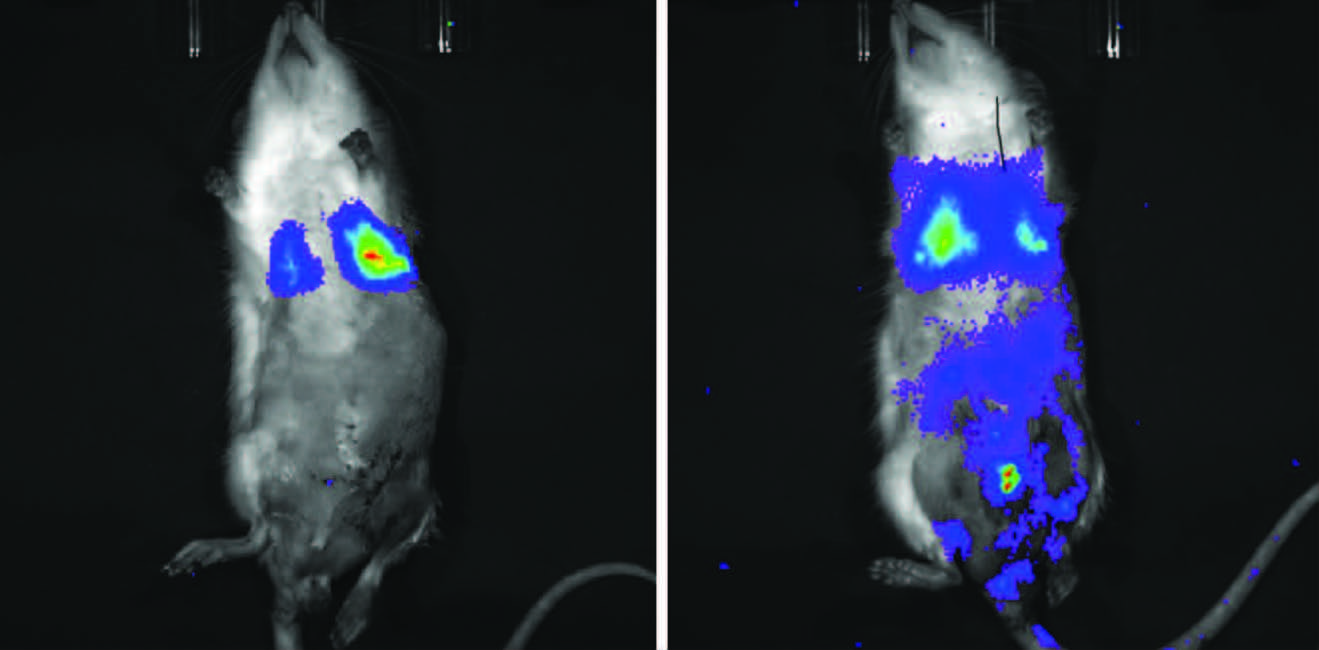
2 结果 2.1 BMSCs归巢的观察CBP+BMSCs组大鼠仅肺部内存留带荧光标记的BMSCs,而CBP+MEUS+BMSCs组 全身多部位均可见带荧光标记的BMSCs,以肺部和前列腺部最明显(图 1)。
|
| A:CBP+BMSCs组;B:CBP+MEUS+BMSCs组 图 1 活体成像观察CBP+BMSCs组与CBP+MEUS+BMSCs组大鼠体内BMSCs分布情况 |
正常对照组前列腺管腔上皮层细胞结构完整,呈柱状排列,间质内未见炎性细胞浸润及纤维组织增生;CBP组、CBP+BMSCs组、CBP+MEUS组均可见前列腺管腔上皮层增生,层次增加,形状呈瘤样变,可见坏死上皮细胞;间质内见大量淋巴细胞和浆细胞浸润,大量纤维组织增生,与对照组比较有显著差异(P<0.01);CBP+MEUS+BMSCs组见前列腺管腔结构较完整,间质内炎症细胞少量浸润,纤维组织增生程度较CBP组显著减轻(P<0.01,图 2、表 1)。

|
| A:正常对照组;B:CBP组;C:CBP+BMSCs组;D:CBP+MEUS组;E:CBP+MEUS+BMSCs组 图 2 各组大鼠前列腺组织病理形态变化 (HE ×100) |
| 组别
| 腺腔结构改变 | 炎细胞浸润 | 间质纤维增生 |
| 正常对照组 | 0.23±0.09 | 0.41±0.13 | 0.22±0.07 |
| CBP组 | 3.69±1.08a | 4.41±1.32a | 2.93±0.67a |
| CBP+BMSCs组 | 4.01±1.04a | 3.77±0.98a | 3.21±0.92a |
| CBP+MEUS组 | 3.97±1.12a | 4.14±1.17a | 3.02±0.89a |
| CBP+MEUS+BMSCs组 | 0.64±0.23b | 0.94±0.37b | 1.37±0.46b |
| a:P<0.01,与正常对照组比较;b:P<0.01,与CBP组比较 | |||
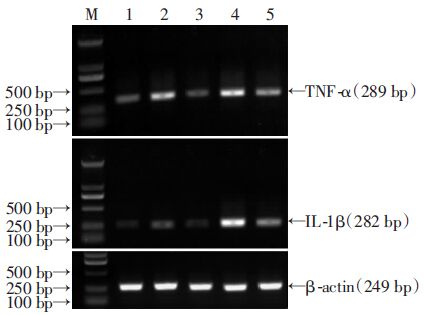
结果显示,TNF-α及IL-1β mRNA含量在CBP组、CBP+BMSCs组、CBP+MEUS组表达显著高于正常对照组和CBP+MEUS+BMSCs组(P<0.05,图 3、表 2)。
|
| M:DNA标准(DL2000);1:正常对照组;2:CBP+BMSCs 组;3:CBP+MEUS+BMSCs组;4:CBP+BMSCs组;5:CBP+MEUS组 图 3 RT-PCR检测TNF-α和IL-1β mRNA在各组中的表达 |
| 组别
| TNF-α | IL-1β |
| 正常对照组 | 0.256±0.059 | 0.282±0.067 |
| CBP组 | 0.631±0.116a | 0.824±0.123a |
| CBP+BMSCs组 | 0.876±0.137a | 0.893±0.117a |
| CBP+MEUS组 | 0.814±0.127a | 0.683±0.097a |
| CBP+MEUS+BMSCs组 | 0.313±0.079 | 0.322±0.086 |
| a:P<0.05,与正常对照组和CBP+MEUS+BMSCs组比较 | ||
结果显示,CBP组、CBP+BMSCs组、CBP+MEUS组炎症因子TNF-α和IL-1β含量均显著高于正常对照组和CBP+MEUS+BMSCs组(P<0.01)。而CBP+MEUS+ BMSCs组与正常对照组比较,TNF-α和IL-1β含量增高无统计学差异(P>0.05,表 3)。
| 组别
| IL-1β | TNF-α |
| 正常对照组 | 43.36±11.35 | 13.26±3.97 |
| CBP组 | 315.14±86.08a | 86.41±24.32a |
| CBP+BMSCs组 | 278.87±72.04a | 67.77±16.98a |
| CBP+MEUS组 | 321.24±93.12a | 79.14±19.17a |
| CBP+MEUS+BMSCs组 | 65.34±17.23 | 19.94±5.37 |
| a:P<0.01,与正常对照组和CBP+MEUS+BMSCs组比较 | ||
BMSCs具有快速增殖、低免疫原性、多向分化、抑制炎症反应及促进组织修复的特性,不涉及伦理问题,没有成瘤性,经多次传代后不会改变特性[9, 10]。其因免疫调节功能成为临床医学关注的热点。早先有学者将其应用于系统性红斑狼疮和移植抗宿主病的治疗,其中的免疫调节机制已得到证实[11, 12]。近年来,BMSCs在免疫抑制实验研究中也取得了较多新进展。研究发现在炎症损伤区域,由于TNF-α、IL-1β、趋化因子、自由基形成的微环境的诱导下,体内MSCs会向炎症损伤区域聚集[13],在TNF-α、IL-1、IFN-γ及细菌毒素等刺激下,MSCs可分泌PGE2、IL-10、TSGβ等多种细胞因子,起到抑制T淋巴细胞、NK细胞增殖、巨噬细胞M1,减轻炎症反应、减少促炎因子分泌的作用[2, 14, 15]。Elman等[16]在小鼠革兰阴性菌败血症实验中,应用MSCs治疗,发现BMSCs通过增强单核细胞噬菌活性而提高了小鼠生存率。Nemeth等[17]发现向支气管哮喘大鼠静脉内注射BMSCs,这些细胞1 h后可特异性聚集在肺内炎症部位,通过分泌TGF-β降低了支气管灌洗液中Th2相关炎症因子及血清中IgG1、IgE的水平,从而减轻了免疫炎症反应。另有学者认为干细胞可分泌抗菌肽段,通过生物学效应抑制细菌生长,并增强单核巨噬细胞噬菌能力[6, 18]。
我们在前期实验中发现BMSCs与大肠埃希菌共培养时,可减缓大肠埃希菌生长速度及数量。本实验发现经静脉单纯注入BMSCs或MEUS并不能改善前列腺组织炎症反应,而经静脉注入MEUS复合超声辐照后,再注入BMSCs,可观察到BMSCs在前列腺内聚集,明显减轻前列腺组织炎症反应。本研究结果表明BMSCs可减轻大鼠前列腺的炎症反应,其作用可能与降低组织内TNF-α、IL-1β分泌有关。
超声波在临床诊断中被广泛应用,同时作为一种能量,具有“机械效应、热效应、空化效应”[19],在临床疾病治疗中也得到应用。当发生空化效应时,微射流、冲击波等物理机械能可以导致细胞间紧密连接开放,细胞膜通透性增高[20, 21]。超声造影剂微泡注入静脉内,在超声波协助下发生周期性震荡及“内爆”现象,可增强超声空化效应,降低空化超声波峰值负压及空化阈值,增强超声波生物学效应,开放血管内皮细胞间紧密连接[22]。毛细血管内皮细胞间紧密连接参与血-前列腺屏障构成[23]。课题组早期实验成果已证实血-前列腺屏障阻碍药物进入前列腺间质内,超声复合微泡能够增加大分子药物通透性[24, 25]。血-前列腺屏障同样也阻碍BMSCs进入前列腺内,影响其抑炎作用,而超声复合微泡可开放血-前列腺屏障,促进BMSCs向前列腺归巢,其作用机制可能与超声复合微泡破坏血管内皮紧密连接有关。
由于抗菌药物的广泛及不规则使用,耐药菌株不断出现,同时抗菌药物在前列腺组织内维持时间短,加重了治疗难度[26]。本实验利用超声复合微泡促进BMSCs向大鼠前列腺内归巢,有效地减少了促炎因子TNF-α、IL-1β分泌,减轻了前列腺炎症反应。Zhang等[27]学者在BMSCs治疗急性肺炎的研究中得到相近结果。
本实验仅初步探讨了BMSCs对CBP的治疗作用,今后还需进一步研究BMSCs抗炎的具体作用机制 及远期治疗效果。我们下一步研究将会探索BMSCs对抗生素的协同作用,为BMSCs治疗CBP提供理论依据。
| [1] | Wagenlehner F M, Weidner W, Pilatz A, et al. Urinary tract infections and bacterial prostatitis in men[J]. Curr Opin Infect Dis, 2014, 27(1): 97-101. |
| [2] | Ma S, Xie N, Li W, et al. Immunobiology of mesenchymal stem cells[J]. Cell Death Differ, 2014, 21(2): 216-225. |
| [3] | Comoli P, Ginevri F, Maccario R, et al. Human mesenchymal stem cells inhibit antibody production induced in vitro by allostimulation[J]. Nephrol Dial Transplant, 2008, 23(4): 1196-1202. |
| [4] | Elkahwaji J E, Zhong W X, Hopkins W J, et al. Chronic bacterial infection and inflammation incite reactive hyperplasia in a mouse model of chronic prostatitis[J]. Prostate, 2007, 67(1): 14-21. |
| [5] | 赵玉金, 李瑶琛, 赖洁娟, 等.大鼠骨髓间充质干细胞体外培养条件的优化及生物学特性[J].第三军医大学学报, 2010, 32(20): 2163-2167. |
| [6] | Krasnodembskaya A, Samarani G, Song Y L, et al. Human mesenchymal stem cells reduce mortality and bacteremia in gram-negative sepsis in mice in part by enhancing the phagocytic activity of blood monocytes[J].Am J Physiol Lung Cell Mol Physiol, 2012, 302(10): L1003-L1013. |
| [7] | Zhu Y G, Feng X M, Abbott J, et al. Human mesenchymal stem cell microvesicles for treatment of Escherichia coli endotoxin-induced acute lung injury in mice[J]. Stem Cells, 2014, 32(1): 116-125. |
| [8] | Yoon B I, Bae W J, Choi Y S, et al. The anti-inflammatory and antimicrobial effects of anthocyanin extracted from black soybean on chronic bacterial prostatitis rat model[J]. Chin J Integr Med, 2013, [Epub ahead of print] |
| [9] | Tirino V, Paino F, d’Aquino R, et al. Methods for the identification, characterization and banking of human DPSCs: current strategies and perspectives[J]. Stem Cell Rev, 2011, 7(3): 608-615. |
| [10] | Shi Y, Hu G, Su J, et al. Mesenchymal stem cells: a new strategy for immunosuppression and tissue repair[J]. Cell Res, 2010, 20(5): 510-518. |
| [11] | Le-Blanc K, Frassoni F, Ball L, et al. Mesenchymal stem cells for treatment of steroid-resistant, severe, acute graft-versus-host disease: a phase Ⅱ study[J]. Lancet, 2008, 371(9624): 1579-1586. |
| [12] | Sun L, Akiyama K, Zhang H, et al. Mesenchymal stem cell transplantation reverses multiorgan dysfunction in systemic lupus erythematosus mice and humans[J]. Stem Cells, 2009, 27(6): 1421-1432. |
| [13] | Krysko D V, Denecker G, Festjens N, et al. Macrophages use different internalization mechanisms to clear apoptotic and necrotic cells[J]. Cell Death Differ, 2006, 13(12): 2011-2022. |
| [14] | Shi Y, Su J, Roberts A I, et al. How mesenchymal stem cells interact with tissue immune responses[J]. Trends Immunol, 2012, 33(3): 136-143. |
| [15] | Ma X L, Liu K D, Li F C, et al. Human mesenchymal stem cells increases expression of α-tubulin and angiopoietin 1 and 2 in focal cerebral ischemia and reperfusion[J]. Curr Neurovasc Res, 2013, 10(2): 103-111. |
| [16] | Elman J S, Li M, Wang F, et al. A comparison of adipose and bone marrow-derived mesenchymal stromal cell secreted factors in the treatment of systemic inflammation[J]. J Inflamm (Lond), 2014, 11(1): 1. |
| [17] | Nemeth K, Keane-Myers A, Brown T M, et al. Bone marrow stromal cells use TGF-beta to suppress allergic responses in a mouse model of ragweed-induced asthma[J]. Proc Natl Acad Sci U S A, 2010, 107(12): 5652-5657. |
| [18] | Mei S H, Haitsma J J, Dos-Santos C C, et al. Mesenchymal stem cells reduce inflammation while enhancing bacterial clearance and improving survival in sepsis[J]. Am J Respir Crit Care Med, 2010, 182(8): 1047- 1057. |
| [19] | 冯若.超声空化与超声医学[J].中华超声影像学杂志, 2004, 13(1): 63-65. |
| [20] | Prentice P, Cuschieri A, Dholakia K, et al. Membrane disruption by optically controlled microbubble cavitation[J]. Nat Phys, 2005, 1(2): 107-110. |
| [21] | Doinikov A A, Bouakaz A. Theoretical investigation of shear stress generated by a contrast microbubble on the cell membrane as a mechanism for sonoporation[J]. J Acoust Soc Am, 2010, 128(1): 11-19. |
| [22] | Liu Z, Gao S, Zhao Y, et al. Disruption of tumor neovasculature by microbubble enhanced ultrasound: a potential new physical therapy of anti-angiogenesis[J]. Ultrasound Med Biol, 2012, 38(2): 253-261. |
| [23] | 钟惟德, 何慧婵, 陈玉祥, 等. 医用硅纳米粒跨越血前列腺屏障的实验研究[J].中华泌尿外科杂志, 2004, 25(5): 340-342. |
| [24] | Liu Y, Yi S, Zhang J, et al. Effect of microbubble-enhanced ultrasound on prostate permeability: a potential therapeutic method for prostate disease[J]. Urology, 2013, 81(4): 921.e1- 921.e7. |
| [25] | Li T, Liu G, Li J, et al. Mechanisms of prostate permeability triggered by microbubble-mediated acoustic cavitation[J].Cell Biochem Biophys, 2012, 64(2): 147-153. |
| [26] | 陈江川, 刘永亮, 刘政, 等. 低功率超声辐照微泡造影剂对大鼠前列腺内伊文思蓝浓度的影响[J]. 中国医学影像学杂志, 2014, 22(1): 4-6, 11. |
| [27] | Zhang H, Fang J, Su H, et al. Bone marrow mesenchymal stem cells attenuate lung inflammation of hyperoxic newborn rats[J].Pediatr Transplant, 2012, 16(6): 589-598. |





