2. 400042 重庆,陆军特色医学中心妇产科
2. Department of Gynaecology and Obstetrics, Army Medical Center of PLA, Chongqing, 400042, China
热应激(heat stress,HS)是由于环境温度升高所致组织器官的应激性反应[1]。研究证明,热应激可导致睾丸萎缩、精子发生受阻、睾酮水平降低等[2],是导致男性不育的重要因素之一[3],需要寻找防治途径。据研究报道,当小鼠的睾丸暴露于热应激时,睾丸内过氧化氢含量增加,诱发睾丸细胞脂质过氧化,导致抗氧化酶超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活性降低,细胞抗氧化能力下降导致氧化应激[4]。Keap1-Nrf2信号通路是细胞抗氧化应激损伤的重要机制之一[5-6],热应激对睾丸损伤是否与该通路有关值得深入探讨。
人参是中医临床“补气”要药,有“扶正祛邪”功效。有研究证明,人参皂苷Rg1是人参重要的药物活性成分之一,具有抗炎、抗氧化和抗衰老等多种药理作用[7-8]。既往研究证明,人参皂苷Rg1能拮抗氧化致衰剂D-半乳糖(D-gal)对睾丸的损伤,其机制可能与其抗氧化作用有关[9-10],但人参皂苷Rg1能否减轻小鼠睾丸热应激损伤尚不清楚。本研究通过构建小鼠睾丸和精母细胞热应激损伤模型,探讨人参皂苷Rg1减轻热应激对小鼠睾丸损伤及其相关机制,旨在为防治热应激对男性生殖功能损伤提供实验依据。
1 材料与方法 1.1 实验动物20只6~8周龄SPF级雄性C57BL/6J小鼠(体质量22~25 g)购自成都药康生物科技有限公司[动物许可证号SCXK(川)2020-034]。小鼠在SPF级动物房中饲养,12 h光照/黑暗循环,室温(22±2) ℃,相对湿度(60±5)%,自由饮水和摄食。
1.2 实验试剂人参皂苷Rg1购于成都曼思特生物科技有限公司,纯度99.99%;小鼠睾酮(T)检测试剂盒购于江苏酶免公司;TUNEL原位细胞凋亡检测试剂盒购于武汉伊莱瑞特生物科技股份有限公司;DMEM培养基、F12培养基购于美国GIBCO公司;Nrf2、Keap1与β-actin抗体购于美国CST公司;Bax与Bcl-2抗体购于美国Santa Cruz公司;HO-1购于英国Abcam公司;Caspase3抗体购于中国塞维尔公司。
1.3 小鼠单次热应激模型构建与实验动物分组20只6~8周龄雄性C57BL/6J小鼠适应性饲养1周,按随机数字表法分为4组,每组5只。对照组(Control组)和热应激组(HS组)小鼠腹腔注射0.9%生理盐水[10 mL/(kg·d)×14 d],热应激+人参皂苷Rg1组(HS+Rg1组)和人参皂苷Rg1组(Rg1组)小鼠腹腔注射人参皂苷Rg1[20 mg/(kg·d)×14 d][11]。HS组与HS+Rg1组小鼠在给药第7天时,4%水合氯醛麻醉小鼠,将小鼠下腹部置于43 ℃水浴中单次热应激30 min。Control组和Rg1组不进行热应激处理。模型构建完成后1 d采集小鼠眼球血,颈椎脱臼处死小鼠,取睾丸和附睾用于后续实验。
1.4 睾丸大体形态与睾丸指数测定建模与给药结束后称小鼠体质量,颈椎脱臼处死小鼠,摘取睾丸,观察大体形态并称量。按公式计算睾丸指数:睾丸指数=睾丸质量(mg)/小鼠体质量(g)。
1.5 睾丸组织病理学观察4%多聚甲醛固定睾丸48 h,制备石蜡切片,HE染色,光学显微镜下观察各组睾丸组织病理学变化,每组随机测量30个生精小管的直径和生精上皮的厚度,并进行统计分析。
1.6 血清睾酮测定采集眼球血制备血清,按照ELISA检测试剂盒说明书检测各组小鼠血清中睾酮水平,并进行数据分析。
1.7 精子浓度和活力取附睾置于1 mL预热的PBS中,将附睾尾部剪成若干段,挤压出精子,置于37 ℃、5% CO2的培养箱中孵育15 min,充分混匀后吸取5 μL滴加于精子专用计数板,计算机辅助精子分析(CASA)系统分析小鼠精子浓度和活力。
1.8 睾丸组织匀浆中氧化与抗氧化指标的检测取各组小鼠睾丸组织制备组织匀浆,离心10 min(4 ℃、12 000 r/min),收集上清液。BCA蛋白浓度测定试剂盒检测上清液蛋白浓度,按照检测试剂盒说明书分别检测各组匀浆中CAT、MDA、SOD水平并进行数据分析。
1.9 精母细胞GC-2spd(ts)热应激模型构建与凋亡检测小鼠精母细胞株GC-2spd(ts)购于湖南丰晖生物科技有限公司,细胞在含10%胎牛血清的DMEM高糖培养基、37 ℃、5% CO2饱和湿度恒温培养箱中培养,选取对数生长期细胞作为实验对象。细胞分组:①对照组(Control),细胞常规培养48 h;②热应激组(HS),细胞常规培养36 h,置于43 ℃水浴中单次热应激30 min,继续培养12 h;③热应激+Rg1组(HS+Rg1),在细胞培养体系中加入Rg1(终浓度50 μmol/L[12]),热应激处理同HS组;④Rg1组,不给予热应激处理,其余同HS+Rg1组。建模结束后用TUNEL原位细胞凋亡检测试剂盒检测精母细胞凋亡,荧光显微镜观察拍照,用Image J计算平均荧光强度,评价各组细胞凋亡情况。
1.10 RT-qPCR检测GC-2spd(ts)细胞氧化应激相关基因表达提取各组GC-2spd(ts)细胞的总RNA,检测总RNA的浓度、纯度和完整性,将mRNA逆转录成cDNA,以cDNA为模板进行qPCR检测分析。以β-actin作为内参基因,用2-ΔΔCt法计算目的基因的相对表达量。
| 种属 | 基因 | 序列5′→3′ |
| 鼠 | GCLC | 正向TCAATGGGAAGGAAGGGGTAT |
| 反向TCCACCTGGCAACAGTCATTAG | ||
| 鼠 | GCLM | 正向TGTGATGCCACCAGATTTGACT |
| 反向CCAATCCTGGGCTTCAATGTC | ||
| 鼠 | NQO1 | 正向CAGCCAATCAGCGTTCGGTA |
| 反向CTGGAAATGATGGGGTTGAAGT |
1.11 GC-2spd(ts)细胞氧化应激和凋亡相关蛋白表达检测
收集各组GC-2spd(ts)细胞,RIPA裂解液裂解细胞,提取总蛋白,BCA法检测总蛋白浓度,将各组样本调至相同浓度,100 ℃水浴5 min使蛋白变性,SDS-PAGE分离胶进行电泳、转膜、封闭,孵育一抗、二抗,用Bio-Rad ChemiDoc MP Imaging System检测GC-2spd(ts)细胞氧化应激和凋亡相关蛋白(Nrf2、Keap1、HO-1、Bax、Bcl-2、Caspase3)表达水平,用Image J软件分析各条带灰度值。
1.12 统计学分析实验数据以x±s表示,多组间比较采用单因素方差分析,使用GraphPad Prism 9.0.0软件生成分析图,P<0.05表示差异有统计学意义。
2 结果 2.1 人参皂苷Rg1减轻热应激对睾丸质量的影响建模结束后,取各组小鼠睾丸,观察大体形态并称量,发现HS组小鼠睾丸质量减轻,体积明显缩小,睾丸指数显著降低。Rg1干预热应激过程,即HS+Rg1组小鼠睾丸质量减轻和体积缩小明显改善,睾丸指数也较HS组显著升高。Rg1对正常小鼠睾丸质量和睾丸指数未见显著影响。各组小鼠体质量差异无统计学意义。见图 1。
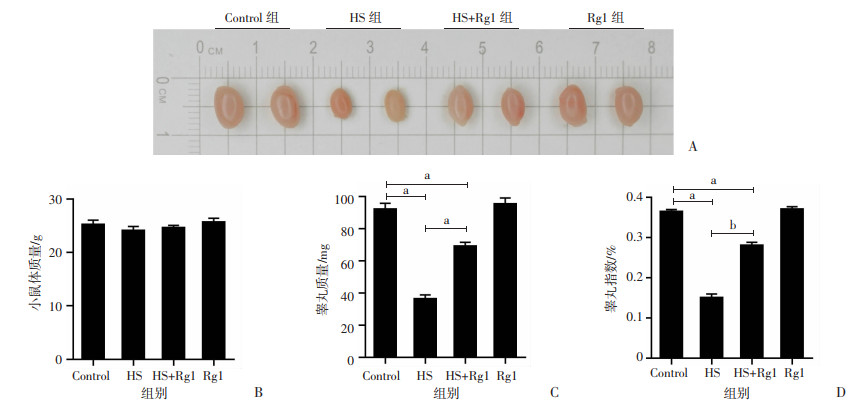
|
|
a:P<0.05 A:小鼠睾丸外观;B:小鼠体质量;C:睾丸质量;D:睾丸指数 图 1 人参皂苷Rg1减轻热应激对睾丸质量和睾丸指数的影响 |
2.2 人参皂苷Rg1减轻热应激对睾丸组织结构的影响
睾丸组织病理学观察结果表明,HS组小鼠睾丸生精小管直径明显变小,生精上皮层数减少,管腔扩大,生精上皮脱落,细胞间出现空泡或坏死,失去精子发生的梯度形态,有些生精小管仅保留基底部的精原细胞;睾丸间质细胞数量明显减少,并出现退变。HS+Rg1组小鼠生精小管损伤明显减轻,生精上皮空泡化明显减少,生精上皮层次减少不明显,未见管腔明显扩张,生精细胞形态基本正常,精子发生的梯度形态明显,管腔内可见精子;间质细胞数量减少不明显,结构基本正常。Rg1对正常小鼠睾丸组织结构未见明显影响(图 2)。
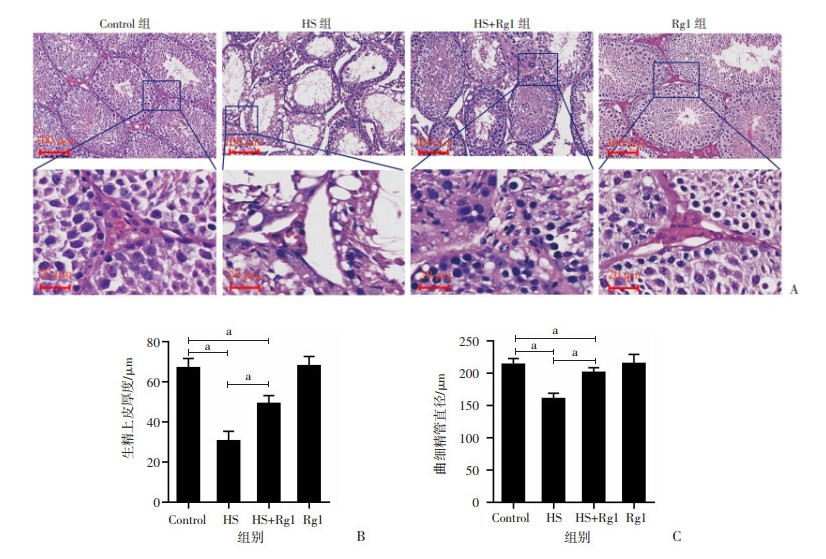
|
|
A:小鼠睾丸HE染色观察 a:P<0.05 B:生精上皮厚度;C:曲细精管直径 图 2 人参皂苷Rg1减轻热应激对睾丸组织结构的影响 |
2.3 人参皂苷Rg1减轻热应激对血清睾酮的影响
血清睾酮检测结果表明,与对照组比较,HS组血清睾酮水平显著降低(P<0.05);经Rg1干预热应激过程后,HS+Rg1组睾酮水平较HS组显著升高(P<0.05); Rg1对正常小鼠血清睾酮水平无明显影响,见图 3。
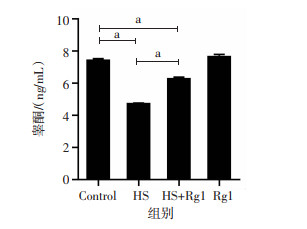
|
| a:P<0.05 图 3 人参皂苷Rg1减轻热应激对血清睾酮的影响 |
2.4 人参皂苷Rg1减轻热应激对附睾精子浓度和活力的影响
CASA分析结果表明,HS组附睾精子浓度和活力显著低于对照组(P<0.05);HS+Rg1组附睾精子浓度和活力明显高于HS组(P<0.05);Rg1对正常小鼠附睾精子浓度和活力未见明显影响,见图 4。
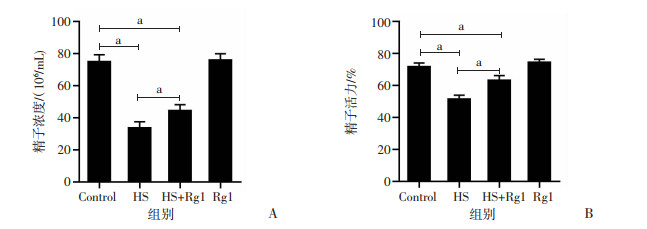
|
|
a:P<0.05 A:精子浓度;B:精子活力 图 4 人参皂苷Rg1减轻热应激对附睾精子浓度和活力的影响 |
2.5 人参皂苷Rg1减轻热应激对睾丸氧化应激指标的影响
氧化应激检测结果表明,与对照组比较,HS组睾丸组织中MDA水平显著升高,CAT和SOD活性明显降低(P<0.05);与HS组比较,HS+Rg1组睾丸组织中MDA水平明显降低,CAT和SOD活性明显升高(P<0.05);Rg1对正常小鼠睾丸组织中MDA水平、CAT和SOD活性无明显影响,见图 5。
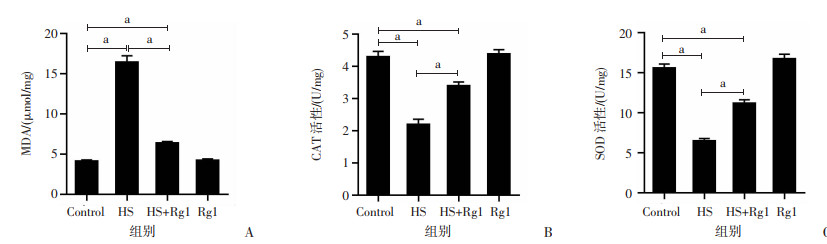
|
|
a:P<0.05 A:MDA水平;B:CAT活性;C:SOD活性 图 5 人参皂苷Rg1减轻热应激对睾丸氧化应激指标的影响 |
2.6 人参皂苷Rg1减轻热应激对GC-2spd(ts)细胞凋亡的影响
通过TUNEL染色检测GC-2spd(ts)细胞凋亡,对照组和Rg1组未见明显凋亡;HS组可见大量GC-2spd(ts)细胞凋亡;与HS组比较,HS+Rg1组GC-2spd(ts)细胞凋亡数量显著减少(P<0.05,图 6)。
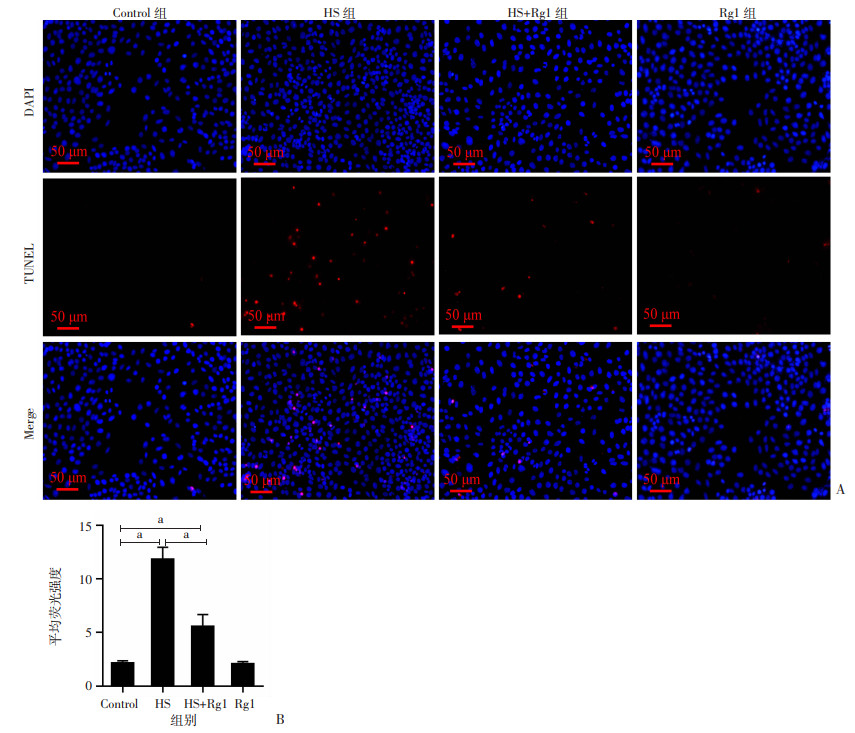
|
|
a:P<0.05 A:小鼠GC-2spd(ts)细胞TUNEL染色;B:TUNEL染色荧光定量分析 图 6 人参皂苷Rg1减轻热应激对GC-2spd(ts)细胞凋亡的影响 |
2.7 人参皂苷Rg1减轻热应激对GC-2spd(ts)细胞凋亡蛋白表达的影响
Western blot结果表明,与对照组比较,HS组GC-2spd(ts)细胞凋亡蛋白Bax和Caspase3表达显著增加(P<0.05),抗凋亡蛋白Bcl-2表达显著降低(P<0.05);与HS组比较,HS+Rg1组GC-2spd(ts)细胞凋亡蛋白Bax和Caspase3表达显著降低(P<0.05),抗凋亡蛋白Bcl-2表达显著增加(P<0.05);与对照组比较,Rg1组GC-2spd(ts)细胞凋亡蛋白Bax、Caspase3和抗凋亡蛋白Bcl-2表达量未见明显改变,见图 7。
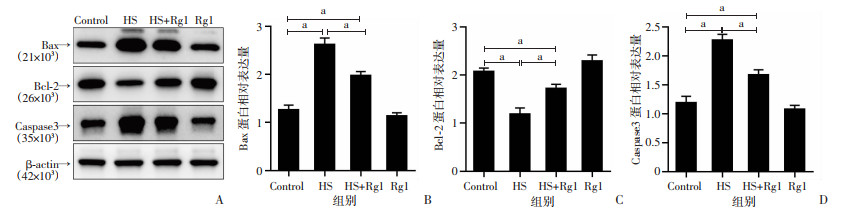
|
|
a:P<0.05 A:Western blot检测Bax、Bcl2和Caspase3蛋白表达;B:Bax蛋白相对表达量;C:Bcl-2蛋白相对表达量;D:Caspase3蛋白相对表达量 图 7 人参皂苷Rg1减轻热应激对GC-2spd(ts)细胞凋亡蛋白表达的影响 |
2.8 人参皂苷Rg1减轻热应激对GC-2spd(ts)细胞Nrf2通路的影响
Western blot结果表明,与对照组比较,HS组GC-2spd(ts)细胞内Nrf2及其下游蛋白HO-1表达显著降低(P<0.05), Keap1蛋白表达显著升高(P<0.05);与HS组比较,HS+Rg1组GC-2spd(ts)细胞内Nrf2及其下游蛋白HO-1表达显著增加(P<0.05), Keap1蛋白表达显著降低(P<0.05);与对照组比较,Rg1组GC-2spd(ts)细胞内Nrf2和Keap1蛋白表达无明显差异,但Nrf2下游蛋白HO-1表达增加。采用RT-qPCR评估Nrf2靶基因GCLC、GCLM和NQO1的相对表达量,结果表明,与对照组比较,HS组Nrf2靶基因GCLC、GCLM和NQO1相对表达量明显降低(P<0.05),Rg1组Nrf2靶基因GCLC、GCLM和NQO1相对表达量明显增加(P<0.05);与HS组比较,HS+Rg1组明显减缓了GCLC、GCLM和NQO1相对表达量的降低(P<0.05),见图 8。
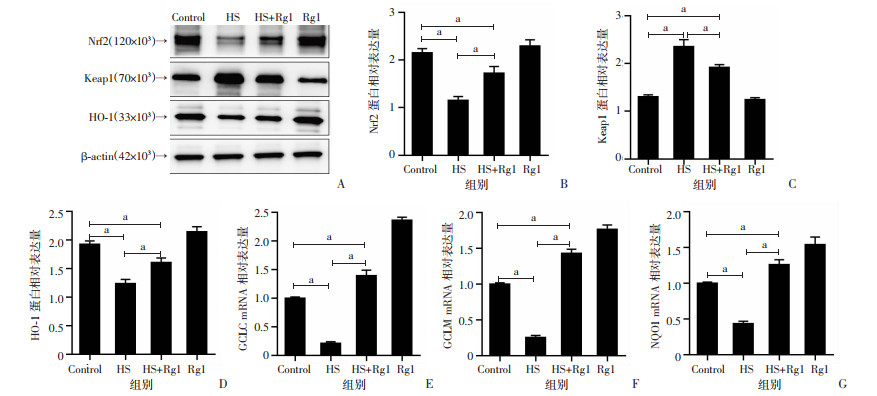
|
|
a:P<0.05 A:Western blot检测Nrf2、Keap1和HO-1蛋白表达;B:Nrf2蛋白相对表达量;C:Keap1蛋白相对表达量;D:HO-1蛋白相对表达量;E:GCLC mRNA相对表达量;F:GCLM mRNA相对表达量;G:NQO1 mRNA相对表达量 图 8 人参皂苷Rg1减轻热应激对GC-2spd(ts)细胞Keap1、Nrf2、HO-1蛋白表达及其下游靶基因表达量的影响 |
3 讨论
热应激是机体受到超过自身体温调节能力高温刺激时所产生的非特异性应答反应。精子发生需要相对低于体内温度的环境,所以哺乳动物的睾丸多位于阴囊内有利于散热[13]。研究表明,环境温度上升、高温作业、疾病发热等对睾丸生精功能和男性生育力有重要影响[14],因此寻找防治高温对睾丸功能的影响成为备受关注的问题。
人参是中医临床“补气”要药,有“扶正祛邪”功效,人参皂苷Rg1是人参中重要的药物活性成分之一,具有抗炎、抗氧化和抗衰老等多种作用[15-16]。课题组既往研究证明,人参皂苷Rg1能拮抗氧化致衰剂对睾丸结构与功能的损伤,提示其机制与其抗氧化作用有关[11-12]。基于前期工作基础,本研究通过构建小鼠睾丸和精母细胞热应激损伤模型,探讨人参皂苷Rg1减轻热应激对小鼠睾丸损伤及其相关机制,旨在为防治热应激对男性生殖功能损伤提供实验依据。
本研究证明,热应激能使睾丸萎缩、睾丸指数降低、生精小管结构损伤、睾丸间质细胞数量减少、精子浓度和活力下降,再次验证了热应激能严重影响男性生殖功能。通过腹腔注射人参皂苷Rg1干预睾丸热应激过程,结果显示,人参皂苷Rg1能明显减轻热应激对睾丸的结构损伤,抑制精子浓度和活力下降,但Rg1对正常小鼠睾丸组织结构、附睾精子浓度与活力并无明显影响,提示人参皂苷Rg1可用于热应激所致睾丸损伤的防护。
本研究通过构建精母细胞热应激损伤模型,探讨热应激对精母细胞损伤的机制。结果证明,热应激可明确诱导GC-2spd(ts)细胞凋亡,且细胞凋亡蛋白Bax和Caspase3表达显著增加,抗凋亡蛋白Bcl-2表达显著降低。在构建热应激细胞模型过程中加入Rg1干预,结果发现,人参皂苷Rg1能显著降低GC-2spd(ts)细胞凋亡蛋白Bax和Caspase3表达,上调抗凋亡蛋白Bcl-2表达,但Rg1对正常GC-2spd(ts)细胞的凋亡无显著影响。结果提示,人参皂苷Rg1可用于减轻热应激所致精母细胞凋亡且没有毒副作用。
睾酮是由睾丸间质细胞分泌的雄性激素,其对促进精子发生、调控男性性功能至关重要[17-19]。本研究表明,睾丸热应激模型小鼠的睾丸间质细胞明显减少,血清睾酮水平明显下降。在构建睾丸热应激损伤模型中采用Rg1干预,结果表明,人参皂苷Rg1可以减轻睾丸间质细胞损伤,阻止睾酮水平下降,但Rg1对正常小鼠睾丸间质细胞结构和睾酮水平无显著影响,对其机制还有待进一步探讨。
热应激损伤与氧化损伤密切相关。热应激时睾丸组织活性氧(ROS)过量累积,打破了细胞氧化还原系统的平衡,睾丸细胞发生脂质过氧化,同时抗氧化酶活性降低,细胞抗氧化能力下降,氧化应激产生[20-22]。同时大量ROS对精子发生起着抑制作用,如果能激活抗氧化应激信号通路可以减轻对生殖细胞的损伤。本研究证明,热应激可以提高睾丸组织中MDA水平,降低CAT和SOD活性,这说明热应激可促进细胞氧化损伤。用Rg1干预热应激过程可降低睾丸组织MDA水平,提高CAT和SOD活性,且Rg1对正常小鼠睾丸组织中MDA水平、CAT和SOD活性无明显影响,这提示Rg1可以减轻氧化损伤,提高细胞抗氧化能力。Nrf2信号通路是细胞抗氧化应答的核心途径,Nrf2信号通路缺失或激活障碍会破坏细胞内正常氧化还原的平衡稳态,进而导致细胞衰老与死亡[23-24]。为探讨人参皂苷Rg1抗氧化损伤的机制,本研究检测了Nrf2及其下游蛋白HO-1的表达情况,Western blot结果表明,与对照组比较,HS组GC-2spd(ts)细胞的Nrf2和HO-1蛋白相对表达量明显降低;与HS组比较,HS+Rg1组GC-2spd(ts)细胞的Nrf2和HO-1蛋白的表达降低受到抑制;与对照组比较,Rg1组GC-2spd(ts)细胞内Nrf2蛋白表达无明显差异,Nrf2下游蛋白HO-1表达增加。RT-qPCR结果表明,与对照组比较,HS组GC-2spd(ts)细胞的Nrf2靶基因GCLC、GCLM和NQO1相对表达量明显降低,Rg1组Nrf2靶基因GCLC、GCLM和NQO1相对表达量明显增加;与HS组比较,HS+Rg1组GC-2spd(ts)细胞的Nrf2靶基因的表达降低受到抑制。Rg1组Nrf2下游蛋白HO-1表达增加,Nrf2靶基因GCLC、GCLM和NQO1相对表达量明显增加,其机制有待进一步研究。Keap1是Nrf2的主要细胞内调节因子[25]。本研究结果表明,人参皂苷Rg1能拮抗热应激所致睾丸组织Keap1蛋白表达的增加,提示热应激可抑制Keap1/Nrf2信号通路,人参皂苷Rg1对睾丸热应激损伤有一定防护作用。
综上所述,人参皂苷Rg1对热应激致小鼠睾丸损伤有明确的防治作用,其机制可能与调控Nrf2抗氧化信号通路有关。
| [1] |
SHAHAT A M, RIZZOTO G, KASTELIC J P. Amelioration of heat stress-induced damage to testes and sperm quality[J]. Theriogenology, 2020, 158: 84-96. |
| [2] |
ZHANG P F, ZHENG Y, LV Y H, et al. Melatonin protects the mouse testis against heat-induced damage[J]. Mol Hum Reprod, 2020, 26(2): 65-79. |
| [3] |
QIN D Z, CAI H, HE C, et al. Melatonin relieves heat-induced spermatocyte apoptosis in mouse testes by inhibition of ATF6 and PERK signaling pathways[J]. Zool Res, 2021, 42(4): 514-524. |
| [4] |
SUI J X, FENG Y N, LI H T, et al. Baicalin protects mouse testis from injury induced by heat stress[J]. J Therm Biol, 2019, 82: 63-69. |
| [5] |
ZHANG J, LIU J, LIU J W, et al. Targeting Keap1 with Inulae Herba activated the Nrf2 receptor to alleviate LPS-mediated acute lung injury[J]. J Ethnopharmacol, 2024, 319(Pt 3): 117358. |
| [6] |
ZHANG J Y, SUN X, CHAI X H, et al. Curcumin mitigates oxidative damage in broiler liver and ileum caused by aflatoxin B1-contaminated feed through Nrf2 signaling pathway[J]. Animals, 2024, 14(3): 409. |
| [7] |
ZHU A N, DUAN Z G, CHEN Y R, et al. Ginsenoside Rh4 delays skeletal muscle aging through SIRT1 pathway[J]. Phytomedicine, 2023, 118: 154906. |
| [8] |
KIM A, PARK S M, KIM N S, et al. Ginsenoside Rc, an active component of Panax ginseng, alleviates oxidative stress-induced muscle atrophy via improvement of mitochondrial biogenesis[J]. Antioxidants, 2023, 12(8): 1576. |
| [9] |
WANG Z L, WANG L, JIANG R, et al. Ginsenoside Rg1 prevents bone marrow mesenchymal stem cell senescence via NRF2 and PI3K/Akt signaling[J]. Free Radic Biol Med, 2021, 174: 182-194. |
| [10] |
HOU J Y, MA R X, ZHU S S, et al. Revealing the therapeutic targets and mechanism of ginsenoside Rg1 for liver damage related to anti-oxidative stress using proteomic analysis[J]. Int J Mol Sci, 2022, 23(17): 10045. |
| [11] |
WANG Z L, CHEN L B, QIU Z, et al. Ginsenoside Rg1 ameliorates testicular senescence changes in D-gal-induced aging mice via anti-inflammatory and antioxidative mechanisms[J]. Mol Med Rep, 2018, 17(5): 6269-6276. |
| [12] |
WANG Z L, DU K H, HOU J Y, et al. Rg1 alleviates oxidative stress and spermatogonium apoptosis in D-gal-induced testicular toxicity by activating Akt[J]. Redox Rep, 2023, 28(1): 2206197. |
| [13] |
HU S Q, LIU D L, LI C R, et al. Wuzi-Yanzong prescription alleviates spermatogenesis disorder induced by heat stress dependent on Akt, NF-κB signaling pathway[J]. Sci Rep, 2021, 11(1): 18824. |
| [14] |
BAI L, ZHANG Y P, ZHENG C M, et al. Tanshinone ⅡA protects mouse testes from heat stress injury by inhibiting apoptosis and TGFβ1/Smad2/Smad3 signaling pathway[J]. Cell Stress Chaperones, 2023, 28(6): 749-759. |
| [15] |
HE F, YAO G P. Ginsenoside Rg1 as a potential regulator of hematopoietic stem/progenitor cells[J]. Stem Cells Int, 2021, 2021: 4633270. |
| [16] |
XIANG Y, WANG S H, WANG L, et al. Effects of ginsenoside Rg1 regulating Wnt/β-catenin signaling on neural stem cells to delay brain senescence[J]. Stem Cells Int, 2019, 2019: 5010184. |
| [17] |
RADMANESH F, RAZI M, SHALIZAR-JALALI A. Curcumin nano-micelle induced testicular toxicity in healthy rats; evidence for oxidative stress and failed homeostatic response by heat shock proteins 70-2a and 90[J]. Biomedecine Pharmacother, 2021, 142: 111945. |
| [18] |
JEREMY M, GURUSUBRAMANIAN G, ROY V K, et al. Co-treatment of testosterone and estrogen mitigates heat-induced testicular dysfunctions in a rat model[J]. J Steroid Biochem Mol Biol, 2021, 214: 106011. |
| [19] |
CHEN Y F, YU T Z. Testosterone mediates hyperthermic response of mice to heat exposure[J]. Life Sci, 2018, 214: 34-40. |
| [20] |
GAO P, ZHUANG J M, CHEN H R, et al. 5-Aminolevulinic acid combined with ferrous iron ameliorates scrotal heat stress-induced spermatogenic damage by enhancing HO-1 expression[J]. Mol Biol Rep, 2023, 50(6): 4999-5011. |
| [21] |
YU T Z, DOHL J, PARK Y M, et al. Protective effects of dietary curcumin and astaxanthin against heat-induced ROS production and skeletal muscle injury in male and female C57BL/6J mice[J]. Life Sci, 2022, 288: 120160. |
| [22] |
HOUSTON B J, NIXON B, MARTIN J H, et al. Heat exposure induces oxidative stress and DNA damage in the male germ line[J]. Biol Reprod, 2018, 98(4): 593-606. |
| [23] |
SHAW P, CHATTOPADHYAY A. Nrf2-ARE signaling in cellular protection: mechanism of action and the regulatory mechanisms[J]. J Cell Physiol, 2020, 235(4): 3119-3130. |
| [24] |
NAKAMURA B N, LAWSON G, CHAN J Y, et al. Knockout of the transcription factor NRF2 disrupts spermatogenesis in an age-dependent manner[J]. Free Radic Biol Med, 2010, 49(9): 1368-1379. |
| [25] |
BELLEZZA I, GIAMBANCO I, MINELLI A, et al. Nrf2-Keap1 signaling in oxidative and reductive stress[J]. Biochim Biophys Acta Mol Cell Res, 2018, 1865(5): 721-733. |




