2. 154007 黑龙江 佳木斯,佳木斯大学临床医学院
2. Clinical Medical School, Jiamusi University, Jiamusi, Heilongjiang Province, 154007, China
鲍曼不动杆菌(Acinetobacter baumannii, Ab)属于革兰阴性菌,是一种严格需氧的机会致病菌,广泛存在于自然界中[1]。Ab为一种常见的院内感染致病菌,通常会引起菌血症、肺炎、脑膜炎、腹膜炎、心内膜炎以及泌尿道和皮肤感染[2]。同时,Ab也是战斗受伤军事人员的重要感染源[3-4]。Ab耐药性产生迅速,耐多药Ab菌株目前在世界范围内普遍存在,对头孢菌素、碳青霉烯类等特殊级抗生素均已产生不同程度的耐药[5-6]。据报道,Ab对碳青霉烯类药物的耐药率全国平均为53.4%,其中河南省最高,为71.6%,给卫生保健系统造成沉重负担[5-8]。
针对Ab耐药严重的现状,WHO将Ab疫苗列为遏制其耐药性蔓延新医疗对策的重中之重[9]。虽然目前已经开发了减毒活疫苗、外膜囊泡/复合物疫苗、DNA疫苗和亚单位疫苗等,并且在动物模型上取得了部分有希望的结果[9],但至今还没有针对Ab的候选疫苗进入临床试验[10]。
Ab感染潜伏期和感染期相对较短,感染最典型的发生于重症监护环境中接受机械通气的患者[2],因此快速、短效的保护措施变得尤为重要,也给疫苗研发带来挑战。Toll样受体(toll-like receptors, TLRs)能够识别病原相关分子模式等先天免疫受体,可能通过激活先天免疫对病原体做出快速反应[11]。TLR2是一种跨质膜受体,其激动剂主要为脂肽;TLR9定位于内体膜,其激动剂为含有CpG基序的DNA[11]。TLR在呼吸道上皮细胞和肺部免疫细胞高表达[12],经鼻免疫可以有效作用于呼吸道,发挥清除病毒作用[13]。TLR9激动剂CpG ODN在2017年首次被批准用于临床,其作为疫苗佐剂的研究也相继被报道[14]。已有许多研究表明,TLR2/TLR9激动剂组合雾化吸入可以诱导对小鼠呼吸道病毒感染的保护,如致命流感肺炎、H1N1流感[15-17],其机制可能依赖于肺上皮细胞MyD88反应和杀灭微生物活性氧的产生[17]。
有证据表明,TLR2敲除小鼠在感染Ab后1 d,肺泡灌洗液中的细菌载量和IL-2、CXCR2水平增加[18-19]。Ab OmpA蛋白通过TLR2依赖的NF-кB途径促进NLRP3炎症小体的组装,并抑制蛋白酶体对胱天蛋白酶-1的降解,从而在细胞外释放大量成熟的IL-1β/IL-18和其他促炎因子,增强机体的炎症反应[18]。在感染Ab后,TLR9敲除小鼠肺部细菌负荷显著增加,肺部炎性浸润增加,结构损伤更严重,且肺外传播增加,全身细胞因子产生增加。故TLR2/TLR9受体可能与Ab清除相关。然而,TLR2/TLR9激动剂对Ab感染的预防保护作用仍处于空白。本研究初步探索了TLR2/TLR9激动剂对Ab肺部感染的短期保护效果及机制,以期为Ab临床快速预防的难题提供解题思路[20]。
1 材料与方法 1.1 试剂、器材及实验动物胰蛋白胨(生工生物),酵母提取物(生工生物),氯化钠(生工生物),琼脂粉(索莱宝),PBS粉末(中杉金桥),瑞氏-吉姆萨染色液(贝索生物),RPMI 1640培养基(Gbico),DMEM培养基(Gbico),Pam2CSK4(Pam)购于上海吉尔生化有限公司,ODN 1826(CpG)由武汉金开瑞生物工程有限公司合成。分光光度计(日本HITACHI),微量注射器(上海玉研),玻璃匀浆器(南京建成),实验鼠固定板。Ab LAC-4菌株及所用仪器均由陆军军医大学药学与检验医学系微生物与生化药学教研室提供。6~8周龄雌性C57小鼠,体质量17~19 g,购于北京维通利华生物科技有限公司,饲养于本教研室SPF级动物实验室。
1.2 培养基配制取10 g胰蛋白胨粉末、10 g氯化钠粉末和5 g酵母提取物粉末加入1 L超纯水中,均匀混合后在121 ℃、20 min高压蒸汽灭菌下得到LB培养基,锡箔纸密封,可短期保存于4 ℃。取10 g胰蛋白胨粉末、10 g氯化钠粉末、15 g琼脂粉末和5 g酵母提取物粉末加入1 L超纯水中,均匀混合后在121 ℃、20 min条件下高压蒸汽灭菌,趁热于超净台中倒入圆形或方形培养皿,得到固态LB培养基,待凝固后密封置于4 ℃备用。
1.3 细菌培养从-80 ℃取出甘油菌,在超净台中用三线法涂于固态LB平板,置于37 ℃孵箱中过夜培养。待长出清晰完整的单菌落,将单菌落接种于20 mL LB培养基中,在37 ℃、220 r/min摇床中过夜培养(即一次活化),按照1 ∶100比例接种于LB培养基中进行二次活化。
1.4 小鼠肺部感染致死剂量Ab实验 1.4.1 不同剂量Pam+CpG对小鼠感染致死剂量Ab的保护效果将小鼠分为PBS、Pam(0.20 μg)+CpG(0.25 μg)、Pam(0.60 μg)+CpG(0.75 μg)、Pam(1.80 μg)+CpG(2.25 μg)共4组(n=7),滴鼻免疫后24 h感染Ab。
1.4.2 Pam、CpG单独免疫、联合免疫对小鼠感染致死剂量Ab的保护效果将小鼠分为PBS、Pam(0.100 μg)、CpG(0.125 μg)、Pam(0.100 μg)+CpG(0.125 μg)共4组(n=8),滴鼻免疫后24 h感染Ab。PBS、Pam(0.20 μg)、CpG(0.25 μg)、Pam(0.20 μg) +CpG(0.25 μg)共4组(n=9),滴鼻免疫后24 h感染Ab。
1.4.3 滴鼻免疫对小鼠感染致死剂量Ab保护时间将小鼠分为PBS、-1 d Pam(0.20 μg)+CpG(0.25 μg)、-3 d Pam(0.20 μg)+CpG(0.25 μg)、-7 d Pam(0.20 μg)+CpG(0.25 μg)组(n=8),滴鼻免疫后1、3、7 d感染Ab。
1.5 小鼠感染Ab实验与细菌定植实验 1.5.1 菌液浓度调整将二次活化的菌液离心收集,用适量无菌PBS重悬后离心,PBS重复洗涤菌体2次,最后用适量PBS重悬洗净的菌液。将菌液稀释一定倍数,在吸光光度计中测得光密度值D(600)为1.0,此时Ab浓度为1×109 CFU/mL。根据实验需求,将母液稀释一定倍数到指定浓度。
1.5.2 感染Ab实验小鼠滴鼻免疫后24 h、1 d、3 d、7 d腹腔注射适量1%戊巴比妥钠,麻醉后用Ab LAC-4菌株感染小鼠,观察生存状态。
1.5.3 细菌定植实验小鼠眼眶取血后将血液用无菌PBS快速稀释,处死后取肺脏、肝脏、肾脏、脾脏。分别用无菌PBS研磨后梯度稀释,取各个稀释梯度的血液或者匀浆液5 μL点涂于LB平板上。平板倒扣,37 ℃孵箱过夜。
1.6 HE染色PBS、Pam、CpG、Pam+CpG组小鼠感染亚致死剂量Ab,24 h后取小鼠肺脏和肾脏用4%多聚甲醛固定12 h,按照切片、染色、脱水、透化、封片等步骤制成组织切片,光镜下观察。
1.7 A549细胞杀菌实验A549细胞用热灭活1640完全培养基培养过夜。弃掉培养基,加入无双抗的热灭活1640培养基,每孔细胞再加入0.4 μg Pam、0.5 μg CpG或0.4 μg Pam+0.5 μg CpG刺激4 h。然后,每孔加入准确计数的Ab细菌2 000 CFU,继续培养4 h。取细胞上清20 μL梯度稀释,点涂于LB固体平板。37 ℃孵箱过夜,数单菌落。
1.8 RAW264.7细胞吞噬实验RAW264.7细胞用热灭活DMEM完全培养基培养,每孔细胞加入0.4 μg Pam、0.5 μg CpG或0.4 μg Pam+0.5 μg CpG刺激过夜。弃掉培养基,加入无双抗的热灭活DMEM培养基。每孔加入准确计数的Ab细菌5 000 CFU,继续培养1 h。取细胞上清20 μL梯度稀释,点涂于LB固体平板。37 ℃孵箱过夜,数单菌落。
1.9 瑞氏吉姆萨染色实验预先将RAW264.7细胞培养在玻璃载玻片上,按照1.8方法刺激细胞并加入Ab。滴加瑞氏吉姆萨A液于载玻片,覆盖标本染色1 min,滴加瑞氏吉姆萨B液充分混匀,继续染色5 min,而后水洗、干燥、封片、镜检。
1.10 统计学分析数据通过GraphPad Prism 9.4.0软件分析,连续变量以x±s表示,组间差异采用单因素方差分析,P<0.05认为差异有统计学意义。
2 结果 2.1 Pam+CpG滴鼻免疫对致死剂量Ab感染小鼠提供了显著保护效果预防流感时雾化用Pam浓度为8 μmol/L,CpG浓度为2 μmol/L[21],经换算,在本研究中采用0.2 μg Pam和0.25 μg CpG(1倍剂量)、0.6 μg Pam和0.75 μg CpG(3倍剂量)、1.8 μg Pam和2.25 μg CpG(9倍剂量)对小鼠进行滴鼻免疫,24 h后用致死剂量Ab感染小鼠(图 1A),评价不同剂量Pam+CpG对小鼠Ab肺部感染的保护效果,其中1倍剂量Pam+CpG对小鼠提供了最好的保护效果(图 1B)。由于剂量增加并未提升保护效果,小鼠生存率反而有所下降,本研究进一步考察了0.5倍和1倍剂量下,单用Pam或CpG,以及二者合用下对小鼠感染的保护作用。
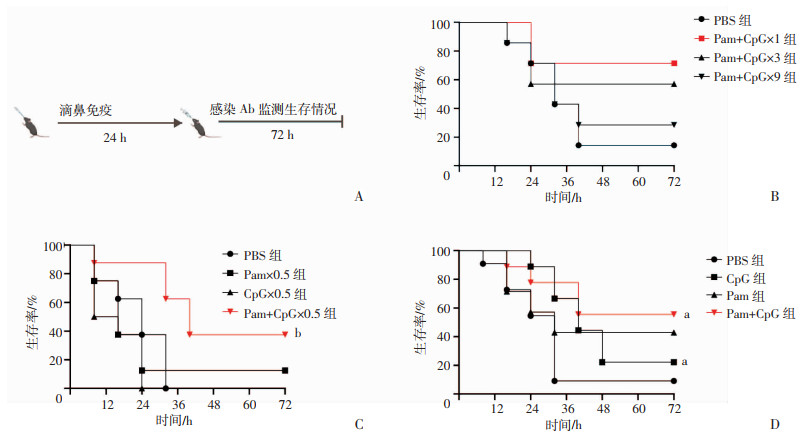
|
|
a:P<0.05,b:P<0.01,与PBS组比较 A:小鼠免疫、感染程序;B:不同剂量Pam+CpG免疫(n=7);C:0.5倍剂量Pam、CpG或Pam+CpG免疫(n=8);D:1倍剂量Pam、CpG或Pam+CpG免疫(n=9) 图 1 各组小鼠感染致死剂量Ab(1.8×107 CFU/只)后生存情况 |
在0.5倍剂量下,单用Pam或CpG小鼠生存率与PBS组相当,Pam+CpG组与PBS组比较有显著差异(P<0.01),保护率为40%(图 1C)。1倍剂量下,单用CpG组和Pam+CpG组小鼠生存率均显著高于PBS组(P<0.05),Pam+CpG组优于单用组,保护率为55.6%(图 1D)。故本研究采用1倍剂量Pam和CpG进行后续实验。
2.2 Pam+CpG显著减少小鼠肺部感染亚致死剂量Ab后各脏器的细菌载量单用Pam或CpG,以及Pam+CpG滴鼻免疫后24 h,小鼠感染亚致死剂量Ab(图 2A)。感染24 h后检测眼眶血、肺脏、肝脏、肾脏、脾脏中细菌的定植量。结果显示:与PBS组比较,Pam+CpG组小鼠血液(P<0.01)、肺脏(P<0.01)、肝脏(P<0.05)、肾脏(P<0.01)、脾脏(P<0.01)的细菌定植量显著下降。Pam、CpG单独使用仅导致脾脏中的定植量显著下降,其他脏器虽然有下降的趋势,但没有统计学差异(图 2B~F)。表明Pam+CpG比单独使用更能降低小鼠细菌载量,可抵抗Ab对小鼠脏器的感染,对小鼠提供保护作用。
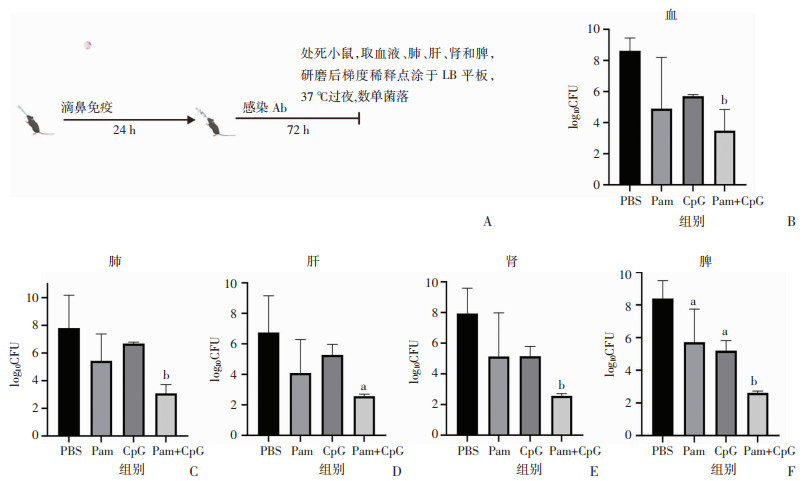
|
|
a:P<0.05,b:P<0.01,与PBS组比较 A:免疫、感染程序及细菌定植量测定;B~F分别为感染亚致死剂量Ab(3×106 CFU)后,小鼠血液、肺脏、肝脏、肾脏和脾脏的细菌定植量 图 2 亚致死剂量Ab肺部感染小鼠后各器官的细菌定植量(n=5,x±s) |
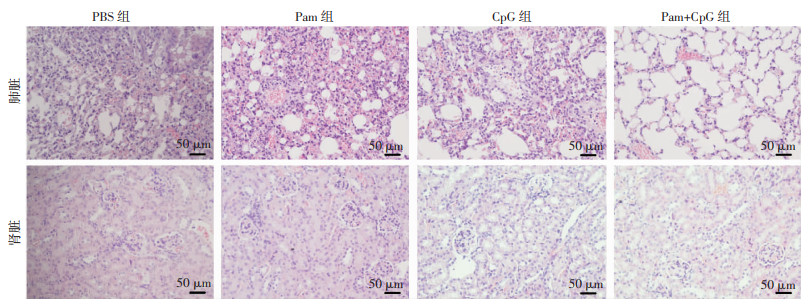
2.3 Pam+CpG显著降低小鼠肺部感染亚致死剂量Ab后肺脏、肾脏的炎症病变
Pam、CpG或Pam+CpG滴鼻免疫后24 h,小鼠感染亚致死剂量Ab,24 h后HE染色观察肺脏、肾脏的炎性病变(图 3)。单用组小鼠的病理损伤与PBS组相当,均观察到中性粒细胞增多,肺泡变形膨胀严重。Pam+CpG组小鼠肺脏、肾脏未见明显病理改变或病变相对轻微。以上结果表明Pam+CpG对Ab感染小鼠具有较好的保护作用,能够有效地提高机体对细菌的清除效果,减少Ab对肺脏、肾脏的损伤作用。
|
| 图 3 HE染色观察小鼠肺部感染亚致死剂量Ab后肺脏、肾脏的病理改变 |
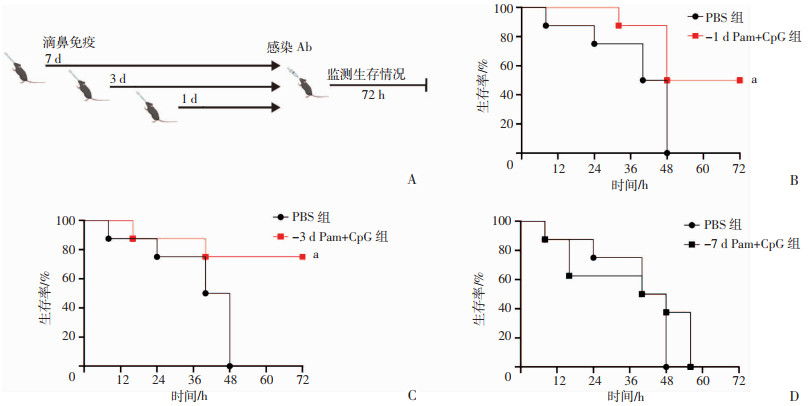
2.4 Pam+CpG滴鼻免疫3 d后对小鼠肺部感染致死剂量Ab提供了最佳的保护效果
为了明确Pam+CpG最佳的起效时间,在Pam+CpG免疫后1、3、7 d分别用Ab感染小鼠(图 4A)。如图 4 B~D所示,免疫1 d和3 d后感染小鼠的生存率与PBS组比较均显著提高(P<0.05),其中免疫3 d后感染的生存率最高,达到75%,7 d后感染与PBS组相当。表明Pam+CpG在滴鼻免疫小鼠后1 d起效,在3 d左右效果最好,7 d以后逐渐失去对抗感染的效果。
|
| A:小鼠免疫感染程序;B~D:分别为Pam+CpG滴鼻免疫1、3、7 d a:P<0.05,与PBS组比较 图 4 Pam+CpG滴鼻免疫后小鼠肺部感染致死剂量Ab(1.8×107 CFU)后的生存情况(n=8,x±s) |
2.5 Pam+CpG可以有效促进A549上皮细胞和RAW264.7细胞对Ab的杀伤或吞噬作用
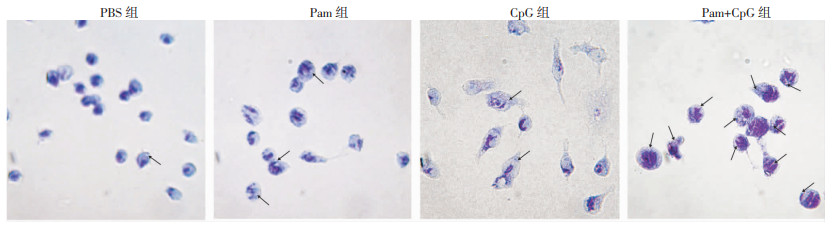
A549上皮细胞或RAW264.7细胞经Pam、CpG或Pam+CpG刺激后与Ab共培养,考察不同刺激组两种细胞对细菌的杀伤或吞噬作用。在两种细胞培养上清中,Pam+CpG刺激组的细菌数量均显著减少(P<0.01,图 5),表明Pam+CpG激活了A549上皮细胞和RAW264.7细胞对细菌的杀伤或吞噬作用。Pam或CpG单独刺激均无促进杀伤或吞噬作用,可能的原因是TLR2和TLR9激动剂在此过程中发挥了协同作用。瑞氏吉姆萨染色观察结果显示(图 6):Pam+CpG刺激组吞噬细菌的能力较PBS组明显增强,Pam组和CpG组吞噬能力也有不同程度增强。以上结果表明:Pam+CpG增强小鼠抵抗感染能力可能是通过促进A549上皮细胞和RAW264.7细胞杀伤或吞噬Ab发挥作用。

|
|
a:P<0.01,与Pam+CPG组比较 A:A549细胞刺激后Ab培养4 h;B:RAW264.7细胞刺激后Ab培养1 h 图 5 A549、RAW264.7细胞经Pam、CpG或Pam+CpG刺激后加入Ab培养的细菌数量(n=3,x±s) |
|
| 图 6 显微镜观察RAW264.7对Ab的吞噬情况(LM ×400) |
3 讨论
传统疫苗免疫周期长、起效速度慢,不能完全满足对院内感染(在入院48 h后出现的感染[22-23])的保护需求。传统疫苗通常包含抗原和佐剂,其中佐剂对于疫苗的安全性和有效性至关重要[24],将抗原加工呈递到免疫效应细胞是适应性免疫发挥病原清除作用的关键[25],且一次只激活对一种病原体的抗原特异性淋巴细胞[20]。过去10年,Ab的候选疫苗主要是通过反向疫苗学和体内动物实验研究验证的亚单位疫苗,虽然取得了一定的研究进展,但由于细菌感染的复杂性以及研发周期较长,至今尚未有一支疫苗成功进入临床试验[26]。
开发一种短期即对入院患者产生预防保护作用的疫苗,能有效防止患者感染院内致病菌进而引发合并疾病和病情加重,对于避免或减轻院内交叉感染具有重要意义。天然免疫用非特异性的方式防止感染[27],可以提供24 h即起效的快速免疫应答,且具有更广泛的病原体靶向性[20]。利用具有佐剂活性的物质激发天然免疫应答,无需抗原即可发挥对病原体快速、短期的保护作用。如真菌配体β葡聚糖可以防止小鼠感染金黄色葡萄球菌,肽聚糖成分胞壁酰二肽可诱导对感染肺炎链球菌和弓形虫小鼠的保护[27]。将TLR2/TLR9激动剂用于呼吸道雾化吸入预防病毒感染,减轻了急性感染的严重程度[17]。有证据表明,巨噬细胞的表观重编程变化以及信号通路调整可能是天然免疫发挥病原体清除作用的机制[20]。
鉴于TLR2/TLR9激动剂针对流感产生较好预防效果以及TLR受体缺失后机体难以抵御Ab,我们探索将其应用于Ab感染的保护。本研究中,TLR2/TLR9激动剂对Ab感染小鼠的保护表现出协同作用,在免疫后1 d或3 d感染小鼠的生存率显著提高,且免疫后3 d保护效果最好。据报道,55%住院患者平均住院时间为4 d[28],TLR2/TLR9激动剂的特性可能提供短期、有效、快速的保护作用,扩大预防药物使用场景,为预防院内感染提供候选方案。小鼠各器官细菌定植情况和HE染色结果表明,TLR2/TLR9免疫组小鼠各脏器细菌载量更低、病理损伤更轻。此外,TLR2/TLR9激动剂发挥作用的机制是刺激上皮细胞和巨噬细胞杀伤或吞噬细菌[29],而非药物本身的抗菌作用。下一步,我们将研究TLR2/TLR9激动剂对小鼠炎性因子、巨噬细胞的调控作用以及表观遗传学变化,阐明其发挥作用的机制,并尝试与其他佐剂进行配伍,提高小鼠生存率,延长保护时间。
| [1] |
YANG N, JIN X, ZHU C, et al. Subunit vaccines for Acinetobacter baumannii[J]. Front Immunol, 2023, 13: 1088130. DOI:10.3389/fimmu.2022.1088130 |
| [2] |
MCCONNELL M J, ACTIS L, PACHÓN J. Acinetobacter baumannii: human infections, factors contributing to pathogenesis and animal models[J]. FEMS Microbiol Rev, 2013, 37(2): 130-155. DOI:10.1111/j.1574-6976.2012.00344.x |
| [3] |
AYOUB MOUBARECK C, HAMMOUDI HALAT D. Insights into Acinetobacter baumannii: a review of microbiological, virulence, and resistance traits in a threatening nosocomial pathogen[J]. Antibiotics, 2020, 9(3): 119. DOI:10.3390/antibiotics9030119 |
| [4] |
JEFFREYS S, CHAMBERS J P, YU J J, et al. Insights into Acinetobacter baumannii protective immunity[J]. Front Immunol, 2022, 13: 1070424. DOI:10.3389/fimmu.2022.1070424 |
| [5] |
AFEKE I, ADU-AMANKWAAH J, NYARKO M, et al. Acinetobacter baumannii-induced infective endocarditis: new insights into pathophysiology and antibiotic resistance mechanisms[J]. Future Microbiol, 2022, 17: 1335-1344. DOI:10.2217/fmb-2021-0279 |
| [6] |
EVANS B A, HAMOUDA A, AMYES S G B. The rise of carbapenem-resistant Acinetobacter baumannii[J]. Curr Pharm Des, 2013, 19(2): 223-238. DOI:10.2174/138161213804070285 |
| [7] |
MA C Y, MCCLEAN S. Mapping global prevalence of Acinetobacter baumannii and recent vaccine development to tackle it[J]. Vaccines, 2021, 9(6): 570. DOI:10.3390/vaccines9060570 |
| [8] |
2022年全国细菌耐药监测报告(简要版). [EB/OL]. [2023-11-20]. https://www.carss.cn/Report/Details?aId=917. National bacterial drug resistance surveillance report 2022(Brief Version). [EB/OL]. [2023-11-20]. https://www.carss.cn/Report/Details?aId=917. |
| [9] |
GELLINGS P S, WILKINS A A, MORICI L A. Recent advances in the pursuit of an effective Acinetobacter baumannii vaccine[J]. Pathogens, 2020, 9(12): 1066. DOI:10.3390/pathogens9121066 |
| [10] |
TAN Y C, LAHIRI C. Promising Acinetobacter baumannii vaccine candidates and drug targets in recent years[J]. Front Immunol, 2022, 13: 900509. DOI:10.3389/fimmu.2022.900509 |
| [11] |
KAUR A, BALDWIN J, BRAR D, et al. Toll-like receptor (TLR) agonists as a driving force behind next-generation vaccine adjuvants and cancer therapeutics[J]. Curr Opin Chem Biol, 2022, 70: 102172. DOI:10.1016/j.cbpa.2022.102172 |
| [12] |
ASHHURST A S, JOHANSEN M D, MAXWELL J W C, et al. Mucosal TLR2-activating protein-based vaccination induces potent pulmonary immunity and protection against SARS-CoV-2 in mice[J]. Nat Commun, 2022, 13(1): 6972. DOI:10.1038/s41467-022-34297-3 |
| [13] |
DELIYANNIS G, WONG C Y, MCQUILTEN H A, et al. TLR2-mediated activation of innate responses in the upper airways confers antiviral protection of the lungs[J]. JCI Insight, 2021, 6(5): e140267. DOI:10.1172/jci.insight.140267 |
| [14] |
LAI C Y, YU G Y, LUO Y P, et al. Immunostimulatory activities of CpG-oligodeoxynucleotides in teleosts: Toll-like receptors 9 and 21[J]. Front Immunol, 2019, 10: 179. DOI:10.3389/fimmu.2019.00179 |
| [15] |
TUVIM M J, GILBERT B E, DICKEY B F, et al. Synergistic TLR2/6 and TLR9 activation protects mice against lethal influenza pneumonia[J]. PLoS One, 2012, 7(1): e30596. DOI:10.1371/journal.pone.0030596 |
| [16] |
TAN A C L, MIFSUD E J, ZENG W G, et al. Intranasal administration of the TLR2 agonist Pam2Cys provides rapid protection against influenza in mice[J]. Mol Phar, 2012, 9(9): 2710-2718. DOI:10.1021/mp300257x |
| [17] |
GOLDBLATT D L, FLORES J R, VALVERDE HA G, et al. Inducible epithelial resistance against acute Sendai virus infection prevents chronic asthma-like lung disease in mice[J]. Br J Pharmacol, 2020, 177(10): 2256-2273. DOI:10.1111/bph.14977 |
| [18] |
LI Y M, LIU L B, XIAO C L, et al. Outer membrane protein A of Acinetobacter baumannii regulates pulmonary inflammation through the TLR2-NF-κB pathway[J]. Vet Microbiol, 2023, 284: 109812. DOI:10.1016/j.vetmic.2023.109812 |
| [19] |
KIM C H, KIM D J, LEE S J, et al. Toll-like receptor 2 promotes bacterial clearance during the initial stage of pulmonary infection with Acinetobacter baumannii[J]. Mol Med Rep, 2014, 9(4): 1410-1414. DOI:10.3892/mmr.2014.1966 |
| [20] |
YAN J, NIELSEN T B, LU P, et al. A protein-free vaccine stimulates innate immunity and protects against nosocomial pathogens[J]. Sci Transl Med, 2023, 15(716): eadf9556. DOI:10.1126/scitranslmed.adf9556 |
| [21] |
LEIVA-JUAREZ M M, KIRKPATRICK C T, GILBERT B E, et al. Combined aerosolized Toll-like receptor ligands are an effective therapeutic agent against influenza pneumonia when co-administered with oseltamivir[J]. Eur J Pharmacol, 2018, 818: 191-197. DOI:10.1016/j.ejphar.2017.10.035 |
| [22] |
ISIGI S S, PARSA A D, ALASQAH I, et al. Predisposing factors of nosocomial infections in hospitalized patients in the United Kingdom: systematic review[J]. JMIR Public Health Surveill, 2023, 9: e43743. DOI:10.2196/43743 |
| [23] |
WEN R L, LI X Y, LIU T T, et al. Effect of a real-time automatic nosocomial infection surveillance system on hospital-acquired infection prevention and control[J]. BMC Infect Dis, 2022, 22(1): 857. DOI:10.1186/s12879-022-07873-7 |
| [24] |
BOSE R J, KIM M, CHANG J H, et al. Biodegradable polymers for modern vaccine development[J]. J Ind Eng Chem, 2019, 77: 12-24. DOI:10.1016/j.jiec.2019.04.044 |
| [25] |
JOHNSTONE C, CHAVES-POZO E. Antigen presentation and autophagy in teleost adaptive immunity[J]. Int J Mol Sci, 2022, 23(9): 4899. DOI:10.3390/ijms23094899 |
| [26] |
LAU Y T, TAN H S. Acinetobacter baumannii subunit vaccines: recent progress and challenges[J]. Crit Rev Microbiol, 2023, 1-16. DOI:10.1080/1040841x.2023.2215303 |
| [27] |
NETEA M G, DOMÍNGUEZ-ANDRÉS J, BARREIRO L B, et al. Defining trained immunity and its role in health and disease[J]. Nat Rev Immunol, 2020, 20(6): 375-388. DOI:10.1038/s41577-020-0285-6 |
| [28] |
BAEK H, CHO M, KIM S, et al. Analysis of length of hospital stay using electronic health records: a statistical and data mining approach[J]. PLoS One, 2018, 13(4): e0195901. DOI:10.1371/journal.pone.0195901 |
| [29] |
GONG X X, ZHAO Q, WU Y F, et al. Mucoid Acinetobacter baumannii enhances anti-phagocytosis through reducing C3b deposition[J]. Front Med, 2022, 9: 879361. DOI:10.3389/fmed.2022.879361 |




