2. 400038 重庆,陆军军医大学(第三军医大学):药学与检验医学系;
3. 400038 重庆,陆军军医大学(第三军医大学):第一附属医院骨科
2. Department of Microbiology and Biochemical Pharmacy, Faculty of Pharmacy and Laboratory Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Department of Orthopaedics, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
癌症是一种严重威胁人类健康的主要公共卫生问题,目前成熟的治疗方法包括化疗、放疗和手术等。近年来,癌症免疫疗法作为一种有效的治疗方案,成为新的临床选择之一,包括细胞因子疗法[1]、免疫检查点阻断剂[2]、嵌合抗原受体T细胞免疫疗法[3]和肿瘤疫苗[4],这些方法都能诱导抗肿瘤免疫[5],其中以肿瘤新抗原为核心的个性化疫苗研究得到了广泛关注[6]。
肿瘤大多来源于自生,又具有极大的多样性和独特的突变性[7],这些突变产生的肿瘤特异性新抗原为肿瘤疫苗提供了新的靶标。抗原多肽是肿瘤新抗原疫苗的主要形式之一,但其在体内易降解,靶向传递效率低,这些缺点限制了其应用[8]。纳米颗粒疫苗递送载体能增强抗原递送效率,诱导显著的免疫应答反应,为克服上述问题提供了新的策略。mi3是从超嗜热厌氧菌海栖热袍菌(Thermotoga maritima)的2-keto-3-deoxy-phosphogluconate(KDPG)醛缩酶改造而来的一种自组装纳米颗粒,含有7个氨基酸突变。它由60聚体组成多孔12面体,在工程菌中可高效表达,稳定性良好,粒径均一,能够有效提高抗原递送效率,增强抗原免疫原性[9],已被应用于抗原递呈、多价疫苗以及药物递送等方面[10-11]。
SpyTag/SpyCatcher系统是从化脓链球菌(Streptococcus pyogenes)纤连蛋白结合蛋白的CnaB2结构域改造而来的[12]。SpyCatcher是免疫球蛋白样蛋白,SpyTag是由13个氨基酸残基组成的短肽,二者能够高亲和力相互作用并自发形成异肽键,常用于蛋白质的共价连接。本研究以mi3为基础,在mi3的N端连接SpyCatcher构建SpyCatcher-mi3纳米颗粒疫苗递送载体;在CD8+T细胞表位肽OVA257-264的C端连接SpyTag形成OVA257-264-SpyTag[13],通过SpyTag/SpyCatcher系统形成的异肽键,构建新型递送OVA257-264表位肽的纳米颗粒疫苗OVA257-264-mi3,并对SpyCatcher-mi3纳米颗粒疫苗递送载体在肿瘤疫苗中的应用进行研究。
1 材料与方法 1.1 实验动物C57BL/6小鼠,6~8周龄,18~20 g,SPF级,雌性,购自北京维通利华实验动物技术有限公司。
1.2 菌株与细胞SpyCatcher-mi3的编码基因(MH425515)由南京金斯瑞生物科技有限公司构建[14],连接至载体pGEX-6P-1后,转化至E.coli BL21(DE3)大肠杆菌感受态细胞中,制得pGEX-6P-1-SpyCatcher-mi3/E.coli BL21(DE3)工程菌;E.G7-OVA细胞(小鼠T淋巴瘤细胞系)购自美国模式培养物集存库。
1.3 多肽合成OVA257-264-SpyTag序列为SIINFEKLGGGGSAHIV-MVDAYKPTK,由江苏金斯瑞生物科技有限公司合成,纯度≥95%。
1.4 试剂与仪器GST 4B填料购自Cytiva,PreScission Protease酶购自Cytiva,氨苄青霉素钠购自生工生物,胰蛋白胨购自OXOID,酵母提取物购自OXOID,氨苄抗生素液体LB培养基由氯化钠、胰蛋白胨、酵母提取物和氨苄青霉素钠制得,琼脂购自OXOID,氨苄抗生素固体LB培养基由氯化钠、胰蛋白胨、酵母提取物、琼脂和氨苄青霉素钠制得,RPMI 1640培养基购自GIBCO,4%多聚甲醛购自Biosharp,ELISpot: Mouse IFN-γ (ALP) 购自Mabtech,Poly(I: C) (HMW)VacciGradeTM购自Invivogen,Avant Pure 150纯化仪购自Cytiva,小动物核磁共振成像仪购自Aspec Imaging,ELISpot读板机购自AID。
1.5 SpyCatcher-mi3的表达与纯化pGEX-6P-1-SpyCatcher-mi3/E.coli BL21(DE3)工程菌37 ℃、氨苄抗生素固体LB培养基划线培养,挑取单克隆接种至20 mL氨苄抗生素液体LB培养基,2×g、37 ℃培养16 h后转移至2 L氨苄抗生素液体LB培养基中,3×g、37 ℃培养至OD(600 nm)约0.8,加入0.2 mmol/L IPTG,3×g、22 ℃培养20 h。离心收集菌体至缓冲液[25 mmol/L Tris·HCl (pH=7.8),150 mmol/L NaCl]中超声破碎,破碎后离心上清与GST 4B填料结合,PreScission Protease酶酶切过夜,收集初纯液,初纯液经过阴离子交换层析纯化得到SpyCatcher-mi3蛋白。
1.6 OVA257-264-mi3的制备与理化性质分析SpyCatcher-mi3与OVA257-264-SpyTag通过SpyTag/SpyCatcher蛋白质连接系统,以摩尔比1∶7混合,25 ℃孵育16 h后于100×103 MWCO超滤装置去除游离的OVA257-264-SpyTag,得到高纯度的OVA257-264-mi3。通过SDS-PAGE凝胶电泳、Superose 6 Increase 10/300 GL分子筛层析、动态光散射和透射电镜对OVA257-264-mi3的理化性质进行检测。
1.7 免疫将C57BL/6小鼠按随机数字表法分为OVA257-264-mi3组、OVA257-264组和对照组,每组14只。OVA257-264-mi3组将10 μg OVA257-264-mi3与20 μg PolyI: C佐剂混合,OVA257-264组将10 μg OVA257-264与20 μg PolyI: C佐剂混合,以等体积Tris-Hcl缓冲液为Control组,分别于第0、14、28天腹股沟皮下接种。实验动物遵循3R原则,符合伦理标准(编号:AMUWEC2020100)。
1.8 安全性评估细胞溶血实验将小鼠红细胞用生理盐水稀释为2% V/V的悬液,将不同浓度的OVA257-264-mi3(0、25、50、100、200 μg/mL)与红细胞混合,以H2O为对照37 ℃孵育2 h,在450 nm处检测吸光值。细胞毒性实验将1×105个/孔DC 2.4细胞于96孔培养板中培养24 h弃上清,将不同浓度梯度的OVA257-264-mi3(0、25、50、100、200 μg/mL)加入细胞培养板中培养24 h,向每孔加入10 μL CCK-8溶液继续培养2 h,在450 nm处检测吸光值。实验组和Control组每两天监测小鼠体重,并于末次免疫后第7天取小鼠心、肝、脾、肺、肾浸于4%多聚甲醛,固定后进行石蜡包埋切片,HE染色并采集图像。
1.9 ELISpot末次免疫后第14天,随机取OVA257-264-mi3组、OVA257-264组和对照组小鼠各5只取脾细胞,将脾细胞按3×106个/孔加入活化后的ELISpot预包被板中,实验孔每孔加入10 μg OVA257-264多肽,37 ℃,5% CO2培养箱培养2 d后按ELISpot试剂盒说明书检测小鼠脾细胞分泌IFN-γ的斑点数。
1.10 OVA257-264-mi3保护效果评价末次免疫后第14天,取OVA257-264-mi3组、OVA257-264组和对照组小鼠各5只,将小鼠右侧肩背部毛剃光,麻醉后皮下注射100 μL细胞浓度为1×106个/mL的E.G7-OVA细胞,每2 d记录肿瘤长径和短径,计算肿瘤体积并记录小鼠生存率(当小鼠肿瘤体积超过2000 mm3时处死小鼠),肿瘤体积计算公式:V=π/6×L×W2,L为肿瘤的长,W为肿瘤的宽。荷瘤后第18天,使用核磁共振成像系统(magnetic resonance imaging,MRI)观测小鼠肿瘤生长情况。
1.11 统计学分析采用GraphPad Prism 9软件进行统计学分析,两组数据间采用非配对t检验,多组数据间采用ANOVA单因素方差分析。实验数据以x±s表示。P < 0.05示差异有统计学意义。
2 结果 2.1 OVA257-264-mi3自组装纳米颗粒疫苗的制备与表征pGEX-6P-1-SpyCatcher-mi3/E.coli BL21(DE3)工程菌经IPTG诱导产生以可溶形式表达的SpyCatcher-mi3蛋白,纯化后SpyCatcher-mi3与OVA257-264-SpyTag结合经100 kDa MWCO超滤去除剩余OVA257-264-SpyTag得OVA257-264-mi3(图 1A)。SDS-PAGE凝胶电泳结果显示SpyCatcher-mi3、OVA257-264-SpyTag和OVA257-264-mi3相对分子质量分别约为36、3和37 kDa,与理论值相符。OVA257-264-mi3与SpyCatcher-mi3相比条带向上偏移,经100 kDa MWCO超滤离心后OVA257-264-SpyTag条带消失(图 1B)。Superose 6 Increase 10/300 GL层析柱分子筛实验结果显示,SpyCatcher-mi3、OVA257-264-SpyTag和OVA257-264-mi3的出峰体积分别为13.6、21.0、11.8 mL,与标准蛋白的出峰体积相对比,OVA257-264-mi3的分子量约为669 kDa(图 1C),与理论值相符合。动态光散射结果显示,SpyCatcher-mi3与OVA257-264-mi3都具有良好的分散性,平均直径分别为43.8 nm和91.3 nm(图 1D)。透射电镜观察显示SpyCatcher-mi3与OVA257-264-mi3呈均一的球形颗粒(图 1E)。以上结果表明,本研究成功制备了携带OVA257-264抗原的自组装纳米颗粒疫苗OVA257-264-mi3。
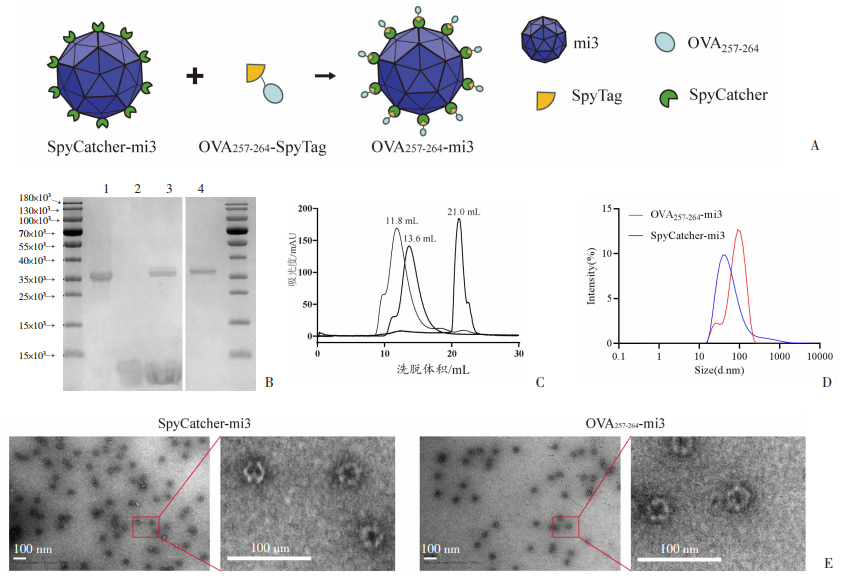
|
| A:SpyCatcher-mi3与OVA257-264-SpyTag结合形成OVA257-264-mi3;B:SDS-PAGE结果 1:SpyCatcher-mi3;2:OVA257-264-SpyTag;3:OVA257-264-SpyTag与SpyCatcher-mi3结合;4:OVA257-264-SpyTag与SpyCatcher-mi3结合后100 kDa MWCO超滤离心;C:分子筛层析结果;D:动态光散射结果;E:SpyCatcher-mi3和OVA257-264-mi3透射电镜图 图 1 OVA257-264-mi3自组装纳米颗粒疫苗的制备与表征 |
2.2 OVA257-264-mi3自组装纳米颗粒疫苗安全性评价
细胞溶血实验和细胞毒性实验结果显示OVA257-264-mi3在不同浓度(0、25、50、100、200 μg/mL)均未发生明显的溶血现象(图 2A),且对DC2.4细胞活率无显著影响(图 2B)。小鼠免疫OVA257-264-mi3后体重变化监测显示,小鼠体重呈上升趋势,未观察到显著差异(图 2C)。且脏器HE染色组织切片结果显示,OVA257-264-mi3组、OVA257-264组和Control组脏器组织切片比较未见明显异常(图 2D)。以上结果表明,OVA257-264-mi3蛋白在体内外具有良好的安全性。
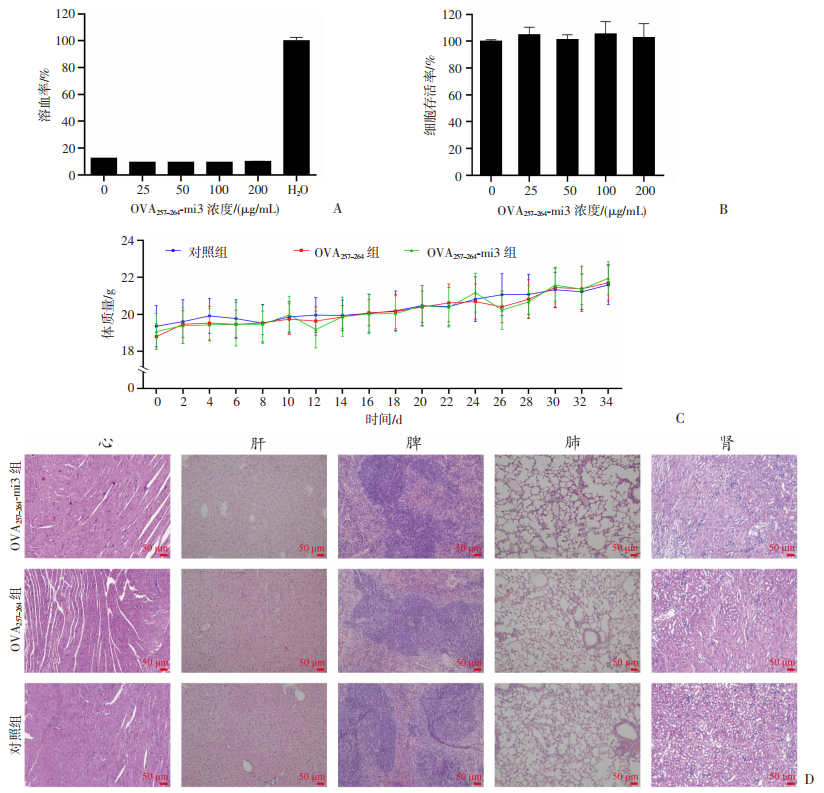
|
| A:不同浓度纳米颗粒疫苗OVA257-264-mi3的溶血实验结果;B:不同浓度纳米颗粒疫苗OVA257-264-mi3的细胞毒性结果;C:免疫后小鼠体重变化情况;D:末次免疫后第14天小鼠脏器HE染色切片 图 2 OVA257-264-mi3纳米颗粒体内外安全性评价 |
2.3 OVA257-264-mi3自组装纳米颗粒疫苗的免疫原性检测
OVA257-264-mi3蛋白与佐剂PolyI: C混合后,分别在第0、14、28天免疫小鼠,末次免疫后第14天通过ELISpot实验检测小鼠脾细胞分泌IFN-γ的细胞数量,评价疫苗诱导产生的免疫应答水平。结果显示,经OVA257-264表位肽刺激后,OVA257-264-mi3组有大量分泌IFN-γ的细胞斑点,而OVA257-264组和Control组几乎未观察到阳性细胞斑点(图 3A)。统计结果显示,OVA257-264-mi3组每1×106个脾脏淋巴细胞中IFN-γ分泌细胞数量达253,显著高于OVA257-264组(P < 0.05,图 3B)。这些结果表明,相较于OVA257-264表位肽,OVA257-264-mi3纳米颗粒疫苗能够显著增强分泌细胞免疫相关因子IFN-γ的细胞数量,增强Th1型特异性免疫应答。
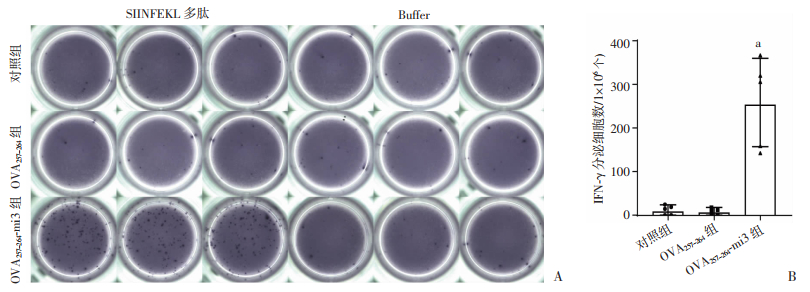
|
| A:不同免疫组分泌IFN-γ的细胞数量典型图像;B:不同免疫组分泌IFN-γ的细胞数量统计学图像,a:P<0.05,与OVA257-264组比较 图 3 不同免疫组小鼠末次免疫后14天ELISpot检测分泌IFN-γ脾淋巴细胞 |
2.4 OVA257-264-mi3自组装纳米颗粒疫苗的免疫保护效果评价
按1.7描述的方法免疫小鼠后,进一步通过皮下E.G7-OVA细胞荷瘤模型评价纳米颗粒疫苗OVA257-264-mi3的免疫保护效果(图 4A)。第18天小动物核磁共振成像结果显示对照组及OVA257-264组小鼠肿瘤组织较大,而OVA257-264-mi3组小鼠未观察到明显的肿瘤生长(图 4B)。肿瘤体积变化监测结果显示对照组小鼠肿瘤生长速度最快,在第14天肿瘤体积平均值达到了约421.1 mm3,OVA257-264组肿瘤体积平均值约为274.3 mm3,而OVA257-264-mi3组未观察到明显的肿瘤生长,提示OVA257-264-mi3组小鼠肿瘤生长受到抑制;第22天时,对照组和OVA257-264组肿瘤体积平均值分别约为1 488.5和1 190.2 mm3,而OVA257-264-mi3组肿瘤体积平均值明显减小,为151.1 mm3,与OVA257-264组相比显著减小(P < 0.05,图 4C)。小鼠生存率结果显示,对照组小鼠在26 d内均达到处死标准,OVA257-264组小鼠在30 d内到达处死标准,而OVA257-264-mi3组小鼠在34 d内仅有2只达到处死标准,与OVA257-264组相比显著延长了荷瘤后生存时间(P < 0.05,图 4D)。以上结果表明OVA257-264-mi3组疫苗的保护效果显著高于OVA257-264组。
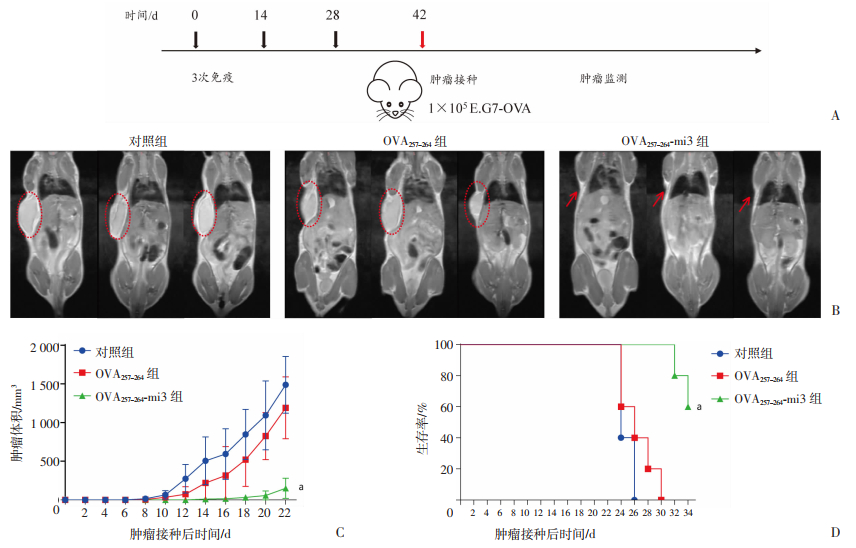
|
| A:荷瘤模型示意图;B:核磁共振成像观察荷瘤小鼠皮下肿瘤生长情况;C:不同免疫组小鼠在皮下注射E.G7-OVA肿瘤细胞后平均肿瘤体积生长曲线,a:P<0.05,与OVA257-264组比较;D:不同免疫组小鼠在皮下注射E.G7-OVA肿瘤细胞后无病生存率,b:P<0.05,与OVA257-264组比较 图 4 OVA257-264-mi3纳米颗粒疫苗保护效果 |
3 讨论
与传统疫苗不同,癌症疫苗针对的是一种来源于宿主自生的,逃脱了免疫压力后才能在临床上有所表现的疾病[7]。癌症具有多样且独特的突变,这些突变带来了新的非自身蛋白免疫识别靶点,也就是新抗原。新抗原的出现为肿瘤个性化疫苗的发展提供了新方向,也带来了新的问题,其主要以人工合成的多肽为主,免疫原性弱、稳定性差、半衰期短、靶向性低,且各患者之间抗原性质差异大,需要个性化定制[6, 8]。因此,本研究构建了纳米颗粒疫苗递送载体SpyCatcher-mi3,并以OVA257-264为免疫原验证了该递送载体在肿瘤疫苗中对表位肽免疫原性和保护效果的增强作用,为SpyCatcher-mi3纳米颗粒针对临床不同患者递送肿瘤新抗原表位肽提供了理论基础。
OVA是疫苗佐剂和递送研究常用的模式抗原之一,其中OVA257-264是该蛋白的CD8+T细胞表位。本研究发现纳米颗粒疫苗OVA257-264-mi3能够诱导显著增强的针对OVA257-264的免疫应答,这可能是由于纳米颗粒提高了抗原的稳定性,防止抗原降解并提高其完整性和溶解度[15]。有研究表明,纳米颗粒疫苗能缓慢释放抗原,增加抗原被免疫系统识别的机会[16]。在小鼠和猪模型上进行的一项关于mi3递送新冠病毒受体结合结构域(receptor binding domain,RBD)的研究中发现,与仅使用RBD免疫组相比,采用mi3纳米颗粒递送RBD免疫组显示出强烈的抗体反应和中和抗体滴度,且更低的免疫剂量也能诱导高滴度的中和抗体反应[17]。
本研究发现纳米颗粒疫苗OVA257-264-mi3能够显著增强细胞免疫相关因子IFN-γ的分泌,提示其可能增强Th1型特异性免疫应答。研究表明,与抗原肽相比纳米疫苗能够提高细胞免疫相关因子IFN-γ的分泌[18]。铁蛋白负载OVA表位肽的研究发现,纳米颗粒被树突状细胞高效摄取诱导特异性CD8+T细胞产生,杀伤特异性靶细胞[19],该结果与本研究发现纳米颗粒疫苗OVA257-264-mi3能够显著提高诱导产生高水平的Th1型应答结果一致。
本文采用了表达OVA的小鼠T淋巴瘤细胞E.G7-OVA构建小鼠荷瘤模型,发现纳米颗粒疫苗OVA257-264-mi3能够诱导针对E.G7-OVA细胞的免疫应答,显著抑制该模型中的肿瘤生长,延长小鼠生存率,发挥更显著的保护效果,这可能与纳米颗粒疫苗的靶向性有关。研究表明聚合物纳米疫苗在肿瘤免疫微环境中可以被特异性的触发,从而促进负载的抗原到达淋巴结中的抗原递呈细胞,内源性的纳米载体所固有的淋巴结靶向能力也能将疫苗递送至淋巴结中[20-21],且粒径20~200 nm的纳米颗粒优先被树突状细胞摄取,更容易引发免疫反应,增强DC细胞的抗原摄取[22]。
| [1] |
BERRAONDO P, SANMAMED M F, OCHOA M C, et al. Cytokines in clinical cancer immunotherapy[J]. Br J Cancer, 2019, 120(1): 6-15. |
| [2] |
BENCI J L, JOHNSON L R, CHOA R, et al. Opposing functions of interferon coordinate adaptive and innate immune responses to cancer immune checkpoint blockade[J]. Cell, 2019, 178(4): 933-948. |
| [3] |
ADACHI K, KANO Y, NAGAI T, et al. IL-7 and CCL19 expression in CAR-T cells improves immune cell infiltration and CAR-T cell survival in the tumor[J]. Nat Biotechnol, 2018, 36(4): 346-351. |
| [4] |
PEREZ C R, DE PALMA M. Engineering dendritic cell vaccines to improve cancer immunotherapy[J]. Nat Commun, 2019, 10(1): 5408. |
| [5] |
CHEN F M, WANG Y J, GAO J, et al. Nanobiomaterial-based vaccination immunotherapy of cancer[J]. Biomaterials, 2021, 270: 120709. |
| [6] |
XIE N, SHEN G B, GAO W, et al. Neoantigens: promising targets for cancer therapy[J]. Signal Transduct Target Ther, 2023, 8(1): 9. |
| [7] |
DUNN G P, BRUCE A T, IKEDA H, et al. Cancer immunoediting: from immunosurveillance to tumor escape[J]. Nat Immunol, 2002, 3(11): 991-998. |
| [8] |
PENG M, MO Y Z, WANG Y A, et al. Neoantigen vaccine: an emerging tumor immunotherapy[J]. Mol Cancer, 2019, 18(1): 128. |
| [9] |
KANG Y F, SUN C, ZHUANG Z, et al. Rapid development of SARS-CoV-2 spike protein receptor-binding domain self-assembled nanoparticle vaccine candidates[J]. ACS Nano, 2021, 15(2): 2738-2752. |
| [10] |
COHEN A A, VAN DOREMALEN N, GREANEY A J, et al. Mosaic RBD nanoparticles protect against challenge by diverse sarbecoviruses in animal models[J]. Science, 2022, 377(6606): eabq0839. |
| [11] |
LEE Y, KIM M, KANG J Y, et al. Protein cages engineered for interaction-driven selective encapsulation of biomolecules[J]. ACS Appl Mater Interfaces, 2022, 14(31): 35357-35365. |
| [12] |
ZAKERI B, FIERER J O, CELIK E, et al. Peptide tag forming a rapid covalent bond to a protein, through engineering a bacterial adhesin[J]. Proc Natl Acad Sci U S A, 2012, 109(12): E690-E697. |
| [13] |
CHOU P Y, LIN S Y, WU Y N, et al. Glycosylation of OVA antigen-loaded PLGA nanoparticles enhances DC-targeting for cancer vaccination[J]. J Control Release, 2022, 351: 970-988. |
| [14] |
BRUUN T U J, ANDERSSON A C, DRAPER S J, et al. Engineering a rugged nanoscaffold to enhance plug-and-display vaccination[J]. ACS Nano, 2018, 12(9): 8855-8866. |
| [15] |
SHAHBAZI M A, SANTOS H A. Revolutionary impact of nanovaccines on immunotherapy[J]. Eur J Mol Clin Med, 2014, 2(2): 44. |
| [16] |
EL-SAY K M, EL-SAWY H S. Polymeric nanoparticles: promising platform for drug delivery[J]. Int J Pharm, 2017, 528(1/2): 675-691. |
| [17] |
TAN T K, RIJAL P, RAHIKAINEN R, et al. A COVID-19 vaccine candidate using SpyCatcher multimerization of the SARS-CoV-2 spike protein receptor-binding domain induces potent neutralising antibody responses[J]. Nat Commun, 2021, 12(1): 542. |
| [18] |
LIU Z H, XU H L, HAN G W, et al. A self-assembling nanoparticle: implications for the development of thermostable vaccine candidates[J]. Int J Biol Macromol, 2021, 183: 2162-2173. |
| [19] |
HAN J A, KANG Y J, SHIN C, et al. Ferritin protein cage nanoparticles as versatile antigen delivery nanoplatforms for dendritic cell (DC)-based vaccine development[J]. Nanomed-Nanotechnol Biol Med, 2014, 10(3): 561-569. |
| [20] |
DING B B, ZHENG P, JIANG F, et al. MnOx nanospikes as nanoadjuvants and immunogenic cell death drugs with enhanced antitumor immunity and antimetastatic effect[J]. Angew Chem Int Ed, 2020, 59(38): 16381-16384. |
| [21] |
WANG S H, GAO J, WANG Z J. Outer membrane vesicles for vaccination and targeted drug delivery[J]. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2019, 11(2): e1523. |
| [22] |
XIANG S D, SCHOLZEN A, MINIGO G, et al. Pathogen recognition and development of particulate vaccines: does size matter?[J]. Methods, 2006, 40(1): 1-9. |




