2. 400038 重庆,陆军军医大学(第三军医大学):军事预防医学系防原医学教研室,全军复合伤研究所,药学与检验医学系药剂学教研室;
3. 400715 重庆,西南大学前沿交叉学科研究院生物学研究中心;
4. 400038 重庆,陆军军医大学(第三军医大学):军事预防医学系防原医学教研室,全军复合伤研究所,军事预防医学系
2. Department of Pharmacoutics, Faculty of Pharmacy and Laboratory Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Biological Science Research Center, Academy for Advanced Interdisciplinary Studies, Southwest University, Chongqing, 400715, China;
4. Faculty of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038
放射复合伤(radiation combined injury,RCI)是战时核武器爆炸与平时核事故发生的重要的、特殊的伤类之一,也可见于临床放疗等病例[1-3]。其中放射损伤合并创伤称为放创复合伤(radiation-wound combined injury,R-W-CI),创伤愈合显著延缓是放创复合伤的突出问题,往往也是导致外源性感染和影响整体救治的重要因素[4-5]。因此,研究放射损伤对创伤愈合影响的细胞与分子机制进而形成有效促愈措施具有重要意义。既往研究表明,辐射(包括全身辐射与局部辐射)可以导致皮肤创面愈合的延缓,并呈现一定的量效与时效关系[1, 4, 6-7]。病理学上表现为:创面炎症反应削弱,呈乏炎性,创伤启动过程延迟;成纤维细胞、上皮细胞等修复细胞增殖受到抑制,肉芽组织的形成和成熟均显著延缓[4-7]。其中,放创复合伤创面炎症反应削弱被认为是修复启动延迟的重要原因[1-4]。基于全身辐射复合皮肤创伤的放射复合伤模型,通常认为电离辐射导致造血组织的系统性抑制和外周血白细胞数量减少与功能降低是这类创面炎症反应削弱的主要原因。然而,一些局部辐射复合皮肤创伤的模型表明,即使没有系统性的造血抑制与外周血白细胞的降低,创面仍然呈现乏炎性为特征的愈合延迟[6-7],提示存在射线所致创面局部的抗炎机制。
血红素加氧酶1(heme oxygenase-1,HO-1)是体内血红素分解代谢的关键酶,可被各种炎症和氧化信号诱导,其在创面愈合过程中表达上调,具有抑制炎症细胞浸润、促进巨噬细胞M2极化等抗炎功能[8-9];同时其也具有抗氧化的重要作用。HO-1对于正常皮肤愈合具有促进作用,研究显示HO-1缺失小鼠与药物抑制模型均表现出创面愈合显著延迟,过度炎症反应是其重要特征;而在糖尿病难愈性创面,存在HO-1表达受损,过表达HO-1可以抗炎改善愈合[10]。同时,在一些感染相关模型,通过干预HO-1调控炎症反应能够实现对感染的控制[11]。然而HO-1在放创复合伤创面的表达模式及功能尚知之甚少。本研究采用小鼠全身6 Gy辐射复合皮肤创伤的放创复合伤模型,研究HO-1在放创复合伤创面持续较高水平表达特点,探讨在创面局部递送针对HO-1的siRNA能否通过调控炎症反应改善肉芽组织形成不良,为放创复合伤创面愈合的治疗摸索新的思路。
1 材料与方法 1.1 材料 1.1.1 动物清洁级健康雄性C57BL/6J小鼠,6~7周龄,共62只,体质量20~25 g,购自斯贝福(北京)生物技术有限公司,许可证号:SCXJ(京)2019-0008。在全军复合伤研究所SPF动物房饲养至8周龄后用于实验。本实验研究中所用动物相关操作均经陆军军医大学实验动物福利伦理委员会批准(AMUWEC20210362)。
1.1.2 主要试剂兔单抗HO-1抗体(ab189491)、Ki67(ab15580)购自英国Abcam公司;兔单抗β-Tubulin抗体(AF1216)、鼠单抗β-actin抗体(AF0003)、BCA蛋白浓度测定试剂盒购自上海碧云天生物科技公司;电泳凝胶试剂盒、电泳液购自上海雅酶生物医药公司;F127购自Sigma公司;高强度RIPA蛋白裂解液(PC101)购自上海雅酶生物科技公司;甲氧基与胆固醇双修饰的siRNA由上海吉玛生物科技公司合成。
1.2 方法 1.2.1 实验动物模型制备C57BL/6J小鼠36只,采用随机数字表法,按照体质量从轻到重将小鼠依次编为1~36号,再按照随机数字顺序与动物编号顺序一一对应分组,分为单纯皮肤创伤组(W组)和合并全身辐射损伤的皮肤创伤组(R-W-CI组),每组18只。W组小鼠给予1%戊巴比妥钠腹腔注射麻醉,剃去后背部毛发,术区常规碘伏消毒,75%酒精脱碘,而后左右对称制备2个直径6 mm圆形创面。将W组致伤时剪去的正常皮肤作为正常对照组(Control组),亦即伤后第0天标本,冻存后用于定量PCR检测与蛋白检测。R-W-CI组小鼠在以钴-60 γ射线进行全身6 Gy(陆军军医大学辐照中心,剂量率0.546 Gy/min)均匀照射制备全身辐射损伤后1 h内按W组小鼠方法制备皮肤创伤[12]。致伤小鼠分别在伤后第0、3、7、10天取创面组织,每组每个时间点取材6只小鼠、12个创面,其中冻存6个创面组织分别用于定量PCR检测(n=5)和蛋白检测(n=4),6个创面以中性甲醛固定用于病理学评价。
1.2.2 皮肤创面愈合W组和R-W-CI组在小鼠致伤后第0、3、7、10天,对创面进行照相,以Image J软件计算创面残留面积。每组取5只小鼠,以每只小鼠第0天的创面面积为参考,计算其伤后3、7、10天的创面残留面积百分比用来表示创面愈合百分比,比较相同时间点2组间的差异。
1.2.3 小鼠外周血检测在W组和R-W-CI组小鼠致伤前2 d和致伤后第1、4、7、10天采集小鼠的尾静脉血,用XT-2000i全自动血液分析仪(日本SYSMEX)检测外周血象,分类记录外周血细胞的动态变化。
1.2.4 siRNA敲降HO-1干预创面的动物实验根据文献合成靶向HO-1基因的siRNA序列为GCUGAC-AGAGGAACACAAA[13],并进行2′Ome和5′Chol修饰增强其稳定性;阴性对照siRNA为公司成品。动物致伤前12 h制备负载siRNA的F127凝胶,其中siRNA的浓度为5 μmol/L,F127浓度为0.3 g/mL,置于4 ℃保存备用。该凝胶具有温敏特性,在低温(4 ℃)呈液态,在37 ℃左右(体温)变为凝胶固态[14]。C57BL/6J小鼠36只,按照随机数字表法分为siRNA敲降HO-1组(si-HO-1组)和siRNA阴性对照组(si-NC组),每组18只。36只小鼠按前述放创复合伤模型致伤,致伤完成后取负载siRNA的F127凝胶60 μL均匀涂抹于每个创面。每组取5只小鼠,于致伤后0、3、9 d对创面进行拍照,并计算创面愈合百分比(n=10)。在致伤后的第1、3、9天取材创面组织,每次取4只小鼠的创面,第9天取5只,分别用于敲降的蛋白检测、定量PCR检测与病理学评价。
1.2.5 定量PCR检测以RNAiso(TaKaRa)提取正常皮肤(Control组)以及W组和R-W-CI组致伤后第3、7、10天创面组织RNA用于检测HO-1的表达;提取siRNA干预后第3天创面组织RNA用于检测IL-1β、IL-6和TNF-α等炎症因子的表达。按照TaKaRa逆转录试剂盒操作说明将RNA逆转录为cDNA,进行定量PCR扩增,采用比较周期阈值方法定量RNA的相对量。引物由擎科生物技术有限公司合成。内参基因TBP:上游引物5′-AAGGGAGAATCATGGACCAG-3′,下游引物5′-CCGTAAGGCATCATTGGACT-3′;HO-1:上游引物5′-CAACATTGAGCTGTTTGAGG-3′,下游引物5′-TGGTCTTTGTGTTCCTCTGTC-3′;IL-1β:上游引物5′-TCTCGCAGCAGCACATCA-3′,下游引物5′-CACAC-ACCAGCAGGTTAT-3′;IL-6:上游引物5′-TGGGAAA-TCGTGGAAATGAG-3′,下游引物5′-CTCTGAAGGACT-CTGGCTTTG-3′;TNF-α:上游引物5′-CCCGGGCTC-AGCCTCTTCTCATTC-3′,下游引物5′-GGATCCGGTGG-TTTGCTACGACGT-3′。
1.2.6 Western blot检测将适量正常皮肤和整个创面组织用液氮在研钵中碾碎,加入高强度RIPA蛋白裂解液(使用前加入磷酸酶抑制剂和蛋白酶抑制剂)后,冰上静置10 min,4 ℃低温离心机12 000×g离心10 min,吸取上清即为组织总蛋白。按照BCA法检测定量蛋白后加入蛋白上样缓冲液制备样品。蛋白样品在SDS-PAGE、凝胶进行电泳分离,随后转印至PVDF膜,用5%脱脂奶粉于37 ℃摇床封闭1 h,加入配制好的一抗于4 ℃摇床孵育过夜,使用PBS在摇床上洗膜后,加入配制好的二抗于37 ℃摇床孵育1 h,再次使用PBS在摇床上洗膜,使用奥德赛显色仪显色成像并测量灰度值。
1.2.7 组织病理学分析以Precipoint M8全自动切片扫描显微镜(德国Precipoint公司)观察、扫描皮肤创面的HE染色图像,以ViewPoint BETA软件系统分析图像。指标测量方法参见文献[14-15]:创面两端皮肤损伤真皮胶原断裂处之间的距离代表创面宽度(μm);测量两端真皮胶原断裂处之间的新生组织面积代表创面新生肉芽组织面积(mm2);测量创面新生角质上皮的迁移距离作为再上皮化长度(μm);测量创面上部坏死痂皮组织的面积作为痂皮面积(mm2)。
1.2.8 Ki67免疫组化染色放创复合伤创面HO-1敲降(si-HO-1)组和对照(si-NC)组第3天的创面组织蜡块切片后进行Ki67免疫组化染色,Ki67一抗工作液(1∶200)用于标记创缘表皮和真皮组织增殖细胞的细胞核。半定量方法参见文献[16],针对表皮,计数创缘增厚表皮Ki67阳性细胞数目,同时测量其对应长度,以每毫米表皮上的Ki67阳性细胞数目进行统计分析;针对创缘真皮组织,计数Ki67阳性细胞数目,同时计算真皮间质面积,以每平方毫米间质中Ki67阳性细胞数目进行统计分析。
1.3 统计学分析采用GraphPad Prism 8.0进行数据处理以及统计学分析,数据以x±s表示,2组间比较采用t检验,P<0.05表示差异具有统计学意义。
2 结果 2.1 合并6 Gy全身辐射损伤对小鼠皮肤创面愈合的影响在致伤后的第0、3、7、10天观察、照相、记录2组小鼠创面愈合变化情况,大体观察发现R-W-CI组小鼠创面愈合延迟明显(图 1A)。W组在伤后第10天已经完全愈合,而R-W-CI组伤后第10天仍然未愈合。测量残留创面面积并计算其相对于0天创面面积的百分比,对数据进行分析显示在伤后第7、10天,R-W-CI组伤口面积显著大于W组(分别为P<0.000 1和P<0.01,图 1B)。进一步取第7天创面组织进行病理学观察发现,W组创面肉芽组织丰富、成熟,已经完成再上皮化;而R-W-CI组创面肉芽生长不良,表现为细胞成分明显减少,再上皮化未完成(图 1C)。这些结果表明:γ射线全身6 Gy照射能够显著延缓皮肤创面的愈合,放创复合伤模型建立成功。
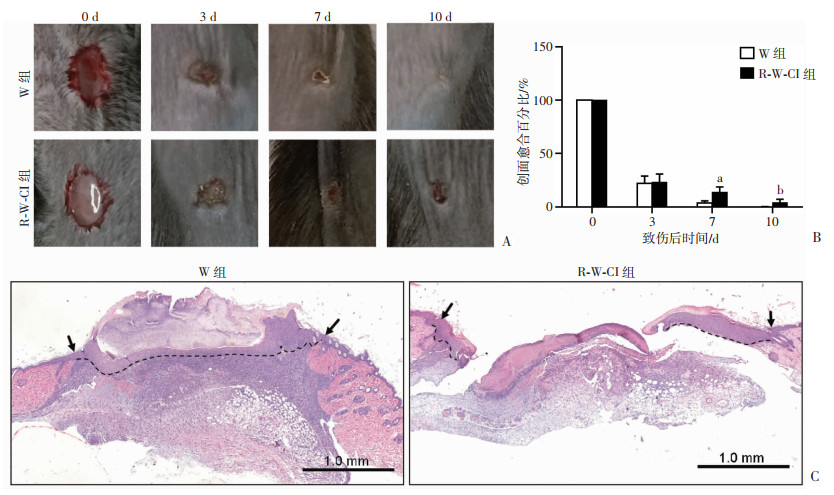
|
| A:2组小鼠致伤后不同时间创面观察;B:2组小鼠创面愈合残留面积的量化比较(n=5,x±s) a:P<0.0001,b:P<0.01,与同时间W组比较;C:2组小鼠创面第7天的HE切片病理观察 ↑:示创面致伤处;虚线:示新生上皮 图 1 放创复合伤创面延缓愈合的模型建立与评价 |
2.2 放创复合伤小鼠早期外周血变化特点
全身辐射会导致造血系统等辐射敏感组织的损伤,进而影响到各类炎症细胞的水平,是导致创面炎症反应削弱的重要原因。为评估本实验模型中R-W-CI组的各类免疫细胞受影响的程度,本研究检测了致伤前2 d和致伤后第1、4、7、10天的外周血细胞水平。结果表明,在致伤的早期,R-W-CI组的白细胞较红细胞与血小板降低得更早、下降的幅度更明显,而W组的外周血各时间点无显著差异(P>0.05,图 2A~C)。R-W-CI组白细胞总数在损伤后第1天即显著下降,持续至检测终点第10天(图 2C)。进一步的白细胞分类计数显示:中性粒细胞相对单核细胞与淋巴细胞下降偏晚,至少在伤后第1天还维持在致伤前水平;而单核细胞与淋巴细胞在致伤后第1天即开始显著降低,到末次检测的第10天未见显著回升迹象(图 2E、F)。
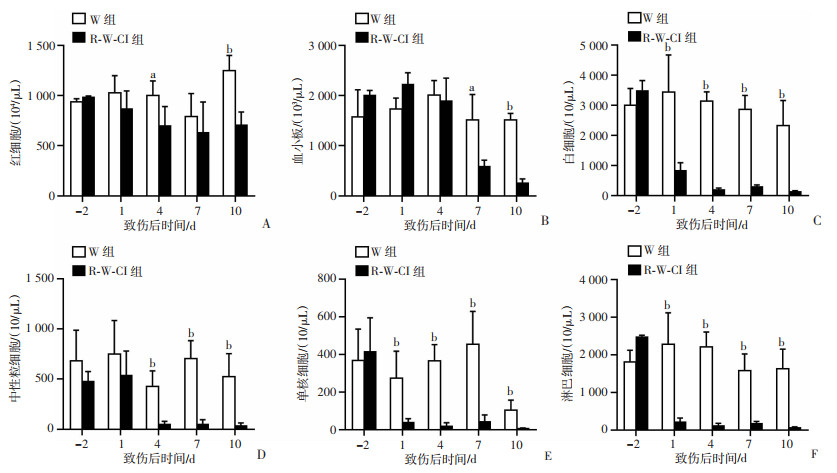
|
|
a:P<0.05,b:P<0.001,与同时间W组比较 A:外周血红细胞在致伤前2 d和致伤第1、4、7、10天的变化;B:外周血血小板计数变化;C:外周血白细胞计数变化;D:外周血中性粒细胞计数变化;E:外周血单核细胞计数变化;F:外周血淋巴细胞计数变化 图 2 2组小鼠致伤前后不同时间外周血象变化(n=8,x±s) |
2.3 HO-1在放创复合伤创面修复过程中的表达变化
Western blot检测HO-1蛋白在创面修复过程中的表达发现,创面组织中检测到32×103和28×103 2种分子量的HO-1蛋白(图 3A)。在单纯皮肤创伤的W组创面组织中,HO-1蛋白在第3天(炎症反应期)表达最高,在第7天(增殖期)随着炎症反应消退有所下降,至第10天基本与正常皮肤水平相当。而在放创复合伤的R-W-CI组创面组织中,HO-1蛋白在第3天表达与W组相当,但其截短形式的细胞核水平有降低的趋势;第7天表达仍与W组相当,但细胞核形式有增高趋势;第10天表达较W组显著增高(P<0.05),且与第7天水平相当(图 3A~D)。进一步以定量PCR检测其mRNA水平,发现R-W-CI组第3天HO-1的表达有低于W组的趋势,但在第7、10天HO-1的表达显著高于W组(P<0.05,图 3E)。研究结果表明:在外周血中性粒细胞、单核巨噬细胞等创面炎症关键细胞水平显著降低的放创复合伤模型,具有抗炎功能的HO-1蛋白在其创面仍维持与单纯皮肤创面相当甚至更高的水平,提示其可能作为局部炎症抑制因素进一步削弱放创复合伤创面的炎症反应,进而延缓愈合。
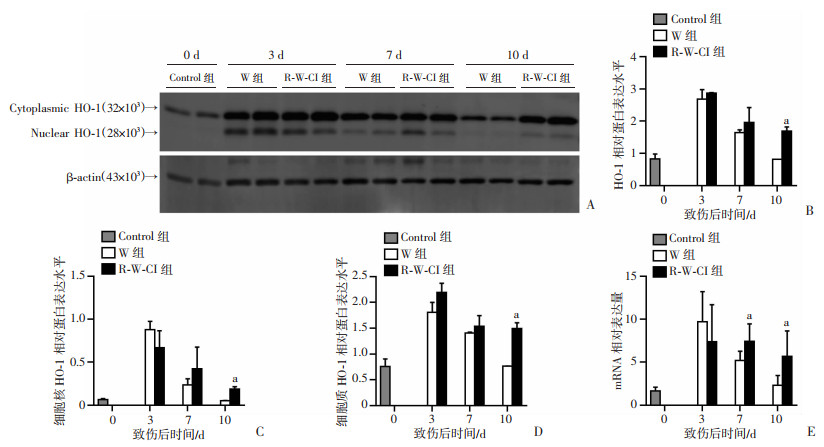
|
|
a:P<0.05,与同时间W组比较 A:HO-1蛋白在2组致伤0、3、7、10 d创面组织的表达变化的Western blot检测;B:HO-1蛋白的半定量分析(n=4,x±s);C:细胞核(截短)HO-1蛋白的半定量分析(n=4,x±s);D:细胞质(全长)HO-1蛋白的半定量分析(n=4,x±s);E:HO-1的定量PCR检测(n=5,x±s) 图 3 HO-1在放创复合伤创面修复中的表达变化 |
2.4 负载siRNA的F127凝胶敲降放创复合伤创面的HO-1蛋白水平效果评价及对创面愈合影响的大体观察
以负载siRNA的F127凝胶涂抹到放创复合伤创面,作用第1天后行Western blot检测表明此方法能够显著抑制创面HO-1的蛋白水平(P<0.05,图 4A、B);而在第3天,针对HO-1的siRNA作用后其蛋白水平虽有下降,但差异无统计学意义(P>0.05,图 4C、D)。这些结果表明,F127凝胶负载的siRNA能够有效的暂时性敲降放创复合伤创面的HO-1蛋白水平。通过测量创面残留面积进一步评估敲降HO-1对放创复合伤创面愈合的影响。结果显示:在si-HO-1干预的第3天,创面残留面积显著缩小,提示敲降HO-1能够促进伤口收缩(P<0.05,图 4E);然而在第9天,si-HO-1组创面残留面积反而较大,其痂皮面积大且厚,提示该组的炎症反应更为明显(P<0.01,图 4F)。
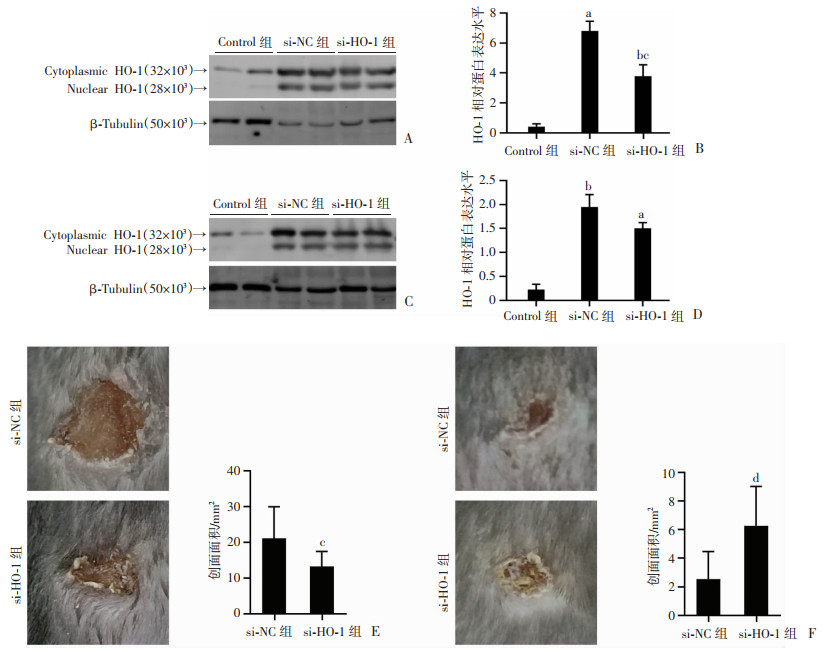
|
|
a:P<0.01,b:P<0.05,与Control组比较;c:P<0.05,d:P<0.01,与si-NC组比较 A:si-HO-1干预放创复合伤创面第1天对创面组织HO-1蛋白水平的影响;B:干预第1天创面组织HO-1蛋白的半定量分析(n=4,x±s);C:si-HO-1干预放创复合伤创面第3天对创面组织HO-1蛋白水平的影响;D:干预第3天创面组织HO-1蛋白的半定量分析(n=4,x±s);E:si-HO-1干预第3天创面的大体观察与残留面积分析(n=10,x±s);F:si-HO-1干预第9天创面的大体观察与残留面积分析(n=10,x±s) 图 4 放创复合伤创面siRNA敲降HO-1的效果验证及创面愈合的大体情况 |
2.5 创面siRNA敲降HO-1上调放创复合伤创面IL-6和TNF-α表达
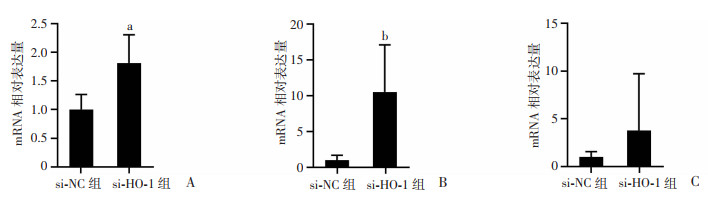
致伤后第3天,定量PCR检测促炎细胞因子的mRNA表达情况。结果显示:敲降HO-1显著上调创面组织中IL-6和TNF-α的表达水平(P<0.01,P<0.05,图 5A、B),而IL-1β的表达虽有升高的趋势,但无显著差异(P>0.05,图 5C)。
|
|
a:P<0.01,b:P<0.05,与si-NC组比较 A:IL-6定量PCR检测结果;B:TNF-α定量PCR检测结果;C:IL-1β定量PCR检测结果 图 5 siRNA敲降放创复合伤创面HO-1对第3天创面组织IL-6、TNF-α和IL-1β表达的影响(n=6,x±s) |
2.6 创面siRNA敲降HO-1促进放创复合伤第3天创缘组织细胞增殖
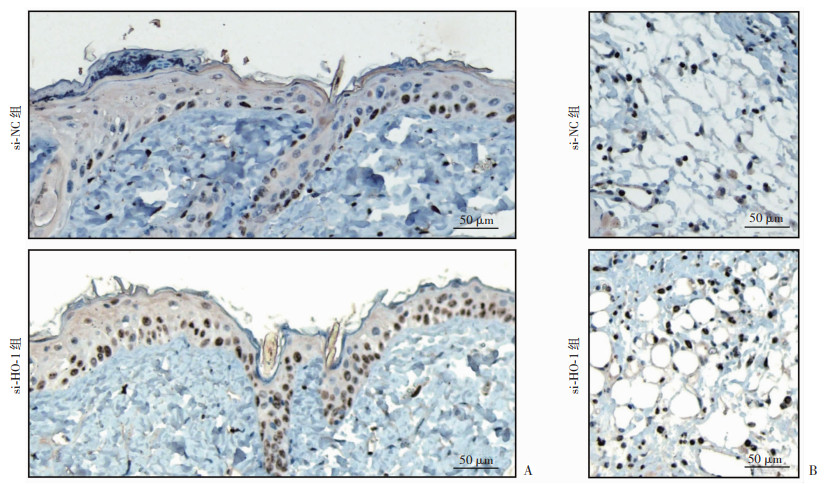
取致伤后第3天组织标本制备蜡块后,进行Ki67免疫组织化学染色,计数创缘表皮和间质组织的阳性细胞数目,进行半定量分析。结果显示:si-HO-1组创缘表皮的Ki67阳性细胞数目(104.98个/mm)较si-NC组(63.47个/mm)显著增多(P<0.000 1,图 6A);与之一致,其创缘间质Ki67阳性细胞数目(1 043.99个/mm)也较si-NC组(567.4个/mm)显著增多(P<0.001,图 6B)。
|
| A:创缘表皮Ki67组化染色观察;B:创缘间质组织Ki67组化染色观察 图 6 siRNA敲降放创复合伤创面HO-1对第3天创缘组织Ki67免疫组织化学染色的影响 |
2.7 创面siRNA敲降HO-1改善放创复合伤创面组织病理
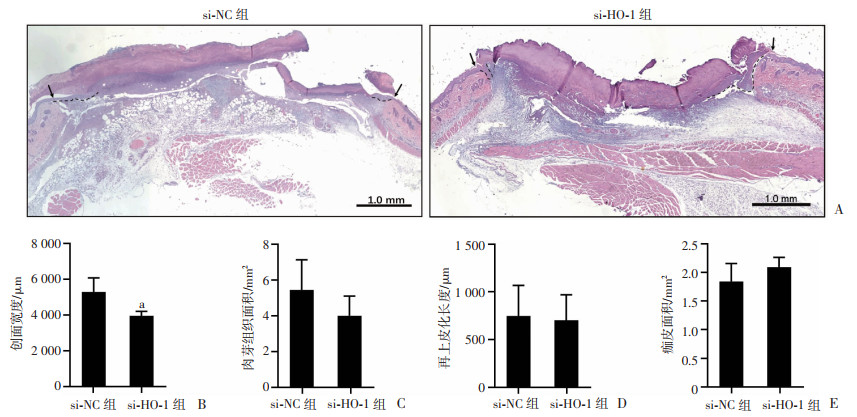
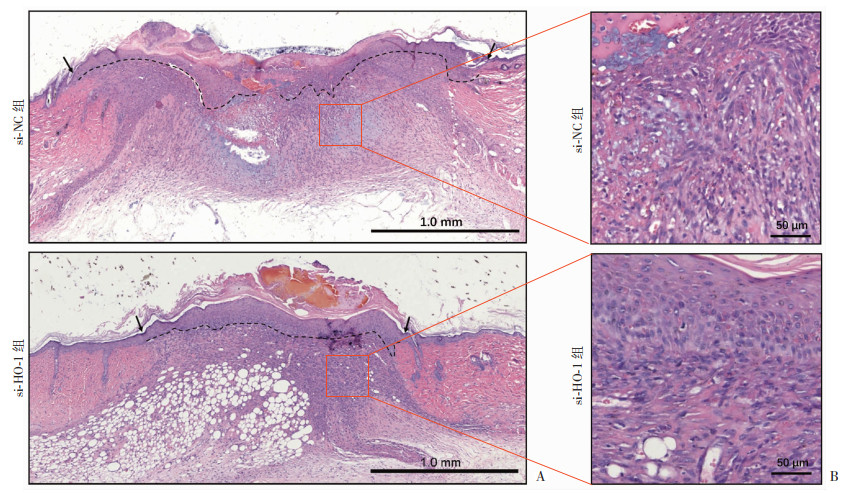
本研究对致伤干预后第3、9天的创面组织病理进行了分析、评价。致伤后第3天,相较于si-NC组,si-HO-1组创面具有较厚痂皮,浸润炎症细胞较多(图 7A)。组织学测量分析显示,si-HO-1组创面宽度显著缩小(P<0.01,图 7B),肉芽组织面积也有减少的趋势(图 7C),但再上皮化的新生角质细胞的长度2组差异无统计学意义(图 7D),而si-HO-1组痂皮面积虽有增高的趋势,但2组无显著差异(图 7E)。致伤后第9天,虽然大体观察痂皮面积较大,但si-HO-1组实现痂下愈合,创面已全部完成再上皮化,肉芽组织趋于成熟;而si-NC组创面仍有部分未完成再上皮化,肉芽生长不良(图 8)。进一步组织病理学测量分析显示,si-HO-1组创面宽度(1 600.42 μm)显著小于对照组(2 589.17 μm,P<0.01),表明si-HO-1干预促进了创面收缩;虽然si-HO-1组的肉芽组织面积有增大的趋势,但2组间未见显著差异(si-NC组:3.44 mm2,si-HO-1组:4.05 mm2)。
|
| A:HE染色观察第3天创面组织病理学改变 ↑:示创面致伤处;虚线:示新生上皮;B:创面宽度半定量分析a:P<0.01,与si-NC组比较;C:肉芽组织面积半定量分析;D:新生上皮长度半定量分析;E:痂皮面积半定量分析 图 7 siRNA敲降放创复合伤创面HO-1对第3天创面组织影响的病理观察与分析(n=5,x±s) |
|
| A:HE染色观察第9天创面组织病理学改变 ↑:示创面致伤处,虚线:示新生上皮;B:HE染色观察第9天创面组织病理学改变的局部放大观察 图 8 siRNA敲降放创复合伤创面HO-1对第9天创面组织影响的病理观察 |
3 讨论
放射复合伤创面愈合延迟的机制与促愈策略是放射复合伤救治的重要内容,本研究尝试以放射复合伤创面局部抑制炎症的分子为切入点进行探究。研究采用小鼠全身6 Gy辐射复合皮肤创伤的放创复合伤模型,检测了抗炎分子HO-1在创面表达变化的模式,并尝试通过siRNA干预敲降HO-1调控炎症促进放创复合伤创面愈合。
3.1 调控放创复合伤创面炎症反应是一种有潜力的促愈策略既往研究表明,小鼠6 Gy全身照射能够导致重度骨髓型急性放射病,对造血组织产生显著的抑制;同时6 Gy全身照射能够显著抑制伤口的早期修复启动[17]。本研究的结果发现,实验中采用的放创复合伤模型能够显著延缓小鼠的创面愈合,影响伤口7 d时肉芽组织的成熟度,表明模型建立是成功的。同时通过外周血细胞计数评价了这种模型对于造血系统的损伤,发现红细胞、血小板和白细胞均显著受到影响,其中白细胞受影响最大,在致伤后第1天即显著下降。进一步的白细胞分类计数表明这种伤后第1天的下降主要的贡献来自外周血的淋巴细胞和单核细胞,而中性粒细胞无显著变化。中性粒细胞和单核巨噬细胞是创面炎症反应调控的重要细胞类型,前者对于早期创面炎症反应的贡献更大。既往研究发现对离体血液大剂量照射后,中性粒细胞本身的存活、趋化与吞噬功能几乎没有受到影响[18]。但在体的研究表明,放创复合伤早期(24 h甚至更早)创面浸润的中性粒细胞数目减少,同时这些细胞的吞噬与趋化功能受损[17-19]。考虑到放创复合伤外周血中性粒细胞在第1天并无显著降低,提示放创复合伤创面局部的因素对早期炎症反应存在一定的抑制效应,而早期干预吸引更多的中性粒细胞到创面浸润调节炎症反应是有细胞学基础的。
围绕放创复合伤创面愈合延缓的机制,本研究从病理、细胞层面进行了深入探索,提出了“以细胞损害为关键环节的愈合诸因素调控失调”的学说,认为造血细胞和修复细胞的数量与功能损害是导致创面难愈的关键环节,其中由于辐射所致造血损伤导致免疫细胞来源减少是创面局部炎症反应削弱的重要原因[4-5]。循此思路,采用苯妥英钠、神经生长因子等药物能在放射损伤造血抑制和外周血白细胞减少的情况下,通过局部用药,吸引中性粒细胞和巨噬细胞向伤部趋化,增加数量、增强功能,启动修复细胞反应,从而发挥促愈作用[1-3]。然而,与合并全身辐射损伤的伤口类似,局部照射并不引起造血的系统性损伤,其伤口也存在明显的炎症反应削弱特征[6-7]。这提示放创复合伤创面炎症反应削弱除造血损伤导致的炎症细胞数量减少与功能降低外,在创面也存在局部的抑制炎症反应的因素。新近本课题组研究发现,具有促进炎症消退功能的kazal型丝氨酸蛋白酶抑制因子7(serine peptidase inhibitor,kazal type 7,SPINK7)在放创复合伤创面的表达较单纯创面更高,创面局部递送针对SPINK7的小干扰RNA能够上调放创复合伤创面的炎症反应,改善肉芽组织形成不良,显著促进创面愈合[20]。本研究进一步探究了通过调控抗炎因子HO-1改善放创复合伤创面愈合的可能。
3.2 创面早期敲降HO-1上调炎症反应改善放创复合伤创面修复本研究首先通过Western blot和定量PCR检测了HO-1在放创复合伤创面修复中的表达模式,发现其mRNA表达在放创复合伤创面组织第7、10天显著高于单创组织;而蛋白水平在第3、7天略高、第10天显著高于单创组织,呈现一种持续高水平的状态。皮肤创伤会诱导HO-1的表达上调,其参与炎症反应、血管生成等事件的调控,本研究在单纯皮肤创面的结果与之前的报道一致[8, 21]。而HO-1在放创复合伤创面修复中持续较高水平的表达,结合该模型本身外周血炎症细胞已经显著降低,推测放创复合伤创面高水平的HO-1表达更不利于炎症反应的启动与演进,进一步削弱炎症反应。同时本研究发现,在创面修复中HO-1存在细胞质全长(32×103)和细胞核截短(28×103)2种形式的蛋白。通常认为前者主要是发挥血红素降解限速酶的作用,在缺氧等细胞应激时前者被信号肽酶等蛋白酶剪切截短成后者进而转位到细胞核,发挥转录调控、信号转导调节等功能[13, 22-23]。而在放创复合伤创面这2种形式HO-1蛋白的相对比例也发生了改变,提示引入放射因素后对创面修复分子影响的复杂性。
进而本研究尝试在放创复合伤创面早期暂时性敲降HO-1蛋白水平是否有利于愈合修复。尽管有较多小分子药物可以特异性抑制HO-1表达[21, 23],但考虑到HO-1在多种组织脏器均有表达且功能复杂,本研究保守地选择了以F127凝胶负载siRNA敲降的方式。既往课题组曾多次使用该方法,发现其具有便于操作、效果确实的优点,更重要的是单次干预以缓释的方式可实现局部暂时性敲降[14]。结果表明:敲降HO-1后创面第3天的IL-6和TNF-α等促炎细胞因子表达显著升高,提示能够上调创面早期炎症反应;同时,Ki67组化染色也显示HO-1敲降显著促进伤后第3天创缘表皮和间质组织细胞的增殖。组织病理学评价也显示,HO-1敲降显著促进创面收缩,改善肉芽生长不良。需要指出的是,这一干预措施只是一种实验性质的研究,距离应用还有很大的差距,还存在需要进一步考虑的问题。譬如,本模型采用的是小创面,比之于体表面积15%损伤的经典放射复合伤模型其对整体的影响要小很多,局部愈合更加容易;再如,对于大的体表缺损采用这种调高局部创面炎症的方式是否会导致全身系统性的炎症反应失控,即对调节的度的把握也是一个关键问题。
综上所述,本研究表明在放创复合伤创面存在抗炎分子HO-1的持续高水平表达,将其暂时性敲降可以通过调控炎症反应改善创面愈合。结合之前SPINK7相关的工作,本研究认为放创复合伤创面局部本身的抗炎因素加剧削弱了炎症反应,调控这些因素或可成为促进这类创面愈合的新的策略。
| [1] |
程天民, 邹仲敏. 放射复合伤的研究进展[J]. 中华放射医学与防护杂志, 1998, 18(5): 299-304. CHENG T M, ZOU Z M. Research progress of radiation combined injury[J]. Chin J Radiol Med Prot, 1998, 18(5): 299-304. |
| [2] |
ZOU Z, SUN H, SU Y, et al. Progress in research on radiation combined injury in China[J]. Radiat Res, 2008, 169(6): 722-729. |
| [3] |
RAN X Z, SHI C M, ZHENG H E, et al. Experimental research on the management of combined radiation-burn injury in China[J]. Radiat Res, 2011, 175(3): 382-389. |
| [4] |
史春梦, 程天民. 放射损伤对创面愈合的影响[J]. 国外医学(放射医学核医学分册), 2005, 29(1): 30-32. SHI C M, CHENG T M. Effects of radiation injury on wound healing[J]. Foreign Med Sci Sect Radiat Med Nucl Med, 2005, 29(1): 30-32. |
| [5] |
王涛, 冉新泽, 王军平. 放射复合伤的研究进展与展望[J]. 中华损伤与修复杂志(电子版), 2023, 18(4): 353-357. WANG T, RAN X Z, WANG J P. Advances and prospect in research of radiation combined injuries[J]. Chin J Inj Repair Wound Heal Electron Ed, 2023, 18(4): 353-357. |
| [6] |
谷庆阳, 王德文, 崔彩彬, 等. 不同剂量照射对大鼠伤口愈合影响规律的分子病理学研究[J]. 中华放射医学与防护杂志, 1998, 18(3): 166-169. GU Q Y, WANG D W, CUI C B, et al. Molecular pathological study on the effect of different doses of radiation on wound healing in rats[J]. Chin J Radiol Med Prot, 1998, 18(3): 166-169. |
| [7] |
刘霞, 刘建忠, 周元国, 等. 局部辐射对大鼠伤口愈合过程中细胞增殖和凋亡的影响规律[J]. 中华放射医学与防护杂志, 2002, 18(3): 187-188. LIU X, LIU J Z, ZHOU Y G, et al. Effect of local radiation on cell proliferation and apoptosis during wound healing in rats[J]. Chin J Radiol Med Prot, 2002, 18(3): 187-188. |
| [8] |
WAGENER F A D T G, VAN BEURDEN H E, VON DEN HOFF J W, et al. The heme-heme oxygenase system: a molecular switch in wound healing[J]. Blood, 2003, 102(2): 521-528. |
| [9] |
NAITO Y, TAKAGI T, HIGASHIMURA Y. Heme oxygenase-1 and anti-inflammatory M2 macrophages[J]. Arch Biochem Biophys, 2014, 564: 83-88. |
| [10] |
LEAL E C, CARVALHO E. Heme oxygenase-1 as therapeutic target for diabetic foot ulcers[J]. Int J Mol Sci, 2022, 23(19): 12043. |
| [11] |
COSTA D L, AMARAL E P, ANDRADE B B, et al. Modulation of inflammation and immune responses by heme oxygenase-1: implications for infection with intracellular pathogens[J]. Antioxidants, 2020, 9(12): 1205. |
| [12] |
汪国建, 谭雨龙, 龙爽, 等. 高温高湿环境暴露对重度放创复合伤小鼠损伤恢复的影响[J]. 中华损伤与修复杂志(电子版), 2023, 18(4): 285-292. WANG G J, TAN Y L, LONG S, et al. Effects of hot and humid environments exposure on recovery of mice subjected to severe radiation injury combined with skin-wound trauma[J]. Chin J Inj Repair Wound Heal Electron Ed, 2023, 18(4): 285-292. |
| [13] |
LIN X L, LV J J, LV J, et al. Heme oxygenase-1 directly binds STAT3 to control the generation of pathogenic Th17 cells during neutrophilic airway inflammation[J]. Allergy, 2017, 72(12): 1972-1987. |
| [14] |
ZHAO N, WANG G J, LONG S, et al. MicroRNA-34a deficiency leads to impaired wound closure by augmented inflammation in mice[J]. Ann Transl Med, 2020, 8(7): 447. |
| [15] |
CHEN L, MIRZA R, KWON Y, et al. The murine excisional wound model: contraction revisited[J]. Wound Repair Regen, 2015, 23(6): 874-877. |
| [16] |
赵娜, 刘登群, 汪国建, 等. 自噬在小鼠皮肤创面修复中作用的初步研究[J]. 第三军医大学学报, 2019, 41(1): 25-32. ZHAO N, LIU D Q, WANG G J, et al. Role of autophagy during cutaneous wound healing in mice[J]. J Third Mil Med Univ, 2019, 41(1): 25-32. |
| [17] |
陈晓红, 程天民, 冉新泽. 电离辐射对大鼠创面愈合早期阶段的影响[J]. 第三军医大学学报, 2001, 23(1): 24-26. CHEN X H, CHENG T M, RAN X Z. Effects of irradiation on early stage wound healing in traumatic rats[J]. J Third Mil Med Univ, 2001, 23(1): 24-26. |
| [18] |
HOLLEY T R, VAN EPPS D E, HARVEY R L, et al. Effect of high doses of radiation on human neutrophil chemotaxis, phagocytosis and morphology[J]. Am J Pathol, 1974, 75(1): 61-72. |
| [19] |
陈晓红, 程天民, 冉新泽. 电离辐射对大鼠伤口中性粒细胞肌动蛋白的影响[J]. 中华放射医学与防护杂志, 2000, 20(6): 388-390. CHEN X H, CHENG T M, RAN X Z. Effects of irradiation on actin in wound neutrophils of rats[J]. Chin J Radiol Med Prot, 2000, 20(6): 388-390. |
| [20] |
赵娜. 丝氨酸蛋白酶抑制因子Spink7促进炎症消退的作用与机制探索: 基于小鼠创面愈合与结肠炎模型的实验研究[D]. 重庆: 陆军军医大学, 2021. DOI: 10.27001/d.cnki.gtjyu.2021.000054. ZHAO N. Effect and mechanism of serine protease inhibitor Spink7 in promoting inflammation fading—an experimental study based on mouse wound healing and colitis model[D]. Chongqing: Army Medical University, 2021. DOI: 10.27001/d.cnki.gtjyu.2021.000054. |
| [21] |
GROCHOT-PRZECZEK A, LACH R, MIS J, et al. Heme oxygenase-1 accelerates cutaneous wound healing in mice[J]. PLoS One, 2009, 4(6): e5803. |
| [22] |
LIN Q, WEIS S, YANG G, et al. Heme oxygenase-1 protein localizes to the nucleus and activates transcription factors important in oxidative stress[J]. J Biol Chem, 2007, 282(28): 20621-20633. |
| [23] |
YANG Q, WANG W Q. The nuclear translocation of heme oxygenase-1 in human diseases[J]. Front Cell Dev Biol, 2022, 10: 890186. |




