2. 611130 成都, 西南财经大学统计学院
2. School of Statistics, Southwestern University of Finance and Economics, Chengdu, Sichuan Province, 611130, China
急性心力衰竭(acute heart failure, AHF)是指短时间内心脏功能异常,心衰症状或体征迅速发生或恶化的急性临床综合征,主要表现为肺淤血/肺水肿、体循环淤血、低心排血量和组织器官低灌注[1],是年龄>65岁患者住院的主要原因[2]。尽管目前AHF的治疗策略不断优化,患者的心衰症状能在住院期间得到较大改善,但其在出院后早期(2~3个月)处于由急性失代偿向慢性稳定性转变的衔接阶段,仍有较高的死亡和复发风险。研究表明,AHF患者出院后3个月内的死亡率和再入院率高达15%和30%[3-4],GREENE等[5]将这一发生不良预后事件风险极高的时间段定义为“易损期”。《中国心力衰竭诊断与治疗指南2018》首次明确出院后早期不良心血管事件高发的这一时期为心衰的易损期,提醒临床医生高度关注这一时段的风险评估与监测管理[6]。
目前,经典的心衰标志物及传统的预测模型在心衰易损期风险预测中的作用有限[7],随着医疗大数据的盛行,机器学习(machine learning, ML)作为人工智能最重要的实现方法已被广泛用于数据驱动的风险预测[8-10],也为心衰预后评估提供了更精准的方式[11-12]。在医疗决策中,可解释性比预测准确性更加重要,Shapley加性解释(Shapley additive explanation, SHAP)算法可以量化临床特征对模型输出结果的影响[13],解决了机器学习不可解释的“黑盒子”问题[14]。本研究应用6种机器学习算法建立AHF患者易损期死亡或再入院复合终点事件的风险预测模型,筛选最优模型对其进行解释,探讨影响易损期预后的相关因素,为AHF患者的早期风险评估提供建议。
1 资料与方法 1.1 数据来源选取2019年10月至2021年7月于陆军军医大学第二附属医院心血管内科住院治疗的651例AHF患者作为研究对象。纳入标准:①年龄≥18岁;②符合《中国心力衰竭诊断与治疗指南2018》急性心力衰竭诊断。排除标准:①院内死亡患者;②恶性肿瘤患者;③妊娠期患者;④严重精神病史及认知障碍;⑤临床资料缺失严重;⑥出院早期(3个月)失访者。本研究经陆军军医大学第二附属医院伦理委员会审查通过(2021-研第019-01)。
1.2 资料收集和随访应用医院电子病历系统收集入选患者的临床资料,包括:①性别、年龄、体质量指数(body mass index, BMI)、纽约心脏病协会(New York Heart Association, NYHA)心功能分级、吸烟史等一般资料;②心率、收缩压、舒张压、平均动脉压(mean arterial pressure, MAP)等入院生命体征;③ 高血压、糖尿病、冠状动脉粥样硬化性心脏病、房颤等合并症;④B型利钠肽(B-type natriuretic peptide, BNP)、血肌酐、血清尿酸(serum uric acid, SUA)、血清白蛋白、血红蛋白等实验室检查指标;⑤心电图、超声心动图等检查结果。以AHF患者治疗出院后第3个月作为随访时间节点,通过电子病历及电话随访,了解患者出院早期健康情况。复合终点事件定义为AHF患者出院后3个月内发生全因死亡或心衰加重再入院,根据3个月内是否发生复合终点事件将AHF患者分为发生复合终点事件组(n=203)和未发生复合终点事件组(n=448)。
1.3 数据预处理与模型构建研究队列中缺失超过20%的变量予以删除;剩余缺失变量采用K近邻(K-nearest neighbor, KNN)插补法进行填补。采用简单随机抽样法对处理后的数据集进行拆分,其中80%进入训练集,20%作为测试集。在训练集中应用最小绝对收缩和选择算子(least absolute shrinkage and selection operator, LASSO)算法筛选有意义的特征变量纳入模型,构建逻辑回归(logistic regression, LR)、随机森林(random forest, RF)、决策树(decision tree, DT)、轻量梯度提升(light gradient boosting machine, LGBM)、极端梯度提升(extreme gradient boosting, XGBoost)和神经网络(neural network, NN)6种预测AHF患者易损期复合终点事件的机器学习模型,采用十折交叉验证法确定6种模型的最优参数,并在测试集中进行独立验证,绘制受试者工作特征(receiver operating characteristic, ROC)曲线和临床决策(decision curve analysis, DCA)曲线评估各模型区分度和临床净收益(实用性)。DCA曲线是目前评价临床预测模型优劣的常用方式,通过量化不同阈值概率(横坐标)下的净收益(纵坐标),可帮助医疗决策者选择合适的预测模型。使用SHAP算法对表现最优的模型进行解释分析,从而提高模型的可解释性与透明度。研究技术流程见图 1。
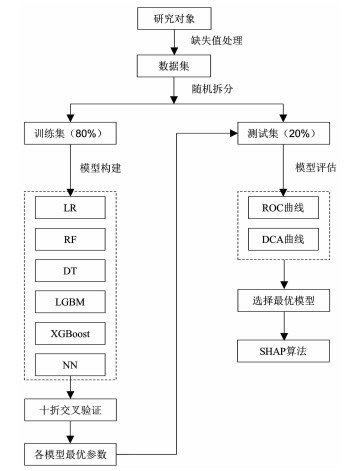
|
| 图 1 研究技术流程图 |
1.4 统计学分析
采用SPSS 27.0软件进行数据分析。符合正态分布的计量资料以x±s表示,组间比较采用独立样本t检验;不符合正态分布的计量资料以M(P25, P75)表示,组间比较采用Mann-Whitney U检验。计数资料以百分比(%)表示,组间比较采用χ2检验。P<0.05为差异具有统计学意义。采用R 4.3.1软件进行模型构建,并计算ROC曲线下面积(area under curve, AUC)、灵敏度、特异度等模型评价指标,绘制DCA曲线评估临床获益。
2 结果 2.1 基线资料经筛选,最终纳入651例AHF患者,其中203例(31.2%)在易损期内发生复合终点事件。将所有患者按8 ∶2随机划分为训练集(n=521)和测试集(n=130)后,得到训练集中有157例(30.1%)发生复合终点事件,测试集中有46例(35.4%)发生复合终点事件。易损期内发生复合终点事件组与未发生组比较,NYHA分级为Ⅳ级的患者数量更多,BNP、D-二聚体、血清尿酸、血尿素氮水平更高,BMI值和平均动脉压更低(P均<0.05,表 1)。
| 指标 | 总体(n=651) | 发生复合终点事件组(n=203) | 未发生复合终点事件组(n=448) | P |
| 年龄/岁 | 67(54, 74) | 67(55, 74) | 67(54, 74) | 0.661 |
| 男性 | 407(62.5) | 124(61.1) | 283(63.2) | 0.611 |
| BMI/(kg/m2) | 23.0(20.3, 25.5) | 22.2(18.0, 24.8) | 23.2(20.8, 25.7) | 0.006 |
| NYHA分级Ⅳ级 | 120(18.4) | 54(26.6) | 66(14.7) | <0.001 |
| 高血压 | 250(38.4) | 66(32.5) | 184(41.1) | 0.038 |
| 冠心病 | 326(50.1) | 94(46.3) | 232(51.8) | 0.195 |
| 慢性阻塞性肺疾病 | 77(11.8) | 25(12.3) | 52(11.6) | 0.796 |
| 糖尿病 | 145(22.3) | 39(19.2) | 106(23.7) | 0.206 |
| 房颤 | 153(23.5) | 52(25.6) | 101(22.5) | 0.392 |
| 心率/(次/min) | 84.0(73.0, 96.0) | 84.0(73.0, 95.0) | 84.0(72.0, 96.0) | 0.723 |
| 平均动脉压/mmHg | 87.0(77.3, 98.0) | 83.0(74.0, 92.7) | 89.2(78.3, 101.3) | <0.001 |
| BNP/(ng/L) | 1 180.0(824.0, 1 450.0) | 1 320.0(1 020.0, 1 570.0) | 1 130.0(667.0, 1 400.0) | <0.001 |
| D-二聚体/(mg/L) | 0.7(0.3, 1.5) | 0.9(0.6, 1.8) | 0.6(0.2, 1.4) | <0.001 |
| 白蛋白/(g/L) | 35.8(35.1,41.7) | 38.4(35.0,41.7) | 38.50(35.1,41.7) | 0.538 |
| 血红蛋白/(g/L) | 129.0(113.0,142.0) | 130.0(110.0,142.0) | 129.0(114.0,143.0) | 0.492 |
| 血清尿酸/(μmol/L) | 476.1±138.9 | 526.5±127.1 | 453.2±138.2 | <0.001 |
| 血尿素氮/(mmol/L) | 8.2(6.3,11.1) | 9.0(6.9,11.7) | 7.9(6.0,10.7) | <0.001 |
2.2 模型性能评价
在测试集中对6种模型的预测能力进行评估。ROC曲线显示,以基于传统逻辑回归原理建立的LR模型(AUC=0.707)作为参考时,XGBoost模型(AUC=0.768)和RF模型(AUC=0.756)的区分度更高,预测能力更好(图 2)。各模型详细性能指标(表 2)中,XGBoost模型准确率和灵敏度高于RF模型,对样本预测正确的比例和对阳性样本的识别能力优于RF模型,能更准确、灵敏地识别易损期高危患者。DCA曲线中,“无”和“全部”分别表示患者均不接受和全部接受临床决策干预时的获益,XGBoost模型在大部分阈值范围内的净收益高于其他模型,表明使用该模型可获得较大的临床净收益(图 3)。综合比较上述指标,XGBoost模型预测效能最佳。
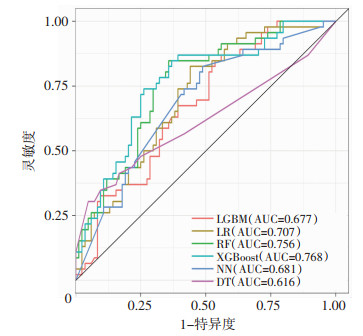
|
| 图 2 6种预测模型的ROC曲线 |
| 预测模型 | AUC | 准确率 | 灵敏度 | 特异度 | F1得分 |
| LR模型 | 0.707 | 0.646 | 0.739 | 0.595 | 0.596 |
| RF模型 | 0.756 | 0.654 | 0.478 | 0.750 | 0.494 |
| DT模型 | 0.616 | 0.708 | 0.349 | 0.905 | 0.457 |
| LGBM模型 | 0.677 | 0.600 | 0.478 | 0.667 | 0.458 |
| XGBoost模型 | 0.768 | 0.685 | 0.826 | 0.607 | 0.650 |
| NN模型 | 0.681 | 0.631 | 0.739 | 0.571 | 0.586 |
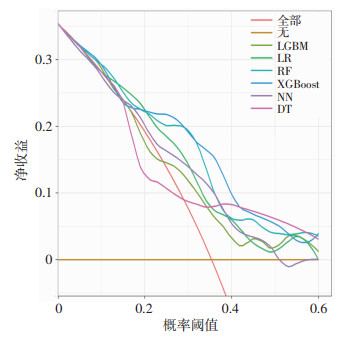
|
| 图 3 6种预测模型的DCA曲线 |
2.3 模型解释分析
采用SHAP算法对XGBoost模型进行解释分析(图 4)。图 4A展示了临床特征SHAP值分布情况,纵坐标轴上的位置由临床特征按重要性排序确定,横坐标轴上的位置由SHAP值确定。图 4B为按照特征的SHAP绝对值的均值从大到小排列后形成的特征重要性条形图,展示各临床特征对模型预测结果的具体影响程度。
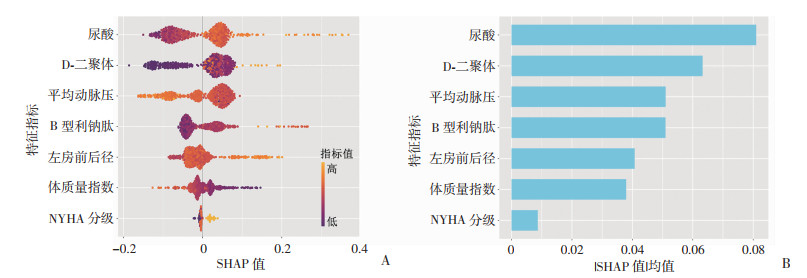
|
| A:SHAP特征指标分布情况;B:SHAP特征重要性分布情况 图 4 SHAP汇总图 |
在SHAP汇总图的基础上,进一步输出临床特征的SHAP依赖图(图 5),以解释临床特征不同的值对预测结果的具体影响。SHAP依赖图中,横轴为特征的变化范围,纵坐标为该值对应的SHAP值,当其对应的SHAP值>0,表示患者易损期发生复合终点事件的风险增加。
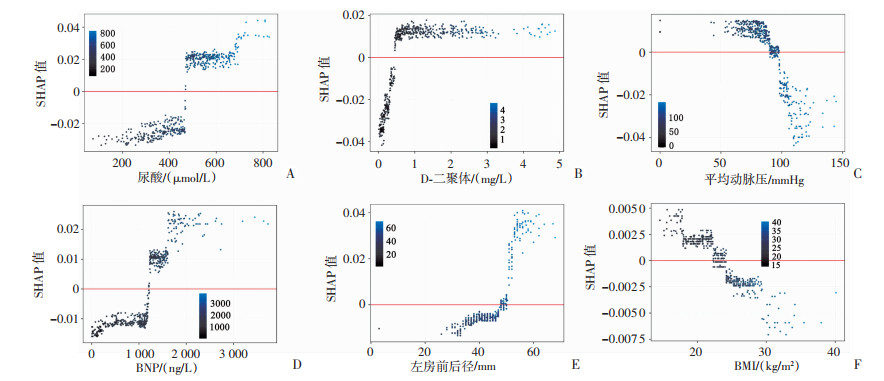
|
| A:尿酸的SHAP依赖图;B:D-二聚体的SHAP依赖图;C:平均动脉压的SHAP依赖图;D:B型利钠肽的SHAP依赖图;E:左房前后径的SHAP依赖图;F: 体质量指数的SHAP依赖图 图 5 影响模型输出结果的临床特征SHAP依赖图 |
3 讨论 3.1 心衰易损期是需要高度关注的脆弱时段
心衰易损期是指AHF患者在出院后早期(3个月内)死亡或再入院事件高发的特殊时期。一项关于坎地沙坦降低心衰患者死亡或再入院率的研究表明[15],心衰患者出院后3个月内全因死亡风险较未住院的心衰患者显著增加4~6倍,该风险随出院时间的延长而逐渐降低,OPTIMIZE-HF、EHFS-Ⅱ等大型注册研究也得到一致结果。作为遏阻心衰进展的关键时间节点,早期识别易损期高危患者是优化心衰全程管理的重点和难点。我国AHF患者死亡和再入院风险预测模型研究始于2020年,建立的预测模型数量较少[16],并且关注重点多为AHF患者出院30 d临床结局[17-18]。由于AHF患者的“脆弱窗口”长达出院后3个月,故以易损期作为开展AHF患者风险预测研究的时间窗口更为合适。
3.2 机器学习模型的优势与适用性研究表明,对于心衰的预后预测,机器学习模型较传统统计模型更具优势[19-20]。本研究开发并验证6种机器学习模型,预测AHF患者易损期发生复合终点事件的风险,其中XGBoost模型较传统逻辑回归模型表现出更好的预测性能。采用SHAP算法对XGBoost模型进行解释,模型纳入的特征变量在临床上获取方便,易于基层医院推广应用。
3.3 预测模型的重要临床特征及其意义在本研究构建的预测模型中,血清尿酸和D-二聚体的预测能力优于常用的心衰标志物BNP,基线平均动脉压和BMI是易损期预后的保护因素。当血清尿酸>420 μmol/L时,AHF患者易损期发生不良事件的风险随尿酸水平升高呈上升趋势。既往研究表明,在射血分数降低以及射血分数保留的AHF患者中[21],基线尿酸升高是心衰病情严重、短/长期预后不良的独立预测因子[22-23]。另有荟萃分析指出,合并高尿酸血症的AHF患者,尿酸浓度每增加59.52 μmol/L,全因死亡率风险增加11%,死亡或再入院复合终点风险增加12%[22]。欧洲心脏病学会(European Society of Cardiology, ESC)推荐的西雅图心衰模型,也将尿酸纳入独立预测因素[24]。作为人体食物和内源性嘌呤代谢的最终产物,高水平的尿酸可能通过增强氧化应激水平,介导血管内皮功能障碍,促进炎症反应等多种病理生理机制,进一步导致AHF患者心功能恶化[25-26]。当D-二聚体>0.5 mg/L时,AHF患者易损期发生复合终点风险增加。研究表明,D-二聚体是AHF患者出院后3个月内发生死亡或再次入院事件的独立预测因子[27],D-二聚体高的心衰患者,1年死亡风险显著升高[28]。作为交联纤维蛋白的特异性降解产物,D-二聚体的升高可能与心衰患者血流动力学不稳定有关,反映了较差的心脏功能状态,升高的D-二聚体反过来又通过诱导炎性细胞因子的合成和释放导致炎症反应,加重心衰负担。
结果显示,AHF患者平均动脉压和BMI是易损期发生复合终点事件的保护因素,可能因为平均动脉压较高的患者血流动力学状况较好,体循环淤血程度较轻,保证了重要器官的灌注水平[29]。BMI与易损期预后的关系,符合“肥胖悖论”,即BMI的增加与心衰患者全因死亡风险的降低相关,BMI高的患者可能受益于更强的代谢储备或肾素-血管紧张素-醛固酮系统的减弱反应,且BMI高的患者血压通常也较高,可能意味着耐受更高剂量的药物,从而改善心衰预后[30]。
本研究存在一定的局限性:①本研究为回顾性、单中心研究,存在一定的选择偏倚;②由于缺乏外部验证,所开发的模型在临床上的适用性与实用性有待前瞻性研究进一步明确;③本研究纳入的临床资料和样本量有限,未纳入患者住院期间及出院后心衰药物使用情况等可能影响易损期预后的因素,可能会使模型预测效能和稳定性欠佳。
综上所述,本研究基于6种机器学习算法分别构建了AHF患者易损期死亡或再入院的风险预测模型,其中,XGBoost模型表现出更优的预测效能,预测结果可靠性较高,模型纳入的特征变量兼具可获得性和通用性,可为AHF患者临床决策和个体化精准治疗提供一定参考。
| [1] |
ARRIGO M, JESSUP M, MULLENS W, et al. Acute heart failure[J]. Nat Rev Dis Primers, 2020, 6(1): 16. |
| [2] |
HAO G, WANG X, CHEN Z, et al. Prevalence of heart failure and left ventricular dysfunction in China: the China hypertension survey, 2012-2015[J]. Eur J Heart Fail, 2019, 21(11): 1329-1337. |
| [3] |
DESAI A S, STEVENSON L W. Rehospitalization for heart failure: predict or prevent?[J]. Circulation, 2012, 126(4): 501-506. |
| [4] |
GHEORGHIADE M, VADUGANATHAN M, FONAROW G C, et al. Rehospitalization for heart failure[J]. J Am Coll Cardiol, 2013, 61(4): 391-403. |
| [5] |
GREENE S J, FONAROW G C, VADUGANATHAN M, et al. The vulnerable phase after hospitalization for heart failure[J]. Nat Rev Cardiol, 2015, 12(4): 220-229. |
| [6] |
中华医学会心血管病学分会心力衰竭学组, 中国医师协会心力衰竭专业委员会, 中华心血管病杂志编辑委员会. 中国心力衰竭诊断和治疗指南2018[J]. 中华心血管病杂志, 2018, 46(10): 760-789. Heart Failure Group of Chinese Society of Cardiology of Chinese Medical Association, Chinese Heart Failure Association of Chinese Medical Doctor Association, Editorial Board of Chinese Journal of Cardiology. China guidelines for diagnosis and treatment of heart failure 2018[J]. Chin J Cardiol, 2018, 46(10): 760-789. |
| [7] |
石珂, 贾永平. 心力衰竭易损期再入院率和死亡评估新进展[J]. 中西医结合心脑血管病杂志, 2019, 17(18): 2783-2786. SHI K, JIA Y P. New progress of readmission rate and death assessment in vulnerable period of heart failure[J]. Chin J Integr Med Cardio Cerebrovasc Dis, 2019, 17(18): 2783-2786. |
| [8] |
RU B S, TAN X, LIU Y, et al. Comparison of machine learning algorithms for predicting hospital readmissions and worsening heart failure events in patients with heart failure with reduced ejection fraction: modeling study[J]. JMIR Form Res, 2023, 7: e41775. |
| [9] |
SABOURI M, RAJABI A B, HAJIANFAR G, et al. Machine learning based readmission and mortality prediction in heart failure patients[J]. Sci Rep, 2023, 13(1): 18671. |
| [10] |
伍亚舟, 陈锡程, 易东. 人工智能在临床领域的研究进展及前景展望[J]. 陆军军医大学学报, 2022, 44(1): 89-102. WU Y Z, CHEN X C, YI D. Advances and perspective of artificial intelligence in clinical area[J]. J Army Med Univ, 2022, 44(1): 89-102. |
| [11] |
DESAI R J, WANG S V, VADUGANATHAN M, et al. Comparison of machine learning methods with traditional models for use of administrative claims with electronic medical records to predict heart failure outcomes[J]. JAMA Netw Open, 2020, 3(1): e1918962. |
| [12] |
SHIN S, AUSTIN P C, ROSS H J, et al. Machine learning vs. conventional statistical models for predicting heart failure readmission and mortality[J]. ESC Heart Fail, 2021, 8(1): 106-115. |
| [13] |
LUNDBERG S M, ERION G, CHEN H, et al. From local explanations to global understanding with explainable AI for trees[J]. Nat Mach Intell, 2020, 2(1): 56-67. |
| [14] |
PETCH J, DI S, NELSON W. Opening the black box: the promise and limitations of explainable machine learning in cardiology[J]. Can J Cardiol, 2022, 38(2): 204-213. |
| [15] |
SOLOMON S D, DOBSON J, POCOCK S, et al. Influence of nonfatal hospitalization for heart failure on subsequent mortality in patients with chronic heart failure[J]. Circulation, 2007, 116(13): 1482-1487. |
| [16] |
王薇, 雷璐碧, 赵倩, 等. 急性心力衰竭再入院及死亡风险预测模型研究进展[J]. 中华流行病学杂志, 2023, 44(12): 2005-2011. WANG W, LEI L B, ZHAO Q, et al. Progress in research of models for predicting the risk of readmission and mortality among patients with acute heart failure[J]. Chin J Epidemiol, 2023, 44(12): 2005-2011. |
| [17] |
ZHUANG B, SHEN T, LI D J, et al. A model for the prediction of mortality and hospitalization in Chinese heart failure patients[J]. Front Cardiovasc Med, 2021, 8: 761605. |
| [18] |
YANG M X, TAO L Y, AN H, et al. A novel nomogram to predict all-cause readmission or death risk in Chinese elderly patients with heart failure[J]. ESC Heart Fail, 2020, 7(3): 1015-1024. |
| [19] |
BAZOUKIS G, STAVRAKIS S, ZHOU J D, et al. Machine learning versus conventional clinical methods in guiding management of heart failure patients—a systematic review[J]. Heart Fail Rev, 2021, 26(1): 23-34. |
| [20] |
王齐, 陈康玉, 严激. 基于人工智能的心力衰竭预后研究[J]. 中华心血管病杂志, 2022, 50(7): 637-645. WANG Q, CHEN K Y, YAN J. Artificial intelligence based prognostic studies in patients with heart failure[J]. Chin J Cardiol, 2022, 50(7): 637-645. |
| [21] |
PALAZZUOLI A, RUOCCO G, DE VIVO O, et al. Prevalence of hyperuricemia in patients with acute heart failure with either reduced or preserved ejection fraction[J]. Am J Cardiol, 2017, 120(7): 1146-1150. |
| [22] |
PALAZZUOLI A, RUOCCO G, PELLEGRINI M, et al. Prognostic significance of hyperuricemia in patients with acute heart failure[J]. Am J Cardiol, 2016, 117(10): 1616-1621. |
| [23] |
WEI F F, CHEN X W, CHENG W, et al. Associations of long-term mortality with serum uric acid at admission in acute decompensated heart failure with different phenotypes[J]. Nutr Metab Cardiovasc Dis, 2023, 33(10): 1998-2005. |
| [24] |
LEVY W C, MOZAFFARIAN D, LINKER D T, et al. The Seattle Heart Failure Model: prediction of survival in heart failure[J]. Circulation, 2006, 113(11): 1424-1433. |
| [25] |
DOEHNER W, FRENNEAUX M, ANKER S D. Metabolic impairment in heart failure: the myocardial and systemic perspective[J]. J Am Coll Cardiol, 2014, 64(13): 1388-1400. |
| [26] |
王晓琪, 苏冠华. 高尿酸血症和心力衰竭的病理生理机制、治疗和预后价值[J]. 心血管病学进展, 2021, 42(9): 780-783. WANG X Q, SU G H. Pathophysiological mechanism, treatment and prognostic value of hyperuricemia and heart failure[J]. Adv Cardiovasc Dis, 2021, 42(9): 780-783. |
| [27] |
张加良, 高蓉蓉, 李新立, 等. D-二聚体评估急性心力衰竭短期预后的临床意义[J]. 上海大学学报(自然科学版), 2016, 22(3): 376-380. ZHANG J L, GAO R R, LI X L, et al. Clinic significance of D-dimer in short-term prognosis of patients with acute heart failure[J]. J Shanghai Univ Nat Sci Ed, 2016, 22(3): 376-380. |
| [28] |
HUANG L Y, LIANG L, TIAN P C, et al. D-dimer and outcomes in hospitalized heart failure patients across the ejection fraction phenotypes[J]. ESC Heart Fail, 2022, 9(5): 3060-3070. |
| [29] |
LIU M H, CHEN X H, ZHANG S Z, et al. Long-term visit-to-visit mean arterial pressure variability and the risk of heart failure and all-cause mortality[J]. Front Cardiovasc Med, 2021, 8: 665117. |
| [30] |
JONES N R, ORDÓÑEZ-MENA J M, ROALFE A K, et al. Body mass index and survival in people with heart failure[J]. Heart, 2023, 109(20): 1542-1549. |




