脑出血(intracerebral hemorrhage,ICH)的预后差与血肿形成后的继发性脑损伤(secondary brain injury,SBI)密切相关[1]。SBI的病理生理机制包括氧化应激、细胞凋亡、铁死亡、线粒体功能障碍和神经炎症等,然而目前SBI的发病机制尚未完全阐明[2]。神经炎症作为ICH后SBI病理生理学的主要因素之一,介导了ICH后继发性的神经元死亡。焦亡是一种由炎症小体介导的新型程序性细胞死亡,其特点是质膜快速破裂和胞内物质的释放,其中炎性物质的释放可进一步促进ICH后过度的神经炎症反应[3-4]。因此,抑制神经元焦亡从而减少炎性物质释放可能是减轻ICH后的神经炎症和脑损伤的治疗靶点。
G蛋白偶联受体39(G protein-coupled receptor39, GPR39)是细胞膜上G蛋白偶联受体家族的成员之一[5]。研究表明GPR39可以调节大量的生理功能,如细胞的增殖和分化、细胞连接和离子的转运等[6]。最近,越来越多的体外证据表明,激活GPR39通过减少促炎细胞因子白介素-1β(interleukin-1β, IL-1β)的表达、增强抗炎细胞因子白介素-10(interleukin-10, IL-10) 的产生发挥抗炎活性。在中枢神经系统中,GPR39被证实在维持神经系统、神经精神和神经血管生理稳态中都发挥着重要的作用,并展现出其作为相关疾病治疗靶点的潜力[7-9]。体外的细胞实验证明,激活GPR39可以减轻由皮质酮引起的神经元细胞损伤[10]。在体内大鼠模型的研究中, 激活GPR39可通过抑制因缺血缺氧脑病导致的神经炎症,从而改善新生大鼠的神经功能和脑损伤[11]。然而,激活GPR39在ICH后脑损伤是否具有神经保护作用,目前仍然不清楚。
研究表明GPR39激活后可引起磷酸化的环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)表达增加[12]。在小鼠ICH模型中,通过激活CREB信号通路可抑制氧化应激和改善神经炎症从而提供神经保护[13]。最近的研究表明CREB激活可以调节NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3, NLRP3)的表达,从而起到抗炎作用[14]。
本研究假设激活GPR39可能部分通过CREB信号通路抑制神经元焦亡引起的神经炎症。通过自体血注射法建立小鼠ICH模型,探索激活GPR39后可能的神经保护作用及其相关机制,旨在为ICH后改善SBI寻找新的临床治疗方法。
1 材料与方法 1.1 实验动物及材料176只雄性C57/BL6小鼠(SPF级,年龄6~8周,体质量20~25 g)从重庆医科大学动物实验中心购买[生产许可证:SCXK(渝)2022-0010,使用许可证: SYXK(渝)2022-0016]。将小鼠置于温度为(22±1)℃和周期为12 h自然光和暗光的受控环境中,在生活区内可以不受限制地获得新鲜食物和干净的水。动物实验经重庆医科大学动物伦理委员会审核通过(IACUG-CQMU-2022-0015)。所有的操作过程和处死方案遵循国际通用实验动物使用指南。小鼠按随机数字表法分成8组:Sham组(n=42)、ICH组(12 h、24 h、48 h、72 h、7 d,n=34)、ICH+Vehicle组(n=32)、ICH+TC- G 1008组(n=44)、ICH+GPR39 siRNA组(n=6)、ICH+Scramble siRNA组(n=6)、ICH+TC-G 1008+666-15组(n=6)、ICH+TC-G 1008+Vehicle 2组(n=6)。GPR39抗体购自中国博奥森公司,抗神经元细胞核(NeuN)抗体购自美国Cell Signaling Technology公司,抗离子钙接头分子-1(Iba1)抗体购自中国艾方生物公司,p-CREB抗体、C-caspase-1和NLRP3抗体购自美国Abcam公司,CREB抗体、gasdermin-D蛋白(GSDMD)抗体和β-actin抗体购自中国武汉三鹰公司,抗鼠或抗兔二抗购自中国爱博泰克公司。ELISA试剂盒购自美国R&D Systems公司,TUNEL凋亡和尼氏染色试剂盒购自中国塞维尔生物。蛋白提取试剂盒、BCA蛋白浓度测定试剂盒等购自中国碧云天生物科技有限公司。
1.2 方法 1.2.1 小鼠脑出血模型的建立小鼠经腹腔注射1%戊巴比妥(50 mg/kg)深度麻醉后,俯卧位固定于立体定位仪框架内,在前囟右侧距离颅骨中线2 mm处,使用直径1 mm的钻头钻1个小孔。从小鼠尾部抽取30 mL尾静脉血,然后将未抗凝的血液通过微量注射器缓慢注射至小鼠右侧基底节,其立体定位坐标为:前囟前方0.2 mm, 前囟右侧2.3 mm, 颅骨腹侧3.5 mm。在目标位置上方0.7 mm处先注射5 mL血液并保持微量注射器在原位5 min,将剩余的25 mL血液输送到3.5 mm深度。注射后固定针头10 min,接着以1 mm/min的速度缓慢退出针头。最后用骨蜡覆盖钻孔,缝皮后消毒。ICH组小鼠都进行了脑出血模型的建立,其中Sham组小鼠在相同位置注射等体积的无菌生理盐水。
1.2.2 侧脑室注射小鼠深度麻醉后固定于立体定位仪,去除毛发消毒后沿中线做纵向切口,在前囟右侧距离颅骨右侧1 mm处,钻1个小孔以方便针头穿过,并在2.5 mm深度将药物注射到侧脑室。将GPR39 siRNA(GenePharma,上海,正义链5′-GCGCUA-CAUUGCCAUUUGUTT-3′,反义链5′-ACAAAUGGCA-AUGUAGCGCTT-3′)或Scramble siRNA (GenePharma,上海,正义链5′-UUCUCCGAACGUACGUTT-3′,反义链5′-ACGUGACACGUUCGGAGAATT-3′)或CREB抑制剂666-15(MCE, 美国)按照制造商的说明溶解在无菌无核酸水中。使用微型注射器将GPR39 siRNA或Scramble siRNA(100 pmol/2 μL)或666-15(10 mg/kg)的混合物注入侧脑室。注射完毕后,将针头保持在原位5 min后,再缓慢拔出针头。最后用骨蜡封住颅骨针刺口,缝合切口并消毒。在手术干预和术后恢复期间全程用加热垫保持合适的温度以保持小鼠体温。其中ICH+GPR39 siRNA组(n=6)、ICH+Scramble siRNA组(n=6)、ICH+TC-G 1008+666-15组(n=6)、ICH+TC-G 1008+Vehicle 2(n=6)组都进行了对应药物或对照载体的侧脑室注射操作。
1.2.3 TC-G 1008灌胃在小鼠ICH建模后1 h和25 h根据小鼠体质量给予3种不同剂量的TC-G 1008(8、24、72 mg/kg)灌胃。轻柔的抓住小鼠,使其头、颈和身体呈一直线,将溶解充分的TC-G 1008混合液灌胃。灌胃过程中控制好速度,以减少小鼠的不适感,灌胃完成后,仔细观察小鼠反应。其中ICH+Vehicle组和ICH+TC-G 1008组所有的小鼠进行了药物或对照载体溶剂灌胃治疗。
1.2.4 神经行为功能评估神经行为功能评估包括改良的加西亚实验、前肢置放实验和转角实验三部分。改良的加西亚实验评分由7个独立的子测试组成,包括自由运动(0~3分)、轴向感觉(1~3分)、爪接触反应(1~3分)、侧向转身(0~3分)、前肢伸展(0~3分)、肢体对称性运动(0~3分)和攀爬能力(1~3分),共21分,评分越低表明神经损伤越严重。前肢置放实验是由实验人员轻柔地抬起小鼠的身体,让它的前肢摇摆,让小鼠左侧触须擦拭台面的边缘,统计10次实验后小鼠左前肢成功放在台面的次数,每次实验间隔1 min,成功次数越低表明神经损伤越严重。转角实验是将小鼠被放在1个30°的角落,小鼠可自由地向右转或向左转离开拐角。进行10次实验,2次实验之间至少间隔30 s。计算出10次转向中小鼠左转次数的百分比,小鼠左转的次数比例越高表明神经功能损伤恢复越好。测试均由对本实验不知情的实验员测试并记录。其中Sham组(n=12)、ICH+Vehicle组(n=6)、ICH+TC-G 1008(8 mg/kg)组(n=6)、ICH+TC-G 1008(24 mg/kg)组(n=6)、ICH+TC-G 1008(72 mg/kg)组(n=6)、ICH+TC-G 1008组(n=6)、ICH+ TC-G 1008+666-15组(n=6)、ICH+TC-G 1008+Vehicle 2组(n=6)小鼠进行了神经行为评估。
1.2.5 脑水含量测定小鼠经深度麻醉后立即予以处死,完整的取出脑组织。脑组织被迅速分为5个部分:同侧(ipsilateral)和对侧(contralateral)的基底节(basal ganglia, BG)组织、同侧和对侧的皮层(cortex, CX)组织、小脑(cerebellum)组织,其中小脑组织作为内部对照。使用电子分析天平称量每个部分湿质量(wet weight, WW),在100 ℃下干燥72 h以获得干质量(dry weight, DW)。脑含水量=[(WW-DW)/WW]×100%。其中Sham组(n=6)、ICH+Vehicle组(n=6)、ICH+TC-G 1008(8 mg/kg)组(n=6)、ICH+TC-G 1008 (24 mg/kg)组(n=6)、ICH+ TC-G 1008(72 mg/kg)组(n=6)进行了脑水含量测定。
1.2.6 脑切片的制备小鼠深度麻醉后,通过心尖灌注4 ℃预冷的20 mL磷酸盐缓冲液(PBS,0.01 mol/L, pH=7.4)置换出体内的血液,快速收集整个大脑,然后在4%的多聚甲醛中于4 ℃固定24 h。分别在10%、20%、30%的蔗糖溶液中脱水后经OCT化合物包埋。在-25 ℃的低温恒温切片机将脑组织切成厚度为10 μm的冠状切片,用于进行后续免疫荧光、TUNEL染色和尼氏染色实验。
1.2.7 免疫荧光染色将经脱蜡、抗原修复、破膜后的脑组织切片用0.01 mol/L PBS洗涤3次后,每次10 min。然后与一抗4 ℃孵育过夜: 抗离子钙接头分子-1(Iba1, 1 ∶100)、抗神经元细胞核(NeuN, 1 ∶200)、GPR39(1 ∶250)、NLRP3(1 ∶250),随后与荧光二抗抗鼠或抗兔(1 ∶250, Abbkine, 中国)在37 ℃孵育1 h,最后用DAPI染色10 min后封片。封片后用荧光显微镜(U-HGLGPS, OLYMPUS,日本)观察并拍照。其中Sham组(n=8)、ICH-24h组(n=4)、ICH+Vehicle组(n=4)和ICH+TC-G 1008(n=4)组小鼠脑切片进行了免疫荧光染色。
1.2.8 ELISA检测炎性相关因子将小鼠麻醉后立即处死,获得完整的小鼠的脑组织,取出血肿周围(0.5~2.0 mm)脑组织加入含有蛋白酶抑制剂的裂解液并匀浆,匀浆充分后的混合液在4 ℃超速离心机(10 000×g)离心10 min,取上清液进行测定。最后根据试剂商提供的ELISA试剂盒说明书分别在各自的不同波长处测量所得上清液中白介素-1β(IL-1β),肿瘤坏死因子(tumor necrosis factor-α,TNF-α)和髓过氧化物酶(myeloperoxidase, MPO)的OD值,记录标准品、对照品的平均OD值,然后将数据生成标准曲线,最后带入各个样品孔的平均OD值后计算出对应的数值。其中Sham组(n=12)、ICH+Vehicle组(n=12)、ICH+TC-G 1008组(n=12)、ICH+GPR39 siRNA组(n=6)和ICH+Scramble siRNA组(n=6)小鼠脑组织进行了IL-1β、TNF-α和MPO检测。
1.2.9 TUNEL染色使用TUNEL细胞凋亡检测试剂盒检测神经元的凋亡情况。脑切片按先前概述的方法制备和脱蜡处理后用按免疫荧光处理方法,切片在4 ℃与小鼠抗NeuN抗体(1 ∶100)孵育12 h,然后用蛋白酶K溶液(20 mg/mL)在37 ℃下处理切片20 min。处理后的切片用PBS洗涤3次,每次10 min,洗涤后将脑切片与TUNEL溶液(含TdT酶溶液)在37 ℃黑暗环境中孵育30 min。孵育用PBS洗涤3次后与Alexa Fluor-594 (1 ∶500)标记的二抗在37 ℃下孵育1 h,用DAPI染色液以显示细胞核。最后封片后在荧光显微镜观察。其中Sham组(n=4)、ICH+Vehicle组(n=4)、ICH+TC-G 1008(n=4)组小鼠脑切片进行了TUNEL染色检测。
1.2.10 尼氏染色尼氏染色用于观察血肿周围神经元细胞的形态特征和细胞密度。石蜡切片经过脱蜡和再水化后,脑切片在甲苯胺蓝溶液(塞维尔生物)中染色40 min,温度50~60 ℃。切片在梯度酒精下脱水,用二甲苯澄清,用中性树脂封片。最后在显微镜下观察血肿周围存活神经元结构和形态并计数。其中Sham组(n=4)、ICH+Vehicle组(n=4)、ICH+TC-G 1008(n=4)组小鼠脑切片进行了尼氏染色检测。
1.2.11 Western blot分析小鼠深度麻醉后断头取脑组织(靠近血肿周围组织0.5~2.0 mm), 使用RIPA裂解缓冲液制备蛋白样本。然后将等量30 μg的脑组织提取蛋白标本装载到8%浓度的SDS-PAG凝胶上并进行电泳。电泳完成后将载装蛋白的凝胶转移到PVDF膜上,250 mA恒定电流转膜, 转膜后室温封闭膜1 h,封闭完成后的PVDF膜在4 ℃与对应的蛋白一抗稀释液孵育12 h。孵育后的条带用TBST清洗3次,每次10 min,随后将条带在37 ℃与对应的二抗(抗兔或抗鼠)室温继续孵育1 h。最后用ECL显影液在曝光分析仪下成像并保留图片。采集的图片采用Image J软件分析得出灰度值并记录。其中Sham组(n=18)、ICH组(n=30)、ICH+Vehicle组(n=12)、ICH+TC-G 1008组(n=6)、ICH+GPR39 siRNA组(n=6)、ICH+Scramble siRNA组(n=6)、ICH+TC-G 1008+666-15组(n=6)、ICH+TC-G 1008+Vehicle 2组(n=6)小鼠脑组织进行了Western blot检测。
1.3 统计学分析采用GraphPad Prism 9进行数据的统计分析,数据用x ± se表示。2组之间采用Tukey’s检验,多组间统计采用单因素方差分析。P<0.05被认为差异有统计学意义。
2 结果 2.1 ICH后血肿周围组织的内源性GPR39表达增加小鼠ICH后,按不同时间点取血肿周围组织,采用Western blot和免疫荧光检测内源性的GPR39的表达(图 1A)。Western blot结果显示, 与Sham组相比,GPR39在小鼠ICH后48 h达到表达高峰(P<0.05,图 1B、C)。双标免疫荧光结果表明, GPR39在神经元和小胶质细胞中均有表达,与Sham组相比,ICH后48 h GPR39的表达增加(图 1D)。
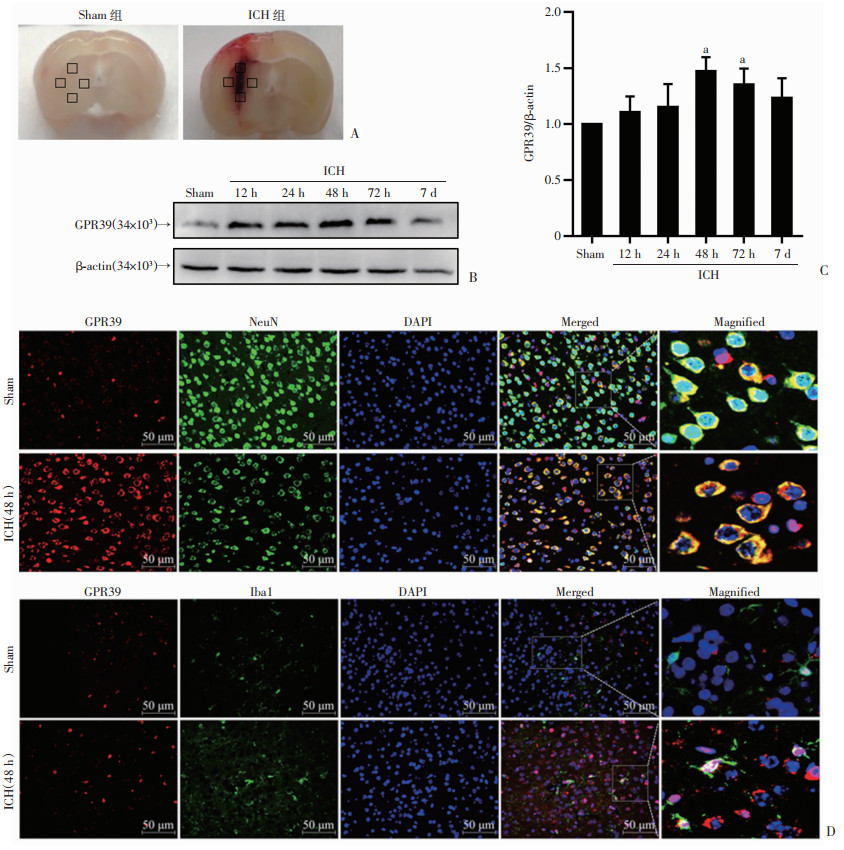
|
| A: 脑组织标本取样范围示意图;B、C: Western blot检测ICH后各个时间点血肿周围组织中GPR39的表达及GPR39定量分析(n=6,x ± se) a: P<0.05,与Sham组比较;D:双标免疫荧光染色观察脑出血后48 h GPR39后神经元(NeuN)和小胶质细胞(Iba1)在血肿周围组织中的表达和细胞定位 图 1 小鼠ICH后血肿周围组织中GPR39的表达及细胞定位 |
2.2 TC-G 1008激活GPR39改善小鼠ICH后短期神经功能缺陷和脑水肿
与Sham组相比,短期神经功能测试(改良的加西亚实验、前肢置放实验和转角实验)结果表明,在ICH后48 h,小鼠出现严重的神经功能缺陷,相较于低剂量ICH+TC-G 1008(8 mg/kg)组和高剂量ICH+TC-G 1008(72 mg/kg)组,中等剂量组ICH+TC-G 1008 (24 mg/kg)组激活GPR39后显著改善了小鼠ICH后改良的加西亚实验评分、左前肢放置成功率和左转次数增加(P<0.05,图 2A~C)。与ICH+Vehicle组相比,TC-G 1008(24 mg/kg)组小鼠同侧基底节和皮层的脑水肿显著减轻(P<0.05,图 2D)。根据以上实验结果,后续实验选择24 mg/kg为TC-G 1008的最佳治疗剂量, 并选择ICH后48 h作为实验终止时间点。
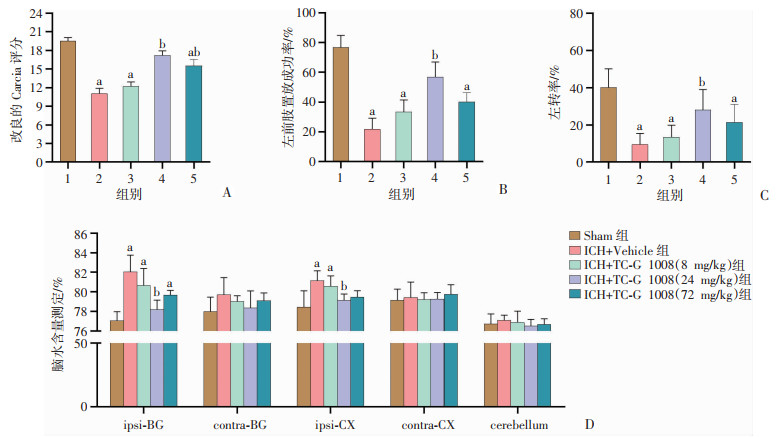
|
|
1:Sham组;2:ICH+Vehicle组;3:ICH+TC-G 1008(8 mg/kg)组;4:ICH+TC-G 1008(24 mg/kg)组;5:ICH+TC-G 1008(72 mg/kg)组;a: P<0.05,与Sham组比较;b: P<0.05,与ICH+Vehicle组比较 A:各组小鼠改良Garcia评分;B: 各组小鼠前肢置放实验;C:各组小鼠转角实验;D:各组小鼠不同部位的脑水含量 图 2 TC-G 1008治疗ICH后48 h各组小鼠神经功能和脑水含量(n=6,x ± se) |
2.3 TC-G 1008激活GPR39降低ICH后相关炎性因子的表达
ELISA结果表明,小鼠ICH后48 h,与Sham组相比,ICH+Vehicle组在ICH后48 h促炎相关因子IL-1β、TNF-α和MPO的水平显著升高。同ICH+Vehicle组相比,ICH+TC-G 1008组中IL-1β、TNF-α和MPO的水平显著降低(P<0.05,图 3A~C)。免疫荧光结果表明,同Sham组相比,ICH+Vehicle组神经元中NLRP3炎症小体的表达明显升高,与ICH+Vehicle组相比,ICH+TC-G 1008组神经元中NLRP3炎症小体的表达显著减少(P<0.05,图 3D、E)。
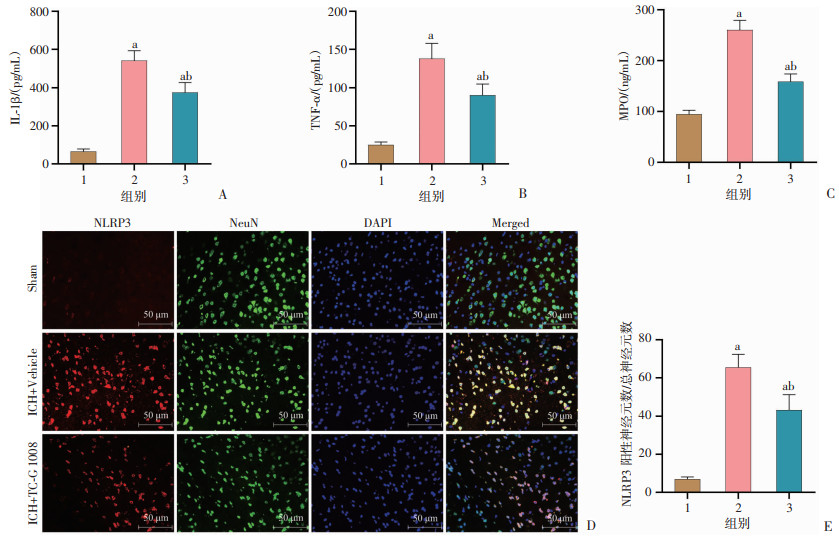
|
|
1:Sham组;2:ICH+Vehicle组;3:ICH+TC-G 1008组;a: P<0.05,与Sham组比较;b: P<0.05,与ICH+Vehicle组比较 A~C:小鼠ICH后48 h各组IL-1β、TNF-α和MPO的含量(n=6,x ± se);D、E: 免疫荧光观察NLRP3在各组的表达及半定量分析(n=4,x ± se) 图 3 TC-G 1008激活GPR39对小鼠ICH后血肿周围组织炎性因子的影响 |
2.4 TC-G 1008激活GPR39减少ICH后血肿周围神经元的损伤
TUNEL染色结果表明,小鼠ICH后48 h,ICH+Vehicle组小鼠脑组织血肿周围凋亡的神经元数量相较于Sham组显著升高,TC-G 1008治疗后血肿周围的神经元凋亡的数量显著减少(P<0.05,图 4A、B)。尼氏染色结果显示, ICH后血肿周围的正常形态的存活的神经元数量减少,与ICH+Vehicle组相比,经TC-G 1008治疗后, 血肿周围神经元细胞轮廓更清晰,存活的神经元数量增多(P<0.05,图 4C、D)。
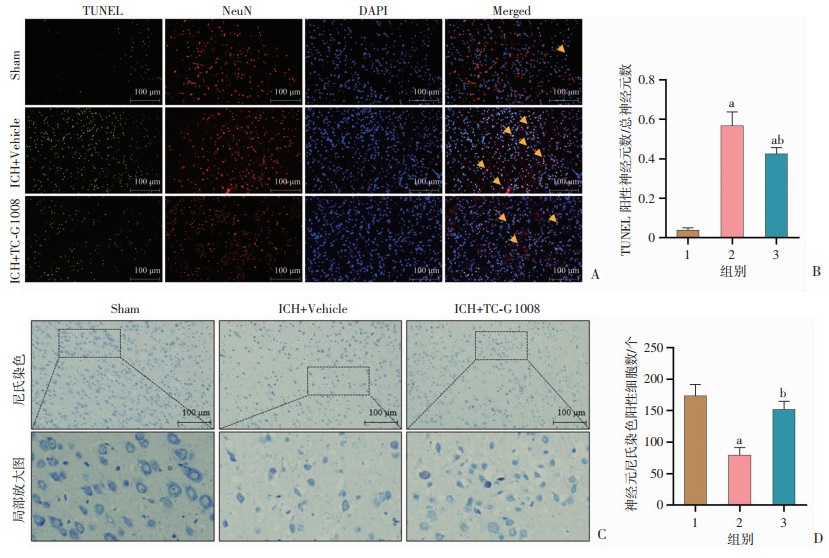
|
|
1:Sham组;2:ICH+Vehicle组;3:ICH+TC-G 1008组;a: P<0.05,与Sham组比较;b: P<0.05,与ICH+Vehicle组比较 A:ICH后48 h各组TUNEL染色;B: TUNEL阳性神经元数量与总神经元数量比值(n=4,x ± se) 图 4 TC-G 1008激活GPR39对ICH后血肿周围神经元损伤的影响 |
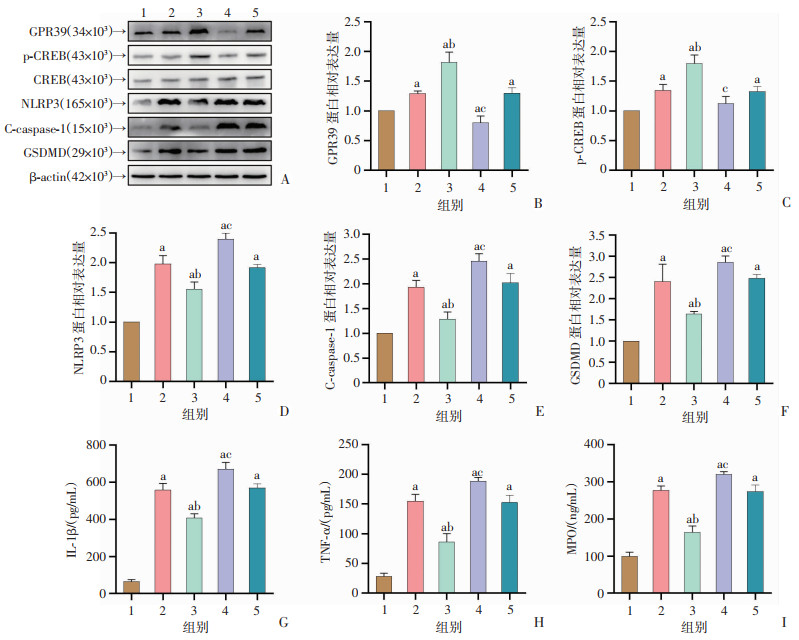
2.5 敲低GPR39对ICH后细胞焦亡相关分子表达和促炎相关因子影响
为了验证GPR39对焦亡相关分子的影响,在ICH建模前24 h经侧脑室注射GPR39 siRNA以抑制内源性GPR39的表达。Western blot和ELISA检测结果表明,与ICH+Vehicle组相比,ICH+TC-G 1008组中焦亡相关分子NLRP3、C-caspase-1和GSDMD的表达和促炎相关因子IL-1β、TNF-α和MPO的水平降低。然而,ICH+GPR39 siRNA组与ICH+Scramble siRNA组相比,敲低GPR39后焦亡相关分子的表达和促炎相关因子的水平部分增加(P<0.05,图 5)。
|
|
1:Sham组;2:ICH+Vehicle组;3:ICH+TC-G 1008组; 4:ICH+GPR39 siRNA组;5:ICH+Scramble siRNA组;a: P<0.05,与Sham组比较;b: P<0.05,与ICH+Vehicle组比较;c: P<0.05,与ICH+Scramble siRNA组比较 A~F: Western blot检测GPR39、p-CREB、NLRP3、C-caspase-1、GSDMD的蛋白表达及半定量分析;G~I: ICH后48 h各组IL-1β、TNF-α和MPO的含量 图 5 敲低GPR39对ICH后血肿周围脑组织细胞焦亡相关分子和炎症相关因子的影响(n=6,x ± se) |
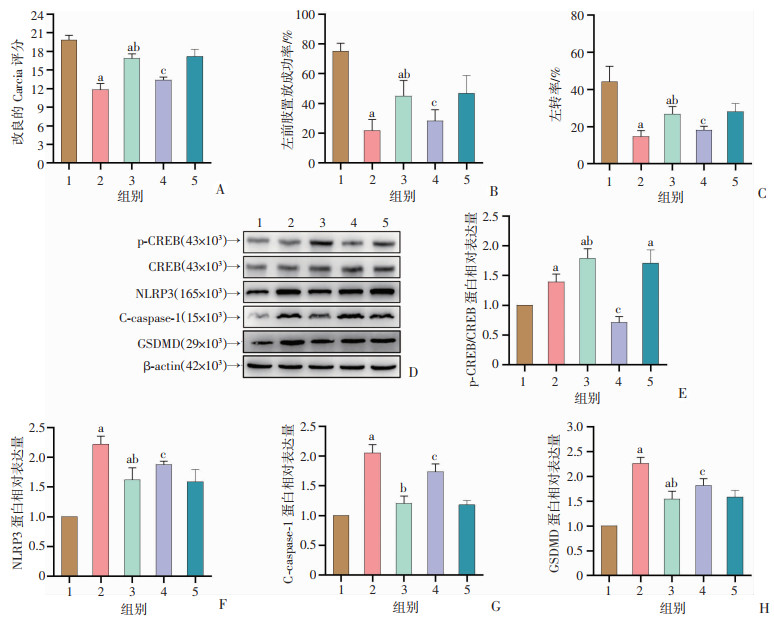
2.6 666-15部分减少TC-G 1008激活GPR39的神经保护作用
为明确TC-G 1008激活GPR39的神经保护作用是否与CREB信号通路有关,在ICH建模前24 h通过侧脑室注射666-15, 并在建模后给予TC-G 1008治疗。与ICH+TC-G 1008+Vehicle 2组相比,ICH+TC-G 1008+ 666-15组小鼠ICH后48 h呈现出明显的神经功能缺陷(P<0.05,图 6A~C)。Western blot检测结果表明,当下调p-CREB的表达后,与ICH+TC-G 1008+Vehicle 2组相比,ICH+TC-G 1008+666-15组小鼠血肿周围组织中的NLRP3、C-caspase-1和GSDMD的表达增加(P<0.05,图 6D~H)。
|
|
1:Sham组;2:ICH+Vehicle组;3:ICH+TC-G 1008组; 4. ICH+TC-G 1008+666-15组;5:ICH+TC-G 1008+Vehicle 2组;a: P<0.05,与Sham组比较;b: P<0.05,与ICH+Vehicle组比较;c: P<0.05,与ICH+TC-G 1008+Vehicle 2组比较 A~C:ICH后48 h各组小鼠改良Garcia评分、左前肢放置实验和转角实验;D~H: Western blot检测各组CREB、NLRP3、C-caspase-1和GSDMD蛋白表达及半定量分析 图 6 666-15部分减少TC-G 1008激活GPR39对ICH后小鼠的短期神经功能和细胞焦亡分子的影响(n=6,x ± se) |
3 讨论
本研究利用小鼠ICH模型对GPR39的激活可能部分通过CREB信号通路抑制神经元焦亡后神经炎症的作用进行了探讨。观察到以下结果:①小鼠ICH后血肿周围组织内GPR39表达升高,神经元和小胶质细胞上均有GPR39表达;②TC-G 1008激活GPR39可显著改善小鼠短期的神经功能障碍和脑水肿;③TC-G 1008激活GPR39减轻了小鼠ICH后血肿周围组织神经元的损伤,并伴有NLRP3的表达减少,IL-1β、TNF-α和MPO的水平降低;④敲低GPR39部分增加ICH后焦亡相关因子NLRP3、C-caspase-1、GSDMD和炎症相关因子的表达;⑤CREB信号通路可能是GPR39介导神经保护的潜在机制。
焦亡的途径包含经典和非经典焦亡途径。其中经典的焦亡途径由caspase-1介导[15]。最新的研究表明,NLRP3炎症小体可通过激活caspase-1触发GSDMD的切割和加速促炎性因子的成熟参与到ICH后的细胞焦亡的过程[16]。裂解的GSDMD在细胞膜上形成非选择的细胞膜孔,以加速细胞内炎症物质的释放,从而导致炎症反应进一步加重,最终导致细胞炎性死亡[17-18]。焦亡是ICH导致脑损伤的重要机制,可导致血肿周围神经元细胞在内的多种细胞炎性死亡[19]。本研究观察到小鼠ICH后血肿周围神经元内焦亡相关分子NLRP3的表达增加,表明神经元细胞焦亡参与了ICH后脑损伤的过程,因此抑制神经元细胞焦亡可能缓解ICH后过度的神经炎症和脑损伤。
G蛋白偶联受体家族具有典型的七次跨膜结构,使它们能够检测各种细胞刺激,也使其成为药理学干预的理想靶点[20]。GPR39已被证实在中枢神经系统中的杏仁核、海马区和听觉皮层中广泛表达[7]。Zn2+既往被确定为GPR39的生理激动剂,胞外的Zn2+可激活GPR39受体从而触发多种信号传导途径[6]。缺锌饮食会导致海马区GPR39表达下降,膳食补锌后可显著消除GPR39的异常表达[21]。在中风的内环境下,脑组织的神经元会大量释放细胞外Zn2+以促进促炎症细胞因子的产生[22]。本研究观察到ICH后血肿周围GPR39的表达以时间依赖性方式增加,可能是由于神经元释放的Zn2+导致的。然而Zn2+导致内源性GPR39的表达增加可能还不足以抵抗小鼠ICH后的整体脑损伤。因此,在给予激动剂进一步激活GPR39的表达后,本研究观察到小鼠短期神经行为缺陷的改善,这表明GPR39参与了ICH后的病理进展过程。
既往研究表明,GPR39在促进伤口愈合、减轻炎症性肠病症状、减轻焦虑行为和促进胰岛素分泌等方面发挥着重要作用[23]。在中枢神经系统中,体外研究发现激活GPR39可以通过抗细胞凋亡和缓解内质网应激保护海马神经元细胞[10]。体内实验表明激活GPR39可以抑制神经炎症从而改善新生大鼠的神经行为缺陷[11]。在本研究中,TC-G 1008激活GPR39显著改善了小鼠ICH后短期的神经行为缺陷和脑水肿,下调了小鼠血肿周围组织焦亡相关分子NLRP3、C-capase-1和GSDMD的表达,并降低了促炎相关因子IL-1β,TNF-α和MPO的水平。GPR39 siRNA敲低GPR39后小鼠血肿周围组织NLRP3、C-capase-1和GSDMD以及炎性相关因子的表达增加。因此,GPR39在小鼠ICH后可能通过抑制血肿周围组织神经元焦亡,减少炎性物质的释放,从而减轻神经炎症和脑损伤。
GPR39是G蛋白偶联受体家族中的一员,其可能通过经典的G蛋白偶联受体/PKA途径调节CREB信号进而调节炎症小体的表达[24-25]。在ICH的研究中,CREB激活通常起到抗神经炎症的作用[26]。研究发现,激活GPR39可通过CREB信号通路抑制皮质酮诱导的海马细胞神经元凋亡[10]。最近的研究表明CREB参与了ICH后神经元焦亡的机制[24]。同之前研究一致,本研究观察到激活GPR39增加了p-CREB的表达,而666-15抑制p-CREB后部分减轻了TC-G 1008激活GPR39后的神经保护作用。表明激活GPR39可能部分通过CREB信号通路调节神经元焦亡从而抑制神经炎症。
据报道,GPR39是一种多功能蛋白,研究证实激活GPR39可通过Sirt1/PGC1-α/Nrf2信号通路调节线粒体生物发生从而减轻神经炎症引起的慢性神经性疼痛,但本研究仅探索了GPR39激活后在ICH后抗神经元焦亡和神经炎症的作用。由于GPR39还在小胶质细胞中表达,其在ICH后参与小胶质细胞中的抗焦亡作用需要进一步研究。未来还需要进一步探索给予TC-G 1008激活GPR39后在ICH后脑损伤中的长期结局和其他的潜在机制。
综上所述,激活GPR39可能部分通过CREB信号通路抑制神经元焦亡,从而减轻因神经元焦亡后炎性物质释放导致的神经炎症,进而改善小鼠ICH后继发性脑损伤。因此,GPR39可能作为ICH患者减轻脑损伤的治疗靶点。
| [1] |
PUY L, PARRY-JONES A R, SANDSET E C, et al. Intracerebral haemorrhage[J]. Nat Rev Dis Primers, 2023, 9(1): 14. |
| [2] |
MAGID-BERNSTEIN J, GIRARD R, POLSTER S, et al. Cerebral hemorrhage: pathophysiology, treatment, and future directions[J]. Circ Res, 2022, 130(8): 1204-1229. |
| [3] |
GU L G, SUN M J, LI R H, et al. Didymin suppresses microglia pyroptosis and neuroinflammation through the asc/caspase-1/GSDMD pathway following experimental intracerebral hemorrhage[J]. Front Immunol, 2022, 13: 810582. |
| [4] |
SONG D P, YEH C T, WANG J, et al. Perspectives on the mechanism of pyroptosis after intracerebral hemorrhage[J]. Front Immunol, 2022, 13: 989503. |
| [5] |
MCKEE K K, TAN C P, PALYHA O C, et al. Cloning and characterization of two human G protein-coupled receptor genes (GPR38 and GPR39) related to the growth hormone secretagogue and neurotensin receptors[J]. Genomics, 1997, 46(3): 426-434. |
| [6] |
HERSHFINKEL M. The zinc sensing receptor, ZnR/GPR39, in health and disease[J]. Int J Mol Sci, 2018, 19(2): 439. |
| [7] |
XU Y F, BARNES A P, ALKAYED N J. Role of GPR39 in neurovascular homeostasis and disease[J]. Int J Mol Sci, 2021, 22(15): 8200. |
| [8] |
MLYNIEC K, SIODŁAK D, DOBOSZEWSKA U, et al. GPCR oligomerization as a target for antidepressants: focus on GPR39[J]. Pharmacol Ther, 2021, 225: 107842. |
| [9] |
DAVIS C M, BAH T M, ZHANG W H, et al. GPR39 localization in the aging human brain and correlation of expression and polymorphism with vascular cognitive impairment[J]. Alzheimers Dement, 2021, 7(1): e12214. |
| [10] |
MO F F, TANG Y X, DU P, et al. GPR39 protects against corticosterone-induced neuronal injury in hippocampal cells through the CREB-BDNF signaling pathway[J]. J Affect Disord, 2020, 272: 474-484. |
| [11] |
XIE S C, JIANG X L, DOYCHEVA D M, et al. Activation of GPR39 with TC-G 1008 attenuates neuroinflammation via SIRT1/PGC-1α/Nrf2 pathway post-neonatal hypoxic-ischemic injury in rats[J]. J Neuroinflammation, 2021, 18(1): 226. |
| [12] |
JING W X, SUN W Y, ZHANG N, et al. The protective effects of the GPR39 agonist TC-G 1008 against TNF-α-induced inflammation in human fibroblast-like synoviocytes (FLSs)[J]. Eur J Pharmacol, 2019, 865: 172663. |
| [13] |
WU X, FU S M, LIU Y, et al. NDP-MSH binding melanocortin-1 receptor ameliorates neuroinflammation and BBB disruption through CREB/Nr4a1/NF-κB pathway after intracerebral hemorrhage in mice[J]. J Neuroinflammation, 2019, 16(1): 192. |
| [14] |
KIM E N, NABENDE W Y, JEONG H, et al. The marine-derived natural product epiloliolide isolated from Sargassum horneri regulates NLRP3 via PKA/CREB, promoting proliferation and anti-inflammatory effects of human periodontal ligament cells[J]. Mar Drugs, 2021, 19(7): 388. |
| [15] |
SHI J J, GAO W Q, SHAO F. Pyroptosis: gasdermin-mediated programmed necrotic cell death[J]. Trends Biochem Sci, 2017, 42(4): 245-254. |
| [16] |
HUANG Y, XU W, ZHOU R B. NLRP3 inflammasome activation and cell death[J]. Cell Mol Immunol, 2021, 18(9): 2114-2127. |
| [17] |
CAI L, GONG Q Y, QI L, et al. ACT001 attenuates microglia-mediated neuroinflammation after traumatic brain injury via inhibiting AKT/NFκB/NLRP3 pathway[J]. Cell Commun Signal, 2022, 20(1): 56. |
| [18] |
DING J, WANG K, LIU W, et al. Pore-forming activity and structural autoinhibition of the gasdermin family[J]. Nature, 2016, 535(7610): 111-116. |
| [19] |
GU L G, SUN M J, LI R H, et al. Activation of RKIP binding ASC attenuates neuronal pyroptosis and brain injury via caspase-1/GSDMD signaling pathway after intracerebral hemorrhage in mice[J]. Transl Stroke Res, 2022, 13(6): 1037-1054. |
| [20] |
HAUSER A S, ATTWOOD M M, RASK-ANDERSEN M, et al. Trends in GPCR drug discovery: new agents, targets and indications[J]. Nat Rev Drug Discov, 2017, 16(12): 829-842. |
| [21] |
CHEN N N, ZHAO D J, SUN Y X, et al. Long-term effects of zinc deficiency and zinc supplementation on developmental seizure-induced brain damage and the underlying GPR39/ZnT-3 and MBP expression in the hippocampus[J]. Front Neurosci, 2019, 13: 920. |
| [22] |
HIGASHI Y, ARATAKE T, SHIMIZU S, et al. Brain zinc dyshomeostasis and glial cells in ischemic stroke[J]. Nihon Yakurigaku Zasshi, 2019, 154(3): 138-142. |
| [23] |
LAITAKARI A, LIU L Z, FRIMURER T M, et al. The zinc-sensing receptor GPR39 in physiology and as a pharmacological target[J]. Int J Mol Sci, 2021, 22(8): 3872. |
| [24] |
YAN J, XU W L, LENAHAN C, et al. CCR5 activation promotes NLRP1-dependent neuronal pyroptosis via CCR5/PKA/CREB pathway after intracerebral hemorrhage[J]. Stroke, 2021, 52(12): 4021-4032. |
| [25] |
JIN P, DENG S X, TIAN M, et al. INT-777 prevents cognitive impairment by activating Takeda G protein-coupled receptor 5 (TGR5) and attenuating neuroinflammation via cAMP/PKA/CREB signaling axis in a rat model of sepsis[J]. Exp Neurol, 2021, 335: 113504. |
| [26] |
WEN A Y, SAKAMOTO K M, MILLER L S. The role of the transcription factor CREB in immune function[J]. J Immunol, 2010, 185(11): 6413-6419. |




