空间记忆是脑的高级功能之一,这一功能的实现与前额叶-海马-内嗅皮层记忆神经网络密切相关[1]。内嗅皮层作为海马的“门户”系统,介导了皮层与海马之间的信息交流[1-2]。根据到海马齿状回的投射,内嗅皮层可分为内侧内嗅皮层(medial entorhinal cortex,MEC)和外侧内嗅皮层(lateral entorhinal cortex, LEC),两者在信息编码方面存在差异,其中MEC主要编码空间位置信息,而LEC则与物体的特征(如气味、形状等)信息表征有关[3]。损毁MEC导致动物空间位置记忆和空间导航功能明显受损[4]。
丘脑连接核(thalamic nucleus reuniens,RE)是位于腹侧中线的丘脑核团,直接位于第三脑室上方,接收广泛的来自脑干、下丘脑、杏仁核、基底前脑和边缘皮质等部位的投射[5],并发出纤维投射到眶侧和内侧前额叶、压后皮质、海马、海马旁区(嗅周皮层和内嗅皮层)等[6]。由于其与海马和内侧前额叶的双向连接[7],RE在近十年来受到广泛的关注。越来越多的证据表明RE是参与各种认知和记忆过程的关键结构[8]。前期研究报道,RE连接内侧前额叶皮层和海马,参与了情景记忆和空间记忆的形成, 损毁或失活RE降低了皮层-海马神经网络振荡的同步性,损害了皮层与海马之间的信息交流,进而导致空间记忆明显受损[9]。
鉴于RE在记忆神经环路中的重要位置,前期研究发现RE同时发出纤维投射到MEC脑区[6],因此,我们可以合理推测RE可能调控MEC参与的空间记忆与空间导航功能。但目前关于RE-MEC神经通路的功能作用的报道较少,RE是如何调控MEC参与空间记忆形成的具体作用和潜在机制也尚不清楚。为此,本研究首先通过逆行和顺行神经示踪技术验证RE与MEC之间的神经环路联系,随后采用光纤记录技术观察投射至MEC的RE神经元在空旷场探索时的活动模式。最后采用化学遗传学方法特异性抑制RE-MEC神经通路,探究对小鼠空间探索行为的影响,为RE神经元调控MEC相关的空间记忆的作用机制研究提供依据。
1 材料与方法 1.1 材料 1.1.1 实验动物健康成年雄性C57BL/6J小鼠(8~12周龄,体质量20~24 g),购自陆军军医大学动物实验中心。小鼠饲养环境符合标准实验室条件,按12 h光照/12 h黑暗交替,温度为(22±1)℃。所有实验操作严格遵守相关实验动物福利和伦理规范。
1.1.2 主要试剂本研究主要采用的试剂有:Red RetroBeads(美国Lumaflouor公司),AAV2/9-hSyn-EGFP(武汉枢密公司),AAV2/9-CAG-FLEX-jGCaMP7b、AAV2/2Retro-hSyn-cre(上海泰儿图公司),AAV2/9-EF1α-DIO-mCherry、AAV2/9-EF1α-DIO-hM4D-mCherry(武汉枢密公司),氯氮平N-氧化物(CNO, 美国Tocris公司),磷酸盐缓冲溶液(PBS,中国中杉金桥公司),4%多聚甲醛(4% PFA,美国Sigma公司),蔗糖(中国生工公司)。
1.2 方法 1.2.1 逆行与顺行神经示踪实验脑立体定位注射操作流程参考课题组前期研究[10]。C57BL/6J小鼠(8~12周龄)使用2.0%异氟烷(流速0.5 mL/min) 诱导麻醉,将其置于立体定位仪上(中国瑞沃德公司),而后麻醉药浓度调至0.1%。参照小鼠脑图谱第3版,以前囟点(bregma)为坐标轴原点,调平,确定双侧MEC脑区位置(AP=-4.50 mm;ML=±3.75 mm;DV=-1.95 mm)。使用微推玻璃针分别注射200 nL Red Retrobeads到双侧MEC,注射完毕后留针10 min,缓慢拔出玻璃注射针。消毒缝合后待小鼠恢复清醒状态后放入笼中饲养。染料注射7 d后,灌注取材观察形态。在顺行神经示踪实验中,将200 nL AAV2/9-hSyn-EGFP病毒缓慢注射RE脑区(AP= -0.75 mm;ML=0.00 mm;DV=-4.40 mm),留针10 min。病毒注射4周后,灌注取材并观察形态。
1.2.2 行为学实验与轨迹记录在进行行为学实验前,对小鼠进行3 d的限食和环境适应,控制其体质量为初始体质量的85%,并在正式训练前每天抚触小鼠5~10 min,以防止正式训练时小鼠应激。设置长、宽、高分别为30 cm×30 cm×30 cm或50 cm×50 cm×30 cm的空旷场,在4个壁上粘贴不同图案(星形、三角形、正方形、圆形)。每次实验前,用75%酒精擦拭环境,消除食物气味对小鼠探索新环境的干扰。正式训练过程中,每次从旷场的同一方位放入小鼠,通过Cineplex v2/v3软件(Plexon,采样频率:30 Hz)联合头顶摄像头记录小鼠在空旷场中自由探索10 min的运动轨迹和行为。
1.2.3 轨迹分析与行为学检测追踪视频数据导入MATLAB软件程序,通过识别小鼠身体较低的灰度值(暗,阈值设置0~30)与旷场背景(亮)之间的对比度,追踪得到小鼠运动轨迹数据。设置速度阈值为3 cm/s,低于速度阈值判断为静止状态,记录小鼠的运动和静止时间,并分析投射到MEC的RE神经元钙信号与速度之间的相关性。根据视频判断并手动记录小鼠站立、抬头、理毛行为的时间,导入到MATLAB程序,分析行为事件期间的钙信号,并做相关性分析。为了研究干预RE-MEC通路是否会对小鼠的焦虑程度产生影响,进而影响到小鼠探索的行为表现,分析小鼠在中央区(用MATLAB对旷场底部以4×4方式划分为16个小的正方形,中心的4个小格为中央区)的停留时间。
1.2.4 光纤记录与分析小鼠麻醉固定,暴露颅骨,调平后,定位RE和MEC位置,坐标同1.2.1。在RE脑区注射200 nL AAV2/9-CAG-FLEX-jGCaMP7b病毒载体,在两侧MEC分别注射200 nL AAV2/2Retro-hSyn-cre病毒载体,注射完毕后缓慢拔出,消毒缝合。病毒表达3周,进行光纤埋置手术。在小鼠颅骨表面定位6个骨窗位置,坐标分别为(AP=+1.50 mm;ML=±1.50 mm),(AP=-3.00 mm;ML=±2.00 mm),(AP=-6.00 mm;ML=±2.00 mm),用于埋置螺丝。定位RE脑区,坐标不变,缓慢植入光纤,并于目标位置上方约0.5 mm处开始实时探测钙信号,当幅值到达最大值且平稳后,停止植入,牙科水泥固定光纤。术后恢复7 d,将小鼠放入30 cm×30 cm的空旷场进行空间探索任务,使用光纤记录系统(中国Inper公司)记录投射至MEC的RE神经元钙信号(410 nm发光强度:10~20 μW,470 nm发光强度:20~40 μW,采样频率: 20 Hz),校正处理后得到ΔF/F表征钙信号变化情况,具体分析方法见课题组前期工作[11], 行为训练结束后进行灌注取材,确定病毒表达情况及光纤埋置位置。该实验中,共计排除3只小鼠(无病毒表达)。
1.2.5 化学遗传干预实验为了观察特异性抑制RE-MEC通路对空间探索行为的影响,将16只同一批C57BL/6J小鼠按随机数字表法分为2组。小鼠麻醉固定,定位RE和MEC,在RE脑区注射200 nL AAV2/9-EF1α-DIO-hM4D-mCherry或对照病毒AAV2/9-EF1α-DIO-mCherry,在两侧MEC分别注射200 nL AAV2/2Retro-hSyn-cre病毒载体,注射完毕后缓慢拔出,消毒缝合,具体步骤同1.2.4。病毒表达3周,进行导管埋置手术。埋置6颗螺丝,定位RE脑区,缓慢埋置导管,植入深度约为4.35~4.40 mm,牙科水泥固定导管。术后恢复7 d,小鼠进行空旷场空间探索任务。旷场训练前15 min,使用微量注射泵经给药导管于RE脑区给予200 nL CNO(5 μmol/L,注射速度为100 nL/min)。行为训练结束后,灌注取材确定病毒表达情况及导管埋置位置是否准确。该实验中,2组小鼠共计排除4只(处理组3只,对照组1只)。
1.2.6 灌注取材实验将小鼠麻醉固定后,充分暴露心脏,灌注针插入左心室,以30 mL、37 ℃的PBS溶液及30 mL、4%PFA进行心脏灌流后,取出脑组织,浸泡于4%PFA中后固定12 h,转移至30%蔗糖溶液中脱水。
1.2.7 脑片制备与形态学鉴定实验脑组织完全沉底后取出修块,使用OCT包埋剂固定脑组织,放入冰冻切片机(CM1900,美国Leica)于-20 ℃下连续切片,切片厚度为40 μm。收集含有RE或MEC的脑片,用含有DAPI的防荧光淬灭封片剂封片,在荧光显微镜(BX53F,日本Olympus)或共聚焦显微镜(LSM900,德国Zeiss)下拍照,收集形态学数据。
1.3 统计学分析数据均以x±s表示,采用Prism统计软件进行分析,正态性检验通过且方差齐,采用独立样本t检验、单因素方差分析;不满足正态分布则采用非参数检验。旷场探索路程数据未通过正态性检验,采用SPSS 26.0软件进行两因素非参数方差分析(Scheirer-Ray-Hare检验)[12]。检验水准:α=0.05,以P < 0.05认为差异具有统计学意义。
2 结果 2.1 RE神经元投射至空间记忆相关的MEC为了鉴定可能驱动MEC神经元发挥空间记忆功能的上游脑区,本研究在MEC注射逆行示踪染料Red Retrobeads(图 1A、B),结合小鼠脑图谱,收集含有注射位点的冠状脑片,显微镜下观察红色荧光颗粒局限表达在MEC脑区,发现上游RE脑区的神经元胞体感染了大量从MEC逆追上来的红色荧光颗粒(图 1C、D),且荧光颗粒的分布与RE的解剖结构相吻合,从RE的头端到尾端,验证了MEC接收来自RE的纤维投射。
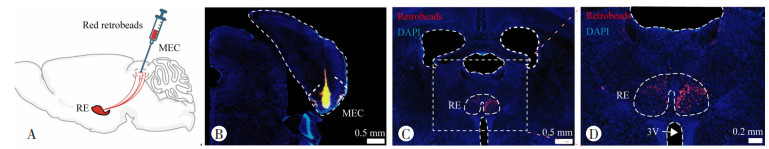
|
| A:Red Retrobeads介导的逆行神经示踪示意图;B:MEC注射位点染料定位情况(n=5);C:MEC逆行示踪至RE脑区Retrobeads红色表达情况 蓝色:DAPI;D:C图白色虚线方框的放大视图 虚线框出结构(自上而下):背侧第三脑室、RE、腹侧第三脑室 图 1 逆行神经示踪实验鉴定RE是MEC的上游投射脑区 |
本研究通过顺行神经示踪方法在RE脑区注射AAV2/9-hSyn-EGFP病毒载体(图 2A、B),在下游脑区MEC的不同亚区观察RE的纤维末梢分布情况,发现MEC浅层(主要是Ⅰ层)有致密的带绿色荧光表达的神经纤维分布,其他亚区也有部分RE的神经纤维末梢分布,说明RE主要投射至MEC浅层,深层也有少量纤维投射,以上结果为RE可能参与调控MEC介导的空间记忆形成提供了形态学基础。
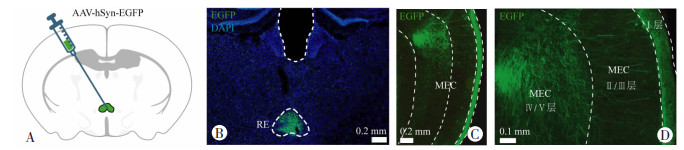
|
| A:顺行神经示踪注射示意图;B:RE注射位点病毒表达情况(n=7);C:RE投射至MEC的带EGFP的神经纤维末梢示意图;D:MEC脑区局部带EGFP的纤维末梢放大图 图 2 RE神经元投射至空间记忆相关的MEC |
2.2 光纤记录投射至MEC的RE神经元在空间探索相关行为中激活
形态学证据表明RE投射至空间记忆相关的MEC,在此基础上,进一步探究在体情况下RE-MEC通路在空间探索时的神经活动特征。首先在两侧MEC注射AAV2/Retro-hSyn-Cre病毒,同时在RE注射Cre依赖的CAG-FLEX-GCaMP7b病毒,标记特异性投射至MEC的RE神经元。等待病毒表达3周后,在RE埋置光纤(图 3A)。形态学鉴定钙指示剂蛋白GCaMP7b表达神经元集中分布在RE,且光纤植入位点在RE上方(图 3B)。手术恢复1周后,记录小鼠在空旷场中探索10 min的行为和神经元钙信号活动(图 3C、D)。分析特异性投射至MEC的RE神经元在探索行为和刻板行为期间的钙信号活动,该群神经元在站立行为期间的ΔF/F (5.94%±0.24%,n=251次) 与抬头行为期间的ΔF/F (5.80%±0.17%,n=510次)相近,差异无统计学意义。在理毛行为期间的ΔF/F为(3.866%±0.607%,n=21次),小鼠处于静止期间的ΔF/F为(5.30%±0.24%,n=266次)。站立行为期间钙信号高于静止行为期间的钙信号(P=0.035)和理毛期间的钙信号(P=0.034 9)。以上结果表明RE-MEC通路在探索行为中激活,在小鼠处于静止或刻板行为期间活动减弱。同时,本研究分析了投射至MEC的RE神经元的钙活动与速度之间的相关性,发现这群神经元的钙活动与小鼠运动速度之间呈正相关(P < 0.001),提示RE-MEC通路在小鼠运动探索时激活。
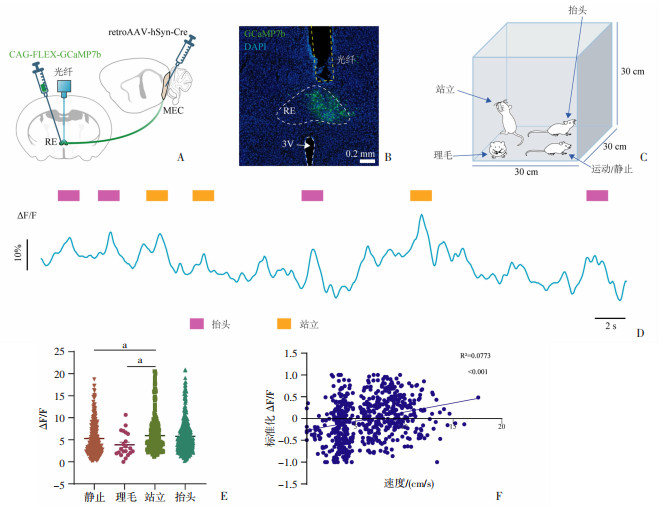
|
| A:RE与MEC病毒注射及光纤埋置示意图;B:RE内感染GCaMP7b及光纤记录典型代表图 绿色荧光:GCaMP7b,黄色虚线:光纤埋置位置,白色虚线(自上而下):RE、腹侧第三脑室;C:小鼠在空旷场内不同行为示意图;D:光纤记录小鼠在旷场内不同行为期间投射至MEC的RE神经元钙信号变化典型代表图(ΔF/F) 方框:示行为事件;E:空旷场中小鼠投射至MEC的RE神经元钙信号的Kruskal-Wallis检验(n=9), a:P<0.05,4组之间两两比较;F:投射至MEC的RE神经标准化钙信号与小鼠在空旷场内运动速度之间的相关性分析(n=9) 图 3 投射至MEC的RE神经元在空间探索相关行为中激活 |
2.3 化学遗传学抑制RE-MEC通路损害空间记忆
动物在探索新环境时,大脑神经的神经元同时在编码与环境相关的空间信息,进而形成空间记忆。光纤记录实验结果表明,RE-MEC通路在空间探索行为中激活,因此,本研究通过化学遗传学干预RE-MEC通路,分析小鼠在空间探索全过程中探索距离持续动态的变化情况,进而探究RE-MEC通路对空间记忆编码过程的调控作用。首先在两侧MEC注射AAV2/Retro-hSyn-Cre病毒,同时在RE注射Cre依赖的DIO-hM4D-mCherry病毒或对照DIO-mCherry病毒,标记特异性投射至MEC的RE神经元。等待病毒表达3周后,在RE埋置导管(图 4A)。形态学鉴定hM4D集中表达在RE,且导管植入位点在RE上方(图 4B)。手术恢复1周后,记录小鼠在空旷场中探索10 min的行为和轨迹(图 4C、D)。在小鼠放入旷场正式训练前15 min,通过给药导管在RE脑区注射CNO诱导抑制RE-MEC通路。与对照组(mCherry)小鼠比较,处理组(hM4D)小鼠在空旷场中探索距离(时间窗/30 s)明显高于对照组小鼠。同时,处理组小鼠在整个空间探索过程中的运动时间存在增加的趋势(图 4F)。为了排除干预RE-MEC通路影响小鼠情绪水平引起小鼠空间记忆受损的因素,我们对比分析了处理组小鼠与对照组小鼠在中央区的停留时间和刻板理毛行为次数,两组小鼠之间中央区时间差异无统计学差异(图 4G),对小鼠的重复刻板理毛行为没有造成影响(图 4H),说明抑制RE-MEC通路不会对小鼠的情绪水平造成影响。这些结果提示化学遗传抑制RE-MEC通路损害小鼠的空间记忆,使得小鼠需要探索更长的距离对新环境的空间信息进行表征。
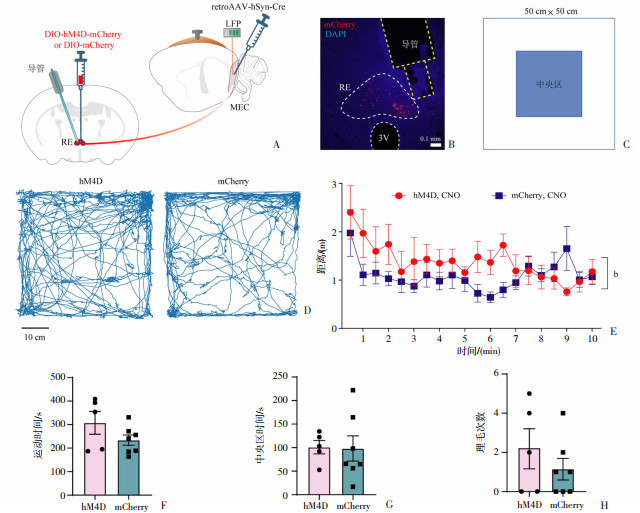
|
| A:RE与MEC病毒注射与导管埋置示意图;B:RE病毒表达与导管埋置位置典型示意图 红色荧光:mCherry,黄色虚线:导管埋置位置;C:空旷场及中央区(蓝色填充)分布示意图;D:处理组(hM4D)与对照组(mCherry)小鼠在空旷场中运动轨迹示意图;E:化学遗传抑制RE-MEC通路后,小鼠在连续时间窗(30 s)的运动距离 b:P<0.01,与对照组比较;F:化学遗传抑制RE-MEC通路后,小鼠在空旷场内探索10 min的总运动时间;G:化学遗传抑制RE-MEC通路后,小鼠在中央区的停留时间;H:化学遗传抑制RE-MEC通路后,小鼠在空旷场内的理毛次数 图 4 化学遗传抑制RE-MEC通路损害空间记忆 |
3 讨论
空间记忆是对环境位置或方向信息的表征,与皮层-海马神经环路密切相关[14]。内嗅皮层是海马结构的输入和输出结构,是海马-前额叶环路的重要节点,介导了海马与皮层之间的信息交流[13, 15]。RE与前额叶-海马-内嗅皮层神经环路建立广泛的联系[6, 16]。海马发出直接投射至前额叶,有趣的是,前额叶并未发出直接的纤维投射至海马,而是通过RE中继将信息传递至海马[17]。同时,RE也发出神经纤维投射至空间记忆相关的内嗅皮层。另外,行为学证据表明RE参与空间记忆的形成,损毁或抑制RE导致空间记忆的编码和长期形成受损[18-19]。且RE在觉醒期间高度活跃[20],是皮层信息传递至海马和MEC的重要中继站和输出站[8, 21],为RE调控MEC参与空间记忆提供了合理的理论基础。本研究首先利用逆行神经示踪和顺行神经示踪技术,探究RE与MEC之间形态学联系特征,并进一步记录了特异性投射到MEC的RE神经元在空间探索中的活动模式,为RE-MEC通路在空间学习记忆的作用机制研究提供了基础。
通过逆行神经示踪和顺行神经示踪技术,验证了RE与MEC存在大量的纤维投射(在MEC浅层Ⅰ层有密集的纤维投射),Ⅰ层(分子层)基本不包含神经元胞体,而是分布着致密的纤维带,是其他亚层神经元胞体的轴突或树突棘集中分布的区域,并建立广泛的突触连接[13]。这与课题组另一发现是不同的,促觉醒脑区外侧下丘脑促进空间记忆编码,主要是通过投射至MEC浅层的Ⅱ/Ⅲ层的胞体,Ⅱ/Ⅲ层主要由星状神经元或锥状神经元胞体组成[11]。MEC的不同亚层之配合紧密,以一个整体网络的形式进行工作,并在空间记忆的储存、巩固和提取中发挥作用。以上结果提示RE与外侧下丘脑调控MEC的机制不同,可能作为两个独立又互补的上游系统调控MEC相关的空间记忆编码。
在形态学证据的基础上,本研究探索了在体情况下RE-MEC通路在小鼠进行空间探索时的活动特征。本研究构建了小鼠在空旷场中自由探索的一系列行为谱,包括探索行为(站立行为、抬头行为),刻板行为(理毛行为)、运动和静止状态,记录了这些行为期间投射至MEC的RE神经元的活动模式。发现RE-MEC通路在小鼠进行探索相关行为时更活跃,而在静止和刻板行为期间钙活动减弱,进一步分析钙信号与小鼠运动速度呈正相关,小鼠运动的钙活动明显高于静止状态时的钙活动,这些结果提示投射至MEC的RE神经元可能主要参与了空间记忆的编码过程,促进小鼠对新环境空间信息的表征。并且分析这群神经元的钙信号,明显升高发生在行为事件启动时,前期研究报道在丘脑中也存在空间位置编码的功能细胞,如头向细胞、边界细胞等[22-23],这些结果提示RE的输入可能为MEC参与空间记忆编码提供了自我运动的线索,关于RE投射至MEC的这群神经元是否为功能细胞及是哪种功能细胞类型仍有待进一步验证,并探究此通路是否对空间记忆编码的其他方面存在调控作用。
为了进一步验证RE-MEC通路在空间记忆编码的因果关系,本研究通过化学遗传抑制RE-MEC通路,导致小鼠在空旷场自由探索的距离增加,提示干预这条通路可能损害小鼠的空间记忆编码能力,使得小鼠需要探索更长的距离来加强对新环境空间信息的编码。需要注意的是,本研究仍存在一定的局限性,为进一步研究RE调控MEC参与空间记忆的具体作用,可以在多个空间记忆研究的行为范式如两物体空间位置改变实验、新物体识别实验等验证RE-MEC参与空间记忆的形成,并结合光遗传学操控,达到更高的时间分辨率,进一步明确RE调控MEC参与空间记忆的时间窗。前期研究报道,MEC与海马在觉醒期协同参与空间记忆的编码、存储与提取,场电位呈现出theta-gamma耦合振荡特征[24-27],另外,最新研究表明RE驱动皮层-海马神经网络振荡的同步化,促进情景记忆的编码或巩固转化为长期记忆[9, 19]。RE作为记忆神经环路中关键的一环,与前额叶、海马、内嗅皮层之间有着广泛的纤维联系,在空间记忆中发挥着重要作用,RE是通过什么神经网络振荡机制来促进MEC相关的空间记忆编码或提取,其上游驱动机制是什么,RE-MEC神经环路与前额叶-RE-海马神经环路在情景记忆信息处理有什么异同,RE对MEC的神经调控作用是否可以完善记忆神经环路的组件,这些问题有待进一步的研究。
综上所述,本研究结果表明,特异性投射至MEC的RE神经元在空间记忆编码过程中激活,并且抑制RE-MEC神经通路影响空间记忆。本研究结果为后续进一步解析和完善空间记忆神经环路机制研究提供了新的环路方向。
| [1] |
SUH J, RIVEST A J, NAKASHIBA T, et al. Entorhinal cortex layer Ⅲ input to the hippocampus is crucial for temporal association memory[J]. Science, 2011, 334(6061): 1415-1420. |
| [2] |
KERR K M, AGSTER K L, FURTAK S C, et al. Functional neuroanatomy of the parahippocampal region: the lateral and medial entorhinal areas[J]. Hippocampus, 2007, 17(9): 697-708. |
| [3] |
VAN CAUTER T, CAMON J, ALVERNHE A, et al. Distinct roles of medial and lateral entorhinal cortex in spatial cognition[J]. Cereb Cortex, 2013, 23(2): 451-459. |
| [4] |
HALES J B, VINCZE J L, REITZ N T, et al. Recent and remote retrograde memory deficit in rats with medial entorhinal cortex lesions[J]. Neurobiol Learn Mem, 2018, 155: 157-163. |
| [5] |
MCKENNA J T, VERTES R P. Afferent projections to nucleus reuniens of the thalamus[J]. J Comp Neurol, 2004, 480(2): 115-142. |
| [6] |
DOLLEMAN-VAN DER WEEL M J, GRIFFIN A L, ITO H T, et al. The nucleus reuniens of the thalamus sits at the nexus of a hippocampus and medial prefrontal cortex circuit enabling memory and behavior[J]. Learn Mem, 2019, 26(7): 191-205. |
| [7] |
VERTES R P, HOOVER W B, SZIGETI-BUCK K, et al. Nucleus reuniens of the midline thalamus: link between the medial prefrontal cortex and the hippocampus[J]. Brain Res Bull, 2007, 71(6): 601-609. |
| [8] |
CASSEL J C, FERRARIS M, QUILICHINI P, et al. The reuniens and rhomboid nuclei of the thalamus: a crossroads for cognition-relevant information processing?[J]. Neurosci Biobehav Rev, 2021, 126: 338-360. |
| [9] |
HALLOCK H L, WANG A, GRIFFIN A L. Ventral midline thalamus is critical for hippocampal-prefrontal synchrony and spatial working memory[J]. J Neurosci, 2016, 36(32): 8372-8389. |
| [10] |
REN S C, WANG Y L, YUE F G, et al. The paraventricular thalamus is a critical thalamic area for wakefulness[J]. Science, 2018, 362(6413): 429-434. |
| [11] |
LIAO Y X, WEN R Y, FU S W, et al. Spatial memory requires hypocretins to elevate medial entorhinal gamma oscillations[J]. Neuron, 2024, 112(1): 155-173.e8. |
| [12] |
申希平, 祁海萍, 刘小宁, 等. 两因素非参数方差分析在SPSS中的实现[J]. 中国卫生统计, 2013, 30(6): 913-914. SHEN X P, QI H P, LIU X N, et al. Realization of two-factor nonparametric variance analysis in SPSS[J]. Chin J Health Stat, 2013, 30(6): 913-914. |
| [13] |
CANTO C B, WOUTERLOOD F G, WITTER M P. What does the anatomical organization of the entorhinal cortex tell us?[J]. Neural Plast, 2008, 2008: 381243. |
| [14] |
MOSER E I, MOSER M B, MCNAUGHTON B L. Spatial representation in the hippocampal formation: a history[J]. Nat Neurosci, 2017, 20(11): 1448-1464. |
| [15] |
WITTER M P, DOAN T P, JACOBSEN B, et al. Architecture of the entorhinal cortex A review of entorhinal anatomy in rodents with some comparative notes[J]. Front Syst Neurosci, 2017, 11: 46. |
| [16] |
SCHEEL N, WULFF P, DE MOOIJ-VAN MALSEN J G. Afferent connections of the thalamic nucleus reuniens in the mouse[J]. J Comp Neurol, 2020, 528(7): 1189-1202. |
| [17] |
VERTES R P. Analysis of projections from the medial prefrontal cortex to the thalamus in the rat, with emphasis on nucleus reuniens[J]. J Comp Neurol, 2002, 442(2): 163-187. |
| [18] |
ITO H T, ZHANG S J, WITTER M P, et al. A prefrontal-thalamo-hippocampal circuit for goal-directed spatial navigation[J]. Nature, 2015, 522(7554): 50-55. |
| [19] |
FERRARIS M, CASSEL J C, PEREIRA DE VASCONCELOS A, et al. The nucleus reuniens, a thalamic relay for cortico-hippocampal interaction in recent and remote memory consolidation[J]. Neurosci Biobehav Rev, 2021, 125: 339-354. |
| [20] |
VIENA T D, VERTES R P, LINLEY S B. Discharge characteristics of neurons of nucleus reuniens across sleep-wake states in the behaving rat[J]. Behav Brain Res, 2021, 410: 113325. |
| [21] |
RAMANATHAN K R, RESSLER R L, JIN J J, et al. Nucleus reuniens is required for encoding and retrieving precise, hippocampal-dependent contextual fear memories in rats[J]. J Neurosci, 2018, 38(46): 9925-9933. |
| [22] |
JANKOWSKI M M, ISLAM M N, WRIGHT N F, et al. Nucleus reuniens of the thalamus contains head direction cells[J]. Elife, 2014, 3: e03075. |
| [23] |
JANKOWSKI M M, PASSECKER J, ISLAM M N, et al. Evidence for spatially-responsive neurons in the rostral thalamus[J]. Front Behav Neurosci, 2015, 9: 256. |
| [24] |
SCHOMBURG E W, FERNÁNDEZ-RUIZ A, MIZUSEKI K, et al. Theta phase segregation of input-specific gamma patterns in entorhinal-hippocampal networks[J]. Neuron, 2014, 84(2): 470-485. |
| [25] |
MALKOV A, SHEVKOVA L, LATYSHKOVA A, et al. Theta and gamma hippocampal-neocortical oscillations during the episodic-like memory test: impairment in epileptogenic rats[J]. Exp Neurol, 2022, 354: 114110. |
| [26] |
HASSELMO M E, BRANDON M P, YOSHIDA M, et al. A phase code for memory could arise from circuit mechanisms in entorhinal cortex[J]. Neural Netw, 2009, 22(8): 1129-1138. |
| [27] |
BUZSÁKI G. Theta oscillations in the hippocampus[J]. Neuron, 2002, 33(3): 325-340. |




