2. 400038 重庆,陆军军医大学药学与检验医学系微生物与生化药学教研室,国家免疫生物制品工程技术研究中心;
3. 050081 河北石家庄,陆军军医大学士官学校基础部
2. Department of Microbiology and Biochemical Pharmacy, National Engineering Research Center of Immunological Products, Faculty of Pharmacy and Laboratory Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Department of Basic Courses, Noncommissioned Officer School, Army Medical University (Third Military Medical University), Shijiazhuang, Hebei Province, 050081, China
金黄色葡萄球菌(Staphylococcus aureus,简称金葡菌)是世界范围内医院和社区获得性感染疾病的重要病原体。2022年国际权威期刊《柳叶刀》报道显示,金葡菌2019年在全球导致110万人死亡,居33种人体重要致病菌之首[1]。鼻腔是金葡菌在人体内定植的主要部位[2],显著增加了继发性金葡菌肺部感染机会,特别是医院呼吸机使用导致的肺炎。据报道,呼吸机使用导致的肺炎中,约25%~56%是由金葡菌引起[3],其中,以耐甲氧西林金葡菌(MRSA)为代表的多重耐药金葡菌导致的肺炎致死率高达50%,给相关疾病的治疗带来了严峻挑战[4]。
印苦楝内酯(nimbolide,NIM)是从印度楝树(Azadirachta indica)中分离得到的三萜类活性化合物[5],已被证明具有多种生物活性。在癌症方面,NIM可抑制前列腺癌,乳腺癌,胰腺癌等多种癌细胞的增殖与转移[6-8];在抗氧化和抗炎活性方面,NIM可抑制DNA氧化损伤和脂质过氧化改善肝功能,以及抑制巨噬细胞NF-κB信号转导改善小鼠结肠炎[9-10],另外,在抗金葡菌方面,研究者通过最小抑菌浓度(MIC)和最小杀菌浓度(MBC)等方法测定NIM的体外抗菌活性,结果表明NIM有潜力作为有效的抗菌剂[11]。文献报道显示NIM的主要靶点是E3泛素连接酶RNF114[12]。RNF114是RING结构域E3泛素连接酶亚家族中的成员之一[13],结构包括一个N端RING finger结构域和一个C端泛素相互作用基序UIM[14-15],首次报道显示其与银屑病发病相关[16]。近年来研究表明,RNF114可广泛参与调控I型IFN产生、细胞周期、NF-κB活性及T细胞活化等,进而影响相关癌症疾病的发生发展[17-20],而其在金葡菌感染中的作用尚无报道。
在本研究以NIM治疗小鼠金葡菌急性肺炎效果为探索起点,利用小鼠巨噬细胞感染模型,探索NIM通过调控巨噬细胞介导的炎症反应抑制小鼠急性肺炎的作用机制。
1 材料与方法 1.1 实验材料金葡菌USA300菌株由上海交通大学仁济医院李敏教授惠赠;C57BL/6小鼠订购于北京维通利华公司;高糖DMEM培养基购买于上海源培生物;胎牛血清购买于Moregate公司;1×PBS购买于美仑生物;RNF114 shRNA慢病毒和Polybrene试剂购买于美国Santa cruz公司;逆转录试剂盒及2×Hieff Canace Plus PCR购买于上海翌圣生物;TNF-α,IL-1β,IL-6 ELISA试剂盒及快速蛋白凝胶试剂盒购买于北京达科为生物;p65、ERK、p38、JNK、GAPDH及相应的磷酸化抗体均购于美国Cell Signaling Technology公司;Nimbolide购自MCE公司;二甲基亚砜(DMSO)购买于美国Sigma公司;胰蛋白胨大豆肉汤培养基(Tryptone Soya Broth,TSB)购买于英国Oxiod公司。
1.2 金葡菌培养条件挑过夜活化金葡菌USA300单克隆,接种于TSB液体培养基中,37 ℃,220 rpm培养至对数生长期,测量OD600确定细菌感染剂量;其中小鼠感染剂量为5×108,细胞感染复数MOI为10。
1.3 小鼠感染模型SPF级6周龄C57BL/6小鼠,随机分为溶剂组和治疗组,用USA300(5×108 CFU/只)气管插管急性感染两组小鼠3 h后,给予小鼠5% DMSO或5 mg/kg NIM治疗,观察小鼠给药后状态,记录小鼠死亡数量及时间,并取小鼠肺组织,于PBS中研磨组织,取部分研磨液梯度稀释涂板在胰蛋白胨大豆琼脂TSA板上,37 ℃孵育12 h,统计菌落数;剩余肺组织研磨液,12 000 rpm离心后,ELISA检测TNF-α,IL-1β,IL-6炎性因子表达水平。
1.4 巨噬细胞获取及培养室温下,将C57BL/6小鼠脱颈处死后,浸泡在75%无水乙醇,10 min;置于超净台中,用无菌镊子将小鼠下腹部皮肤提起,向小鼠腹腔中注入5 mL高糖DMEM培养基,轻轻摇晃小鼠身体后,注射器收集腹腔盥洗液,800 rpm/min,离心5 min,弃上清,DMEM培养基洗涤1次,用含10%胎牛血清DMEM培养液重悬细胞,调整细胞浓度,按照1×106个/mL接种到细胞培养板中,置于37 ℃,5% CO2细胞培养箱中,静止培养2 h,细胞贴壁后即为小鼠原代腹腔巨噬细胞[21-22]。
1.5 巨噬细胞感染挑单克隆金葡菌USA300,接种于5 mL TSB液体培养基中,37 ℃过夜培养。次日按照1∶100转接至20 mL TSB,37 ℃培养3 h,室温6 000 rpm,离心10 min;测量OD600值确定细菌感染剂量,在巨噬细胞培养板中,按照每孔需要的量加入细菌,处理不同时间点后,用1 mL/孔PBS润洗3次,收集样品。
1.6 巨噬细胞慢病毒感染腹腔巨噬细胞于37 ℃,5% CO2细胞培养箱过夜培养12 h后,将细胞培养基置换为含有shRNF114慢病毒颗粒(MOI: 100)和Polybrene(5 μg/mL)的DMEM完全培养基,混合均匀并孵育过夜,第2天用完全培养基(不含Polybrene)替换并将细胞培养36 h。
1.7 巨噬细胞药物处理shRNA慢病毒感染巨噬细胞后,用0.05 μmol/L NIM处理对照组(shNC)和RNF114 shRNA(shRNF114)组各30 min,2 mL/孔PBS润洗3次后用金葡菌感染。
1.8 ELISA检测USA300感染腹腔巨噬细胞9 h后,收集细胞上清,4 ℃,6 000 rpm,离心10 min,收集处理后的上清,按照ELISA试剂盒说明书稀释标准品和样品,检测TNF-α,IL-1β,IL-6的表达。用酶标仪检测OD450 nm,绘制标准曲线后,按照公式分别计算TNF-α,IL-1β和IL-6的样品浓度。
1.9 Western blotUSA300感染巨噬细胞15、30、60 min后,弃细胞上清,1 mL/孔PBS润洗2-3次,使用Western及IP细胞裂解液,4 ℃摇床裂解15 min;4 ℃,12 000 rpm,离心15 min,收集上清。首先用Bradford法测定蛋白浓度,进行SDS-PAGE电泳,湿转印至0.25 μm PVDF膜上,室温条件下,将PVDF膜放置于5%脱脂奶粉封闭1 h,TBST,3 min/次,洗涤3次;其次在GAPDH(1∶10 000)、RNF114、p65、ERK、p38、JNK及各磷酸化抗体(1∶1 000)稀释液中,4 ℃摇床孵育过夜,TBST,洗涤3次,5 min/次,辣根过氧化物酶(HRP)偶联二抗在室温下孵育1 h,TBST,洗涤3次,5 min/次;最后使用Thermo化学发光试剂在Bio-rad化学发光检测仪中成像。
1.10 统计学分析采用GrapPad Prism 8.0处理本实验数据,其结果采用x±s偏差表示,生存率用Log-rank test分析,其余各组间利用t检验进行统计学分析,P < 0.05表示差异具有统计学意义。
2 结果 2.1 NIM抑制肺部炎症并提高小鼠存活率文献报道显示NIM具有抑制金葡菌、抗炎等功效[11, 23]。为了探索NIM是否能够治疗金葡菌导致的急性肺炎,我们构建了金葡菌急性肺炎模型,观察NIM药物对金葡菌急性肺炎小鼠生存率、肺组织荷菌量及炎性细胞因子的作用。如图 1A所示,相对于溶剂组,NIM组的小鼠生存率明显提高(P < 0.05,n=8)。对死亡小鼠及10 h仍存活的小鼠进行肺组织荷菌量及细胞因子进行检测,结果如图 1B所示,溶剂组和NIM治疗组的小鼠肺组织荷菌量无明显差异;而在NIM治疗组中,如图 1C,D,E所示,我们观察到小鼠肺组织炎性细胞因子TNF-α,IL-1β,IL-6表达水平均明显低于溶剂组(P < 0.05,n=8),表明NIM可能主要通过抑制金葡菌导致的急性肺部炎症,而不是通过杀伤金葡菌提高小鼠生存率。
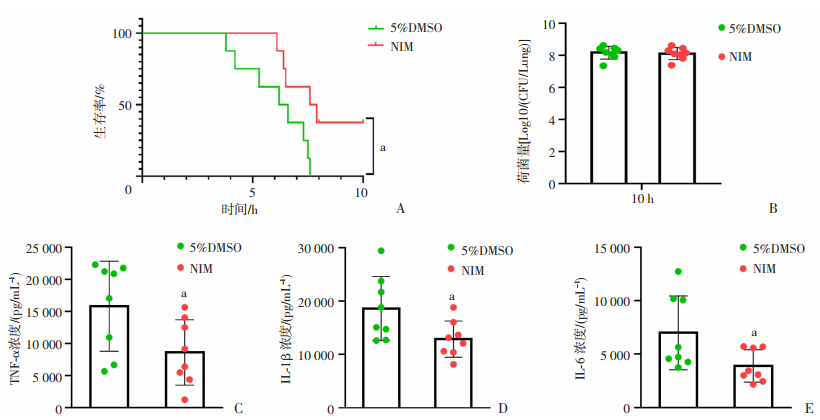
|
| A: 气管插管感染USA300(5×108)3 h后,PBS和5 mg/kg NIM肺部给药后小鼠生存率,P < 0.05,n=8;B: USA300感染3 h后,PBS和5 mg/kg NIM治疗后小鼠肺定植量;C,D,E: USA300感染3 h,PBS和NIM治疗后检测小鼠肺组织TNF-α,IL-1β,IL-6表达情况,P < 0.05,n=8 a: P < 0.05, 与5% DMSO组比较 图 1 USA300气管插管感染3 h NIM治疗小鼠后的生存率差异、肺部荷菌量、小鼠TNF-α,IL-1β,IL-6的表达 |
2.2 NIM抑制巨噬细胞炎症反应
巨噬细胞是维持组织稳态的关键效应细胞,在肺部炎症反应中具有重要调整作用。研究报道在改善小鼠结肠炎[10]过程中,NIM具有抑制巨噬细胞NF-κB信号传导作用。为了进一步探究NIM是否参与金葡菌导致巨噬细胞炎症反应,我们利用巨噬细胞感染模型研究了NIM对巨噬细胞炎性细胞因子表达及炎症信号通路激活的影响。结果如图 2A,B,C所示,在NIM治疗组中,巨噬细胞炎性细胞因子TNF-α,IL-1β,IL-6表达水平均显著低于溶剂组(P < 0.01,P < 0.001,n=3);为了验证NIM是否影响细胞因子上游的信号通路,我们用Western blot检测NF-κB和MAPK信号通路关键分子,结果如图 2D所示,与溶剂组相比,NIM药物处理后能明显下调ERK的磷酸化,该研究结果表明NIM可能通过MAPK通路抑制巨噬细胞炎症反应。
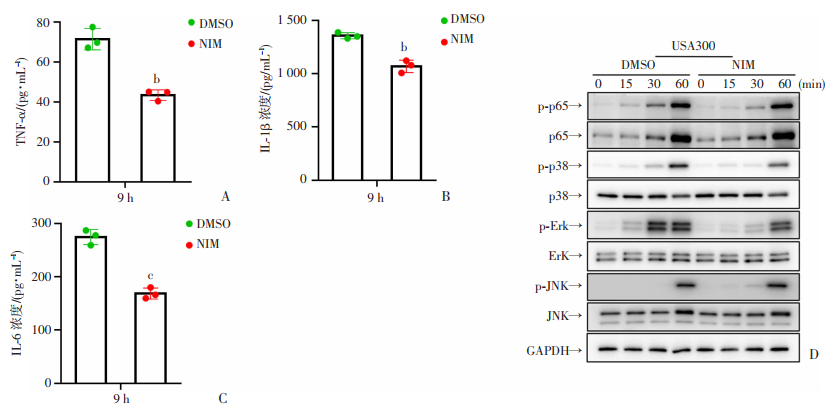
|
| A,B,C: NIM处理30 min后,USA300刺激9 h巨噬细胞TNF-α,IL-1β,IL-6分泌情况,P < 0.01,P < 0.001,n=3;D: NIM处理30 min后,USA300刺激15、30、60 min巨噬细胞MAPK和NF-κB通路蛋白表达情况 b: P < 0.01, c: P < 0.001, 与DMSO组比较 图 2 NIM对巨噬细胞影响 |
2.3 NIM通过RNF114抑制巨噬细胞炎症反应
文献报道NIM可通过结合RNF114破坏其识别底物,从而损害乳腺癌细胞的增殖使其快速稳定[12],提示NIM很有可能通过RNF114抑制金葡菌感染诱导的巨噬细胞炎症信号通路。我们利用慢病毒shRNA敲低原代腹腔巨噬细胞RNF114蛋白水平,通过ELISA及Western Blot探究RNF114敲低后NIM对炎症细胞因子及炎症信号通路影响。如图 3A所示,巨噬细胞经慢病毒shRNF114敲低后,RNF114蛋白表达水平明显下调;ELISA检测结果显示,在shNC组中,结果如图 3B、C、D所示,NIM药物组炎性细胞因子TNF-α,IL-1β,IL-6表达均低于溶剂组(P < 0.001,n=3),而在shRNF114组中,NIM药物组与溶剂组相比无明显差异;为了验证NIM是否通过RNF114影响巨噬细胞ERK蛋白的磷酸化,我们用NIM药物处理shRNF114和shNC巨噬细胞后,如3E所示,NIM药物组与溶剂组相比明显抑制ERK磷酸化表达,而在3F图中,RNF114敲低后NIM药物组与溶剂相比无明显变化,说明NIM在金葡菌感染过程中可能通过RNF114抑制巨噬细胞炎症反应。
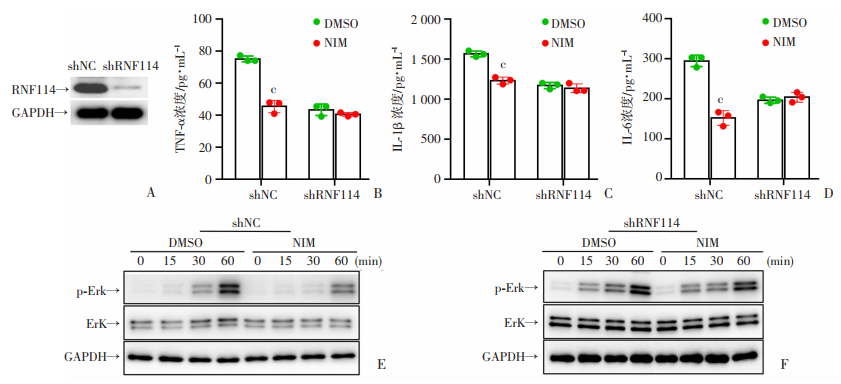
|
| A: shRNF114慢病毒感染腹腔巨噬细胞后检测RNF114蛋白表达;B,C,D: shRNF114慢病毒及对照病毒感染巨噬细胞后,0.05 μM NIM和相应浓度DMSO溶剂处理30 min,USA300感染9 h后检测巨噬细胞TNF-α,IL-1β,IL-6分泌情况,P < 0.001,n=3;E,F: shRNF114慢病毒及对照病毒感染后,0.05 μM NIM和相应浓度DMSO溶剂处理30 min,USA300感染巨噬细胞15、30、60 min p-Erk的表达 c: P < 0.001, 与shNC组比较 图 3 NIM与RNF114作用关系 |
2.4 RNF114介导金葡菌感染导致的巨噬细胞炎症反应
目前尚无RNF114参与调控金葡菌感染方面的报道。为探索RNF114是否参与金葡菌感染导致的巨噬细胞炎症反应,我们利用shRNA慢病毒敲低巨噬细胞RNF114蛋白表达;如图 4A,B,C所示,USA300感染巨噬细胞后,ELISA检测结果发现,shRNF114与shNC组相比TNF-α,IL-1β,IL-6表达被抑制(P < 0.01,P < 0.001,n=3),说明金葡菌感染后RNF114促进巨噬细胞炎症反应;在蛋白水平上,我们同样检测了金葡菌感染巨噬细胞后,NF-κB和MAPK信号通路关键蛋白,如图 4D所示,shNC组ERK磷酸化水平明显高于shRNF114组,说明RNF114主要通过MAPK通路调控巨噬细胞炎症反应。
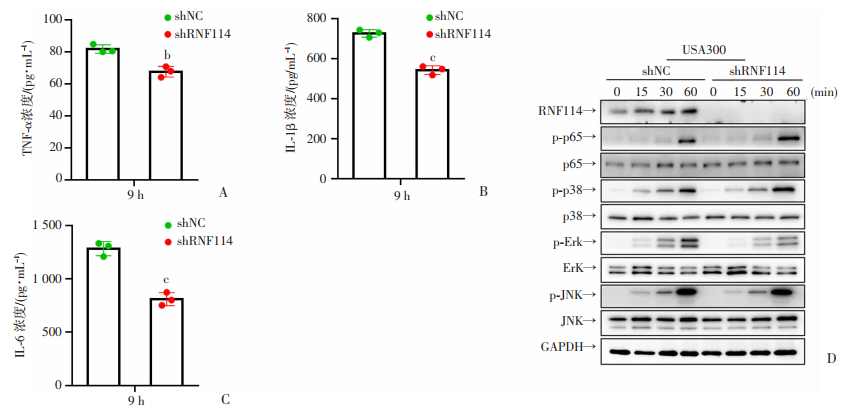
|
| A,B,C: shRNF114慢病毒及对照病毒感染后,USA300感染巨噬细胞9 h,检测细胞因子TNF-α,IL-1β,IL-6分泌情况,P < 0.01,P < 0.001,n=3;D: shRNF114慢病毒及对照病毒感染后,USA300感染巨噬细胞15、30、60 min后MAPK和NF-κB通路蛋白表达 b: P < 0.01, c: P < 0.001, 与shNC组比较 图 4 RNF114介导巨噬细胞炎症反应 |
3 讨论
临床数据[24-25]显示,在全球范围内,MRSA是导致社区获得性和医院获得性感染的重要条件致病菌。MRSA菌株共分为12个不同遗传簇,从USA100到USA1200,其中USA300是最主要的致病株,占据了所有社区获得性MRSA感染的97%,因此,USA300成为研究MRSA肺炎发病机理和免疫机制时最常用的菌株之一[26-28]。MRSA对少数抗生素如万古霉素和利奈唑胺敏感[29],且无有效疫苗,给临床治疗带来挑战。NIM是一种三萜类化合物,对MRSA具有一定的抑制活性,与此同时,相关研究显示,在骨髓瘤细胞中NIM同样具有抑制NF-κB通路作用[30]。为探索NIM是否能够治疗金葡菌导致的急性肺炎,我们观察了NIM药物对金葡菌急性肺炎小鼠生存率、肺组织荷菌量及炎性细胞因子的作用,结果显示,金葡菌感染小鼠后,NIM短时间内可抑制金葡菌急性感染导致的小鼠死亡,有效降低小鼠肺部炎性细胞因子TNF-α,IL-1β,IL-6表达水平,但对肺组织荷菌量无明显差异,说明NIM可能主要通过抑制金葡菌导致的急性肺部炎症,而不是通过杀伤金葡菌提高小鼠生存率。
金葡菌感染中可产生多种病原分子相关模式如脂蛋白、脂磷壁酸、肽聚糖激活宿主TLR2受体及其介导的炎症信号通路[31-32],产生c-di-AMP激活宿主STING介导的炎症信号通路,还可产生肠毒素B等超抗原持续活化T细胞,进而诱导宿主巨噬细胞、中性粒细胞等炎症调控细胞产生大量TNF-α、IL-1β、IL-6等炎症细胞因子,引起炎症因子风暴损伤[33-35]。这些细胞因子具有广泛的生物学活性,有助于协调机体对感染的反应,IL-1β是IL-1家族中重要成员,具有较强的促炎活性,可诱导产生多种促炎介质,如细胞因子和趋化因子[36];与IL-1β相似,TNF-α是一种多效促炎细胞因子,其主要作用包括刺激巨噬细胞分泌IL-1、趋化中性粒细胞、增加血管通透性、促进细胞死亡等作用[37],在炎症因子风暴中起非常关键作用;有研究报道显示,用抗TNF-α药物在病毒感染后能明显减少肺部炎症因子水平[38]。近年来,大量研究报道指出急性肺损伤的病理机制与过度炎症反应和免疫系统激活密切相关,其中,TNF-α和IL-6被认为是急性肺损伤的关键炎症因子[39-40]。在本研究中,我们主要通过检测TNF-α、IL-1β、IL-6表达评价小鼠肺部炎症水平。
MAPK和NF-κB是已知的主要参与调控炎症反应的信号通路。目前哺乳动物细胞已被鉴定出14种不同的MAPK家族成员,其中ERK、p38和JNK研究最为充分[41]。NF-κB信号通路分为经典和非经典2种形式,分别通过p65,p100通路调控炎症细胞因子的产生[42-43]。有研究表明,在金葡菌引起的肺炎中,包括巨噬细胞在内的多种细胞会激活炎症信号通路,从而导致炎性细胞因子[44]、巨噬细胞集落刺激因子和各种趋化因子的产生,引起“细胞因子风暴”,加重肺组织炎症反应和损伤[45]。本实验采用原代腹腔巨噬细胞为感染模型,发现金葡菌刺激巨噬细胞后NIM药物组TNF-α,IL-1β,IL-6表达水平均显著低于溶剂组,Western blot检测显示,NIM药物处理后,能明显下调ERK的磷酸化水平,该研究结果表明NIM通过抑制MAPK通路进而抑制巨噬细胞炎症细胞因子的分泌,可能在金葡菌导致的急性肺炎中具有保护作用。
研究报道NIM能结合RNF114并破坏其识别其作用底物从而损害乳腺癌细胞的增殖使其快速稳定;我们猜想,在金葡菌感染过程中,NIM是否同样具有破坏RNF114底物识别进而调控巨噬细胞炎症反应,然而这一具体过程尚未探索。本研究利用shRNF114慢病毒敲低巨噬细胞RNF114蛋白水平后,研究NIM是否还能够抑制巨噬细胞炎症信号通路,结果显示,在shNC组中,NIM药物组TNF-α,IL-1β,IL-6表达均低于溶剂组,而在shRNF114组中,NIM药物组与溶剂组相比无明显差异;Western blot结果同样显示,在shNC组中,NIM药物处理后ERK磷酸化水平显著低于溶剂组,而shRNF114组,NIM药物组和溶剂组ERK磷酸化水平无明显差异。以上实验结果说明,NIM可能是通过作用于RNF114达成抑制巨噬细胞炎症信号通路的作用。
本研究首次阐述了NIM可能通过调控巨噬细胞RNF114功能,抑制MAPK通路激活,进而抑制小鼠肺部炎症细胞因子的表达,最终抑制肺部高炎症导致的小鼠死亡。为NIM通过调控炎症反应治疗金葡菌急性感染导致的炎症损伤提供了理论支撑,同时也为寻找新型小分子化合物达成抑制金葡菌导致的炎症损伤提供了新靶点RNF114。
| [1] |
COLLABORATORS G 2 A R. Global mortality associated with 33 bacterial pathogens in 2019: a systematic analysis for the Global Burden of Disease Study 2019[J]. Lancet, 2022, 400(10369): 2221-2248. |
| [2] |
KRISMER B, WEIDENMAIER C, ZIPPERER A, et al. The commensal lifestyle of Staphylococcus aureus and its interactions with the nasal microbiota[J]. Nat Rev Microbiol, 2017, 15(11): 675-687. |
| [3] |
DUREAU A F, DUCLOS G, ANTONINI F, et al. Rapid diagnostic test and use of antibiotic against methicillin-resistant Staphylococcus aureus in adult intensive care unit[J]. Eur J Clin Microbiol Infect Dis, 2017, 36(2): 267-272. |
| [4] |
VERMA A K, BAUER C, YAJJALA V K, et al. Linezolid attenuates lethal lung damage during postinfluenza methicillin-resistant Staphylococcus aureus pneumonia[J]. Infect Immun, 2019, 87(10): e00538-e00519. |
| [5] |
COHEN E, QUISTAD G B, CASIDA J E. Cytotoxicity of nimbolide, epoxyazadiradione and other limonoids from neem insecticide[J]. Life Sci, 1996, 58(13): 1075-1081. |
| [6] |
ELUMALAI P, GUNADHARINI D N, SENTHILKUMAR K, et al. Induction of apoptosis in human breast cancer cells by nimbolide through extrinsic and intrinsic pathway[J]. Toxicol Lett, 2012, 215(2): 131-142. |
| [7] |
RAJA SINGH P, SUGANTHA PRIYA E, BALAKRISHNAN S, et al. Inhibition of cell survival and proliferation by nimbolide in human androgen-independent prostate cancer (PC-3) cells: involvement of the PI3K/Akt pathway[J]. Mol Cell Biochem, 2017, 427(1/2): 69-79. |
| [8] |
HARISH KUMAR G, CHANDRA MOHAN K VP, RAO A J, et al. Nimbolide a limonoid from Azadirachta indica inhibits proliferation and induces apoptosis of human choriocarcinoma (BeWo) cells[J]. Invest New Drugs, 2009, 27(3): 246-252. |
| [9] |
ALSHAMMARI G M, BALAKRISHNAN A, CHINNASAMY T. Nimbolide attenuate the lipid accumulation, oxidative stress and antioxidant in primary hepatocytes[J]. Mol Biol Rep, 2017, 44(6): 463-474. |
| [10] |
SEO J Y, LEE C, HWANG S W, et al. Nimbolide inhibits nuclear factor-КB pathway in intestinal epithelial cells and macrophages and alleviates experimental colitis in mice[J]. Phytother Res, 2016, 30(10): 1605-1614. |
| [11] |
SARKAR P, ACHARYYA S, BANERJEE A, et al. Intracellular, biofilm-inhibitory and membrane-damaging activities of nimbolide isolated from Azadirachta indica A. Juss (Meliaceae) against meticillin-resistant Staphylococcus aureus[J]. J Med Microbiol, 2016, 65(10): 1205-1214. |
| [12] |
SPRADLIN J N, HU X R, WARD C C, et al. Harnessing the anti-cancer natural product nimbolide for targeted protein degradation[J]. Nat Chem Biol, 2019, 15(7): 747-755. |
| [13] |
ZHAO Y H, LIANG X, WEI L, et al. RNF114 suppresses metastasis through regulation of PARP10 in cervical cancer cells[J]. Cancer Commun, 2021, 41(2): 187-191. |
| [14] |
GIANNINI A L, GAO Y F, BIJLMAKERS M J. T-cell regulator RNF125/TRAC-1 belongs to a novel family of ubiquitin ligases with zinc fingers and a ubiquitin-binding domain[J]. Biochem J, 2008, 410(1): 101-111. |
| [15] |
ZHANG Y X, LI L F, MUNIR M, et al. RING-domain E3 ligase-mediated host-virus interactions: orchestrating immune responses by the host and antagonizing immune defense by viruses[J]. Front Immunol, 2018, 9: 1083. |
| [16] |
CAPON F, BIJLMAKERS M J, WOLF N, et al. Identification of ZNF313/RNF114 as a novel psoriasis susceptibility gene[J]. Hum Mol Genet, 2008, 17(13): 1938-1945. |
| [17] |
CHEN H W, YANG Y K, XU H, et al. Ring finger protein 166 potentiates RNA virus-induced interferon-β production via enhancing the ubiquitination of TRAF3 and TRAF6[J]. Sci Rep, 2015, 5: 14770. |
| [18] |
HAN J, KIM Y L, LEE K W, et al. ZNF313 is a novel cell cycle activator with an E3 ligase activity inhibiting cellular senescence by destabilizing p21(WAF1.)[J]. Cell Death Differ, 2013, 20(8): 1055-1067. |
| [19] |
BIJLMAKERS M J, KANNEGANTI S K, BARKER J N, et al. Functional analysis of the RNF114 psoriasis susceptibility gene implicates innate immune responses to double-stranded RNA in disease pathogenesis[J]. Hum Mol Genet, 2011, 20(16): 3129-3137. |
| [20] |
RODRIGUEZ M S, EGANA I, LOPITZ-OTSOA F, et al. The RING ubiquitin E3 RNF114 interacts with A20 and modulates NF-κB activity and T-cell activation[J]. Cell Death Dis, 2014, 5(8): e1399. |
| [21] |
YAMASHITA M, SHINOHARA T, TSUJI S, et al. Catalytically inactive cyclooxygenase 2 and absence of prostaglandin E2 biosynthesis in murine peritoneal macrophages following in vivo phagocytosis of heat-killed Mycobacterium bovis bacillus Calmette-Guérin[J]. J Immunol, 2007, 179(10): 7072-7078. |
| [22] |
RAHMAN A, SOBIA P, GUPTA N, et al. Mycobacterium tuberculosis subverts the TLR-2-MyD88 pathway to facilitate its translocation into the cytosol[J]. PLoS One, 2014, 9(1): e86886. |
| [23] |
BODDULURU L N, KASALA E R, THOTA N, et al. Chemopreventive and therapeutic effects of nimbolide in cancer: the underlying mechanisms[J]. Toxicol In Vitro, 2014, 28(5): 1026-1035. |
| [24] |
CARBALLO N, ANTONIO-CUSCO M D, ECHEVERRIA-ESNAL D, et al. Community-acquired pneumonia caused by methicillin-resistant Staphylococcus aureus in critically-ill patients: systematic review[J]. Farm Hosp, 2017, 41(2): 187-203. |
| [25] |
ALTHAQAFI A O, MATAR M J, MOGHNIEH R, et al. Burden of methicillin-resistant Staphylococcus aureus pneumonia among hospitalized patients in Lebanon and Saudi Arabia[J]. Infect Drug Resist, 2017, 10: 49-55. |
| [26] |
THURLOW L R, JOSHI G S, RICHARDSON A R. Virulence strategies of the dominant USA300 lineage of community-associated methicillin-resistantStaphylococcus aureus (CA-MRSA)[J]. FEMS Immunol Med Microbiol, 2012, 65(1): 5-22. |
| [27] |
DELEO F R, OTTO M. An antidote forStaphylococcus aureus pneumonia?[J]. J Exp Med, 2008, 205(2): 271-274. |
| [28] |
NIMMO G R. USA300 abroad: global spread of a virulent strain of community-associated methicillin-resistant Staphylococcus aureus[J]. Clin Microbiol Infect, 2012, 18(8): 725-734. |
| [29] |
MISSIAKAS D, SCHNEEWIND O. Staphylococcus aureus vaccines: Deviating from the carol[J]. J Exp Med, 2016, 213(9): 1645-1653. |
| [30] |
BARIANA M, CASSELLA E, RATESHWAR J, et al. Inhibition of NF-κB DNA binding suppresses myeloma growth via intracellular redox and tumor microenvironment modulation[J]. Mol Cancer Ther, 2022, 21(12): 1798-1809. |
| [31] |
SRISKANDAN S, COHEN J. Gram-positive sepsis. Mechanisms and differences from gram-negative sepsis[J]. Infect Dis Clin North Am, 1999, 3(2): 397-412. |
| [32] |
SCHMALER M, JANN N J, FERRACIN F, et al. Lipoproteins in Staphylococcus aureus mediate inflammation by TLR2 and iron-dependent growth in vivo[J]. J Immunol, 2009, 182(11): 7110-7118. |
| [33] |
KRAKAUER T. Staphylococcal superantigens: pyrogenic toxins induce toxic shock[J]. Toxins, 2019, 11(3): 178. |
| [34] |
LIU Z Z, YANG Y J, ZHOU C K, et al. STING contributes to host defense against Staphylococcus aureus pneumonia through suppressing necroptosis[J]. Front Immunol, 2021, 12: 636861. |
| [35] |
吴沁蕊, 彭显, 周学东. 细菌c-di-AMP在宿主免疫中的作用研究[J]. 四川大学学报(医学版), 2022, 53(6): 1098-1103. WU Q R, PENG X, ZHOU X D. Advances in research on the role of bacterial c-di-AMP in host immunity[J]. J Sichuan Univ Med Sci, 2022, 53(6): 1098-1103. |
| [36] |
FAN W J, TANG T T, ZENG Q, et al. The role of IL-1β in aortic aneurysm[J]. Clin Chim Acta, 2020, 504: 7-14. |
| [37] |
KARKI R, SHARMA B R, TULADHAR S, et al. Synergism of TNF-α and IFN-γ triggers inflammatory cell death, tissue damage, and mortality in SARS-CoV-2 infection and cytokine shock syndromes[J]. Cell, 2021, 184(1): 149-168. |
| [38] |
LIU L, VOLLMER M K, AHMAD A S, et al. Pretreatment with Korean red ginseng or dimethyl fumarate attenuates reactive gliosis and confers sustained neuroprotection against cerebral hypoxic-ischemic damage by an Nrf2-dependent mechanism[J]. Free Radic Biol Med, 2019, 131: 98-114. |
| [39] |
MOWERY N T, TERZIAN W T H, NELSON A C. Acute lung injury[J]. Curr Probl Surg, 2020, 57(5): 100777. |
| [40] |
ZHOU J, PENG Z L, WANG J. Trelagliptin alleviates lipopolysaccharide (LPS)-induced inflammation and oxidative stress in acute lung injury mice[J]. Inflammation, 2021, 44(4): 1507-1517. |
| [41] |
XU J J, ZHAO Y X, AISA H A. Anti-inflammatory effect of pomegranate flower in lipopolysaccharide (LPS)-stimulated RAW264.7 macrophages[J]. Pharm Biol, 2017, 55(1): 2095-2101. |
| [42] |
JIMI E, FUKUSHIMA H. NF-κB signaling pathways and the future perspectives of bone disease therapy using selective inhibitors of NF-κB[J]. Clin Calcium, 2016, 26(2): 298-304. |
| [43] |
KIM E, YOON J Y, LEE J, et al. TANK-binding kinase 1 and Janus kinase 2 play important roles in the regulation of mitogen-activated protein kinase phosphatase-1 expression after toll-like receptor 4 activation[J]. J Cell Physiol, 2018, 233(11): 8790-8801. |
| [44] |
DAUM R S, SPELLBERG B. Progress toward a Staphylococcus aureus vaccine[J]. Clin Infect Dis, 2012, 54(4): 560-567. |
| [45] |
PIVARD M, MOREAU K, VANDENESCH F. Staphylococcus aureus arsenal to conquer the lower respiratory tract[J]. mSphere, 2021, 6(3): e00059-e00021. |




