2. 637000 四川 南充,川北医学院附属医院神经内科;
3. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院临床医学研究中心
2. Department of Neurology, Affiliated Hospital of North Sichuan Medical College, Nanchong, Sichuan Province, 637000, China;
3. Clinical Medical Research Center, Second Affiliated Hospital, Army Medical University(Third Military Medical University), Chongqing, 400037
癫痫是一种常见的神经系统疾病,主要特征是反复出现的大脑节律异常[1]。全球范围内,大约有6 500万人受其影响。当前认为,癫痫发作的病因是神经网络内抑制性和兴奋性动力学失衡所致[2],癫痫的主要治疗手段是药物治疗,以控制癫痫发作频率和降低复发风险,但仍有1/3左右患者对抗癫痫药物产生耐药性[3-5]。对于这类耐药性局灶性癫痫,最有效的治疗方法是癫痫手术[5]。尽管癫痫手术能够有效帮助约70%的患者,但仍有30%的患者的病情未能得到解决[6]。因此,深入理解癫痫发作的病理生理机制并据此研发新的抗癫痫药物是当前急需解决的问题。
耐药性癫痫的动物模型的开发与模拟疾病进程紧密相关。其中,海人酸(kainic acid, KA)诱导的癫痫模型因其操作的便利性和研究的灵活性而成为当前常用的持续性癫痫模型之一[7]。该KA模型使研究人员能够深入研究癫痫发作时神经元的异常放电、突触传递的改变以及神经炎症等病理生理过程,为潜在治疗靶点的发现提供了重要支持。KA模型可以通过不同途径制备,包括侧脑室注射、腹腔注射腹腔注射和海马内注射,每种方式都具有各自的优势。侧脑室注射可实现药物直接注入脑脊液,使用相对少的药物量即可达到诱导效果,减少了潜在的干扰和神经系统损伤[8]。腹腔注射具有方便快捷、单次量化注射多只动物等优点。然而,在实际研究中,研究者仍面临如何选择适当模型的挑战。目前,对于侧脑室注射与腹腔注射两种海人酸诱导的癫痫模型在病理学特征上差异的系统比较研究尚不充分。因此,本研究通过制备两种不同途径注射的癫痫模型,采用病理形态学和分子生物学等检测方法,初步比较分析这两种模型在死亡率、神经变性、神经凋亡以及胶质细胞激活等方面的差异,为研究者选择和应用适当的癫痫模型提供初步的实验依据。
1 材料与方法 1.1 实验动物选取100只8~12周龄雄性C57BL/6N小鼠,体质量为18~24 g,由陆军军医大学动物中心提供[许可证号:SCXK(渝)2017-0002]。实验操作均符合动物伦理学要求。饲养于恒温恒湿12 h光照/12 h黑暗交替的SPF级动物房内。小鼠自由摄食饮水,室温控制在22~25 ℃。
1.2 动物分组与模型制备小鼠适应性饲养1周后,所有C57BL/6小鼠按照随机数字表法分为4组:ICV+NS对照组,ICV+KA模型组,IP+NS对照组,IP+KA模型组。对照组每组10只,模型组每组40只。
侧脑室注射KA的癫痫模型按照本课题组先前方法制备[6]。将小鼠放置在2%~4%异氟醚的麻醉诱导箱中,使小鼠到达足够麻醉深度。剪去小鼠头部毛发,将小鼠门齿固定于立体定位仪前段门齿钳,双侧头部用耳杆固定。调整小鼠位置及耳杆松紧度,使小鼠脑平面位于正中央,且平行于水平面。确认小鼠头部固定牢固不晃动。头皮处消毒,随后用弯剪沿头部失状线将小鼠头皮剪开,开口范围为1~2 cm。用10% H2O2去除脑膜,暴露头骨及囟线,确认前囟点,即Bregma点的位置。以Bregma点为坐标原点调零,调整台面前后高度以确认前后囟点Z轴差值在±0.03 mm。调整台面左右高度,将Bregma点左右旁开1.0 mm处颅骨Z轴差值控制在±0.03 mm。参考Franklin-Paxinos小鼠脑图谱(2001), 在侧脑室位置(X: 1.00 mm;Y:-0.22 mm;Z: -2.5 mm)做标记。用颅钻在标记处钻孔,用玻璃电极吸取KA 600 nL,在标记处缓慢进针,深度为2.5 mm。调节注射速度为20 nL/s。注射后留针5 min,后缓慢退针。确认小鼠无活动性出血后,缝合小鼠头部皮肤。术后观察小鼠情况,保证环境温度适宜。小鼠痫性发作达到成功标准1 h后,适当注射0.3%的戊巴比妥钠以中止癫痫发作。
腹腔注射KA(25 mg/kg)建立小鼠癫痫模型参考文献报道方法进行[9]。对照组在相同时间使用等量的生理盐水进行注射。建立模型后,进行行为学和脑电观察,收集标本,使用分子生物学和病理形态学等技术进行检测。
1.3 行为学评估KA注射后,痫性发作等级按Racine分级[10]标准进行判定。Ⅰ级:耳面部抽搐,胡须纤颤;Ⅱ级:头颈部抽动,出现点头征;Ⅲ级, 前肢痉挛, 伴直立位;Ⅳ级:前肢抽搐伴多肢抽动,肢体强直;V级全身强直阵挛发作,失去平衡后跌倒。ICV+KA组和IP+KA组小鼠均出现癫痫活动相关的行为改变,如湿狗样抖动、凝视、颤动、面部肌肉肌阵挛,运动不能,双前肢抽搐及直立样抽搐等行为,接着发展为全身性抽搐。癫痫发作达到Racine评分Ⅳ级以上,且持续发作超过30 min则认为是模型制备成功。
1.4 实验标本处理制备模型3 d后,根据实验要求取各实验组小鼠,断头取脑,在冰上快速剥离脑组织,分离海马,将其放入微量离心管中,立即放入-80 ℃冰箱中保存,用于Western blot检测。另取同组其他实验小鼠,用PBS和4%的多聚甲醛心脏灌注后,断头取脑,脑组织经多聚甲醛固定24 h后,采用15%~30%的蔗糖进行梯度脱水包埋处理。冰冻切片机切片后进行免疫荧光染色。
1.5 Western blot检测蛋白表达水平将海马组织置于含有蛋白酶和磷酸酶抑制剂的RIPA裂解缓冲液中进行均质化。在组织完全裂解后,在4 ℃下, 以12 000 r/min离心15 min。收集上清液,使用BCA试剂盒测定所得上清液中的蛋白质浓度。将蛋白浓度调整为5 μg/μL之后,将10 μL蛋白样本及Marker上样到聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶上,分别在80、120 V条件下进行40 min电泳。然后在300 mA条件下将蛋白质转移到聚偏氟乙烯(PVDF)膜上,该过程持续60 min。用5%脱脂奶粉将PVDF膜封闭1 h后,TBST洗涤3次,10 min/次。随后,PVDF膜置于一抗孵育盒内,4 ℃,过夜。一抗:GFAP (1 ∶1 000,美国CST公司),Iba-1(1 ∶1 000,美国CST公司), BAX,Bcl-2 (1 ∶1 000, 美国Proteintech公司)。TBST洗涤3次后,膜在室温下用HRP标记的二抗(武汉博士德公司),孵育1 h。用TBST洗涤3次, 10 min/次。将Western blot化学发光HRP底物显影剂的A和B溶液以1 ∶1的比例混合,并将显影剂均匀涂抹到PVDF膜上。将膜放在化学发光成像仪的托盘上,并拍摄图像以备存。
1.6 Fluoro-Jade B染色采用Fluoro-Jade B(FJB)染色技术检测退行性神经元。使用95%和100%乙醇对组织进行梯度脱水处理,每个浓度的乙醇浸泡时间为3~5 min。使用0.06%高锰酸钾溶液浸泡小鼠海马切片10 min,将0.01%的FJB染色剂溶解在醋酸中,搅拌至完全溶解,以制备FJB溶液。将处理后的组织切片浸泡在FJB染色溶液中,切片在暗处孵育20 min。随后用蒸馏水冲洗,风干切片,并用封片剂封片。使用荧光显微镜观察FJB染色的结果。
1.7 TUNEL染色使用TUNEL染色试剂盒(美国Roche公司)检测凋亡细胞。将25 μm厚的组织切片贴于组织防脱片上,随后组织切片用0.1% Triton X-100促渗10 min。加入TUNEL反应混合物,37 ℃孵育1 h。用PBS洗涤后,样品用4′,6-二胺基-2-苯并啉(DAPI)进行5 min的核染色。最后,使用抗荧光淬灭封片剂封片,在荧光显微镜下进行观察。
1.8 免疫荧光采用免疫荧光染色标记星形胶质细胞标记物GFAP与小胶质细胞标记物Iba-1。取出样本脑片,将脑片浸入5%的BSA中封闭30 min。将抗体按照(一抗原液∶一抗稀释液)1 ∶500的比例进行稀释,每张脑片50 μL,完全浸没脑片,4 ℃过夜。第2天取出样本,用PBS清洗,加入稀释好的二抗后,室温孵育2 h。随后每个样本加入50 μL的DAPI染色液,室温避光孵育复染10 min,PBS清洗后,滴加抗荧光淬灭剂对样本进行封片处理。使用全景扫描仪对样本图像进行采集,用Image J进行统计分析。
1.9 统计学分析采用SPSS 17.0统计分析软件进行分析。各组数据以x±s表示,组间比较采用独立样本t检验,多组间使用单因素方差齐性检验。P < 0.05表示差异具有统计学意义。
2 结果 2.1 腹腔注射和侧脑室注射模型诱导的急性发作期行为学变化2组模型制备后,急性发作期的3~5 h内, ICV+KA组和IP+KA组发作分级见表 1所示。结果显示,与IP+KA组小鼠比较,ICV+KA组Racine分级Ⅳ级以上占比明显增高。说明ICV+KA组具有更明显的癫痫发作行为学表现。
| 组别 | n | Racine分级 | ||||
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | ||
| ICV+NS组 | 10 | 0 | 0 | 0 | 0 | 0 |
| IP+NS组 | 10 | 0 | 0 | 0 | 0 | 0 |
| ICV+KA组 | 40 | 0 | 0 | 20 | 25 | 55 |
| IP+KA组 | 40 | 0 | 10 | 30 | 25 | 35 |
2.2 腹腔注射和侧脑室注射对小鼠死亡率与成功率的影响
两对照组无痫性发作,两模型组均出现痫性发作。经KA注射72 h后,ICV+KA组与IP+KA组死亡率分别为47.50%和65.00%(表 2),造模成功率分别为80.00%与60.00%。由此可见,ICV+KA组的死亡率较IP+KA组低, 但造模成功率高于IP+KA组。结果说明,ICV+KA组具有更低的死亡率, 但是具有更高的模型成功率。
2.3 侧脑室注射比腹腔注射模型有更明显的神经变性改变
神经元变性是癫痫发作的重要病理性标志。FJB染色是最重要的神经元变性改变的检测方法。因此,本研究采用FJB染色判定两种模型的神经变性改变情况。在皮层(cerebral cortex, CC)组织,两种模型组并没有显示出明显的FJB阳性标记细胞。与此相反,在海马组织,两种模型小鼠都出现明显的FJB阳性标记物细胞,与IP+KA组比较,ICV+KA组CA3、DG两区域显示出更明显的FJB阳性标记物细胞,二者之间差异有统计学意义(P < 0.05,图 1)。结果说明,ICV+KA组比IP+KA组具备更强烈的神经变性改变。
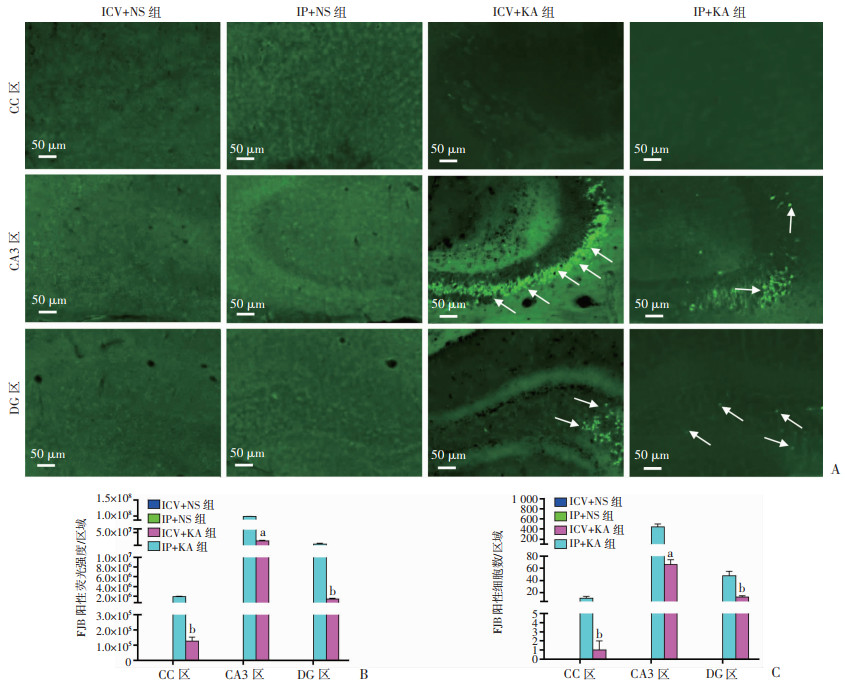
|
|
a:P < 0.05,b:P < 0.01,与ICV+KA组比较 A: 各组小鼠的皮层和海马组织CA3区、DG区的FJB阳性神经元的表达与分布 箭头:示FJB阳性细胞;B: 各组FJB阳性神经元的荧光强度量化比较;C: 各组FJB阳性神经元数量的量化比较 图 1 海人酸腹腔注射与侧脑室注射模型小鼠神经元的神经变性改变(n=6,x±s) |
2.4 侧脑室注射模型比腹腔注射模型有更明显的神经凋亡改变
在癫痫患者的大脑中,神经元凋亡可能会发生,并且与癫痫的发病机制密切相关。为更深入比较两种模型的差异,本研究比较了2种模型的神经元凋亡差异,以有助于更好地理解癫痫模型的病理生理过程。TUNEL染色是最重要的神经元凋亡改变的形态学检测方法,而BAX(Bcl-2-associated X protein)和Bcl-2(B-cell lymphoma 2)是2个与细胞凋亡密切相关的重要靶蛋白。因此,本研究通过使用TUNEL染色和凋亡蛋白表达量检测以判定两种模型的神经凋亡改变情况。在皮层组织,对照组并没有出现明显的TUNEL染色阳性细胞。与此相反,在海马组织,两种模型小鼠都出现明显的TUNEL染色阳性标记物细胞(图 2A)。与IP+KA组比较,ICV+KA组CA3,DG两区域显示出更明显的TUNEL染色阳性细胞,二者之间差异有统计学意义(P < 0.05,图 2B)。另外,Western blot结果也显示,两模型组BAX和Bcl-2蛋白表达差异明显,ICV+KA组BAX蛋白表达量显著高于IP+KA组,ICV+KA组Bcl-2蛋白表达量显著低于IP+KA组(图 2C),差异具有统计学意义(P < 0.05, 图 2D)。结果说明,两种癫痫模型的凋亡程度存在明显差异,与腹腔注射模型相比,侧脑室注射模型有更明显的神经凋亡改变。
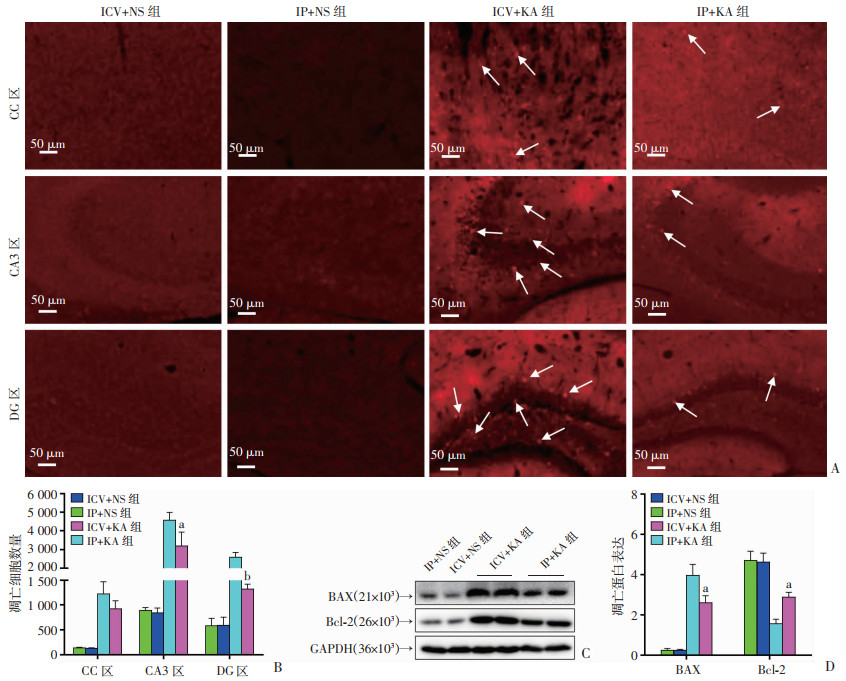
|
|
a:P < 0.05,b:P < 0.01,与ICV+KA组比较 A: 各组小鼠的皮层和海马组织CA3区、DG区的TUNEL阳性神经元的表达与分布 箭头:示TUNEL阳性细胞;B: 各组TUNEL阳性神经元的量化比较;C:Western blot检测各组BAX和Bcl-2表达;D: 各组BAX和Bcl-2蛋白表达的量化比较 图 2 海人酸腹腔注射与侧脑室注射模型小鼠神经元的神经凋亡改变(n=6,x±s) |
2.5 侧脑室注射比腹腔注射模型有更明显的星形胶质细胞激活改变
星形胶质细胞是中枢神经系统(central nervous system,CNS)中的一种神经胶质细胞,星形胶质细胞与癫痫之间存在密切的关联。但两种模型的星形胶质细胞的激活差异尚不清楚。因此,本研究通过星形胶质细胞标记蛋白GFAP染色和蛋白表达定量以比较两种模型的星形胶质细胞的形态学、结构和蛋白表达差异变化。在皮层组织,与对照组比较,两模型组星形胶质细胞明显激活。同时,在海马组织,两种模型小鼠都出现明显的星形胶质细胞激活表现(图 3A)。出现胞体膨胀的细胞体积明显增大、细胞突起数量的明显增多、更多的不规则分支等特征表现。与IP+KA组比较,ICV+KA组皮层、CA3,DG两区域显示出更明显的激活特征,二者之间差异有统计学意义(P < 0.05,图 3B)。另外,Western blot结果也显示,两模型组GFAP蛋白表达差异明显(P < 0.01, 图 3C、D)。结果说明,两种癫痫模型的星形胶质细胞激活程度存在明显差异。

|
|
a:P < 0.05,b:P < 0.01,与ICV+KA组比较 A: 各组小鼠的皮层和海马组织CA3区、DG区的GFAP阳性星形胶质细胞的表达与分布;B: 各组总GFAP阳性星形胶质细胞数量的量化比较;C:Western blot检测各组GFAP蛋白表达;D: 各组GFAP蛋白表达的量化比较 图 3 海人酸腹腔注射与侧脑室注射模型小鼠神经元的星形胶质细胞形态学改变(n=6,x±s) |
2.6 侧脑室注射比腹腔注射模型有更明显的小胶质细胞激活改变
小胶质细胞作为中枢神经系统中的一种免疫细胞,它们在神经系统中的免疫调节和炎症反应中起着重要作用。小胶质细胞与癫痫之间存在密切的关联。在星形胶质细胞比较的基础上,本研究进一步通过小胶质细胞标记蛋白IBA-1染色和蛋白表达定量以比较两种模型的小胶质细胞的形态学、结构和蛋白表达差异。结果显示,在皮层组织和海马组织中,与对照组比较,两模型组小胶质细胞明显激活。在激活状态下,小胶质细胞的胞体会显著膨胀,变得更加肿胀;展示出更多和更长的细胞突起;分支变得更加复杂和丰富(图 4A)。与IP+KA组相比,ICV+KA组皮层、CA3,DG两区域显示出更明显的激活特征,二者之间差异有统计学意义(P < 0.01, 图 4B)。另外,Western blot结果也显示,两模型组IBA-1蛋白表达差异明显,差异具有统计学意义(P < 0.05, 图 4C、D)。结果说明,两种癫痫模型的小胶质细胞激活程度存在明显差异。
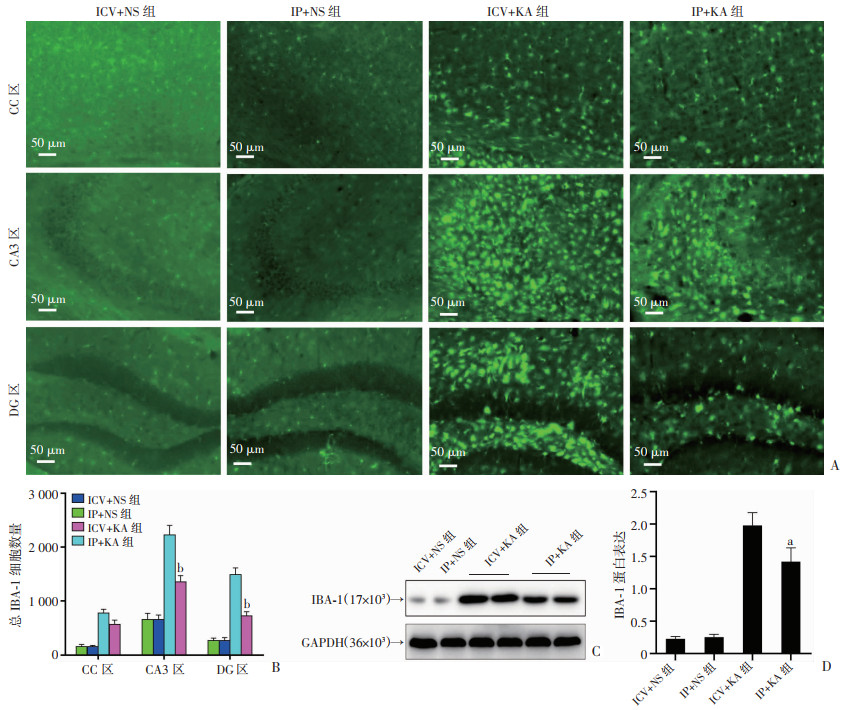
|
|
a:P < 0.05,b:P < 0.01,与ICV+KA组比较 A: 各组的皮层和海马组织CA3区、DG区的的IBA-1阳性小胶质细胞的表达与分布;B:各组总IBA-1阳性小胶质细胞的量化比较;C:Western blot检测各组IBA-1蛋白表达;D: 各组IBA-1蛋白表达的量化比较 图 4 海人酸腹腔注射与侧脑室注射模型小鼠神经元的小胶质细胞形态学改变(n=6,x±s) |
3 讨论 3.1 模型制备方法对病理表现的影响
KA因其生理相似性、可控性和高度可重复性而成为研究癫痫病理机制、药物筛选和治疗策略的重要工具。然而,目前常见的KA模型制备方法包括脑局部注射和全身(腹腔)注射,这两种方法在病理表现上是否存在差异尚不清楚。本研究结果表明,采用ICV方式制备的模型小鼠具有更低的死亡率、更明显的癫痫发作行为学表现、较重的病理损伤(如凋亡和神经变性改变),以及更明显的胶质细胞激活等特征。这些特征的差异有助于更深入地理解脑病理损伤和胶质细胞激活在癫痫发作中的作用。
3.2 神经元凋亡与癫痫发病机制的关联在癫痫中,不正常的神经元电活动可能导致神经细胞的凋亡,这种凋亡过程与癫痫的发病机制紧密相关。在癫痫发作期间,异常的神经元兴奋性和细胞损伤可能导致细胞内环境的变化,凋亡通路可能被激活,进而触发神经细胞的程序性死亡。这种神经凋亡可能对癫痫的发展和持续性有重要影响,包括影响神经网络的结构和功能,从而在癫痫的发作和发展中扮演着重要角色[11]。此外,在癫痫的发展中氧化应激是一个重要因素。氧化应激可以通过激活或抑制特定的信号通路来促进或阻止神经元的凋亡。研究表明,氧化应激在癫痫引起的不同类型的神经元死亡中发挥着关键作用[12]。本研究通过TUNEL染色法详细比较了两种模型中的凋亡特征。结果显示,相比于腹腔注射模型,侧脑室注射模型中神经细胞的凋亡更为显著。
3.3 神经变性在癫痫中的作用神经变性,指神经系统中神经元结构和功能的逐渐受损,通常涉及多种机制,如氧化应激、线粒体功能障碍、细胞凋亡和炎症[13]。在癫痫领域,神经变性的作用机制复杂,既可能是癫痫的原因,也可能是其结果[14]。癫痫的反复发作可引发缺血、缺氧等病理变化,这些变化可能进一步加剧神经变性。而神经的受损和变性也可能增加癫痫发作的频率和严重性,形成一种恶性循环。为了更深入地探讨腹腔注射和侧脑室注射KA模型对神经变性的影响,本研究运用了FJB染色方法进行了检测。FJB作为一种阴离子荧光染料,可以有选择性地标记脑片上的变性神经元,包括神经元胞体、树突、轴突和轴突终末[15]。本研究结果显示,腹腔注射KA制备的癫痫模型中,FJB标记的变性神经元数量明显低于侧脑室注射模型,这2组之间存在显著性差异。这一发现强调了腹腔注射和侧脑室注射KA对模型神经变性的影响存在显著差异。
3.4 胶质细胞激活与癫痫发展的关系最新研究发现,胶质细胞在癫痫发作期间经历明显的形态学和分子特征的改变,这些改变可能与其激活状态紧密相关[16-17]。此外,胶质细胞能够释放多种信号分子,如谷氨酸、ATP和乳酸等,这些分子对神经元的兴奋性产生直接影响,从而促使癫痫发作的发生[18]。另外,胶质细胞的活化与神经炎症反应密切相关,激活的胶质细胞会产生炎症介质,包括细胞因子和白细胞黏附分子,这些分子可以导致神经元的兴奋性增加,进一步加剧癫痫的风险[19]。还有研究揭示,激活的胶质细胞可能参与神经保护机制,以减轻癫痫发作对神经系统的损害[20]。本研究进一步揭示,在两种不同的癫痫小鼠模型中,侧脑室注射模型具有更明显的胶质细胞激活的形态学和结构特征,表现为胶质细胞体积增大、细胞突起增多、分支形态不规则明显加剧等特征。然而,受研究限制,本研究尚未进一步揭示胶质细胞激活的分子标志物改变,以便更准确地识别激活状态。
3.5 模型选择对实验结果的影响前述结果可见,两种模型均具备癫痫发作的行为学特征和表现,均可以模拟癫痫的特定类型、症状或发病机制方面的效果。同时,两模型均也具备癫痫的一些常规病理特征表现:神经变性改变、凋亡改变、胶质细胞激活等。本结果也进一步揭示侧脑室注射模型具有更明显的病理特征,更能够彰显癫痫模型的重要特征。但是腹腔注射模型也具备其优势,因为在脑局部进行特异性观察,如双光子观察,包埋多通道电极、光纤记录等操作的同时,侧脑室注射会影响到这些操作,此时,腹腔注射可以发挥较好的优势。另外,腹腔注射不具备侧脑室注射的局部操作难度大、创伤性和易感染等特点,并且重复性和一致性稍强。但是这些因素对实验结果的可靠性和有效性的影响,部分时候还取决于实验操作人员本身。
综上所述,本研究揭示了两种不同癫痫小鼠模型在死亡率、行为学表型和病理学损伤变化等存在明显的差异。利用ICV路径进行癫痫小鼠的制备,其成功率较高,死亡率较低,并且在神经病理损伤和胶质细胞激活方面的表现更为突出,此方法可以作为优选的制备策略。本研究为模型的选择提供了更全面的视角,这有助于深入理解癫痫的发病机制,并为潜在的治疗策略提供有力支持。
| [1] |
FISHER R S, ACEVEDO C, ARZIMANOGLOU A, et al. ILAE Official Report: a practical clinical definition of epilepsy[J]. Epilepsia, 2014, 55(4): 475-482. |
| [2] |
THIJS R D, SURGES R, O'BRIEN T J, et al. Epilepsy in adults[J]. Lancet, 2019, 393(10172): 689-701. |
| [3] |
NELIGAN A, HAUSER W A, SANDER J W. The epidemiology of the epilepsies[J]. Handb Clin Neurol, 2012, 107: 113-133. |
| [4] |
KWAN P, BRODIE M J. Early identification of refractory epilepsy[J]. N Engl J Med, 2000, 342(5): 314-319. |
| [5] |
KALILANI L, SUN X Z, PELGRIMS B, et al. The epidemiology of drug-resistant epilepsy: a systematic review and meta-analysis[J]. Epilepsia, 2018, 59(12): 2179-2193. |
| [6] |
WANG F X, YANG X L, MA Y S, et al. TRIF contributes to epileptogenesis in temporal lobe epilepsy during TLR4 activation[J]. Brain Behav Immun, 2018, 67: 65-76. |
| [7] |
KEISER M S, CHEN Y H, DAVIDSON B L. Techniques for intracranial stereotaxic injections of adeno-associated viral vectors in adult mice[J]. Curr Protoc Mouse Biol, 2018, 8(4): e57. |
| [8] |
PIJET B, KONOPKA A, REJMAK E, et al. The matrix metalloproteinase inhibitor marimastat inhibits seizures in a model of kainic acid-induced status epilepticus[J]. Sci Rep, 2020, 10: 21314. |
| [9] |
FERRARO T N, GOLDEN G T, SMITH G G, et al. Differential susceptibility to seizures induced by systemic kainic acid treatment in mature DBA/2J and C57BLl6J mice[J]. Epilepsia, 1995, 36(3): 301-307. |
| [10] |
BERGEY G K, MORRELL M J, MIZRAHI E M, et al. Long-term treatment with responsive brain stimulation in adults with refractory partial seizures[J]. Neurology, 2015, 84(8): 810-817. |
| [11] |
DU K, HE M, ZHAO D Y, et al. Mechanism of cell death pathways in status epilepticus and related therapeutic agents[J]. Biomed Pharmacother, 2022, 149: 112875. |
| [12] |
SOKOLOVA T V, ZABRODSKAYA Y M, LITOVCHENKO A V, et al. Relationship between neuroglial apoptosis and neuroinflammation in the epileptic focus of the brain and in the blood of patients with drug-resistant epilepsy[J]. Int J Mol Sci, 2022, 23(20): 12561. |
| [13] |
NABBOUT R, KUCHENBUCH M. Impact of predictive, preventive and precision medicine strategies in epilepsy[J]. Nat Rev Neurol, 2020, 16(12): 674-688. |
| [14] |
UPAGANLAWAR A B, WANKHEDE N L, KALE M B, et al. Interweaving epilepsy and neurodegeneration: vitamin E as a treatment approach[J]. Biomed Pharmacother, 2021, 143: 112146. |
| [15] |
SCHMUED L C, HOPKINS K J. Fluoro-Jade B: a high affinity fluorescent marker for the localization of neuronal degeneration[J]. Brain Res, 2000, 874(2): 123-130. |
| [16] |
VEZZANI A, RAVIZZA T, BEDNER P, et al. Astrocytes in the initiation and progression of epilepsy[J]. Nat Rev Neurol, 2022, 18(12): 707-722. |
| [17] |
YU C, DENG X J, XU D. Microglia in epilepsy[J]. Neurobiol Dis, 2023, 185: 106249. |
| [18] |
PURNELL B S, ALVES M, BOISON D. Astrocyte-neuron circuits in epilepsy[J]. Neurobiol Dis, 2023, 179: 106058. |
| [19] |
VEZZANI A, DI SAPIA R, KEBEDE V, et al. Neuroimmunology of status epilepticus[J]. Epilepsy Behav, 2023, 140: 109095. |
| [20] |
CHEN Y, NAGIB M M, YASMEN N, et al. Neuroinflammatory mediators in acquired epilepsy: an update[J]. Inflamm Res, 2023, 72(4): 683-701. |




