2. 400042 重庆,重庆仁品耳鼻喉医院咽喉科
2. Department of Pharynx and Larynx, Chongqing Renpin Ear Nose Throat Hospital, Chongqing, 400042, China
流感病毒为单链RNA病毒并主要感染人呼吸道上皮。其感染的典型症状包括发烧、肌肉疼痛和疲惫等。这种症状在感染后的第2~3天达到高峰,随即在1~2周内消退[1]。流感病毒可快速变异并不断进化,因此,其可感染所有年龄段的健康个体,有的还可出现严重并发症甚至死亡。目前从临床症状上区分流感与其他呼吸道病毒(如新型冠状病毒)或细菌感染仍然十分困难,这或可导致抗病毒药物使用的失误[2]。除了上呼吸道和肺部,流感病毒可以通过血液或神经系统传播到身体的其他部位导致多器官受累。如直接感染心肌可引起心肌炎、脑部感染引发脑炎和肌肉感染导致肌肉炎等[3-5]。
当前关于细胞、组织、器官和系统之间相互作用的多数知识都来源于动物模型及细胞系的共培养。然而动物模型及细胞共培养等都不能完全模拟人体的结构特征,因此类器官技术已成为将各细胞或组织器官维持在接近人体天然状态的有力工具[6]。腭扁桃体是一种位于人鼻咽黏膜表面的次级淋巴组织,是B细胞反应和浆细胞产生的独特诱导免疫部位[7-8],这一天然且易获得的免疫器官给体外建立人体类器官模型带来了方便。目前一些实验团队已经于体外开发了人扁桃体类器官模型,该类器官模型包含有免疫应答关键的生发中心,并且能够反映原代人扁桃体中抗原反应性B细胞和T细胞对病毒刺激后发生反应的细胞动力学特点[9]。因此,人扁桃体类器官模型已经成功应用于EB病毒、腺病毒以及流感病毒等的研究[10-11]。
本研究参照WAGAR等[9]使用的体外扁桃体类器官诱导方法,建立了人扁桃体类器官模型;利用单细胞测序分析技术分析扁桃体类器官各细胞的组成及流感病毒受体的分布;并利用该模型感染流感病毒,在感染后48 h,分别使用流式细胞术和免疫荧光等技术检测B细胞产生流感病毒特异性IgG抗体的能力和T细胞分泌细胞因子的情况,该研究为抗流感病毒病的药物和候选疫苗筛选提供新策略。
1 材料与方法 1.1 实验样本实验所用10例扁桃体样本均摘取自2022年10月至2023年12月期间儿童腺样体肥大手术组织。样本均来自重庆市仁品耳鼻喉专科医院,研究已获本院伦理审核([2024]01号)并取得患者的知情同意。
1.2 主要试剂TBD淋巴细胞分离液购自天津灏洋生物;RPMI1640、FBS、Ham’s F12、MEM非必需氨基酸(NEAA)、丙酮酸钠溶液、Insulin/selenium/transferrin cocktail(IST cocktail)、PBS缓冲液与DPBS缓冲液购自美国Gibco公司;柠檬酸与柠檬酸钠购自比利时Acros organics公司;30%H2O2过氧化氢溶液购自美国赛默飞世尔科技公司;DAPI染料购自德国Sigma公司;BSA粉末购自上海碧云天生物技术有限公司;Normocin、Fixable Viability Dye eflourTM780、Goat anti-Rabbit IgG (H+L) Alexa FluorTM 488绿光二抗购自美国Invitrogen公司;青链霉素混合液(100X)购自北京索莱宝科技有限公司;苏木精染色液、伊红染色液购自北京中杉金桥生物技术有限公司;无水甲醇溶液购自Enox江苏强盛;DAB显色试剂盒购自福州迈新生物技术开发有限公司;ABC kits购自美国Vector公司;BB700 anti-human CD3、BV421TM anti-human CD19、PE anti-human IL-2、FITC anti-human IFN-γ、APC anti-human TNF-α、PE-cy7 anti-human CD4、BV510 anti-human CD8、Perm/WashTM、Cytofix/CytopermTM购自美国BD公司;PE-cy7 anti-human CD27、APC anti-human CD38、PE anti-human IgG、FITC anti-human IgD、AF488 anti-human IgM、Baff重组人B细胞成活因子、Human TruStain FixTM购自美国Biolegend公司;Anti-influenza A Virus Nucleoprotein antibody购自英国abcam公司;Recombinant Mouse IL-2 Protein购自美国RD system公司;流感病毒野生型毒株由重庆国际免疫研究院冯泽清博士惠赠。
消毒液的配置:50 mL Ham’ s F12、100 μL Normocin、500 μL青链霉素混合液(100X),4 ℃保存;完全培养基的配置:40 mL RPMI1640、10%FBS、100 μL MEM NEAA、100 μL丙酮酸钠、100 μL青链霉素混合液(100X)、100 μL IST、20 μL Normocin、1 μg/mL baff因子、10 ng/mL IL-2因子,4 ℃保存;FACs洗涤缓冲液的配置:PBS、2%FBS;Perm/Wash洗涤缓冲液的配置:ddH2O、10% Perm/WashTM,4 ℃保存;抗原修复液的配置:2.1 g柠檬酸粉末定容至100 mL ddH2O中,5.882 g柠檬酸钠粉末定容至200 mL ddH2O中,取9 mL柠檬酸溶液与41 mL柠檬酸钠溶液,加入450 mL ddH2O定容至500 mL,4 ℃保存;内源性过氧化物酶封闭液(3%H2O2)的配置:取150 μL 30%H2O2,加入675 μL无水甲醇与675 μL ddH2O。
1.3 方法 1.3.1 人扁桃体样本的处理与类器官构建经过手术摘除的扁桃体组织放入配置好的消毒液中,4 ℃浸泡1 h,随后用PBS缓冲液冲洗,将70 μm尼龙滤网架于50 mL离心管上,用组织剪将扁桃体组织分成3 mm×3 mm×3 mm大小的小块,随后用研磨器进行研磨。
将研磨后的细胞悬液放入离心机中,于4 ℃条件下250×g离心5 min,弃掉上清后用PBS缓冲液重悬清洗,再次相同条件离心。弃上清后用20 mL PBS缓冲液加10% FBS重悬细胞,另取50 mL空的离心管,加入20 mL淋巴细胞分离液,将细胞悬液小心铺于分离液的液面之上。离心完成后小心吸取中间密度层的白膜。收集完成后放入离心机中4 ℃,250×g离心5 min,弃掉上清,用完全培养基重悬洗涤细胞,同时吸取20 μL细胞悬液进行细胞计数。
使用2.5D类器官培养技术将膜孔径为0.4 μm的Transwell小室放置于6孔细胞培养板中,并在6板下室中加入2 mL含有IL-2与Baff成细胞因子的完全培养基,放入37 ℃,5%CO2细胞培养箱中预热30 min。吸取100 μL调整浓度后的人扁桃体细胞悬液于上层的Transwell小室中[9]。
1.3.2 流感病毒感染在扁桃体类器官培养第6天,将流感病毒野生型毒株按照MOI=1的剂量添加至Transwell培养板下室。随后将培养板放入37 ℃、5% CO2孵箱中孵育,48 h后用完全培养基收取细胞进行流式细胞术(FCM)检测。
1.3.3 石蜡切片的制作与苏木精-伊红染色(HE)将手术后取得的扁桃体组织放入4%多聚甲醛中浸泡24 h以上,固定完成后将组织放入包埋盒中进行组织脱水、透明,随后进行石蜡包埋与切片。切片样本放入65 ℃烘箱中过夜,然后依次放入二甲苯Ⅰ、Ⅱ、Ⅲ中各20 min进行脱蜡,再依次经过100%乙醇Ⅰ、100乙醇Ⅱ、95%乙醇、75%乙醇、50%乙醇中各5 min进行复水,将切片样本放入蒸馏水中3 min,然后滴加苏木精染料,根据染色深浅终止后放入自来水中漂洗并过夜返蓝,随后将切片样本放入100%乙醇中进行胞浆脱水1 min后滴加伊红染料染色30 s,根据染色深浅进行梯度脱水洗去多余的染料,最后放入二甲苯中浸泡,使组织透明,然后封片镜检。
1.3.4 免疫荧光染色流感病毒感染后收取细胞并制成单细胞悬液,随后使用Thermo ScientificTM CytospinTM 4细胞离心涂片机120×g离心8 min制成悬浮细胞涂片样本。用组化笔在细胞区域周围画疏水圈,并滴加3%H202溶液封闭内源性过氧化物酶室温孵育30 min,加PBS缓冲液摇床上晃动洗涤3次,每次5 min,接着滴加3%BSA溶液,4 ℃封闭2 h。随后使用3%BSA 1∶500稀释配置Anti-influenza A Virus Nucleoprotein antibody一抗孵育液,4 ℃避光孵育过夜。使用3%BSA溶液1∶200稀释Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody Alexa FluorTM 488配置荧光二抗孵育液,避光37 ℃孵育1 h后浸没在PBS缓冲液中,晃动洗涤5次,每次5 min。最后使用PBS缓冲液1∶500稀释DAPI染液,避光室温孵育10 min。随后水封涂片,避光镜检。
1.3.5 流式细胞术检测分别在培养第0、3、5、7天收取细胞,将细胞悬液加入96孔板中,用FACs缓冲液洗涤,随后使用100 μL的FACs孵育体系配置表面抗体孵育液。使用50 μL FACs缓冲液加稀释B细胞表面抗体(Fixable Viability Dye,1∶1 000稀释;anti-CD19、anti-CD27及anti-CD38,1∶200稀释)。同样的方法稀释T细胞表面抗体(anti-CD3、anti-CD19、anti-CD4及anti-CD8),室温避光孵育30 min后用FACs缓冲液洗涤。每孔加入200 μL Cytofix/CytopermTM破壁液,室温避光孵育1 h后使用Perm/Wash缓冲液洗涤,随后使用100 μL的Perm/Wash孵育体系配置胞内抗体孵育液,其中B细胞胞内(anti-IgG、anti-IgM及anti-IgD,1∶200),T细胞胞内(anti-IL-2、anti-IFN-γ及anti-TNF-α,1∶200),最后加入200 μL FACs缓冲液并上机检测。
另外在扁桃体类器官培养第6天,将流感病毒野生型毒株按照MOI=1剂量用完全培养基稀释后添加至Transwell培养板下室,用枪头吹吸混匀,随后将培养板放入37 ℃ 5%CO2孵箱中孵育,48 h后用完全培养基收取细胞进行FCM检测。流感病毒感染后的细胞收取采取同样的方法进行流式细胞术的检测。
1.3.6 scRNA-seq测序及数据分析人扁桃体类器官培养第6天与第9天时,使用完全培养基对细胞进行收取,然后使用DPBS缓冲液配置0.04%BSA溶液对单细胞悬液进行洗涤,使用0.4%台盼蓝溶液对细胞活性进行检测(细胞活性>85%)。使用10×Genomics单细胞测序进行cDNA的扩增与文库构建及上机测序。通过10×Genomics测序得到的数据,使用R语言进行生物信息学分析,基于10×标准输出文件创建Seurat对象,对原始数据进行清洗与质控后再进行细胞降维与聚类,然后对所得到的细胞类群进行鉴定,继而分析基因差异的表达,最后根据本研究需要进行基因功能注释和细胞通讯分析。
1.4 统计学分析使用GraphPad Prism 9.5软件进行统计学分析,对感染前与流感病毒感染48 h后的数据进行t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 人扁桃体类器官生长的形态学人扁桃体类器官的构建及病毒感染的实验方案按图 1A方式开展。手术后摘取的人扁桃体样本呈球形或葡萄状,质软。经过石蜡包埋与切片染色后镜检,可见扁桃体增生、肥大样淋巴组织与淋巴滤泡增生,生发中心扩大。在高倍镜下可见较多小淋巴细胞增生和少量浆细胞浸润(图 1B、C)。且通过体外的培养实况图,可以看到扁桃体类器官在第3天出现肉眼可见的细胞聚集,在第5天聚集点扩大并非常明显(图 1D),证明了人扁桃体类器官的成功构建。
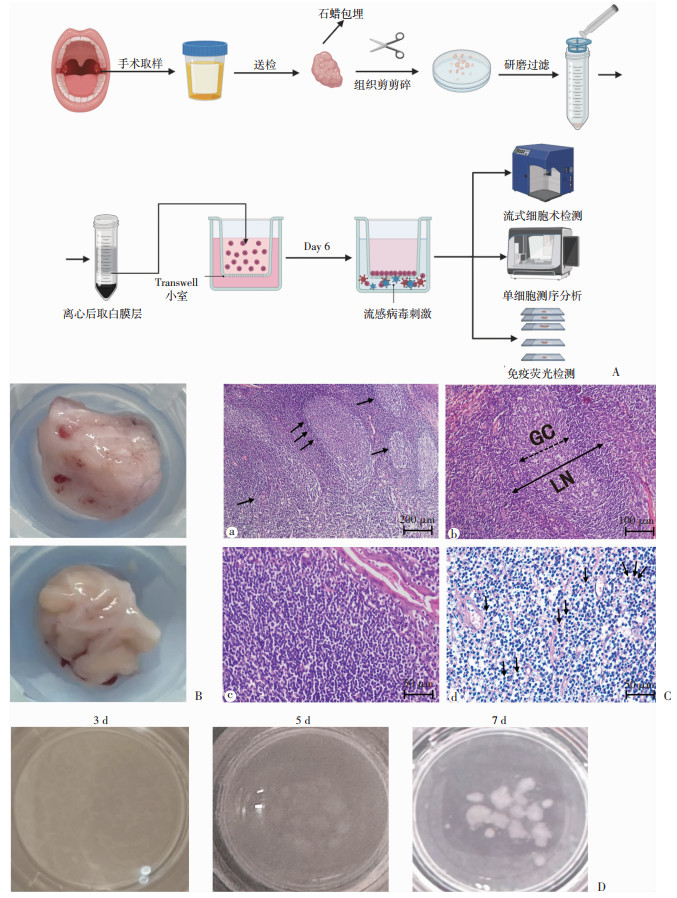
|
| A: 手术样本的处理与扁桃体类器官的构建、病毒刺激与检测方法;B: 扁桃体肥大样本大体观;C: 扁桃体肥大样本镜检观察a: ↑示增生的淋巴滤泡;b: 生发中心扩大,LN示淋巴滤泡,GC示生发中心;c: 淋巴细胞增生;d: ↑示浆细胞浸润;D: 扁桃体类器官培养不同天数 图 1 扁桃体类器官的构建与病毒感染及检测的实验方案 |
2.2 流式细胞术(FCM)检测各细胞亚型变化
按照图 2A的细胞分群圈门策略,将B细胞分为CD38+CD27- (生发中心前体B细胞,pro GC-B)、CD38+CD27+ (生发中心B细胞,GC-B)、CD38-CD27+(记忆性B细胞,Memory B)和CD38-CD27-(幼稚性B细胞,naïve B)。FCM分析发现在培养第5天,GC-B细胞的比例逐渐升高至总细胞量的59%,然后在第7天开始缓慢下降,而整个过程中CD38-CD27+ Memory B细胞的比例无明显变化(图 2B)。
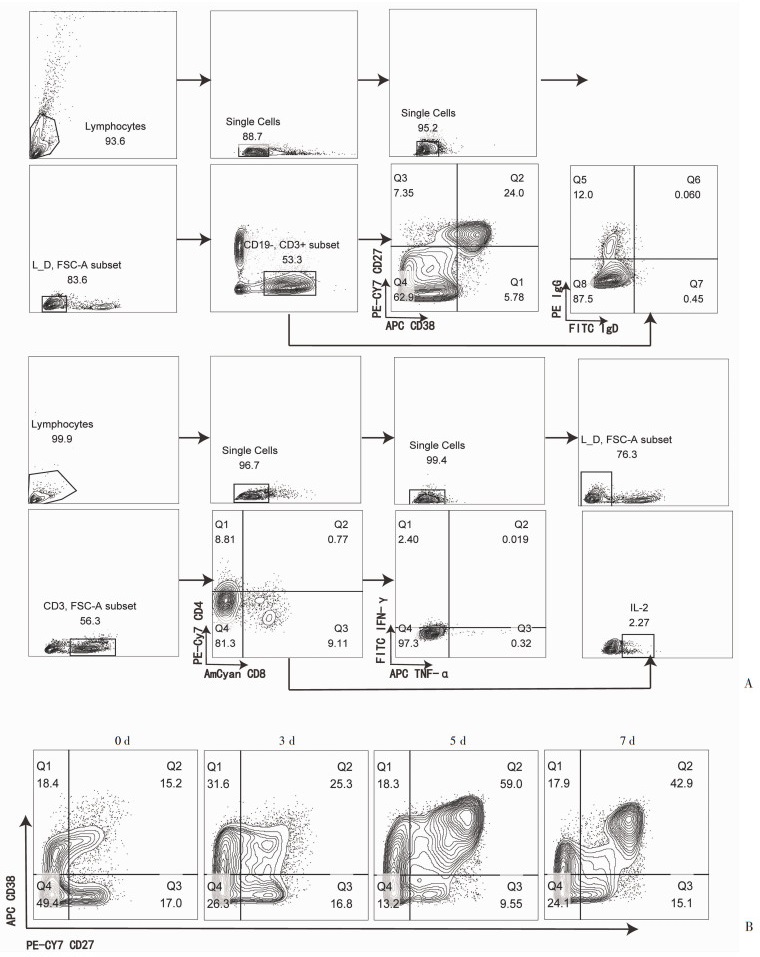
|
| A: 细胞分群圈门策略; B: 扁桃体类器官培养7 d各细胞比例变化 图 2 流式细胞术检测扁桃体类器官生长的细胞含量变化 |
2.3 scRNA-seq分析扁桃体类器官的细胞组成
根据流式细胞术分析结果,扁桃体类器官在培养第5天时各细胞群含量达到峰值,在第7天开始下降,由于其发育的具体细节仍不明确,因此选择扁桃体类器官培养第6天与第9天进行处理,制备单细胞悬液并通过scRNA-seq来分析扁桃体类器官的生长与发育情况。如图 3A所示,扁桃体类器官中T细胞和B细胞占主要成分,无论是第6天还是第9天的scRNA-seq分析结果均显示T、B细胞左右分区明显。
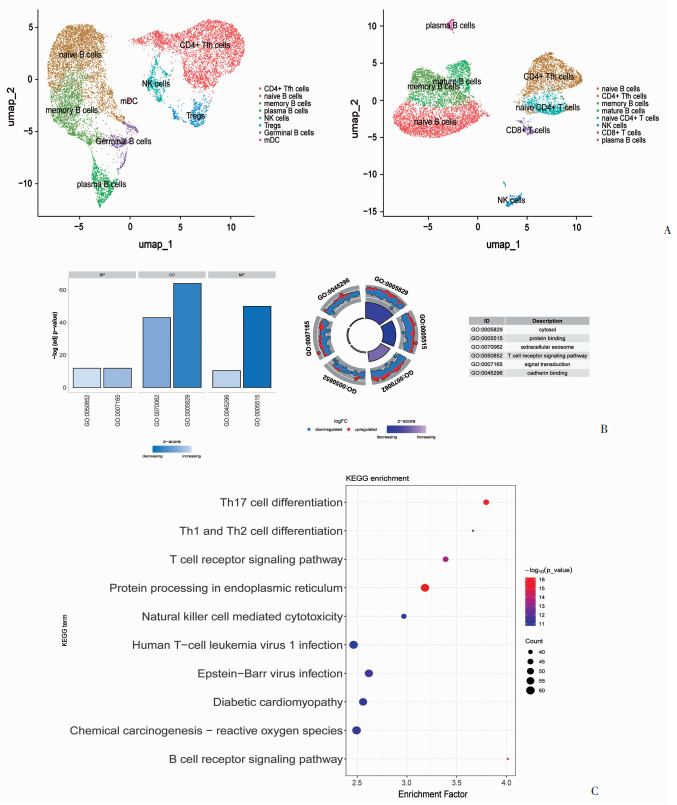
|
| A: 扁桃体类器官培养第6天与第9天的细胞亚群注释; B: GO富集分析人扁桃体类器官培养第6天与第9天的差异基因表达情况; C: KEGG富集分析人扁桃体类器官培养第6天与第9天的差异基因信号通路 图 3 单细胞测序分析扁桃体类器官的细胞组成与基因表达 |
通过生物信息学分析计算获得了人扁桃体类器官培养第6天和第9天单细胞测序数据中的差异基因,通过分子功能(molecular function,MF)、细胞组分(cellular component,CC)、生物过程(biological process,BP)数据库进行Gene Ontology(基因本体)富集分析,结果显示相较于第6天,第9天类器官中下调的差异基因主要富集于细胞质、细胞外体、蛋白质结合等通路中,而上调基因主要富集于T细胞受体(TCR)的信号通路与信号转导通路(图 3B)。同时将差异基因进行KEGG富集分析,发现在第9天类器官中上调的基因主要富集于T细胞分化、T和B细胞受体信号通路、病毒感染相关通路中(图 3C)。
2.4 scRNA-seq分析流感病毒细胞受体在人扁桃体类器官中的分布单细胞转录组测序分析结果显示流感病毒的细胞受体FUT2在人扁桃体类器官中表达丰度低,ST6GAL1则呈高水平表达,且在B细胞区的表达明显高于T细胞区(图 4)。
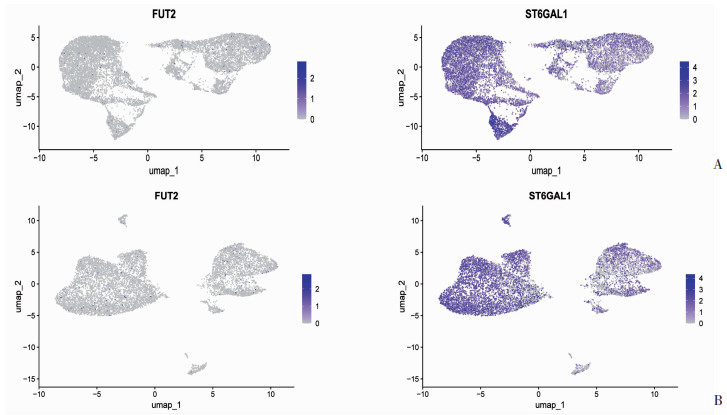
|
| A: FUT2与ST6GAL1在扁桃体类器官培养第6天的分布; B: FUT2与ST6GAL1在扁桃体类器官培养第9天的分布 图 4 流感病毒细胞受体在人扁桃体类器官组织中的分布 |
2.5 FCM检测流感病毒感染48 h前后的T和B细胞含量及细胞因子水平变化
在扁桃体类器官体外感染流感病毒后对其免疫反应变化进行分析(图 5)。FCM检测发现流感病毒感染48 h后,CD38+CD27+的GC-B细胞与未感染流感病毒时相比平均下降了24%,但其被大量分泌抗体的浆细胞所占据。此外CD38-CD27+的Memory B细胞增多,其分泌的IgG显著升高。与未感染流感病毒的对照相比,IgG平均上升了1.4倍;IgD减少了45%而IgM的含量则下降了47%。此外,FCM检测也发现有大量的T细胞被活化。与未感染流感病毒的对照相比,CD4+ T细胞所产生的TNF-α、IFN-γ和IL-2细胞因子平均升高了4.3、2.8和2倍;CD8+ T细胞所分泌的TNF-α和IL-2则分别提高了2倍和3倍。
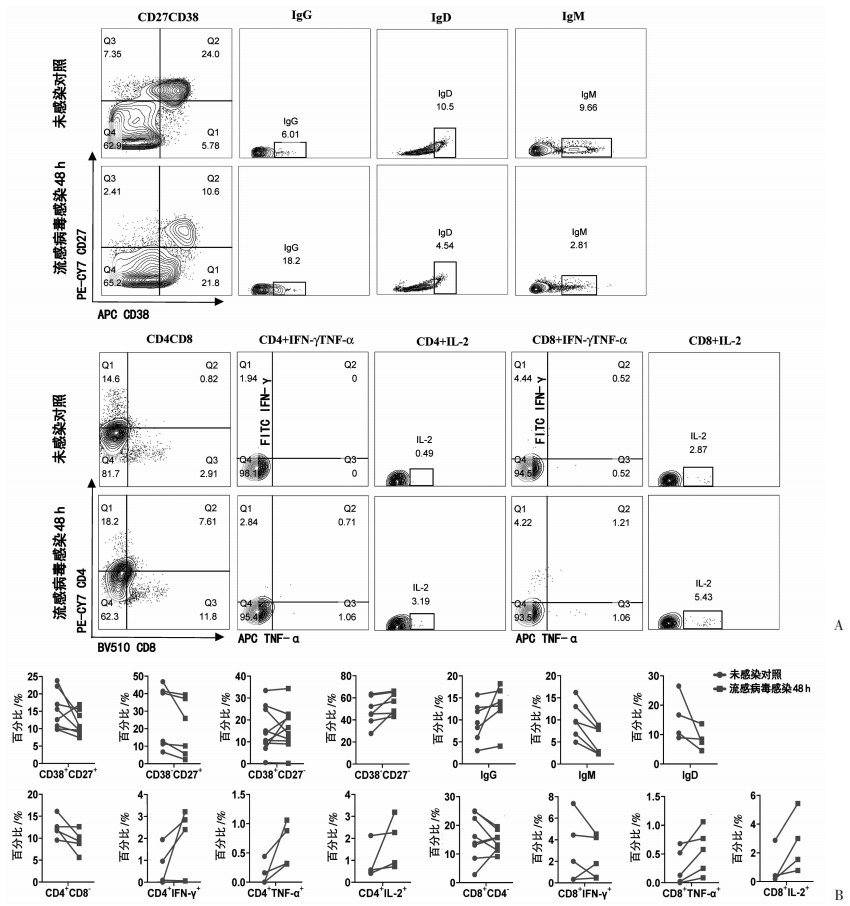
|
| A: 流式细胞术检测流感病毒感染前后T、B细胞及其产生的抗体水平和细胞因子水平对比示例; B: 所有扁桃体样本的流式结果 图 5 流式细胞术检测流感病毒感染扁桃体类器官后的免疫效应 |
2.6 免疫荧光法观察流感特异性抗体的产生
免疫荧光染色观察发现在感染流感病毒的细胞中有流感病毒特异性抗体(图 6),由此说明流感病毒侵袭扁桃体类器官后发生了特异性免疫反应。
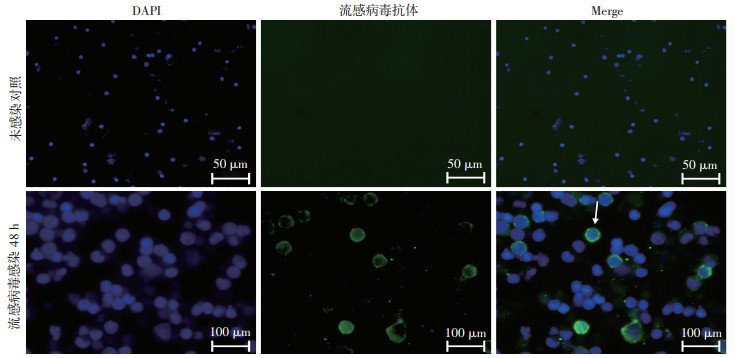
|
| ↑:示流感特异性抗体 图 6 免疫荧光法观察流感特异性抗体的产生 |
3 讨论
本研究使用2.5D-Transwell培养技术模拟了更接近真实生物组织的微环境,人扁桃体组织细胞被培养在具有微通道的介质上,使得细胞能够在更复杂的环境中生长和相互作用,并于体外成功构建了扁桃体的免疫类器官模型并应用于流感病毒的感染,通过FCM分析及scRNA-seq测序结果表明,体外诱导的扁桃体类器官主要以T和B细胞占主要组分。进一步对细胞亚群注释分析发现B细胞逐渐发展成为成熟的B细胞。同时差异基因相关分析结果显示第9天类器官上调的基因主要富集在T细胞分化、T和B细胞受体信号通路、病毒感染相关通路中。目前基于基因敲除小鼠的流感病毒感染模型,已经逐步解析了机体先天和适应性免疫系统在阻止流感病毒复制和促进病毒清除中的关键作用[12]。但由于动物的免疫系统与人的免疫系统存在巨大的差异,因此基于动物模型的研究结果对人类疾病的治疗依然存在局限性。而利用原代人淋巴组织如扁桃体于体外诱导人免疫类器官,可以系统地展示人适应性免疫反应的基本特征,因此广泛应用于临床及实验研究[13]。该模型的建立也可为将来的药物筛选及疫苗设计提供新的手段。
在人类细胞中广泛表达的流感病毒感染的α-2, 6-连接的细胞表面糖基化受体基因包括FUT2(α-1, 2-岩藻糖基转移酶2)和ST6GAL1(α-2, 6-岩藻糖基转移酶1),这些基因的产物参与细胞表面α-2, 6-连接的唾液酸形成,从而作为流感病毒的受体[14-16]。而在scRNA-seq的分析数据中可以观察到流感病毒细胞受体FUT2和ST6GAL1几乎表达于人扁桃体类器官的所有细胞中,但FUT2在人扁桃体类器官中表达丰度低,ST6GAL1呈高水平表达,这些结果表明流感病毒或可感染类器官中所有的细胞类型。为此,进一步使用流感病毒对构建的扁桃体类器官进行体外感染。FCM检测发现,感染后GC-B细胞的数量显著减少,其分化为终末的浆细胞并产生病毒特异性抗体,其中以IgG为主要抗体类型。膜结合型IgD是B细胞分化发育成熟的标志,FCM分析发现在感染流感病毒后,IgD+ B细胞数量提高,提示这些被病毒感染的B细胞向成熟的B细胞方向分化。IgM是初次体液免疫应答中最早出现的抗体,IgM的含量升高则提示机体新近发生感染[17],但本次实验并未观察到感染前后有显著性差异。将流感病毒感染扁桃体类器官48 h后的细胞收取后进行细胞涂片,通过免疫荧光法检测清晰地观察到了流感特异性IgG抗体的产生。除了B细胞相关的体液免疫应答外,T细胞活化及其产生的细胞因子在感染后也有所升高,提示流感病毒感染时促进了人获得性免疫应答。
此外,scRNA-seq分析证实扁桃体类器官中含有Tfh细胞,但是有关于Tfh是否有助于在类器官应对流感病毒感染产生特异性抗体还需进一步探索。同时scRNA-seq分析证实人扁桃体类器官模型保留了淋巴组织的天然细胞库和关键的细胞间相互作用。因此该扁桃体类器官的成功构建可为后续研究新型冠状病毒、塞卡病毒等其他病毒感染提供强有力的支撑。
目前针对流感病毒以及SARS-CoV-2等病原体激发的体液免疫主要利用外周PBMCs的反应进行评价。研究已证实,上呼吸道淋巴节组织是这些病原体感染和复制的主要部位,然而病毒感染是否可以直接诱导淋巴结内的获得性免疫应答尚存争议[18]。扁桃体是人的次级淋巴组织,其含有大量浆细胞,其游离至黏膜部位可分泌免疫球蛋白。滤泡辅助T细胞(Tfh)和B细胞之间的协同作用使免疫球蛋白(Ig)基因发生类别转换,随后B细胞经历体细胞Ig基因的高频突变和亲和力成熟,最终导致高亲和力抗体形成和记忆B细胞的产生[19-20]。在SARS-CoV-2感染早期,在人扁桃体中检测到病毒gtRNA和SARS-CoV-2刺突S抗原特异性的B细胞以及Tfh,因此这些患者体内扁桃体存在病毒特异性的GC并诱导B细胞免疫记忆[21]。最近,扁桃体免疫类器官模型也应用于流感疫苗及佐剂的评价,以及古老的β-型冠状病毒Spike刺突抗原受体结合域(RBD) 激发的广谱免疫应答[9, 22]。因此,扁桃体类器官的广泛应用,有助于更深入地研究人体病毒感染及疫苗激发的适应性免疫应答的分子机制。
| [1] |
HUTCHINSON E C. Influenza virus[J]. Trends Microbiol, 2018, 26(9): 809-810. |
| [2] |
JAVANIAN M, BARARY M, GHEBREHEWET S, et al. A brief review of influenza virus infection[J]. J Med Virol, 2021, 93(8): 4638-4646. |
| [3] |
SKAARUP K G, MODIN D, NIELSEN L, et al. Influenza and cardiovascular disease pathophysiology: strings attached[J]. Eur Heart J Suppl, 2023, 25(Suppl A): A5-A11. |
| [4] |
SONG Y, LI S, XIAO W, et al. Influenza-associated encephalopathy and acute necrotizing encephalopathy in children: a retrospective single-center study[J]. Med Sci Monit, 2021, 27: e928374. |
| [5] |
EKSTRAND J J. Neurologic complications of influenza[J]. Semin Pediatr Neurol, 2012, 19(3): 96-100. |
| [6] |
BAR-EPHRAIM Y, KRETZSCHMAR K, CLEVERS H. Organoids in immunological research[J]. Nat Rev Immunol, 2019, 20: 279-293. |
| [7] |
BRANDTZAEG P. Immune functions of nasopharyngeal lymphoid tissue[J]. Adv Oto Rhino Laryngol, 2011, 72: 20-24. |
| [8] |
BRANDTZAEG P, PABST R. Let's go mucosal: communication on slippery ground[J]. Trends Immunol, 2004, 25(11): 570-577. |
| [9] |
WAGAR L E, SALAHUDEEN A, CONSTANTZ C M, et al. Modeling human adaptive immune responses with tonsil organoids[J]. Nat Med, 2021, 27(1): 125-135. |
| [10] |
KASTENSCHMIDT J M, SURESHCHANDRA S, JAIN A, et al. Influenza vaccine format mediates distinct cellular and antibody responses in human immune organoids[J]. Immunity, 2023, 56(8): 1910-1926. |
| [11] |
SHUKLA R K, GUNASENA M, REINHOLD-LARSSON N, et al. Innate adaptive immune cell dynamics in tonsillar tissues during chronic SIV infection[J]. Front Immunol, 2023, 14: 1201677. |
| [12] |
IWASAKI A, PILLAI P S. Innate immunity to influenza virus infection[J]. Nat Rev Immunol, 2014, 14(5): 315-328. |
| [13] |
WAGAR L E. Human immune organoids: a tool to study vaccine responses[J]. Nat Rev Immunol, 2023, 23: 699. |
| [14] |
RAMAN R, THARAKARAMAN K, SHRIVER Z, et al. Glycan receptor specificity as a useful tool for characterization and surveillance of influenza A virus[J]. Trends Microbiol, 2014, 22(11): 632-641. |
| [15] |
DE VRIES R P, TZARUM N, PENG W J, et al. A single mutation in Taiwanese H6N1 influenza hemagglutinin switches binding to human-type receptors[J]. EMBO Mol Med, 2017, 9(9): 1314-1325. |
| [16] |
WALTHER T, KARAMANSKA R, CHAN R W Y, et al. Glycomic analysis of human respiratory tract tissues and correlation with influenza virus infection[J]. PLoS Pathog, 2013, 9(3): e1003223. |
| [17] |
曹雪涛. 医学免疫学(7版)[M]. 北京: 人民卫生出版社, 2018: 35-37. CAO X T. Medical Immunology (7th Ed)[M]. Beijing: People's Medical Publishing House, 2018: 35-37. |
| [18] |
ALTORKI T A, ABDULAL R H, SULIMAN B A, et al. Robust memory humoral immune response to SARS-CoV-2 in the tonsils of adults and children[J]. Front Immunol, 2023, 14: 1291534. |
| [19] |
张轶. 抗原特异性滤泡辅助性T细胞的活化与诱导在流感减毒活疫苗所诱导的人黏膜免疫抗体应答中发挥关键作用[J]. 微生物学免疫学进展, 2019, 47(2): 93. ZHANG Y. Activation and induction of antigen-specific follicular helper T cells play a key role in human mucosal immune antibody response induced by live attenuated influenza vaccine[J]. Prog Microbiol Immunol, 2019, 47(2): 93. |
| [20] |
XU Q, MILANEZ-ALMEIDA P, MARTINS A J, et al. Adaptive immune responses to SARS-CoV-2 persist in the pharyngeal lymphoid tissue of children[J]. Nat Immunol, 2023, 24(1): 186-199. |
| [21] |
TAN H X, WRAGG K M, KELLY H G, et al. Cutting edge: SARS-CoV-2 infection induces robust germinal Center activity in the human tonsil[J]. J Immunol, 2022, 208(10): 2267-2271. |
| [22] |
HUETING D, SCHRIEVER K, SUN R, et al. Design, structure and plasma binding of ancestral β-CoV scaffold antigens[J]. Nat Commun, 2023, 14(1): 6527. |




