早产儿视网膜病变(retinopathy of prematurity, ROP)是早产儿常见的眼部并发症,也是儿童致盲的主要原因,与早产、低体重、高浓度吸氧密切相关,近年来ROP发病率逐渐升高,严重影响患儿的视力及生活质量[1-2]。ROP病程第一阶段高氧导致视网膜血管生成减少,血管闭塞;第二阶段相对缺氧的环境导致血管加速不规则生长,纤维血管组织异常收缩,最终造成视网膜血管变性、渗出、新生血管形成,甚至牵拉性视网膜脱离[3-4]。目前ROP的治疗手段多为控制给氧、抗血管内皮生长因子A药物治疗、激光治疗等,虽然这些方法能够部分控制ROP进展,但疗效十分有限[5-6]。因此进一步探索ROP的发病机制,寻找新的治疗思路十分必要。
星形胶质细胞是中枢神经系统中分布最广泛的一类细胞[7],对中枢神经系统的发育以及稳态维持都有着重要的作用[8]。在视网膜内,星形胶质细胞是血管内皮生长因子(vascular endothelial growth factor,VEGF)及炎症因子的主要来源[9],抑制星形胶质细胞的激活能减少VEGF及炎症因子释放进而减少新生血管的生成[10-13],这为ROP的治疗提供了新的思路。
G蛋白偶联雌激素受体(G proteincoupled estrogen receptor,GPER)是雌激素非经典型受体,广泛分布于组织和器官[14]。研究表明,在中枢神经系统中,GPER的激活能起到明显的抗炎及神经保护作用[15-16]。而GPER是否能抑制ROP疾病进程中视网膜星形胶质细胞激活还少见报道。稳定的氧诱导下新生小鼠视网膜缺血模型(oxygen-induced retinopathy,OIR)的出现为深入了解ROP发病机制以及寻找ROP治疗思路提供了便捷的手段[17]。本研究选用OIR模型探究ROP发病机制中GPER是否能抑制星形胶质细胞活性,减少视网膜新生血管生成。
1 材料与方法 1.1 实验动物新生7 d龄C57BL/6J小鼠,雄性,体质量4~8 g,孕鼠购买于陆军特色医学中心实验动物中心,实验操作步骤符合伦理标准,并通过陆军军医大学实验动物福利伦理审查委员会审批(AMUWEC20210908)。
1.2 主要仪器及试剂免疫荧光显微镜(日本奥林巴斯公司),蛋白电转仪、电泳仪(美国伯乐公司),胎牛血清封闭液、抗体稀释液、DAPI染剂、蛋白裂解液、蛋白酶抑制剂、磷酸酶抑制剂、金属离子稳定剂、BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司),封闭用羊血清工作液(北京中杉金桥生物技术有限公司),SDS-PAGE凝胶制备试剂盒(上海雅酶生物),化学发光(ECL)检测试剂盒(美国赛默飞公司),GFAP抗体(美国CST公司,#3670),VEGFA抗体(美国Abcam公司,ab46154),GPER抗体(美国GeneTex公司,GTX107748),IL1-β抗体(武汉ABclonal生物科技有限公司,A22257),TNF-α抗体(武汉ABclonal生物科技有限公司,A20851),IGF-1抗体(武汉ABclonal生物科技有限公司,A11985),IB4(美国赛默飞公司,121413),HRP标记山羊抗兔IgG(美国Abcam公司,ab6721)、山羊抗鼠IgG二抗(美国Abcam公司,ab6789),Alexa Fluor594标记的山羊抗鼠IgG二抗(美国CST公司,#8890)、Alexa Fluor488山羊抗兔IgG二抗(美国CST公司,#4412),G-1(GPER激动剂)(MCE公司,HY-107216)。
1.3 实验分组42只新生小鼠采用随机数字表法分为4组:常氧对照组(n=11)、OIR组(n=11)、G-1(GPER激动剂)组(n=10)和溶剂对照组(n=10)。在出生后7 d(P7)时OIR小鼠开始造模,常氧对照组不做处理继续常规饲养。P12造模完成后,连续3 d对G-1组和溶剂对照组按照50 μg/(kg·d)腹腔注射G-1或玉米油溶剂。P12小鼠继续常氧饲养至P17后进行取材与后续操作。
1.4 OIR模型建立新生小鼠在常氧饲养至P7后,检查高氧舱密闭状态后,将新生小鼠与母鼠一同放入高氧舱,先将氧气充至70%,随后打开仓门快速放入鼠笼,关闭仓门后继续充氧至氧气浓度达标,高氧舱氧气浓度设置为(75±5)%,每天2次检查氧气浓度是否在范围内,若氧气浓度下降则快速充氧至设置浓度。期间在第3天时更换母鼠喂养小鼠,避免母鼠长期处于高氧状态,产生躁狂焦虑行为,不继续喂养小鼠,导致小鼠发育不良或致死。5 d后高氧阶段造模完成,在小鼠P12时取出返回常氧环境,通过相对缺氧,模拟缺氧状态下视网膜的病理变化。
1.5 免疫荧光前小鼠灌注及取材固定在P17时处死小鼠,用异氟烷麻醉小鼠后固定小鼠在通风橱操作台上,剪刀从小鼠胃下缘做横向切口,剪破皮肤及筋膜,暴露小鼠的胸腔及腹腔,随后剪断肋骨后暴露心脏,用针头从左心室穿刺,针头停留在心室内,使用止血钳将心壁和针头一并夹持,防止针头滑脱,之后剪破右心耳放血,缓慢推注生理盐水,推注速度控制在0.15~0.20 mL/s,直至流出液体不再带有血色,同时观察暴露肝脏是否变为灰黄色,若符合则停止灌注,随后继续推注15mL 4%多聚甲醛。随后将眼球摘除移至装有多聚甲醛的EP管中继续在固定。
1.6 眼球冰冻切片免疫荧光观察GPER分布情况眼球在4 ℃冰箱中继续多聚甲醛中固定过夜,随后在30%的蔗糖溶液中室温放置1 h脱水至沉底。将OCT倒入一次性模具中,随后将眼球放进OCT中,眼前后节朝向模具左右。将整个模具放入-80 ℃冰箱进行速冻。待OCT完全凝固后脱模用少量OCT将其黏附在底座上,切片厚度设置为10 mm,切下来的眼球组织黏附在防脱载玻片上。PBS冲洗样本后,免疫组化笔圈住组织方便后续抗体孵育。切片上加0.3%Triton溶液,打孔20 min,随后用封闭用山羊血清进行封闭1.5 h,加入抗体稀释液稀释好的鼠源GFAP抗体(1 ∶500)与兔源GPER抗体(1 ∶100)混合溶液,4 ℃孵育过夜,复温加入抗体稀释液稀释好的Cy3标记的山羊抗鼠IgG二抗、山羊抗兔IgG二抗(1 ∶300)孵育2 h,最后PBS稀释DAPI(1 ∶300)染色5 min。每个步骤后均用PBS清洗3次,每次5min。封片后在共聚焦显微镜下观察免疫荧光表达情况。
1.7 视网膜铺片染色观察IB4及GFAP表达情况眼球在多聚甲醛中固定1 h后转移到装有生理盐水的培养皿中,在显微镜下对眼球视网膜进行剥离,剥离完成后在视网膜上剪十字刀,方便后续将视网膜铺平封片。随后将视网膜转移至盖玻片上再盖另一盖玻片,置于6孔板中,装冰甲醇固定30 min,1 min左右时去除盖玻片。将视网膜转移至96孔板中,加入含3% Triton的封闭山羊血清,4 ℃摇床封闭打孔24 h,随后加入抗体稀释液稀释好的鼠源GFAP抗体(1 ∶500),再次4 ℃摇床孵育24 h,同前所述加入Cy3标记的山羊抗鼠IgG二抗4℃摇床孵育24h,最后IB4染料(1 ∶500)4 ℃摇床孵育24 h。每个步骤后均将孔板置于摇床上用生理盐水清洗3次,每次10 min。封片后在共聚焦显微镜下观察免疫荧光表达情况。
1.8 Western blot检测蛋白表达水平P17小鼠过量CO2麻醉后断颈处死,在显微镜下剥离视网膜,3只同组小鼠视网膜作为1个样本进行后续蛋白提取,加入配置好的蛋白裂解液(含蛋白酶抑制剂、磷酸酶抑制剂及金属离子稳定剂)进行裂解。枪头捶打视网膜初次打碎后超声机中处理2个循环再取出,离心(12 000 r/min、4 ℃、15 min)后,取上清液转移至新EP管内,蛋白提取完成,用BCA法测定各组蛋白含量,配平浓度后加入蛋白上样缓冲液于100 ℃水浴锅中煮沸10 min。处理好的蛋白可放于-80 ℃进行保存,但要避免反复冻融。按说明书制备10%的SDS-PAGE凝胶,待SDS-PAGE凝胶完全凝固后进每孔加入等量的蛋白样品并进行凝胶电泳。电泳完毕后进行冰浴电转,将凝胶中的蛋白质转移至PVDF膜上,用5%的BSA溶液封闭2 h,随后孵育一抗GPER(1 ∶1 000)、VEGFA(1 ∶1 000)、GFAP(1 ∶1 000)、IL1-β抗体(1 ∶1 000)、TNF-α抗体(1 ∶1 000)、IGF-1(1 ∶1 000)、GAPDH(1 ∶2 000),4 ℃摇床孵育过夜后,TBST清洗3次,每次10 min。随后室温孵育HRP标记二抗(1 ∶5 000),TBST清洗3次后,加入ECL发光液显影曝光。用Image J分析各条带灰度值与GAPDH比值以表示蛋白的相对表达量。
1.9 统计学方法采用SPSS26.0统计软件对数据进行统计分析,每项实验至少重复3次。对两组进行比较时,采用LSD-t检验,检验水准α=0.05。
2 结果 2.1 GPER蛋白在视网膜中的表达情况眼球切片免疫荧光结果显示常氧对照组小鼠GPER蛋白在视网膜大量表达,几乎分布于视网膜全层。GPER蛋白在视神经节细胞层(ganglion cell layer,GCL)荧光信号最强,其次为内核层(inner nuclear layer,INL)及外丛状层(outer plexiform layer,OPL),少量表达在内丛状层(inner plexiform layer,IPL)、外核层(outer nuclear layer,ONL)和光感受器内外节层(IS/OS)。在GCL中GPER同星形胶质细胞标志物GFAP共定位。见图 1A~E。
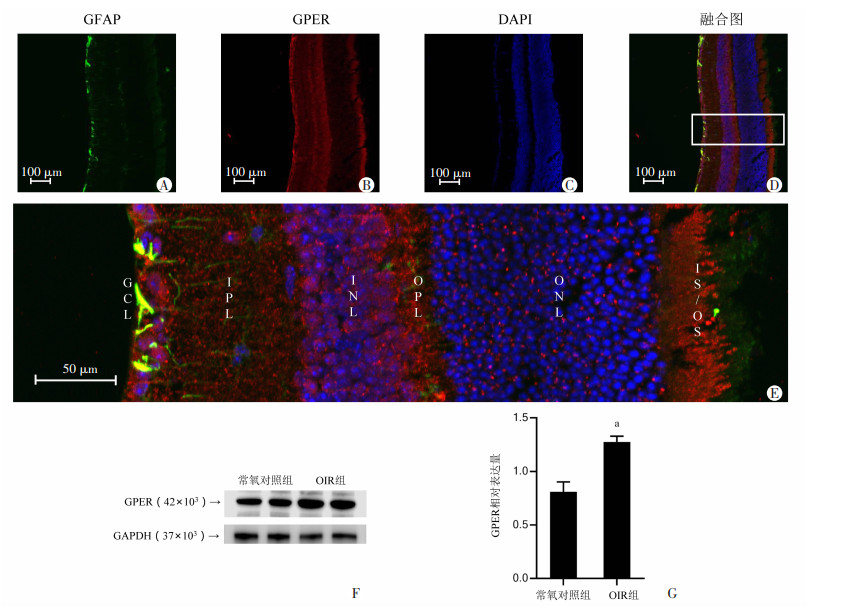
|
| A~D:眼球冰冻切片免疫荧光染色检测视网膜GFAP、GPER分布;E:视网膜免疫荧光染色融合图放大图 GCL:视网膜神经节细胞层,IPL:内丛状层,INL:内核层,OPL:丛状层,ONL:外核层,IS/OS: 光感受器内外节层;F:蛋白免疫印迹法检测常氧对照组及OIR组视网膜GPER表达;G:GFAP相对表达量;a:P < 0.01,与常氧对照组比较 图 1 P17常氧小鼠GPER蛋白在视网膜表达情况 |
蛋白免疫印迹结果显示,GPER蛋白在OIR组显著升高,蛋白表达差异具有统计学意义(P < 0.01)。见图 1F、G。
2.2 OIR模型中视网膜新生血管生成情况对视网膜铺片进行IB4染色,免疫荧光结果显示,与常氧对照组相比,OIR组出现大量杂乱生长的新生血管,并在视网膜中央出现无血管区域。见图 2A~D。
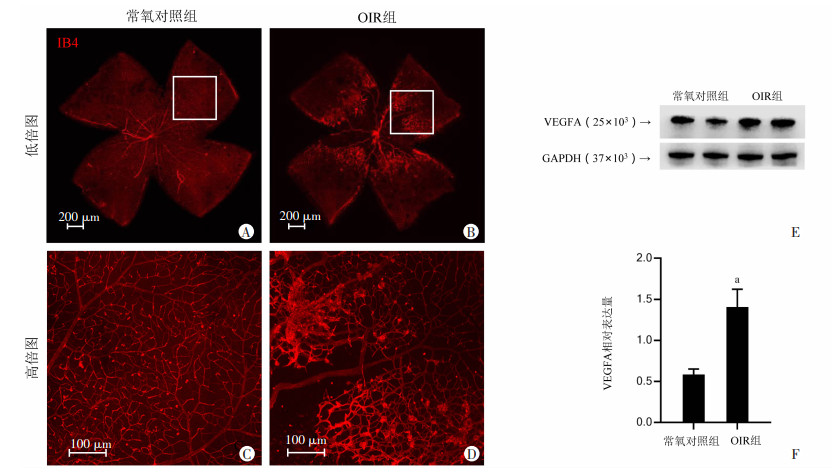
|
| A、B:常氧对照组及OIR组小鼠视网膜IB4免疫荧光染色情况(低倍图);C、D:常氧对照组及OIR组小鼠视网膜IB4免疫荧光染色情况(高倍图);E:蛋白免疫印迹法检测常氧对照组小鼠及OIR组视网膜VEGFA表达情况;F:VEGFA相对表达量;a:P < 0.01,与常氧对照组比较 图 2 OIR小鼠视网膜血管变化情况 |
蛋白免疫印迹结果显示,新生血管高度相关的VEGFA蛋白在OIR组显著升高,蛋白表达差异具有统计学意义(P < 0.01)。见图 2E、F。
2.3 OIR模型中视网膜星形胶质细胞激活情况免疫荧光视网膜铺片结果显示,与常氧对照组相比,OIR组无血管区域及新生血管区域星形胶质细胞标志物GFAP蛋白表达均增加,荧光强度更高,见图 3A~D。
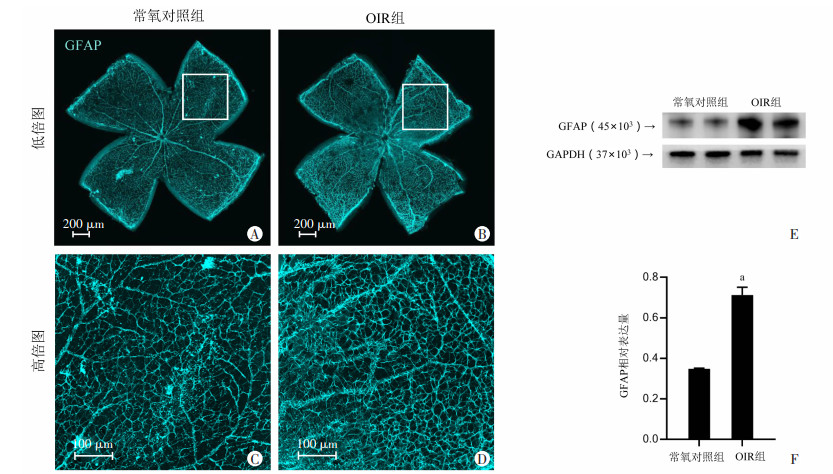
|
| A、B:常氧对照组及OIR组小鼠视网膜GFAP免疫荧光染色情况(低倍图);C、D:常氧对照组及OIR组小鼠视网膜GFAP免疫荧光染色情况(高倍图);E:蛋白免疫印迹法检测常氧对照组及OIR组视网膜GFAP表达;F:GFAP相对表达量;a:P < 0.01,与常氧对照组比较 图 3 OIR小鼠视网膜星形胶质细胞激活情况 |
蛋白免疫印迹结果同样显示,OIR组GFAP蛋白显著升高,蛋白表达差异具有统计学意义(P < 0.01)。见图 3E、F。
2.4 GPER蛋白激活对视网膜新生血管生成的影响小鼠腹腔注射GPER激动剂G-1后,视网膜铺片IB4免疫荧光染色结果显示,G-1组小鼠相较于溶剂对照组小鼠新生血管区域减少,且免疫荧光强度下降。见图 4A~D。
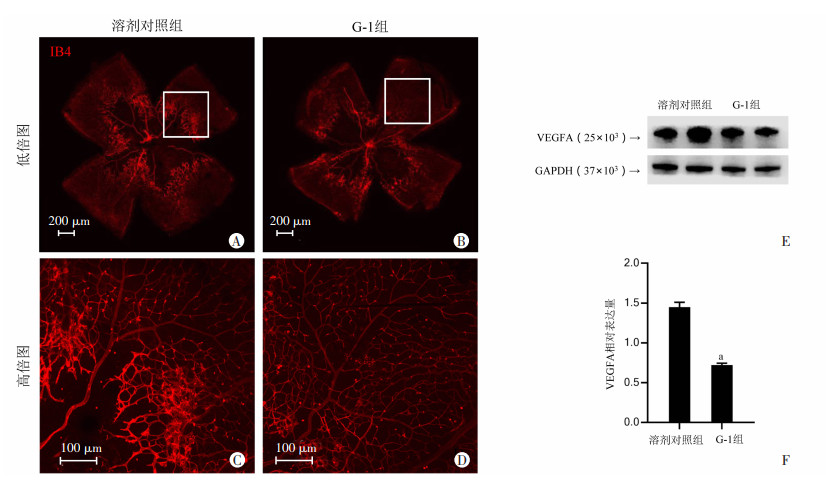
|
|
A、B:溶剂对照组及G-1组小鼠视网膜IB4免疫荧光染色情况(低倍图);C、D:溶剂对照组及G-1组小鼠视网膜IB4免疫荧光染色情况(高倍图);E:蛋白免疫印迹法检测溶剂对照组及G-1组小鼠视网膜VEGFA表达;F:VEGFA相对表达量 a:P < 0.01,与溶剂对照组比较 图 4 GPER蛋白激活对视网膜新生血管生成的影响 |
同免疫荧光结果一致,蛋白免疫印迹结果显示VEGFA蛋白在注射G-1后,蛋白表达量显著下降,差异具有统计学意义(P < 0.01)。见图 4E、F。
2.5 GPER蛋白激活对视网膜星形胶质细胞激活的影响GPER蛋白被G-1激活后,视网膜铺片免疫荧光染色GFAP蛋白结果显示G-1组无血管区域及新生血管区域免疫荧光强度均减弱。见图 5A~D。
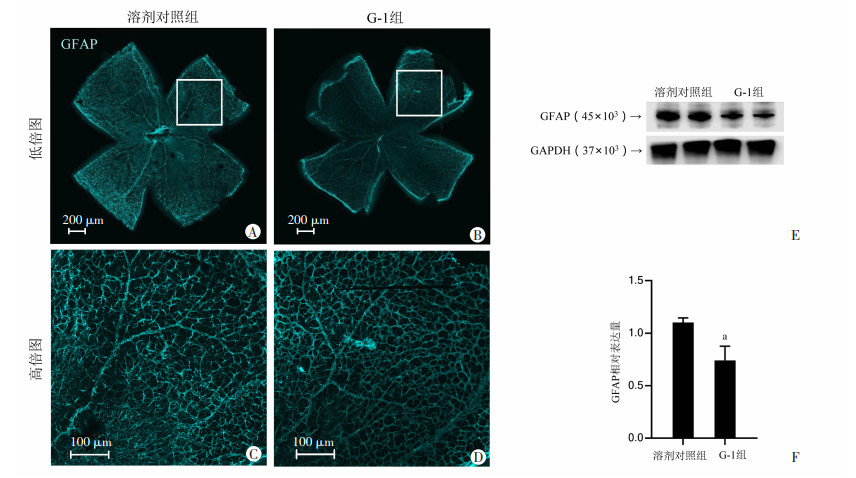
|
| A、B:溶剂对照组及G-1组小鼠视网膜GFAP免疫荧光染色情况(低倍图);C、D:溶剂对照组及G-1组小鼠视网膜GFAP免疫荧光染色情况(高倍图);E:蛋白免疫印迹法检测溶剂对照组及G-1组小鼠视网膜GFAP表达;F:GFAP相对表达量;a:P < 0.05,与溶剂对照组比较 图 5 GPER蛋白激活对视网膜星形胶质细胞激活的影响 |
蛋白免疫印迹结果同免疫荧光结果一致,G-1组星形胶质细胞标志物GFAP蛋白表达显著下降,蛋白表达差异具有统计学意义(P < 0.05)。见图 5E、F。
2.6 GPER蛋白激活对视网膜炎症因子的影响Western blot检测OIR中代表性的炎症因子TNF-α、IGF-1、IL1-β。结果显示G-1组TNF-α、IGF-1及IL-1β蛋白表达均有显著下降,差异具有统计学意义(P < 0.01,P < 0.05)。结果提示GPER的激活同样能引起炎症因子的显著下降。见图 6。
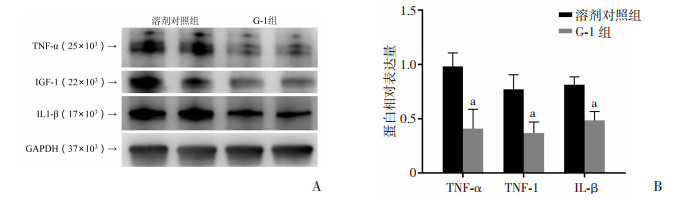
|
| A:蛋白免疫印迹法检测溶剂对照组及G-1组小鼠视网膜TNF-α、IGF-1、IL1-β表达;B:TNF-α、IGF-1、IL1-β相对表达量;a:P < 0.01,b:P < 0.05,与溶剂对照组比较 图 6 GPER蛋白激活对视网膜炎症因子的影响 |
3 讨论
ROP是早产儿中常见的眼部并发症,表现为高氧导致的视网膜血管闭塞和缺氧导致的新生血管异常生成,会导致患者视力严重受损甚至失明[18]。ROP发病的中心环节即为视网膜VEGF和抗VEGF的失衡造成异常新生血管生成,病程中视网膜的炎症水平升高也会促进新生血管的形成[19-21]。例如,TNF-α会诱导内皮细胞凋亡,增加血管通透性及细胞增生[19];IGF-1会促进VEGFA表达增加[20];ILl-β可引起血清蛋白和红细胞向玻璃体内渗漏[21],加重血管内皮细胞损伤。
星形胶质细胞是神经血管单位(neurovascular unit,NVU)的重要组成部分[22-23],在中枢神经系统损伤后,星形胶质细胞会对损伤产生应答,持续激活小胶质细胞,生成炎症因子,不利于损伤修复[9]。同样的,在视网膜内,星形胶质细胞与血管内皮细胞毗邻,是视网膜微环境的主要调节细胞,也是VEGF及炎症因子的主要来源,在视网膜血管生成过程中发挥重要作用[10-11]。研究表明,ROP中星形胶质细胞受低氧刺激后会迅速活化,分泌VEGF及炎症因子,促进异常新生血管生成,而抑制星形胶质细胞的激活能减少新生血管的生成[24]。
OIR模型因其视网膜血管改变与ROP高度相似成为理想的ROP研究手段[25]。本研究选用OIR模型,模拟ROP新生血管的生成,利用视网膜进行免疫荧光染色及蛋白免疫印迹实验,结果提示:OIR组小鼠相较于常氧对照组小鼠,出现了视网膜中央部的缺血区域以及大量杂乱的新生血管生成,且视网膜星形胶质细胞显著激活,这与文献报道一致[3]。
GPER是一种定位于质膜和内质网的跨膜非经典型雌激素受体,与经典雌激素相比,GPER兼顾了治疗潜力同时减弱了激素副作用[26]。研究表明,中枢神经系统中GPER激活能减少星形胶质细胞激活[27-28]。例如在脑缺血模型中,激活GPER可以调节星形胶质细胞的自噬、减少其活化,从而减少IL-6、IL1-β、TNF-α等炎症因子的分泌[15]。也有体外实验显示,在高氧条件下,GPER的激活可以维持星形胶质细胞三磷酸肌醇受体通道(IP3R)转移活性从而影响Ca2+浓度,抑制内质网应激,减少星形胶质细胞活化[29]。然而GPER是否能减少ROP中的星形胶质细胞激活还未见报道。
本研究发现GPER在视网膜中大量表达于GCL层,且与星形胶质细胞标志物GFAP共表达,在OIR小鼠模型中,视网膜GPER蛋白表达增加,提示其参与了OIR小鼠的疾病进程。注射了GPER激动剂G-1的OIR模型小鼠GFAP表达降低且新生血管区域明显减少,说明激活GPER会降低视网膜中星形胶质细胞的活性,抑制了OIR视网膜新生血管的产生。
本研究还检测到VEGFA以及各项炎症因子TNF-α、IGF-1、IL1-β的表达降低,这提示GPER激活后可能通过抑制星形胶质细胞活化,减少VEGFA及炎症因子释放,产生减少视网膜新生血管生成。同时,激活的星形胶质细胞减少还间接降低了小胶质细胞的活化,阻断胶质细胞间的级联反应,从而减少小胶质细胞释放炎症因子[12]。中枢神经系统损伤研究中GPER的激活显著减少星形胶质细胞激活,并减少炎症因子的释放[15],这种神经保护效应是星形胶质细胞及其表达产物直接或间接与神经元的相互作用实现的[9]。而本研究则聚焦在GPER激活后NVU中的星形胶质细胞与血管内皮细胞之间的相互作用,发现其减少了异常新生血管的生成,GPER在小鼠OIR模型中抑制星形胶质细胞活化减少新生血管生成。本研究的结果提示GPER在治疗诸如ROP、糖尿病视网膜病变等新生血管性疾病中可能具有良好的应用前景,而GPER在NVU中的作用机制仍需要进一步探索。
综上所述,本研究结果显示,激活GPER可以减少星形胶质细胞的活化以及VEGFA、炎症因子TNF-α、IGF-1、IL1-β的分泌,显著抑制OIR模型视网膜新生血管的生成,提示GPER可能成为治疗视网膜新生血管性疾病的新靶点。未来研究中我们将进一步深入探索其具体分子机制。
| [1] |
HARTNETT M E, PENN J S. Mechanisms and management of retinopathy of prematurity[J]. N Engl J Med, 2012, 367(26): 2515-2526. |
| [2] |
HANSEN R M, MOSKOWITZ A, AKULA J D, et al. The neural retina in retinopathy of prematurity[J]. Prog Retin Eye Res, 2017, 56: 32-57. |
| [3] |
HARTNETT M E. Pathophysiology and mechanisms of severe retinopathy of prematurity[J]. Ophthalmology, 2015, 122(1): 200-210. |
| [4] |
HELLSTRÖM A, SMITH L E, DAMMANN O. Retinopathy of prematurity[J]. Lancet, 2013, 382(9902): 1445-1457. |
| [5] |
LENG Y X, HUANG W Z, REN G L, et al. The treatment and risk factors of retinopathy of prematurity in neonatal intensive care units[J]. BMC Ophthalmol, 2018, 18(1): 301. |
| [6] |
DUDANI A I, DUDANI AA, DUDANI K, et al. Combination therapy of intravitreal ranibizumab and laser photocoagulation for aggressive posterior retinopathy of prematurity[J]. Indian J Ophthalmol, 2022, 70(2): 703-704. |
| [7] |
BURDA J E, BERNSTEIN A M, SOFRONIEW M V. Astrocyte roles in traumatic brain injury[J]. Exp Neurol, 2016, 275 Pt 3(03): 305-315. |
| [8] |
ENDO F, KASAI A, SOTO J S, et al. Molecular basis of astrocyte diversity and morphology across the CNS in health and disease[J]. Science, 2022, 378(6619): eadc9020. |
| [9] |
LINNERBAUER M, WHEELER M A, QUINTANA F J. Astrocyte crosstalk in CNS inflammation[J]. Neuron, 2020, 108(4): 608-622. |
| [10] |
BUCHER F, STAHL A, AGOSTINI H T, et al. Hyperoxia causes reduced density of retinal astrocytes in the central avascular zone in the mouse model of oxygen-induced retinopathy[J]. Mol Cell Neurosci, 2013, 56: 225-233. |
| [11] |
DORRELL M I, AGUILAR E, JACOBSON R, et al. Maintaining retinal astrocytes normalizes revascularization and prevents vascular pathology associated with oxygen-induced retinopathy[J]. Glia, 2010, 58(1): 43-54. |
| [12] |
LIU L R, LIU J C, BAO J S, et al. Interaction of microglia and astrocytes in the neurovascular unit[J]. Front Immunol, 2020, 11: 1024. |
| [13] |
PUEBLA M, TAPIA P J, ESPINOZA H. Keyrole of astrocytes in postnatal brain and retinal angiogenesis[J]. Int J Mol Sci, 2022, 23(5): 2646. |
| [14] |
VAJARIA R, VASUDEVAN N. Is the membrane estrogen receptor, GPER1, a promiscuous receptor that modulates nuclear estrogen receptor-mediated functions in the brain?[J]. Horm Behav, 2018, 104: 165-172. |
| [15] |
WANG X S, YUE J, HU L N, et al. Activation of G protein-coupled receptor 30 protects neurons by regulating autophagy in astrocytes[J]. Glia, 2020, 68(1): 27-43. |
| [16] |
ZHAO T Z, DING Q, HU J, et al. GPER expressed on microglia mediates the anti-inflammatory effect of estradiol in ischemic stroke[J]. Brain Behav, 2016, 6(4): e00449. |
| [17] |
WANG W W, LEBLANC M E, CHEN X P, et al. Pathogenic role and therapeutic potential of pleiotrophin in mouse models of ocular vascular disease[J]. Angiogenesis, 2017, 20(4): 479-492. |
| [18] |
ZHANG J Q, LIU Z F, WU H Q, et al. Irisin attenuates pathological neovascularization in oxygen-induced retinopathy mice[J]. Invest Ophthalmol Vis Sci, 2022, 63(6): 21. |
| [19] |
YAO Y X, CAI Y J, SUI A L, et al. Etanercept as a TNF-alpha inhibitor depresses experimental retinal neovascularization[J]. Graefes Arch Clin Exp Ophthalmol, 2021, 259(3): 661-671. |
| [20] |
SMITH L E. Pathogenesis of retinopathy of prematurity[J]. Semin Neonatol, 2003, 8(6): 469-473. |
| [21] |
SAYAH D N, ZHOU T E, OMRI S, et al. Novel anti-interleukin-1β therapy preserves retinal integrity: a longitudinal investigation using OCT imaging and automated retinal segmentation in small rodents[J]. Front Pharmacol, 2020, 11: 296. |
| [22] |
GUÉRIT S, FIDAN E, MACAS J, et al. Astrocyte-derived Wnt growth factors are required for endothelial blood-brain barrier maintenance[J]. Prog Neurobiol, 2021, 199: 101937. |
| [23] |
KUGLER E C, GREENWOOD J, MACDONALD R B. The"neuro-glial-vascular" unit: the role of Glia in neurovascular unit formation and dysfunction[J]. Front Cell Dev Biol, 2021, 9: 732820. |
| [24] |
XU Y, LU X, HU Y G, et al. Melatonin attenuated retinal neovascularization and neuroglial dysfunction by inhibition of HIF-1α-VEGF pathway in oxygen-induced retinopathy mice[J]. J Pineal Res, 2018, 64(4): e12473. |
| [25] |
GROSSNIKLAUS H E, KANG S J, BERGLIN L. Animal models ofchoroidal and retinal neovascularization[J]. Prog Retin Eye Res, 2010, 29(6): 500-519. |
| [26] |
ZHANG Z L, QIN P, DENG Y L, et al. The novel estrogenic receptor GPR30 alleviates ischemic injury by inhibiting TLR4-mediated microglial inflammation[J]. J Neuroinflammation, 2018, 15(1): 206. |
| [27] |
GAUDET H M, CHENG S B, CHRISTENSEN E M, et al. The G-protein coupled estrogen receptor, GPER: the inside and inside-out story[J]. Mol Cell Endocrinol, 2015, 418(Pt 3): 207-219. |
| [28] |
ROQUE C, BALTAZAR G. G protein-coupled estrogen receptor 1 (GPER) activation triggers different signaling pathways on neurons andastrocytes[J]. Neural Regen Res, 2019, 14(12): 2069-2070. |
| [29] |
LI R, WANG Y, CHEN P, et al. Inhibiting endoplasmic reticulum stress by activation of G-protein-coupled estrogen receptor to protect retinal astrocytes under hyperoxia[J]. J Biochem Mol Toxicol, 2021, 35(2): e22641. |




