2. 400038 重庆,陆军军医大学(第三军医大学):基础医学院;
3. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院心血管内科,全军心血管病研究所;
4. 400038 重庆,陆军军医大学(第三军医大学):第一附属医院医学大数据与人工智能中心;
5. 400038 重庆,陆军军医大学(第三军医大学):第一附属医院学员管理中心
2. College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Department of Cardiovascular Medicine, Institute of Cardiovascular Diseases of PLA, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037, China;
4. Centre for Medical Big Data and Artificial Intelligence, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038;
5. Student Management Center, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038
糖尿病足溃疡(diabetic foot ulcer, DFU)是糖尿病最常见和最严重的并发症之一,可导致较高的致残率[1]。尽管DFU的发生机制尚未完全阐明,但外周血管病变、下肢神经病变和感染均已被证实是DFU发生发展的核心机制。除了血管内皮细胞自身的保护作用,血液成分中的血小板也被证实对血管内皮功能的保护、血管稳定性和完整性的维持具有重要意义[2]。同时,近期研究还发现血小板具有调节免疫和炎症的作用[3]。然而,血小板也是参与形成血栓的重要组成成分,极易导致患者处于易栓状态。长期的高血糖和胰岛素抵抗状态可导致血管内皮和周细胞损伤,血小板过度活化,使糖尿病患者血小板长期处在血栓形成前状态,这可能加速DFU的形成[4-5]。近期的一项研究指出血液成分中血红蛋白水平与DFU严重程度之间存在明确关联,但具体机制不清,可能与循环炎症相关[6]。
血小板/血红蛋白比值(platelet/hemoglobin, PHR)是反映机体全身炎症状态和氧化应激水平的新型慢性炎症指标。研究表明,PHR不仅与多种心血管疾病的预后密切相关[7-8],还对外周动脉疾病患者的截肢风险具有一定预测价值[9]。然而,PHR与DFU病情严重程度的关系尚不明确。本研究旨在探索PHR与DFU病情严重程度的关系,以期建立新的DFU进展预测模型,提高DFU进展早期识别的准确性和敏感性,及早干预治疗DFU。
1 资料与方法 1.1 研究对象通过陆军军医大学第一附属医院医学大数据与人工智能中心提取2018年3月至2023年3月于陆军军医大学第一附属医院内分泌科住院治疗的DFU患者。2型糖尿病(type 2 diabetes mellitus, T2DM)的诊断按照1999年世界卫生组织(WHO)的标准[10]。参照2019年国际糖尿病足工作组(International Working Group on the Diabetic Foot,IWGDF)发布的指南,糖尿病足定义为与局部神经异常和下肢远端外周血管病变相关的足部感染、溃疡和(或)深层组织破坏[11]。纳入标准:①明确诊断为T2DM和糖尿病足;②Wanger分级≥1级;③年龄>18岁,且<80岁,性别不限;④具有完整的住院病历资料。排除标准:①高血糖高渗状态等急性严重并发症;②恶性肿瘤或精神障碍;③妊娠或哺乳者;④严重肝肾功能不全者,如活动性肝炎、肝硬化、慢性肾功能衰竭。本研究最终纳入符合标准的345例DFU患者为研究对象,其中男性患者246例(71.30%)。多项流行病学调查发现在DFU患者中男性患者显著多于女性患者[12]。因此,该研究可排除人群偏倚对研究结果可能造成的影响。DFU病情严重程度采用Wanger分级标准。根据Wanger分级标准将患者分为轻度溃疡组145例(其中Wanger1级24例,Wanger2级121例)和重度溃疡组200例(其中Wanger3级120例,Wanger4级77例,Wanger5级3例)。同时,依据PHR的四分位数将DFU患者分为4组(Q1:PHR<1.51,Q2:1.51≤PHR<2.04,Q3:2.04≤PHR<2.88,Q4:PHR≥2.88)。本研究经陆军军医大学第一附属医院伦理委员会审核通过[(B) KY2023135],并在国家医学研究登记备案信息系统备案(备案编号:MR-50-23-042040)。
1.2 研究方法提取研究对象的一般人口学资料,包括性别、年龄、体质指数(BMI)、高血压病史、吸烟史、饮酒史。研究对象隔夜禁食8 h以上,于次日清晨空腹抽取静脉血检测空腹血糖(fasting plasma glucose, FPG)、糖化血红蛋白(hemoglobin A1c, HbA1c)等血糖指标;尿酸(uric acid, UA)、估计肾小球滤过率(estimated glomerular filtration rate, eGFR)、肌酐(creatinine, Cr)、尿素(urea)等肾功能指标;谷草转氨酶(aspartate aminotransferase, AST)、球蛋白(globulin, GLB)、丙氨酸氨基转移酶(alanine aminotransferase, ALT)、谷氨酰转移酶(glutamyl transpeptidase,GGT)等肝功能指标;总胆固醇(total cholesterol, TC)、甘油三酯(triacylglycerol, TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)等血脂指标;血红蛋白(hemoglobin, Hb)、血小板计数(platelet count, PLT)、白细胞计数(white blood cell count, WBC)、红细胞计数(red blood cell count, RBC)、淋巴细胞计数(lymphocyte,Lym)、中性粒细胞计数(neutrophil, Neu)、单核细胞计数(monocyte, Mon)等血常规指标,并计算PHR。PHR的计算公式为PHR=PLT/Hb。
1.3 统计学分析采用IBM SPSS Statistics V26.0软件进行统计学分析,MedCalc V20.0.14进行受试者工作特征(ROC)曲线分析。正态分布计量资料以x±s表示,两组间比较采用独立样本t检验;非正态分布计量资料以M(P25, P75)表示,两组间比较采用Mann-Whitney U检验。计数资料用频数(%)表示,组间比较采用χ2检验。将基线资料分析中P<0.1的变量纳入校正Logistic回归分析进一步确定DFU重度溃疡的独立预测因子。根据ROC曲线评价PHR对DFU重度溃疡的预测价值,并计算曲线下面积(AUC)。以P<0.05为差异有统计学意义。
2 结果 2.1 DFU患者轻度溃疡组和重度溃疡组间比较如表 1所示,两组患者在年龄、BMI、吸烟史、饮酒史、高血压史、TG、LDL-C、Urea、UA、Cr、eGFR、GGT、ALT、Lym方面差异无统计学意义;与轻度溃疡组相比,重度溃疡组男性比例、HbA1c、FPG、WBC、PLT、Neu、Mon、PHR显著升高(P<0.05)。此外,重度溃疡组的TC、HDL-C、AST、Hb、RBC均低于轻度溃疡组,差异有统计学意义(P<0.05)。同时,随着PHR四分位数的增加,重度溃疡的患病率显著增加(P<0.01,图 1)。
| 指标 | 总病例(n=345) | 轻度溃疡(n=145) | 重度溃疡(n=200) | P |
| 年龄/岁 | 60.00(52.00, 69.50) | 61.00(54.00, 68.50) | 60.00(52.00, 70.00) | 0.799 |
| 男性 | 246(71.30) | 94(64.83) | 152(76.00) | 0.024 |
| BMI/(kg/m2) | 24.00(22.00, 26.20) | 24.60(22.25, 26.35) | 23.54(21.90, 26.00) | 0.090 |
| 吸烟史 | 179(51.90) | 67(64.21) | 112(56.00) | 0.072 |
| 饮酒史 | 155(44.90) | 62(42.76) | 93(46.50) | 0.490 |
| 高血压 | 206(59.70) | 89(61.38) | 117(58.50) | 0.590 |
| HbA1c/% | 8.90(7.40, 10.90) | 8.70(7.25, 10.20) | 9.10(7.53, 11.45) | 0.010 |
| FPG/(mmol/L) | 8.18(6.12, 12.11) | 7.94(6.03, 10.92) | 8.63(6.24, 13.12) | 0.041 |
| TG/(mmol/L) | 1.38(1.02, 1.90) | 1.36(1.00, 1.99) | 1.41(1.03, 1.84) | 0.493 |
| TC/(mmol/L) | 4.13±1.37 | 4.30±1.22 | 4.00±1.12 | 0.016 |
| HDL-C/(mmol/L) | 0.97(0.80, 1.18) | 1.03(0.88, 1.24) | 0.90(0.74, 1.11) | 0.000 |
| LDL-C/(mmol/L) | 2.65±0.84 | 2.71±0.89 | 2.60±0.81 | 0.212 |
| Cr/(μmol/L) | 78.90(62.25, 108.40) | 75.20(58.35, 107.20) | 80.25(63.85, 108.78) | 0.086 |
| eGFR/[mL/(min·1.73 m2)] | 84.02(59.15, 101.97) | 89.17(60.86, 104.68) | 81.84(58.46, 101.39) | 0.289 |
| UA/(μmol/L) | 325.00(263.00, 413.50) | 326.00(270.82, 416.50) | 323.00(254.50, 410.00) | 0.558 |
| Urea/(mmol/L) | 6.67(5.00, 9.06) | 6.40(4.88, 8.25) | 6.88(5.00, 9.48) | 0.126 |
| AST/(IU/L) | 18.20(14.60, 24.10) | 19.70(15.40, 24.30) | 17.40(14.03, 24.03) | 0.045 |
| GGT/(IU/L) | 28.80(18.50, 49.35) | 58.67(17.10, 48.85) | 30.50(19.93, 50.38) | 0.211 |
| ALT/(IU/L) | 15.90(11.00, 24.30) | 16.30(11.85, 24.80) | 14.95(10.40, 24.00) | 0.204 |
| Hb/(g/L) | 115.00(99.50, 131.00) | 120.00(109.00, 135.50) | 112.00(94.50, 125.00) | <0.001 |
| RBC/(1012/L) | 3.87±0.74 | 4.05±0.74 | 3.74±0.71 | <0.001 |
| WBC/(109/L) | 7.44(5.67, 9.69) | 6.67(5.32, 8.47) | 8.16(6.16, 10.79) | <0.001 |
| PLT/(109/L) | 230.00(173.50, 304.00) | 207.00(162.50, 258.50) | 260.50(190.75, 346.50) | <0.001 |
| Neu/(109/L) | 4.95(3.45, 7.06) | 4.39(3.03, 5.55) | 5.56(4.03, 8.13) | <0.001 |
| Lym/(109/L) | 1.57(1.20, 1.92) | 1.57(1.26, 2.01) | 1.52(1.16, 1.90) | 0.349 |
| Mon/(109/L) | 0.55(0.43, 0.73) | 0.51(0.39, 0.65) | 0.62(0.46, 0.79) | <0.001 |
| PHR | 2.04(1.51, 2.88) | 1.75(1.26, 2.15) | 2.31(1.75, 3.16) | <0.001 |
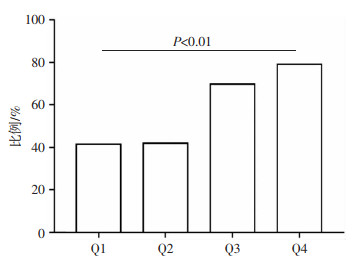
|
| 图 1 不同PHR区间的重度溃疡患者患病率的比较 |
2.2 PHR与DFU严重程度关系的Logistic回归分析结果
依据基线资料分析结果,将所有P<0.1的指标纳入多因素Logistic回归分析,并去除多重共线性因素。结果显示,PHR、男性是DFU患者进展为重度溃疡的独立危险因素(P<0.05),而HDL-C是独立保护因素(P<0.01,表 2)。
| 临床资料 | β | OR | 95%CI | P |
| 男性 | 0.741 | 2.097 | 1.211~3.632 | 0.008 |
| HDL-C | -1.314 | 0.269 | 0.115~0.625 | 0.002 |
| PHR | 0.731 | 2.078 | 1.601~2.698 | <0.001 |
2.3 PHR对DFU严重程度的预测价值
ROC曲线分析显示,PHR预测DFU患者发生重度溃疡的AUC为0.701,95%CI为0.646~0.756,最佳截断值为1.97,敏感度66.50%,特异性68.28%(P<0.01,图 2)。PLT预测DFU患者发生重度溃疡的AUC为0.683,95%CI为0.631~0.732,最佳截断值为311,敏感度33.50%,特异性94.48%。Hb预测DFU患者发生重度溃疡的AUC为0.625,95%CI为0.572~0.677,最佳截断值为108,敏感度45.00%,特异性75.86%。DeLong检验结果显示,只有PHR和Hb的AUC差异具有统计学意义(P=0.005),PHR与PLT的AUC差异及PLT和Hb的AUC差异均无统计学意义。
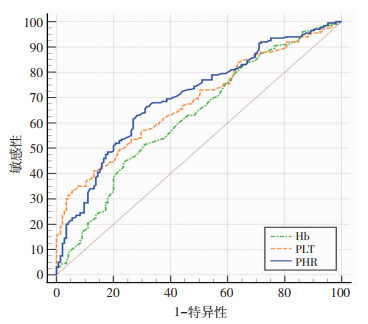
|
| 图 2 ROC曲线分析Hb、PLT、PHR对糖尿病足重度溃疡的预测价值 |
3 讨论
DFU是导致糖尿病足患者住院的主要原因,不仅给个人和社会带来了巨大的经济负担,也严重制约了糖尿病患者的生活和工作。因此加强其早期筛查并及时干预管理,对加速DFU愈合和减少截肢具有重要意义。PHR是反映机体局部或全身炎症状态的一个新指标,其可由简单的血常规分析得出,具有便宜、快速、稳定、高效的特点[8]。本研究发现,PHR与DFU严重程度密切相关,可预测DFU的发生,提示PHR可作为DFU早期筛查的重要指标。
慢性炎症和氧化应激是T2DM的典型病理特征之一[13]。而血小板在炎症和氧化应激的触发与平衡中发挥着重要的调节作用。因此,循环血小板数量和功能的改变可能在T2DM中发挥一定的作用。正常情况下,机体出现伤口时,血小板可通过粘附、聚集、促凝等方式促进伤口愈合[14]。而T2DM患者体内的血小板却存在着不同程度的功能障碍,主要表现为对前列腺素和一氧化氮的敏感性降低;从而激活血管损伤部位的血小板活性与凝聚性,导致凝血增加、纤维蛋白溶解受损和血管内皮功能障碍,加重下肢血管病变,最终加剧了DFU的发生和发展[4, 15]。同时,DFU的加重将促使活化的血小板释放炎症介质,招募包括淋巴细胞、单核细胞在内的多种免疫细胞并与之相互作用从而加速促炎细胞因子释放,再次加重血管损伤和全身炎症[5, 14]。与此一致的是,基线资料分析显示,重度溃疡组的WBC、Neu、Mon明显高于轻度溃疡组,这表明重度溃疡组存在更严重的全身炎症反应。
氧化应激也是糖尿病发生发展的重要机制之一。研究已证实糖尿病患者氧化应激水平显著高于健康人群,主要表现之一是糖尿病患者血小板生成的活性氧簇(ROS)明显高于健康人群[16]。可能的原因是:①活化的血小板促进ROS的产生,引起或加重氧化应激。血小板不仅可以通过NOX1/2信号产生ROS,还可以通过与包括红细胞、内皮细胞、成纤维细胞等在内的其他产生ROS的细胞相互作用,促进ROS的生成,增强氧化应激,加速糖尿病血管损伤的进程[17]。②氧化应激反馈作用于血小板,进一步活化血小板。过量的ROS可通过改变血小板内信号导致血小板过度活化[17]。特别是在T2DM中,过量的ROS使细胞内钙稳态进一步破坏,血小板膜糖蛋白GPⅡb-Ⅲa激活,导致了血小板的高反应性和高聚集性[18]。③体内抗氧化能力与自由基水平不平衡。ROS的过量产生超过了人体的抗氧化能力,损害了氧化还原稳态并增加氧化应激。临床研究揭示,T2DM患者的超氧化物歧化酶和过氧化氢酶活性降低,谷胱甘肽过氧化物酶活性增强,其抗氧化能力下降[19-20]。外源性引入抗氧化剂可显著提高血小板的抗氧化应激能力,阻止血小板活化与聚集[21]。
血液成分中,除了血小板在炎症氧化应激等病理生理状态下发挥重要作用外,Hb也可以在不同病理和生理状态下发挥相应的作用。Hb具有携带和运输氧气功能,是人体内最重要的蛋白质之一[22]。而循环低水平的Hb可导致HbA1c虚假性降低,从而影响对T2DM患者的临床决策并延误救治,增加DFU的患病风险[23]。据报道,在DFU患者中贫血的患病率高达51.9%~85.3%[24]。因此,Hb水平与DFU的关系亟需进一步的临床证据。本研究发现重度溃疡组Hb水平明显低于轻度溃疡组。推测低Hb与DFU相关性的机制可能是:①低Hb水平导致病变部位的营养和氧缺乏,影响免疫调节能力而最终加重感染和炎症[25];②低Hb浓度导致病变部位低氧诱导因子和促愈合因子合成减少,使溃疡愈合延迟或不愈合[26];③Hb浓度过低,加重病变部位的神经损伤,从而促进DFU转变为重度溃疡[27]。
然而,血小板和Hb均极易受药物、感染、创伤等各种外在因素的影响而出现波动,仅凭单一指标难以客观地评价全身炎症和氧化应激水平。相反,除了血液病等特殊情况外,PHR具有相对较高的稳定性,可稳定地反映机体的全身炎症和氧化应激状态[8]。既往大量临床研究表明,PHR可将成为肺栓塞、外周动脉疾病、冠心病等疾病辅助诊断和预后判断的重要生物标志物[7-9, 28]。本研究发现PHR与DFU进展为重度溃疡显著相关,可以预测重度溃疡的发生。我们推测PHR与DFU进展相关的潜在机制是:DFU患者多数存在贫血,其Hb水平较低。低Hb水平可通过代偿性增加循环血量,人为地促进血小板聚集。同时,低Hb水平常与炎症并存,大量的炎性细胞因子可直接增加血小板反应性。高反应性、高聚集性的血小板大量堆积将进一步加重机体炎症和氧化应激,从而加重DFU。
此外,前期研究已证实男性、吸烟、血糖控制不佳、血脂异常等因素与DFU病情进展密切相关[12, 29]。流行病学研究发现在DFU人群中男性患者显著多于女性患者。可能的原因在于男性吸烟等不良生活方式更多。本研究结果也显示重度溃疡组中吸烟患者的比例高于轻度溃疡组。长期大量的吸烟可引起周围血管收缩、血运受阻,易损害血管内皮系统的稳定性,增加下肢血管闭塞或硬化性病变的风险。同时,吸烟不仅可以通过损害胰岛β细胞破坏机体血糖控制稳态,还可以通过胰岛素抵抗干扰脂质代谢造成血脂紊乱[30-31]。本研究也证实了与轻度溃疡组相比,重度溃疡组HbA1c、FPG显著升高,而HDL-C、TC显著降低。众所周知,血脂异常也是T2DM的主要病理生理改变,二者是代谢综合征的基本组成[32]。T2DM患者脂代谢异常的主要特点之一是HDL-C浓度降低[33]。HDL-C是传统的保护性脂蛋白,具有抗炎、抗氧化、抗凋亡的功能,可抑制TC在血管壁的沉积[34]。特别地,HDL-C还具有抗血小板作用。研究证实HDL-C可以与血小板表面的B类清道夫受体SR-BI相互作用,促进NO的生成,抑制血小板的过度活化与凝集[35]。并且,HDL-C还可通过降低氧化应激水平间接地影响血小板功能[36],低水平的HDL-C已被确定为DFU发展的独立危险因素[37-38]。可能的原因是低水平的HDL-C增加了糖尿病周围神经病变和外周动脉疾病的风险,从而加速溃疡进展[39-40]。这提示我们对T2DM患者血脂的管理也可有效降低多种并发症的发生风险,有助于改善患者预后。
本研究不足之处:①本研究为单中心横断面研究,样本量较小,可能存在一定的偏倚,尚无法确立因果关系,需进一步开展大样本、多中心、前瞻性研究来证实结论;②本研究未纳入超敏C反应蛋白、白细胞介素1等经典的炎症标志物,将在后续研究纳入此类炎症指标,以明确炎症与DFU的关系;③研究对象的随访工作困难,尚无法评价PHR与DFU患者预后的关系;后续需要开展前瞻性队列研究评价DFU预后与PHR的关系。
综上所述,PHR与DFU的严重程度紧密相关。PHR、男性以及HDL-C是发生重度DFU的独立预测因子,对其具有一定的预测价值,可能作为DFU预后评价的指标。这提示我们在临床实践中,应重视动态监测PHR。
| [1] |
ARMSTRONG D G, TAN T W, BOULTON A J M, et al. Diabetic foot ulcers: a review[J]. JAMA, 2023, 330(1): 62-75. |
| [2] |
XU X R, ZHANG D, OSWALD B E, et al. Platelets are versatile cells: new discoveries in hemostasis, thrombosis, immune responses, tumor metastasis and beyond[J]. Crit Rev Clin Lab Sci, 2016, 53(6): 409-430. |
| [3] |
KOUPENOVA M, CLANCY L, CORKREY H A, et al. Circulating platelets as mediators of immunity, inflammation, and thrombosis[J]. Circ Res, 2018, 122(2): 337-351. |
| [4] |
KAUR R, KAUR M, SINGH J. Endothelial dysfunction and platelet hyperactivity in type 2 diabetes mellitus: molecular insights and therapeutic strategies[J]. Cardiovasc Diabetol, 2018, 17(1): 121. |
| [5] |
JOHNY E, BHASKAR P, ALAM M J, et al. Platelet mediated inflammation in coronary artery disease with type 2 diabetes patients[J]. J Inflamm Res, 2021, 14: 5131-5147. |
| [6] |
YAMMINE K, HAYEK F, ASSI C. Is there an association between anemia and diabetic foot ulcers? A systematic review and meta-analysis[J]. Wound Repair Regen, 2021, 29(3): 432-442. |
| [7] |
ZHENG Y Y, WU T T, CHEN Y, et al. Platelet-to-hemoglobin ratio as a novel predictor of long-term adverse outcomes in patients after percutaneous coronary intervention: a retrospective cohort study[J]. Eur J Prev Cardiol, 2020, 27(19): 2216-2219. |
| [8] |
BAO K M, HUANG H Z, HUANG G Y, et al. Platelet-to-hemoglobin ratio as a valuable predictor of long-term all-cause mortality in coronary artery disease patients with congestive heart failure[J]. BMC Cardiovasc Disord, 2021, 21(1): 618. |
| [9] |
OZBEYAZ N B, GOKALP G, ALGUL E, et al. Platelet-hemoglobin ratio predicts amputation in patients with below-knee peripheral arterial disease[J]. BMC Cardiovasc Disord, 2022, 22(1): 337. |
| [10] |
ALBERTI K G, ZIMMET P Z. Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1: diagnosis and classification of diabetes mellitus provisional report of a WHO consultation[J]. Diabet Med, 1998, 15(7): 539-553. |
| [11] |
SCHAPER N C, VAN NETTEN J J, APELQVIST J, et al. Practical guidelines on the prevention and management of diabetic foot disease (IWGDF 2019 update)[J]. Diabetes Metab Res Rev, 2020, 36(Suppl 1): e3266. |
| [12] |
ZHANG P Z, LU J, JING Y L, et al. Global epidemiology of diabetic foot ulceration: a systematic review and meta-analysis[J]. Ann Med, 2017, 49(2): 106-116. |
| [13] |
REHMAN K, AKASH M S H. Mechanism of generation of oxidative stress and pathophysiology of type 2 diabetes mellitus: how are they interlinked?[J]. J Cell Biochem, 2017, 118(11): 3577-3585. |
| [14] |
SCOPELLITI F, CATTANI C, DIMARTINO V, et al. Platelet derivatives and the immunomodulation of wound healing[J]. Int J Mol Sci, 2022, 23(15): 8370. |
| [15] |
VINIK A I, ERBAS T, PARK T S, et al. Platelet dysfunction in type 2 diabetes[J]. Diabetes Care, 2001, 24(8): 1476-1485. |
| [16] |
PANENI F, BECKMAN J A, CREAGER M A, et al. Diabetes and vascular disease: pathophysiology, clinical consequences, and medical therapy: part Ⅰ[J]. Eur Heart J, 2013, 34(31): 2436-2443. |
| [17] |
MASSELLI E, POZZI G, VACCAREZZA M, et al. ROS in platelet biology: functional aspects and methodological insights[J]. Int J Mol Sci, 2020, 21(14): 4866. |
| [18] |
JANG J Y, MIN J H, CHAE Y H, et al. Reactive oxygen species play a critical role in collagen-induced platelet activation via SHP-2 oxidation[J]. Antioxid Redox Signal, 2014, 20(16): 2528-2540. |
| [19] |
BANERJEE M, VATS P. Reactive metabolites and antioxidant gene polymorphisms in type 2 diabetes mellitus[J]. Redox Biol, 2014, 2: 170-177. |
| [20] |
PROMYOS N, PHIENLUPHON P P, WECHJAKWEN N, et al. Inverse correlation of superoxide dismutase and catalase with type 2 diabetes among rural Thais[J]. Nutrients, 2023, 15(9): 2071. |
| [21] |
BEGONJA A J, GAMBARYAN S, GEIGER J, et al. Platelet NAD(P)H-oxidase-generated ROS production regulates alphaⅡbbeta3-integrin activation independent of the NO/cGMP pathway[J]. Blood, 2005, 106(8): 2757-2760. |
| [22] |
GIARDINA B. Hemoglobin: multiple molecular interactions and multiple functions. An example of energy optimization and global molecular organization[J]. Mol Aspects Med, 2022, 84: 101040. |
| [23] |
KAIAFA G, VENETI S, POLYCHRONOPOULOS G, et al. Is HbA1c an ideal biomarker of well-controlled diabetes?[J]. Postgrad Med J, 2021, 97(1148): 380-383. |
| [24] |
SHAREEF A M, AHMEDANI M Y, WARIS N. Strong association of anemia in people with diabetic foot ulcers (DFUs): study from a specialist foot care center[J]. Pak J Med Sci, 2019, 35(5): 1216-1220. |
| [25] |
SAHAY M, KALRA S, BADANI R, et al. Diabetes and anemia: International Diabetes Federation (IDF)—Southeast Asian Region (SEAR) position statement[J]. Diabetes Metab Syndr, 2017, 11(Suppl 2): S685-S695. |
| [26] |
HONG W X, HU M S, ESQUIVEL M, et al. The role of hypoxia-inducible factor in wound healing[J]. Adv Wound Care, 2014, 3(5): 390-399. |
| [27] |
WU F, JING Y Y, TANG X J, et al. Anemia: an independent risk factor of diabetic peripheral neuropathy in type 2 diabetic patients[J]. Acta Diabetol, 2017, 54(10): 925-931. |
| [28] |
OZBEYAZ N B, GOKALP G, GEZER A E, et al. Novel marker for predicting the severity and prognosis of acute pulmonary embolism: platelet-to-hemoglobin ratio[J]. Biomark Med, 2022, 16(12): 915-924. |
| [29] |
YIN K L, QIAO T C, ZHANG Y K, et al. Unraveling shared risk factors for diabetic foot ulcer: a comprehensive Mendelian randomization analysis[J]. BMJ Open Diabetes Res Care, 2023, 11(6): e003523. |
| [30] |
REHMAN K, HAIDER K, AKASH M S H. Cigarette smoking and nicotine exposure contributes for aberrant insulin signaling and cardiometabolic disorders[J]. Eur J Pharmacol, 2021, 909: 174410. |
| [31] |
CAMPAGNA D, ALAMO A, PINO A D, et al. Smoking and diabetes: dangerous liaisons and confusing relationships[J]. Diabetol Metab Syndr, 2019, 11: 85. |
| [32] |
DESPRÉS J P, LEMIEUX I. Abdominal obesity and metabolic syndrome[J]. Nature, 2006, 444(7121): 881-887. |
| [33] |
YOUSRI N A, SUHRE K, YASSIN E, et al. Metabolic and metabo-clinical signatures of type 2 diabetes, obesity, retinopathy, and dyslipidemia[J]. Diabetes, 2022, 71(2): 184-205. |
| [34] |
WONG N K P, NICHOLLS S J, TAN J T M, et al. The role of high-density lipoproteins in diabetes and its vascular complications[J]. Int J Mol Sci, 2018, 19(6): 1680. |
| [35] |
VAN DER STOEP M, KORPORAAL S J A, VAN ECK M. High-density lipoprotein as a modulator of platelet and coagulation responses[J]. Cardiovasc Res, 2014, 103(3): 362-371. |
| [36] |
ROBERT J, OSTO E, VON ECKARDSTEIN A. The endothelium is both a target and a barrier of HDL's protective functions[J]. Cells, 2021, 10(5): 1041. |
| [37] |
IKURA K, HANAI K, SHINJYO T, et al. HDL cholesterol as a predictor for the incidence of lower extremity amputation and wound-related death in patients with diabetic foot ulcers[J]. Atherosclerosis, 2015, 239(2): 465-469. |
| [38] |
CHEN L H, MA W X, CHEN D W, et al. Association of high-density lipoprotein cholesterol and wound healing in patients with diabetic foot ulcers[J]. Chin Med J, 2022, 135(1): 110-112. |
| [39] |
DE MACEDO RIBEIRO F R C, RIBEIRO C H M A, TAVONI T M, et al. Disturbances of the transfer of cholesterol to high-density lipoprotein (HDL) in patients with peripheral artery disease with or without type 2 diabetes mellitus[J]. Vasc Med, 2021, 26(6): 602-607. |
| [40] |
PAI Y W, LIN C H, LEE I T, et al. Prevalence and biochemical risk factors of diabetic peripheral neuropathy with or without neuropathic pain in Taiwanese adults with type 2 diabetes mellitus[J]. Diabetes Metab Syndr, 2018, 12(2): 111-116. |




