2. 400038 重庆,陆军军医大学(第三军医大学):第一附属医院生殖科;
3. 650032 昆明,昆明医科大学第一附属医院器官移植中心
2. Department of Reproductive Medicine, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Organ Transplantation Center, First Affiliated Hospital of Kunming Medical University, Kunming, Yunnan Province, 650032, China
胸腺是T细胞发育成熟的中枢免疫器官,胸腺上皮细胞、成纤维细胞、树突状细胞和周细胞等间质细胞构成胸腺微环境,其中胸腺上皮细胞为胸腺细胞增殖分化、阳性选择和阴性选择提供信号,对维持胸腺微环境以及功能正常运作尤为重要[1]。胸腺微环境在年龄增长过程中,特别是青春期伊始,逐渐发生结构破坏和萎缩,并被脂肪组织填充。此外,急性感染、放化疗、压力应激、不良生活和饮食习惯、多次妊娠等因素,都可诱导胸腺加速衰退[2]。在病生理因素共同作用下,以胸腺上皮细胞为主的胸腺微环境遭到破坏,依赖胸腺微环境信号的胸腺细胞发育成熟受阻,导致胸腺输出下降,自身反应性T细胞异常释放到外周,扰乱外周T细胞亚群构成,使得免疫监视、防御和自稳能力大幅下降,癌症、感染性疾病和自身免疫性疾病发病率升高[3]。在当前人口老龄化加剧的形势下,胸腺功能衰退导致的免疫力失衡是亟需解决的公共卫生问题。
胰岛素样生长因子结合蛋白5(Insulin Like Growth Factor-Binding Protein 5, IGFBP5)是胰岛素样生长因子结合蛋白家族成员中进化最为保守的成员[4],该家族成员具有保守的胰岛素样生长因子结合结构域和甲状腺球蛋白1型结构域。作为一种分泌型蛋白,IGFBP5通过与循环及组织局部胰岛素样生长因子1(Insulin-like Growth Factor1, IGF1)结合,以器官和时空特异性的冗杂表达方式,精细调控IGF1生物利用度和下游生长信号强度[5]。除外,既往研究还发现IGFBP5能通过与受体酪氨酸激酶样孤儿受体1 (Receptor Tyrosine Kinase-like Orphan Receptor 1, ROR1)/ 人表皮生长因子受体2(Human Epidermal Growth Factor Receptor 2, HER2) [6]等核受体结合,或以核定位依赖的方式调控细胞生命活动[7]。
线粒体自噬是一种重要的线粒体质量控制机制,通常在线粒体氧化应激和和线粒体DNA突变负荷过大的情况下被激活[8]。线粒体自噬利用微管相关蛋白1B(Microtubule Associated Protein 1 Light Chain 3 Beta, LC3B)依赖的巨自噬体形成,通过PTEN诱导激酶1(Pten Induced Kinase 1, PINK1)/ Parkin泛素蛋白连接酶(Parkin Rbr E3 Ubiquitin Protein Ligase, Parkin)通路依赖的泛素化途径或BCL2互作蛋白3(BCL2 Interacting Protein 3, BNIP3)、BNIP3样蛋白(BCL2 Interacting Protein 3 Like, BNIP3L)和FUN14结构域包含1(FUN14 Domain Containing 1, FUNDC1)等线粒体自噬受体蛋白依赖的非泛素化途径介导线粒体自噬的发生[9]。细胞和机体衰老过程常伴随线粒体功能障碍的发生,线粒体自噬能够及时清除受损线粒体,防止与线粒体功能障碍相关的阿尔茨海默病,帕金森病、心血管疾病和免疫功能障碍的发生[10-12],但过度的线粒体自噬也会导致细胞供能障碍和细胞凋亡的发生[8]。
有文献报道,在小鼠中观察到IGFBP5在胸腺中随年龄增长表达升高的现象[13],但研究涉及的年龄跨度短,物种受限,且作用机制及生理意义均未阐明。因此,本文拟在人类和小鼠胸腺中进行长年龄跨度的研究,探索IGFBP5表达升高对胸腺上皮细胞线粒体自噬水平及命运的影响,增加对增龄性胸腺衰退成因的理解,并提供潜在干预手段。
1 材料与方法 1.1 主要材料C57/BL6小鼠购自恩斯维尔生物技术有限公司。DAB显色试剂盒(ZLI-9018)购自北京中杉金桥生物技术有限公司;反转录试剂盒(RK20429)购自武汉爱博泰克生物技术有限公司;qPCR试剂盒(HY-K0501)购自美国MedChemExpress公司;ELISA试剂盒(JL25239-96T)购自江莱生物科技有限公司;线粒体抽提试剂盒(KTP4003)购自亚科因生物技术有限公司;细胞凋亡检测试剂盒(C1069S)购自碧云天生物技术有限公司;Hoechst 33342染液(H3570)购自赛默飞世尔科技公司;IGFBP5过表达质粒由重庆优宝生物技术公司构建(载体为pcDNA3.1,插入片段IGFBP5来自小鼠IGFBP5转录本cDNA,蛋白羧基端连接3×flag蛋白标签,启动子为CMV,携带原核抗性为氨苄霉素,真核抗性为遗传霉素)。
PINK1抗体(6946T)、Parkin抗体(32833S)、P62抗体(23214T)、COX Ⅳ抗体(38563S)、Caspase3抗体(9662S)、Cleaved-Caspase3(9661S)抗体购自美国Cell Signaling Technology公司;IGFBP5抗体(Ab254324)、LC3B抗体(Ab192890)购自英国Abcam公司;HRP标记的兔二抗(AS038)、488偶联的兔二(AS053)抗购自武汉爱博泰克生物技术有限公司;α-Tubulin抗体(AG0126)购自碧云天生物技术有限公司;BNIP3抗体(68091-1-Ig)购自武汉三鹰生物技术有限公司。
1.2 人胸腺单细胞数据获取和分析从GEO数据库中获取GSE147520数据集,使用Seurat包降维聚类,SCT标准化去批次,按照原文中标记基因注释细胞群(使用EPCAM/KRT8作为胸腺上皮细胞标志基因,PDGFRA/LUM/LAMA2作为间充质细胞标志基因,PDGFRB/MCAM/CSPG4作为周细胞标志基因,PECAM1/VEGFC/GJA4作为血管内皮标志基因,PECAM1/ACKR1/SELE/APLNR作为血管静脉内皮基因标志,LYVE1/PROX1/CCL21作为淋巴管内皮细胞标志基因,GYPA/HBA1/HBG1作为红细胞标志基因,PTPRC/CD3D/CD7作为免疫细胞标记基因,MSLN/UPK3B/PRG4作为间皮细胞标记基因,将细胞无监督聚类分为13群)[14],提取EPCAM阳性和KRT8阳性代表的胸腺上皮细胞亚群;使用FindMarkers函数对25岁样本和6天样本胸腺上皮细胞表达基因进行差异分析,ggplot2[15]绘制火山图展示差异分析结果。使用Seurat包中RidgePlot绘制山峦图、FeaturePlot绘制基因表达散点图,展示IGFBP5表达水平在6 d、10月和25岁样本胸腺上皮细胞中的差异(出生前样本因获取细胞数量较少,且非关注重点,未予以展示)[16]。使用AverageExpression函数获取产前及产后各年龄点胸腺上皮细胞样本中基因表达平均值,趋势分析R包Mfuzz[17]以非监督聚类方式将基因按照随年龄增长变化趋势自动划分为10群,对IGFBP5所在的随年龄增长而上调的第四群基因进行GO富集分析[18],富集分析结果使用ggplot2绘制柱状图进行可视化。
1.3 人与小鼠IGFBP5蛋白序列同源性比对和组织器官分布比较从uniprot网站(UniProt)获取人鼠IGFBP5蛋白序列,去除信号肽后,将FASTA格式蛋白序列输入CLUSTALW网站[Multiple Sequence Alignment-CLUSTALW (genome.jp)]进行蛋白序列比对,下载生成的clustalw.aln文件,在ESPript3网站[ESPript 3(ibcp.fr)]中输入上述文件,使用aligned sequences工具生成序列比对图。
从NIH gene数据库[National Center for Biotechnology Information(nih.gov)]获取人(RNA sequencing of total RNA from 20 human tissues)鼠(Mouse ENCODE transcriptome data)IGFBP5转录本组织器官表达丰度数据,绘制条形图展示IGFBP5组织器官表达水平。
1.4 小鼠胸腺石蜡切片免疫组化获取体质量28~33 g的8周龄、18月龄雄性C57小鼠,乙醚麻醉后脱颈处死,取出胸腺组织后,投入4%多聚甲醛固定48 h,梯度脱水、透明、浸蜡、包埋制作石蜡切片。石蜡切片烤片后梯度脱蜡,复水,柠檬酸钠抗原修复液微波修复抗原后,PBS缓冲液洗涤3次,0.1% TritonX-100室温通透样品15 min,3%双氧水室温封闭30 min,PBS缓冲液洗涤3次,5%山羊血清室温封闭1 h后,吸水纸吸尽血清,滴加1 ∶100稀释的IGFBP5抗体,4 ℃孵育过夜。取出切片,室温平衡45 min,PBS-T缓冲液洗涤三次,滴加1 ∶200稀释的HRP标记的兔二抗,37 ℃孵育1 h,PBS-T缓冲液洗涤三次。配制DAB显色液,滴加于切片上,显微镜下观察到阳性反应后投入蒸馏水中,停止显色反应。苏木素复染切片2 min,自来水下冲洗切片45 min反蓝,梯度脱水,中性树胶封片,使用PreciPoint M8显微扫描仪获取免疫组化图形。使用ViewPoint BETA v0.8.2.7软件截取并分析图片,计数视野下IGFBP5阳性细胞数量。
1.5 IGFBP5过表达鼠胸腺上皮细胞系构建和鉴定永生化的小鼠胸腺上皮细胞系(iTECs)由浙江中医药大学高建莉教授惠赠[19]。配制含10%胎牛血清,链霉素100 mg /L和青霉素100 kU/L的DMDM培养基(DMEM完全培养基)。将0.5×107细胞接种于预铺12 mL DMEM完全培养基10 cm培养皿中,置于5% CO2、饱和湿度、37 ℃培养箱培养至细胞70%~90%汇合度时,更换为opti-MEM减血清培养基,使用Lipofectamine 3000转染15 ng质粒到培养皿中,继续培养24 h后,更换为含有500 μg/mL遗传霉素的DMEM完全培养基进行稳转细胞筛选,每2~4天更换含遗传霉素的培养基,待无漂浮细胞后,更换为含有100 μg /mL遗传霉素筛选的DMEM完全培养基维持培养。将空载质粒转染和IGFBP5过表达的iTECs按照1×106细胞每孔分别接种于6孔板,置于细胞培养箱培养12 h后,收集细胞培养液,经4 ℃ 400×g离心5 min后,吸取上清到新的1.5 mL ep管中,-80 ℃冻存。使用trizol法提取细胞RNA,依据试剂盒说明书使用一步法反转录获得cDNA作为qPCR模版,使用qPCR反应试剂盒和相应引物进行qPCR反应。所用引物:IGFBP5(正向引物:AGAAGGAGGCAGCAGAG-AACAC;反向引物:GCACAGAGAGGATGAGGATGGG),β-actin(正向引物: GGCTGTATTCCCCTCCATCG;反向引物: CCAGTTGGTAACAATGCCATGT)。细胞培养液经4倍稀释后,依据说明书进行IGFBP5分泌水平的ELISA检测实验。
1.6 细胞透射电镜将对数生长期的空载质粒转染和IGFBP5过表达的iTECs经0.25%胰酶消化后,300×g离心5 min弃上清,PBS洗涤2次,加入20倍细胞体积的0.5%戊二醛固定液,重悬细胞,冰上固定5 min,转移至1.5 mL ep管中,16 200×g离心10 min,弃上清,沿管壁缓慢加入3%戊二醛固定液,4 ℃保存。制样结束后分别于细胞、亚细胞辨析度下拍摄电镜照片,观察线粒体形态,计数代表性细胞中线粒体自噬体数量。
1.7 线粒体和全细胞组分蛋白免疫印迹分别取6孔板中对数生长期的空载质粒转染和IGFBP5过表达的iTECs,弃培养基,PBS润洗,每孔加入200 μL含蛋白酶抑制剂的RIPA细胞裂解液,冰上吹打裂解10 min,4 ℃,16 200×g离心5 min,取上清,BCA法检测的蛋白浓度后加入6×蛋白上样缓冲液,95 ℃金属浴煮10 min。线粒体组分的抽提依据厂家试剂盒说明书进行,抽提后的线粒体蛋白制备方法同细胞组分。使用4%~20% SDS-page预制浓缩分离胶,将线粒体裂解液和全细胞裂解液按照每孔30 μg每孔上样,120 V电泳40 min直至蛋白分离,经ThermoFisher半干转系统1.3A转印12 min,将蛋白转印到0.22 μm PVDF膜。室温封闭1 h后,加入1 ∶1 000稀释的目的蛋白一抗(内参1 ∶5 000稀释),4 ℃孵育过夜,TBST洗膜5次,加入1 ∶10 000稀释HRP标记的二抗,室温孵育1 h,TBST洗膜6次,ECL发光液显影并保存图像。
1.8 细胞免疫荧光分别将空载质粒转染和IGFBP5过表达的iTECs以2×104细胞/mL密度铺于放置了14 mm细胞爬片的24孔培养皿中,待其贴壁后,弃去上清,加入含100 nmol/L线粒体探针的DMEM完全培养基,细胞培养箱中孵育25 min后弃去培养基,PBS漂洗2次,每孔加入400 μL 4%多聚甲醛,室温固定15 min,PBS漂洗三次,每孔加入200 μL 0.2%triton X-100通透15 min,PBS漂洗三次。5%山羊血清室温封闭1 h,吸尽血清,加入1 ∶200稀释的一抗,4 ℃孵育过夜,PBS漂洗三次,加入1 ∶400~1 ∶800稀释的相应种属荧光二抗,37 ℃孵育1 h,0.05%PBST漂洗三次后,蒸馏水润洗,滴加含DAPI的防猝灭封片剂封片,使用荧光正置显微镜100×油镜观察拍照。
1.9 流式细胞术分别将空载质粒转染和IGFBP5过表达的iTECs以2×105细胞每孔铺于6孔培养皿中,培养至细胞汇合度为70%~80%时,分别收集细胞培养液至15 mL ep管中,0.25%无EDTA胰酶消化细胞并收集到ep管中。每管计数1×105细胞转移到1.5mL新ep管中,每组收集6管,400×g离心5 min,弃上清,PBS洗涤一次,400×g离心5 min,200 μL AnnexinⅤ-mcherry binding buffer重悬细胞,每管加入5 μL AnnexinⅤ-mcherry染液,冰上染色15 min后,加入100 μg/mL hoechst 33342染色5 min,补充200 μL Annexin Ⅴ binding buffer,转移至流式管中进行细胞凋亡检测。使用FlowJo_v10.8.1分析流式结果。
1.10 计学分析使用GraphPad Prism 9.4.0统计绘图软件分析数据绘制图片,两组间比较使用t检验进行,检验标准α=0.05。
2 结果 2.1 IGFBP5是人胸腺上皮细胞中随年龄增长上调最显著的基因,与IGFBP5共趋势的基因集显著富集线粒体功能为寻找与增龄性胸腺退化相关的基因,我们从人胸腺基质单细胞数据集(GSE147520)中鉴定和提取出胸腺上皮细胞亚群,以年龄为分组变量进行基因表达差异分析,发现IGFBP5是胸腺上皮细胞中随年龄增长而表达上调幅度最大的基因(图 1A)。IGFBP5在胸腺上皮细胞各亚群中表达随年龄增长表现出表达量逐渐升高(图 1B),表达细胞逐渐增多的模式(图 1C)。IGFBP5可能与年龄增长导致的胸腺衰退密切相关。
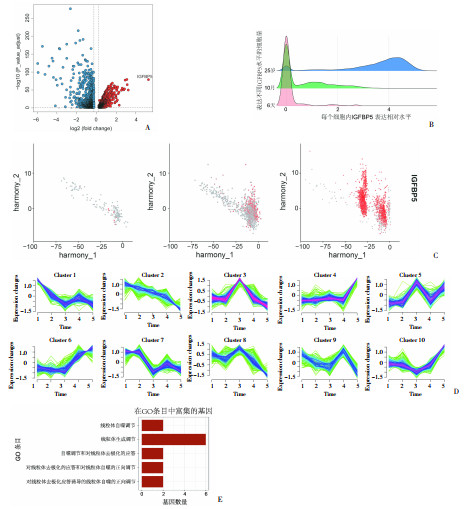
|
| A:火山图展示人胸腺上皮细胞随年龄变化表达基因的差异分析结果;B:山峦图展示随年龄增长时表达IGFBP5的细胞的数量和IGFBP5表达量的变化;C:散点图展示6天、10月、25岁样本中表达IGFBP5的胸腺上皮细胞在该样本所有胸腺上皮细胞中的比例及表达量;D:线图展示胸腺上皮表达的所有基因在各年龄段中表达变化趋势的聚类结果;E:条形图展示与IGFBP5共趋势基因的GO分析结果 图 1 公共数据集GSE147520分析结果 |
为探索IGFBP5在增龄性胸腺衰退中可能的生物学功能,我们使用Mfuzz趋势分析方法对人胸腺上皮细胞中表达的基因进行分群,以随年龄增长的表达模式变化作为分群策略,无监督聚类为10群(图 1D),获取与IGFBP5具有相同年龄表达模式的基因集。对IGFBP5所处的第4群基因进行功能富集分析,发现该群基因功能主要富集在线粒体去极化、线粒体自噬和线粒体组织等通路上(图 1E)。这提示随年龄增长,以IGFBP5为首的基因表达升高可能影响线粒体能量代谢功能。
2.2 人与小鼠IGFBP5高度同源且表达模式一致为明确在小鼠中构建胸腺衰退模型、研究IGFBP5在胸腺上皮细胞中功能的可行性,我们对人和小鼠IGFBP5蛋白序列同源性,表达模式相似性进行研究。从uniprot数据库中获取人(homo sapiens)和小鼠(mus musculus)的IGFBP5蛋白序列(删除信号肽后的成熟形式)进行比对发现,人、小鼠IGFBP5蛋白高度同源,仅有第87、90、116、157、159、183、245、252位氨基酸存在差异(图 2A)。
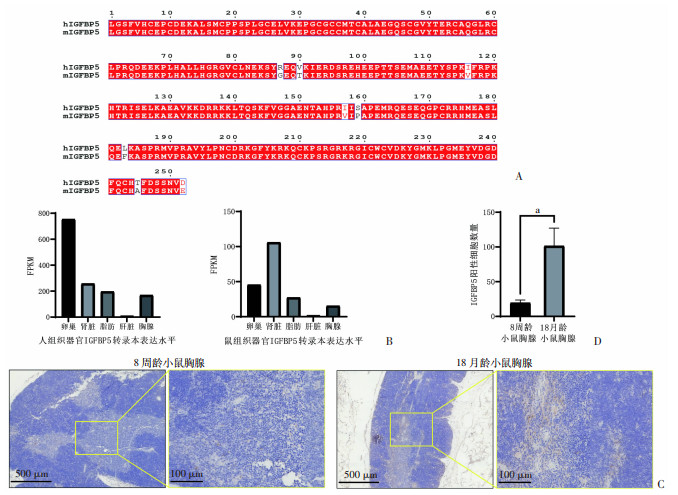
|
| A:人和鼠IGFBP5蛋白氨基酸序列同源性比对;B:人和小鼠IGFBP5在器官和组织中表达模式的比较;C:免疫组化展示年轻鼠(8周龄)和年老鼠(18月龄)IGFBP5表达水平差异;D:统计IGFBP5阳性细胞数量 a:P < 0.05,与8周龄小鼠比较 图 2 人与小鼠IGFBP5蛋白序列高度同源且时空表达模式相似 |
NIH转录组数据表明,IGFBP5在人和小鼠肾脏、脂肪等组织器官高表达,在肝脏中极低表达,在胸腺中呈适中表达(图 2B)。
使用年轻(8周龄)和年老(18月龄)小鼠胸腺组织石蜡切片进行IGFBP5免疫组化染色,结果显示,相较年轻小鼠,老年小鼠胸腺中IGFBP5阳性细胞数量显著增加(图 2C),与人胸腺基质单细胞转录组中的呈现的表达模式相似(图 1B)。
上述结果从蛋白质结构保守性、组织器官分布特征和在胸腺组织中随年龄增长表达趋势变化三个方面,综合说明IGFBP5在人和小鼠胸腺中具有相似的表达模式。证明使用小鼠模型研究IGFBP5表达上升对胸腺上皮细胞功能的影响是可行的。
2.3 IGFBP5过表达促进胸腺上皮细胞PINK1/Parkin介导的泛素化途径依赖的线粒体自噬为研究IGFBP5表达升高在胸腺上皮细胞中发挥的作用,我们使用小鼠胸腺上皮细胞系(iTECs)过表达IGFBP5基因,探索IGFBP5过表达对胸腺上皮细胞功能的影响。qPCR和ELISA结果表明IGFBP5多表达株的构建是成功的(图 3A~D)。
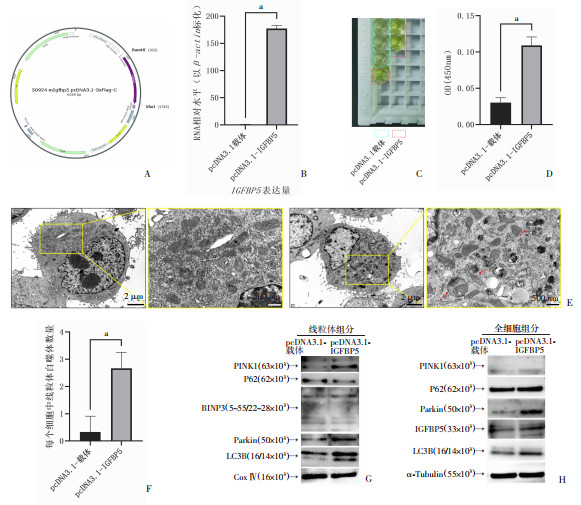
|
| A:IGFBP5过表达质粒图示意图;B~D:构建过表达株后测量IGFBP5 mRNA表达水平、培养基中IGFBP5蛋白水平 a:P < 0.05,与空载体质粒转染组比较;E: 细胞透射电镜结果(红色箭头指示为自噬小体);F: 统计线粒体自噬体数量 a:P<0.05,与空载体质粒转染组比较;G、H:线粒体组分和全细胞组分中线粒体自噬相关基因蛋白免疫印记结果 图 3 IGFBP5过表达促进泛素化依赖的线粒体自噬 |
首先,我们使用细胞透射电镜观察IGFBP5过表达对线粒体形态的影响。相较空载质粒转染组,IGFBP5过表达株中线粒体自噬体数量显著升高(图 3E、F),提示IGFBP5过表达诱导了线粒体自噬的发生。
进一步,为研究IGFBP5过表达诱导线粒体自噬发生的途径,我们使用线粒体组分(图 3G)和全细胞组分(图 3H)进行线粒体自噬标志物蛋白免疫印迹(Western Blot, WB)。相较空载质粒转染组,IGFBP5过表达使线粒体组分和细胞组分中LC3B表达水平升高,自噬接头蛋白P62(Sequestosome 1, P62)则未表现出明显趋势,提示巨自噬水平增加,线粒体自噬增多;PINK1和Parkin表达均升高,BNIP3水平未表现出明显趋势,提示IGFBP5过表达诱导的线粒体自噬依赖PINK1/Parkin介导的泛素化途径,而非BNIP3线粒体自噬受体依赖的非泛素化途径。
进一步,我们使用线粒体探针和线粒体自噬标志物细胞免疫荧光原位观测线粒体自噬的特征。相较空载质粒转染组,IGFBP5过表达株胞质中出现显著增多的LC3B代表的自噬小体颗粒,且该颗粒与线粒体探针代表的线粒体共定位,差异具有统计学意义(图 4A、B);PINK1/Parkin也呈现出显著增多的,与线粒体共定位的胞质颗粒(图 4C~F);BNIP3则保持弥散分布,未出现聚集和与线粒体共定位增加现象(图 4G、H)。细胞免疫荧光的结果与蛋白免疫印迹结果相符,共同表明IGFBP5在iTECs中的过表达促进了PINK1/Parkin介导的泛素化途径依赖的线粒体自噬的发生。
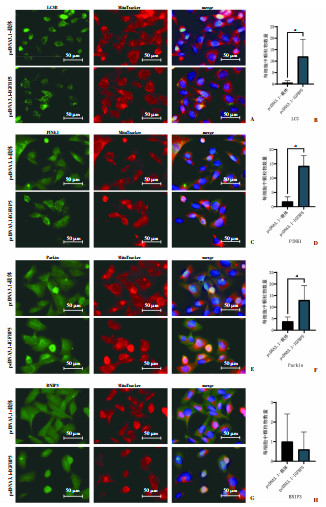
|
|
a:P < 0.05,与空载体质粒转染组比较 A、C、E、G: 双重免疫荧光展示LC3B、PINK1、Parkin、BNIP3分别与线粒体的细胞定位关系; B、D、F、H统计双重免疫荧光中LC3B、PINK1、Parkin、BNIP3分别与线粒体的共定位颗粒数量 图 4 IGFBP5过表达促进泛素化依赖的线粒体自噬标志物LC3B、PINK1、Parkin与线粒体共定位 |
2.4 IGFBP5过表达诱导胸腺上皮细胞凋亡
为探索IGFBP5过表达对iTECs命运的影响,我们使用WB检测IGFBP5过表达iTECs的凋亡水平。结果显示,相较空载质粒转染组,IGFBP5过表达株细胞凋亡标记物活化型胱天蛋白酶3 (Cleaved-Caspase3)水平升高(图 5C),提示Caspase3介导的凋亡通路激活。进一步,我们使用流式细胞术(Flow Cytometry, FCM)检测细胞凋亡水平,结果显示,相较空载质粒转染组,IGFBP5过表达组凋亡早期细胞和总凋亡细胞比例显著升高,而在凋亡晚期则稍低。FCM中早期细胞凋亡升高的结果与WB中胱天蛋白酶3(Caspase3)介导的凋亡通路激活的结果相符,表明IGFBP5过表达可通过Caspase3介导的经典凋亡途径,促进胸腺上皮细胞的丢失。
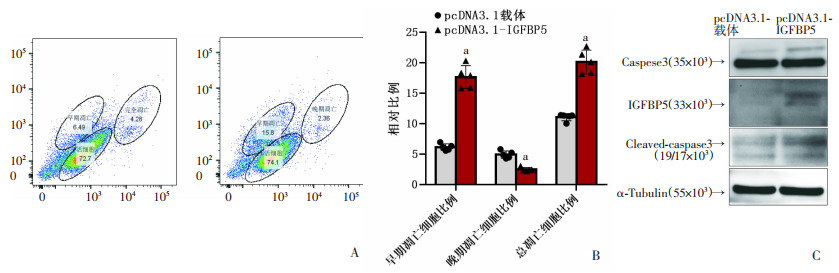
|
| A: 流式细胞术展示细胞凋亡水平;B: 统计细胞凋亡流式细胞术检测结果 a:P<0.05,与空载体质粒转染组比较;C: WB展示细胞凋亡标志物Cleaved-Caspase3水平变化 图 5 IGFBP5过表达促进细胞凋亡发生 |
3 讨论
胸腺上皮细胞作为提供适宜信号,介导胸腺细胞发育成熟的“抚育者”[20],其细胞亚群的丰富性和功能的多样性在单细胞技术发展的推动下,达到了空前的高度[1]。胸腺皮质上皮细胞趋化胸腺细胞祖细胞定植到胸腺,完成T细胞谱系特化,增殖分化和阳性选择[21];胸腺髓质上皮细胞则在AIRE基因的调控下,模拟外周组织细胞发育轨迹,形成“镜像细胞”,表达外周抗原,通过阴性选择介导自身耐受形成[22]。因此,维持胸腺上皮细胞正常功能对于免疫稳态至关重要[1]。衰老相关的胸腺萎缩和功能衰退以上皮细胞丢失为主要特征,导致胸腺微环境破坏,胸腺细胞的定植和发育受损,免疫稳态失衡,但其内在机制尚未得到明确阐述。
既往研究发现,瘦素(leptin)[23]、生长激素(growth hormone, GH)[24]、胰岛样生长因子1(insulin like growth factor 1, IGF1)[25],成纤维细胞生长因子7/10/21(fibroblast growth factor 7/10/21,FGF7/10/21)[26]等营养因子或模拟热量限制(caloric restriction mimetics)[27]等手段可延缓或逆转胸腺萎缩和功能衰退的发生,这些影响因素大多集中于IGF1调控轴上。IGFBP5作为IGF1的结合蛋白,可通过更高的亲和力与IGF1R竞争结合IGF1,拮抗IGF1R下游的生存和增殖信号,产生生长因子缺乏的局部微环境[28]。已有研究发现在乳腺上皮细胞中,IGFBP5蛋白表达水平在强制离乳诱导的乳腺退化模型中升高,而IGFBP5基因敲除可导致小鼠乳腺上皮细胞中Caspase蛋白家族介导的经典细胞凋亡途径下调,乳腺萎缩退化延迟[29]。在本研究中,我们挖掘已发表人胸腺基质细胞单细胞转录组数据,发现IGFBP5在人和小鼠胸腺上皮细胞中呈现增龄相关表达上调,且与IGFBP5共趋势的基因集功能富集在线粒体代谢上;体外实验证明IGFBP5过表达促进Caspase3活化和细胞凋亡的发生。然而,胸腺增龄性退化是否也由IGFBP5介导的凋亡而推动,需要体内研究进一步证实。
此外,我们还观察到IGFBP5过表达诱导胸腺上皮细胞线粒体自噬发生。线粒体自噬是重要的线粒体质量控制机制。一方面,线粒体自噬增加可清除损伤的线粒体,从而保护细胞免于凋亡;但是另一方面,过度的线粒体自噬也可导致自噬依赖的细胞死亡发生[30]。受限于研究方法和时间,本研究并未就IGFBP5过表达诱导的线粒体自噬和细胞凋亡之间的关系展开进一步研究,但我们结果提示,IGFBP5可能参与了自噬依赖的细胞死亡发生。
下一步,我们将使用IGFBP5敲除鼠等工具和多组学方法深入研究IGFBP5在胸腺衰退中的作用,并探讨线粒体自噬与细胞凋亡间的调控关系。综上,我们发现IGFBP5是介导年龄相关胸腺退化的关键调控基因,为干预胸腺衰退、重构人体免疫力提供了重要靶点。
致谢 感谢浙江中医药大学高建莉教授赠与永生化小鼠胸腺上皮细胞系。| [1] |
KADOURI N, NEVO S, GOLDFARB Y, et al. Thymic epithelial cell heterogeneity: TEC by TEC[J]. Nat Rev Immunol, 2020, 20(4): 239-253. |
| [2] |
LYNCH H E, GOLDBERG G L, CHIDGEY A, et al. Thymic involution and immune reconstitution[J]. Trends Immunol, 2009, 30(7): 366-373. |
| [3] |
MITTELBRUNN M, KROEMER G. Hallmarks of T cell aging[J]. Nat Immunol, 2021, 22(6): 687-698. |
| [4] |
JAMES P L, STEWART C E, ROTWEIN P. Insulin-like growth factor binding protein-5 modulates muscle differentiation through an insulin-like growth factor-dependent mechanism[J]. J Cell Biol, 1996, 133(3): 683-693. |
| [5] |
ALLARD J B, DUAN C M. IGF-binding proteins: why do they exist and why are there so many?[J]. Front Endocrinol, 2018, 9: 117. |
| [6] |
LIN W W, NIU R, PARK S M, et al. IGFBP5 is an ROR1 ligand promoting glioblastoma invasion via ROR1/HER2-CREB signaling axis[J]. Nat Commun, 2023, 14(1): 1578. |
| [7] |
POREBA E, DURZYNSKA J. Nuclear localization and actions of the insulin-like growth factor 1(IGF-1) system components: Transcriptional regulation and DNA damage response[J]. Mutat Res Mutat Res, 2020, 784: 108307. |
| [8] |
ZHANG T, LIU Q, GAO W H, et al. The multifaceted regulation of mitophagy by endogenous metabolites[J]. Autophagy, 2022, 18(6): 1216-1239. |
| [9] |
WANG S L, LONG H J, HOU L J, et al. The mitophagy pathway and its implications in human diseases[J]. Signal Transduct Target Ther, 2023, 8(1): 304. |
| [10] |
ELDEEB M A, THOMAS R A, RAGHEB M A, et al. Mitochondrial quality control in health and in Parkinson's disease[J]. Physiol Rev, 2022, 102(4): 1721-1755. |
| [11] |
BRAVO-SAN PEDRO J M, KROEMER G, GALLUZZI L. Autophagy and mitophagy in cardiovascular disease[J]. Circ Res, 2017, 120(11): 1812-1824. |
| [12] |
KERR J S, ADRIAANSE B A, GREIG N H, et al. Mitophagy and Alzheimer's disease: cellular and molecular mechanisms[J]. Trends Neurosci, 2017, 40(3): 151-166. |
| [13] |
LI B X, YE Y Q, HONG L S, et al. Transcriptome analysis reveals a potential regulatory mechanism of the lnc-5423.6/IGFBP5 axis in the early stages of mouse thymic involution[J]. Acta Biochim Biophys Sin, 2023, 55(4): 548-560. |
| [14] |
BAUTISTA J L, CRAMER N T, MILLER C N, et al. Single-cell transcriptional profiling of human thymic stroma uncovers novel cellular heterogeneity in the thymic medulla[J]. Nat Commun, 2021, 12(1): 1096. |
| [15] |
SpringerLink. ggplot2: Elegant Graphics for Data Analysis[DB/OL]. [2023.12.11]. https://link.springer.com/book/10.1007/978-3-319-24277-4
|
| [16] |
PubMed. Integrating single-cell transcriptomic data across different conditions, technologies, and species [DB/OL]. [2023.12.11]. https://pubmed.ncbi.nlm.nih.gov/29608179/
|
| [17] |
KUMAR L, FUTSCHIK M E. Mfuzz: a software package for soft clustering of microarray data[J]. Bioinformation, 2007, 2(1): 5-7. |
| [18] |
WU T Z, HU E Q, XU S B, et al. clusterProfiler 4.0: a universal enrichment tool for interpreting omics data[J]. Innovation(Camb), 2021, 2(3): 100141. |
| [19] |
SHEN J M, MA L, HE K, et al. Identification and functional study of immortalized mouse thymic epithelial cells[J]. Biochem Biophys Res Commun, 2020, 525(2): 440-446. |
| [20] |
Garland Science. Janeway's Immunobiology -9th Edition[DB/OL]. [2023.12.11]. https://www.academia.edu/40521511/Janeways_Immunobiology_9th_Edition
|
| [21] |
ZENG Y, LIU C, GONG Y D, et al. Single-cell RNA sequencing resolves spatiotemporal development of pre-thymic lymphoid progenitors and Thymus organogenesis in human embryos[J]. Immunity, 2019, 51(5): 930-948.e6. |
| [22] |
MICHELSON D A, HASE K, KAISHO T, et al. Thymic epithelial cells co-opt lineage-defining transcription factors to eliminate autoreactive T cells[J]. Cell, 2022, 185(14): 2542-2558.e18. |
| [23] |
DIXIT V D, YANG H, SUN Y X, et al. Ghrelin promotes thymopoiesis during aging[J]. J Clin Invest, 2007, 117(10): 2778-2790. |
| [24] |
TESSELAAR K, MIEDEMA F. Growth hormone resurrects adult human thymus during HIV-1 infection[J]. J Clin Invest, 2008, 118(3): 844-847. |
| [25] |
CHU Y W, SCHMITZ S, CHOUDHURY B, et al. Exogenous insulin-like growth factor 1 enhances thymopoiesis predominantly through thymic epithelial cell expansion[J]. Blood, 2008, 112(7): 2836-2846. |
| [26] |
ROSSI S W, JEKER L T, UENO T, et al. Keratinocyte growth factor(KGF) enhances postnatal T-cell development via enhancements in proliferation and function of thymic epithelial cells[J]. Blood, 2007, 109(9): 3803-3811. |
| [27] |
SPADARO O, YOUM Y, SHCHUKINA I, et al. Caloric restriction in humans reveals immunometabolic regulators of health span[J]. Science, 2022, 375(6581): 671-677. |
| [28] |
BAXTER R C. Signaling pathways of the insulin-like growth factor binding proteins[J]. Endocr Rev, 2023, 44(5): 753-778. |
| [29] |
NING Y, HOANG B, SCHULLER A G P, et al. Delayed mammary gland involution in mice with mutation of the insulin-like growth factor binding protein 5 gene[J]. Endocrinology, 2007, 148(5): 2138-2147. |
| [30] |
GUSTAFSSON Å B, DORN G W 2nd. Evolving and expanding the roles of mitophagy as a homeostatic and pathogenic process[J]. Physiol Rev, 2019, 99(1): 853-892. |




