子宫内膜息肉(endometrial polyps,EPs)是由子宫内膜腺体及含厚壁血管的纤维化子宫内膜间质构成的突出于子宫内膜表面的良性结节,常见的首发临床症状为异常子宫出血,是常见的子宫内膜病变之一[1-2]。EPs的发病机制至今尚未阐明,目前认为其是一种激素依赖性妇科疾病,与激素分泌、炎症刺激以及内膜细胞增殖/凋亡失衡等相关[3]。子宫内膜息肉发生风险因素复杂,年龄因素和他莫昔芬诱发子宫内膜息肉的风险已经得到共识。然而,慢性炎症、宫腔手术史、家族遗传史以及妇科合并症(包括盆腔炎、子宫内膜异位症、子宫腺肌症、排卵障碍、慢性子宫内膜炎等)也可能是该病的潜在风险因素[4],但目前尚无统一定论。不孕患者中EPs检出率较高(占15%~32%),且多数不孕合并EPs患者无明显症状,因此揭示子宫内膜息肉的发病风险因素,对临床工作中高效识别高危患者、优化患者助孕结局具有重要指导意义。本研究回顾性分析我院生殖中心2016年1月至2022年12月间经宫腔镜诊断EPs并行子宫内膜息肉切除术后首次行胚胎移植的不孕患者临床资料,旨在探讨不孕症患者合并EPs的风险因素以及其对辅助生殖助孕结局的影响。
1 资料与方法 1.1 一般资料本研究采用病例-对照研究设计方案。收集2016年1月至2022年12月期间因不孕症就诊于陆军军医大学第一附属医院生殖医学中心行胚胎移植术的患者资料。纳入标准:接受宫腔镜检查且术后首次行胚胎移植的不孕患者。排除标准:①生殖道发育畸形,如单角子宫、双子宫、纵隔子宫等;②夫妇其中之一染色体异常,包括核型、基因组病等;③子宫内膜不典型增生或子宫内膜癌者;④随访资料不全;⑤接受胚胎移植术后获临床妊娠但尚未到活产时间者。该研究已经通过陆军军医大学第一附属医院伦理委员会批准[(B)KY2024006],并免除签署知情同意书。流程详见下图 1。
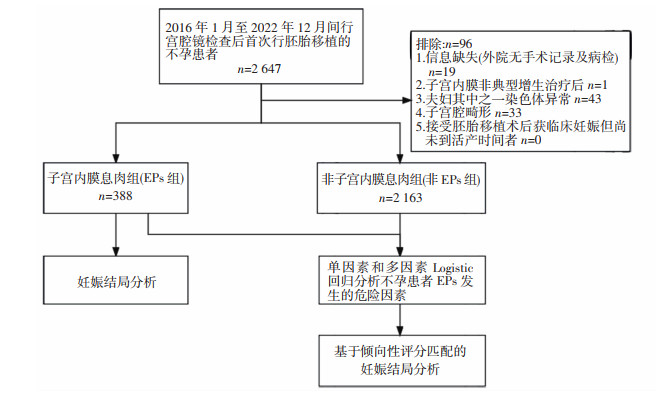
|
| 图 1 不孕症合并EPs与非EPs患者纳入及分析流程图 |
1.2 诊断及治疗 1.2.1 宫腔镜检查及组织病理学诊断
宫腔镜检查及组织病理学检查是诊断子宫内膜息肉的金标准,手术一般在月经干净后的卵泡中/晚期完成,部分患者于黄体中期进行。术中使用生理盐水(0.9%等渗氯化钠)溶液进行膨宫,对宫腔形态(观察并记录宫颈内口、宫腔前后壁、宫底及宫角等处有无息肉以及息肉的大小、位置、形态与数量),对子宫内膜色泽、弹性、腺体和内膜血管分布等进行检查并记录,检查发现EPs行息肉切除术(图 2),取样本送病理检查;无异常者搔刮少许内膜组织送病理检查。内膜样本均行病理学苏木精-伊红(hematoxylin-eosin,HE)染色,见腺体排列方式极不规则,腺体与间质的发育与周围子宫内膜不同步,间质纤维化伴大量胶原及厚壁血管,则诊断为子宫内膜息肉;可疑内膜炎患者行CD138免疫组织化学分析,若每高倍镜下≥5个CD138阳性浆细胞,则诊断为慢性子宫内膜炎,病理诊断标准详见诊断病理学[5]。
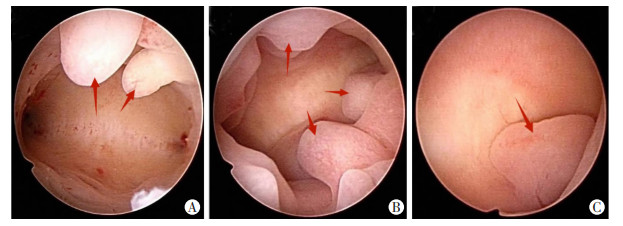
|
|
↑:示观察点 A:前壁多发子宫内膜息肉;B:多发性子宫内膜息肉;C:宫角子宫内膜息肉 图 2 不同位置子宫内膜息肉在宫腔镜下的表现 |
1.2.2 辅助生殖治疗情况
新鲜胚胎周期:根据患者年龄、卵巢储备状况及基础疾病等制定超促排卵方案[6],常规于取卵后选取卵裂期胚胎或囊胚进行移植,以卵裂球的数目、大小、形态及碎片的状态进行评分[7-8]。冻融胚胎周期:根据患者有无排卵及合并症等情况选择内膜准备方案,所有患者胚胎移植术后给予常规黄体支持方案[9-10]。
1.2.3 数据采集对患者个人史(年龄、不孕年限、孕产次、初潮年龄、吸烟史、饮酒史)、体重指数(body mass index,BMI)、基础雌激素(basal estrogen,bE2)基础促卵泡生成素(basal follicle-stimulating hormone,bFSH)、基础促黄体生成素(basal luteinizing hormone,bLH)、既往史(盆腔手术史、结核病史)、其他疾病(排卵障碍、子宫内膜异位症、子宫腺肌症、子宫肌瘤、卵巢储备功能减低、慢性子宫内膜炎)、息肉特征(息肉大小、息肉位置、息肉单发/多发、是否复发等情况)及随访妊娠结局(生化妊娠、临床妊娠、早期流产、晚期流产、是否活产)进行整理。
1.2.4 分组情况最终符合纳入条件2 551例,依据宫腔镜和(或)病理检查结果分为息肉组和无息肉组,其中息肉组388例,无息肉组2 163例;将病例组(EPs患者)根据宫腔镜术中记录的息肉位置(前壁、后壁、侧壁、宫角、宫底、弥散分布)、息肉大小(1~5 mm,>5~10 mm,>10 mm)、息肉数量(单发,多发)以及是否复发进行组内亚组划分,对比各组间妊娠结局差异。
1.2.5 妊娠结局观察指标主要指标:临床妊娠率=临床妊娠例数/总移植周期数×100%,次要指标:生化妊娠率=生化妊娠例数/总移植周期数×100%,早期/晚期流产率=早期或晚期流产例数/临床妊娠例数×100%,活产率=足月活产的周期数/总移植周期数×100%。指标定义:以移植后14 d血β-hCG>10 U/L为生化妊娠;移植后4~5周行超声检查可见孕囊为临床妊娠;孕12周前的临床妊娠自然终止为早期流产,妊娠12~28周妊娠自然终止的为晚期流产。
1.3 统计学分析使用SPSS 26.0软件对数据进行统计分析。计量资料均不满足正态分布,以M(P25,P75)描述,采用Mann-Whitney U检验;计数资料以率(%)表示,组间比较采用χ2检验或Fisher确切概率法进行检验。多因素分析使用逐步逻辑回归分析。采用倾向性评分匹配用于平衡2组患者基线特征,以减少混杂因素对妊娠结局的影响。匹配因素包括年龄、盆腔炎病史、盆腹腔手术史、结核病史、孕产次、吸烟饮酒史、月经初潮、不孕类型、不孕年限、其他疾病、基础内分泌等,采用最邻近配比法,根据本研究两组样本数据量使用1 ∶2匹配。倾向性评分匹配采用DecisionLinnc.1.0平台中的MatchIt包分析。P < 0.05视为差异有统计学意义。
2 结果 2.1 2组不孕症患者一般资料对比EPs组与非EPs组不孕症患者在年龄(P=0.002)、既往盆腔炎病史(P=0.000)、初潮年龄(P=0.000)、孕次数(P=0.000)、不孕年限(P=0.002)、原发不孕(P=0.000)、合并子宫内膜异位症(P=0.032)、合并子宫肌瘤(P=0.001)、bE2(P=0.016)等指标上差异有统计学意义,见表 1。
| 变量 | 息肉组 (n=388) |
非息肉组 (n=2163) |
P |
| 年龄/岁 | 31(29,34) | 31(28,33) | 0.002a |
| 盆腔炎病史 | 166(42.78) | 1 388(64.17) | 0.000b |
| 盆腹腔手术史 | 225(57.99) | 1 211(56.00) | 0.464b |
| 结核病史 | 18(4.63) | 155(7.17) | 0.068b |
| 吸烟史 | 16(4.12) | 92(4.25) | 0.907b |
| 饮酒史 | 5(1.28) | 21(0.97) | 0.765b |
| 月经初潮/岁 | 14(12,14) | 13(12,14) | 0.000a |
| 孕次/次 | 0(0,1) | 1(0,2) | 0.000a |
| 产次/次 | 0(0,0) | 0(0,0) | 0.437a |
| 不孕类型 | 0.000b | ||
| 原发不孕 | 234(60.31) | 1 086(50.21) | |
| 继发不孕 | 154(39.69) | 1 077(49.79) | |
| 不孕年限/年 | 4(2.1,6.0) | 4(2.0,6.0) | 0.002a |
| 其他疾病 | |||
| 排卵障碍 | 44(11.34) | 283(13.08) | 0.344b |
| 子宫内膜异位症 | 37(9.53) | 141(6.52) | 0.032b |
| 子宫腺肌症 | 5(1.28) | 33(1.53) | 0.723c |
| 子宫肌瘤 | 46(11.86) | 150(6.93) | 0.001b |
| 卵巢储备功能减低 | 60(15.46) | 261(12.07) | 0.063b |
| 慢性子宫内膜炎 | 32(8.25) | 236(10.91) | 0.115b |
| 基础内分泌 | |||
| bE2/(μg/L) | 38.12(27.00,59.00) | 36.00(25.00,53.00) | 0.016a |
| bLH/(U/L) | 4.27(3.08,5.83) | 4.28(3.05,5.90) | 0.595a |
| bFSH/(U/L) | 7.63(6.43,9.42) | 7.78(6.54,9.28) | 0.687a |
| BMI/(kg/m2) | 22.00(19.95,24.00) | 21.90(20.20,24.20) | 0.518a |
| a:Mann-Whitney U检验;b:Pearson χ2检验;c:Fisher精确检验 | |||
2.2 EPs发病风险的逐步回归分析
将单因素分析中具有统计学意义的指标作为自变量,EPs的发生作为因变量,逐步逻辑回归分析结果显示:年龄(OR:1.082,95%CI:1.053~1.113,P < 0.05)、原发不孕(OR:2.951,95%CI:1.990~4.376,P < 0.05)、bE2升高(OR:1.003,95%CI:1.001~1.005,P < 0.05)是EPs发病的独立危险因素,而盆腔炎病史及孕次数是EPs的保护因素(表 2)。
| 指标 | B | SE | Wald χ2 | P | OR | 95%CI |
| 年龄 | 0.079 | 0.014 | 31.554 | 0.000 | 1.082 | 1.053~1.113 |
| 盆腔炎病史 | -0.764 | 0.116 | 43.602 | 0.000 | 0.466 | 0.371~0.584 |
| 孕次数 | -1.136 | 0.139 | 66.741 | 0.000 | 0.321 | 0.245~0.422 |
| 原发不孕 | 1.082 | 0.201 | 28.985 | 0.000 | 2.951 | 1.990~4.376 |
| bE2 | 0.003 | 0.001 | 11.034 | 0.001 | 1.003 | 1.001~1.005 |
| 常量 | -5.793 | 0.743 | 60.873 | 0.000 | 0.003 |
2.3 倾向性评分匹配后EPs组与非EPs组妊娠结局比较分析
使用1 ∶2倾向性评分对两组样本进行匹配以控制混杂因素对妊娠结局产生的偏倚。匹配后EPs组与非EPs组间年龄、盆腔炎病史、盆腹腔手术史、结核病史、烟酒史、月经初潮、孕产次、不孕类型、不孕年限、合并症、基础内分泌情况及BMI均无统计学差异(P>0.05)。匹配前EPs组治疗后临床妊娠率(53.09% vs 47.25%,P=0.043)、活产率(43.81% vs 37.86%,P=0.027)较非EPs组高,其余各指标对比无统计学差异(P>0.05),匹配后2组对比生化及临床妊娠率、活产率仍有统计学差异(表 3)。
| 指标 | 匹配前 | P | 匹配后 | P | ||
| 息肉组 (n=388) |
非息肉组 (n=2 163) |
息肉组 (n=388) |
非息肉组 (n=776) |
|||
| 生化妊娠 | 230(59.28) | 1 174(54.28) | 0.068a | 230(59.28) | 409(52.71) | 0.034a |
| 临床妊娠 | 206(53.09) | 1 022(47.25) | 0.043a | 206(53.09) | 353(45.49) | 0.018a |
| 异位妊娠 | 4(1.94) | 20(1.96) | 0.842b | 4(1.94) | 10(2.83) | 0.776b |
| 早期流产 | 26(12.62) | 144(14.09) | 1.000b | 26(12.62) | 51(14.45) | 1.000b |
| 晚期流产 | 3(1.46) | 28(2.74) | 0.613b | 3(1.46) | 11(3.12) | 0.408b |
| 活产 | 170(43.81) | 819(37.86) | 0.027a | 170(43.81) | 278(35.82) | 0.008a |
| a:Pearson χ2检验;b:Fisher精确检验 | ||||||
2.4 EPs特征对妊娠结局的影响
根据EPs的宫腔占位、大小、数量以及首发/复发对纳入的EPs术后患者进行分层,通过χ2检验或Fisher精确检验分析以上因素对妊娠结局的影响。结果显示:息肉的宫腔占位和大小对妊娠结局的影响不具有统计学意义,息肉数量和是否复发与早期流产存在关联;对其他结局指标影响不显著,提示多发和复发性息肉可能是早期流产的风险因素(表 4)。
| 组别 | n | 生化妊娠 | 临床妊娠 | 早期流产 | 晚期流产 | 活产 |
| 宫腔占位 | ||||||
| 前壁 | 72 | 42(58.33) | 40(55.55) | 7(17.50) | 0 | 32(44.44) |
| 后壁 | 58 | 37(63.79) | 35(60.34) | 4(11.42) | 2(5.71) | 29(50.00) |
| 侧壁 | 58 | 36(62.06) | 32(55.17) | 2(6.25) | 0 | 30(51.72) |
| 宫角 | 58 | 34(58.62) | 29(50.00) | 5(17.24) | 0 | 21(36.21) |
| 宫底 | 12 | 7(58.33) | 6(50.00) | 0(0.00) | 1(16.67) | 4(33.33) |
| 多处 | 130 | 74(56.92) | 64(49.23) | 8(12.50) | 0 | 54(41.54) |
| 息肉大小 | ||||||
| 1~5 mm | 269 | 159(59.11) | 145(53.90) | 19(13.10) | 3(2.07) | 118(43.87) |
| >5~10 mm | 101 | 61(60.40) | 53(52.47) | 7(13.21) | 0 | 44(43.56) |
| >10 mm | 18 | 10(55.55) | 8(44.44) | 0 | 0 | 8(44.44) |
| 息肉数量 | ||||||
| 单发 | 181 | 108(59.67) | 96(53.04) | 7(7.29) | 3(3.13) | 81(44.75) |
| 多发 | 207 | 122(58.94) | 110(53.14) | 19(17.27)a | 0 | 88(42.51) |
| 是否复发 | ||||||
| 复发 | 31 | 19(61.29) | 18(58.06) | 5(27.78) | 1(5.56) | 12(38.71) |
| 首发 | 357 | 211(59.10) | 187(52.38) | 21(11.23)b | 2(1.07) | 159(44.54) |
| a:P < 0.05,与多发比较;b:P < 0.05,与首发比较 | ||||||
3 讨论 3.1 子宫内膜息肉高危因素分析
EPs是最常见的内膜良性病变之一,现有研究估计其不同人群的总体患病率在7.8%~34.9%,因部分患者无症状,其真实患病率可能更高[11]。经阴道超声是EPs最常用的检查方法,而宫腔镜检查及镜下活组织病理检查是诊断EPs的金标准[12]。本研究共纳入2 551例接受过宫腔镜检查的不孕患者,以宫腔镜联合组织病理学检查作为EPs诊断标准。按照本研究纳入标准,EPs患者占不孕患者总体比例约15.2%(388/2 551),与国内报道的数据相近(13.1%)[13],但与国外研究的数据存在差异(8.9%)[14],可能与诊断方法及研究对象有关。
胚胎质量与宫腔环境是胚胎植入并持续妊娠的关键。子宫内膜病变如子宫内膜息肉、宫腔粘连以及子宫内膜炎症等都是子宫内膜容受性和胚胎着床的不利因素[15]。EPs可能通过物理阻塞、炎症反应、内膜容受性降低等途径导致不孕和复发性流产风险增加[16-17]。对于EPs合并不孕症患者,国内外研究或专家共识均推荐行宫腔镜下息肉切除术,以改善自然怀孕或辅助生殖的妊娠率[12, 16, 18-19]。不孕症宫腔镜检查的指征包括超声或子宫输卵管造影等影像学提示宫腔回声异常(如可疑子宫内膜息肉、黏膜下子宫肌瘤或肌瘤影响内膜、子宫畸形及宫腔粘连等)、异常子宫出血、不明原因胚胎反复种植失败以及反复流产史,虽然宫腔镜在异常宫腔诊断方面具有较高的敏感性及特异性,但并不推荐作为辅助生殖常规检查项目[20]。因此,结合患者基本信息和临床检查识别EPs发生风险人群,对于辅助生殖临床治疗方案的制定有着重要指导意义。通过单因素分析和逐步逻辑回归分析,本研究发现年龄、原发不孕、基础雌激素升高为EPs发病的风险因素。
EPs可发生于各年龄段,风险随着年龄增加,围绝经期达到高峰[21]。年龄相关性提示雌激素依赖性疾病和代谢综合征相关疾病是EPs发生的基础因素。既往关于EPs与原发不孕关联性的研究结论并不统一[13, 22-24]。本研究结果显示:原发不孕患者的EPs发生频率更高,风险是继发不孕的2.951倍,证实原发不孕是EPs风险因素,也从另一个角度提示EPs可能是原发不孕的贡献因素。子宫内膜异位症和子宫肌瘤也是常见的妇科疾病,本研究单因素分析发现EPs患者中合并这两种疾病的不孕患者显著增多且有统计学意义,但逐步逻辑回归结果显示并无相关性。WANG等[25]研究报道,内膜异位症与非异位症患者的内膜息肉在形态学上仅存微小差异(如平均体积更小且大多无蒂),但内膜异位症合并息肉患者的原发不孕比例和息肉复发率均更高。
3.2 子宫内膜息肉对不孕患者妊娠结局的影响本研究对EPs术后患者与非息肉患者胚胎移植术后妊娠结局进行了比较,结果显示,PSM后息肉术后组的临床妊娠率(53.09% vs 45.49%,P=0.018)及活产率(43.81% vs 35.82%,P=0.008)均高于非息肉组。既往YANG等[26]研究也发现胚胎移植前行宫腔镜下息肉切除术的患者较同期无息肉患者的临床妊娠率更高(63% vs 41%,P=0.009)。胚胎着床伴随着子宫内膜基因表达的系统性的适应调控,其中就包括内膜分泌腺中HOXA10和HOXA11表达上调[27-30],然而它们在内膜息肉患者的内膜中的表达却受到抑制,提示子宫内膜容受性受损[31],息肉切除术是否通过纠正子宫内膜容受性相关分子表达进而实现了患者妊娠率改善值得进一步研究。尽管子宫内膜搔刮术对提高妊娠率的作用存在争议,但仍有研究提出子宫内膜局部损伤可增加胚胎着床率[32],因此患者行宫腔镜下息肉切除术是否通过内膜局部损伤提高妊娠率同样值得探讨。需要注意的是LASS等[33]通过对89例息肉 < 2 cm患者进行分析,发现新鲜胚胎移植组与宫腔镜息肉切除术后进行冻融胚胎移植组相比,妊娠率无统计学差异。
本研究进一步探讨了EPs的位置、大小、数量以及复发史对术后妊娠结局的影响,结果显示:多发性EPs(17.27% vs 7.29%,P < 0.05)及复发性EPs(27.78% vs 11.23%,P < 0.05)的早期流产率更高,息肉大小和位置的影响不显著。助孕后胚胎早期流产的原因复杂,孕妇的年龄、内分泌与免疫、宫腔形态、全身性疾病,以及胚胎的染色体异常与基因突变等都是潜在因素[34-35]。既往研究表明,EPs与复发性流产密切相关[36-38],本研究结果某种程度上也证实了此种关联。息肉增加流产风险的机制尚不明确,除了影响内膜容受性以外[31],还可能通过诱发炎症、出血及拮抗孕激素受体等途径影响胚胎发育和促进子宫收缩[39]。此外,有文献报道过内膜息肉嵌入胎盘的案例,推测可能是由于胚胎靠近息肉部位着床导致胎盘中嵌入内膜息肉,理论上息肉多发或复发会增加此类事件的概率[40]。有研究表明,息肉数量多、子宫内膜异位症和既往息肉切除术史是息肉复发的重要预测因素[41]。因此,尽管患者在胚胎移植术前已行内膜息肉切除,但仍需警惕因息肉复发导致的流产可能。
EPs患者的临床方案尚需更多大规模随机对照试验证据予以优化,有文献报道认为促性腺激素释放激素激动剂联合激素替代治疗方案(gonadotrophin releasing hormone agonist-hormone replacement treatment,GnRHa-HRT)方案可有效减少息肉的复发,且不会降低EPs患者的妊娠率或增加其流产率[42]。张莉莉等[43]对息肉患者的促排卵方案研究显示,超长方案在获卵数和优质胚胎率没有优势的情况下,其临床妊娠率与长方案相近甚至略高,提示超长方案可能有助于患者子宫内膜容受性或者减少息肉复发。
综上所述,本研究显示年龄、原发不孕、基础雌激素升高是EPs发生的危险因素,EPs患者在胚胎移植术前行宫腔镜下子宫内膜息肉切除术可以得到较为满意的妊娠结局。息肉的位置与大小对妊娠结局的影响较小,但多发和复发性息肉可能会增加早期流产的风险,应加强多发与复发性内膜息肉患者的早期随访,以便及时识别流产风险并加以处理。对于如何改善患者胚胎移植术后流产率的临床策略仍需进一步探索。
| [1] |
LOPES R G, BARACAT E C, DE ALBUQUERQUE NETO L C, et al. Analysis of estrogen- and progesterone-receptor expression in endometrial polyps[J]. J Minim Invasive Gynecol, 2007, 14(3): 300-303. DOI:10.1016/j.jmig.2006.10.022 |
| [2] |
AFIFI K, ANAND S, NALLAPETA S, et al. Management of endometrial polyps in subfertile women: a systematic review[J]. Eur J Obstet Gynecol Reprod Biol, 2010, 151(2): 117-121. DOI:10.1016/j.ejogrb.2010.04.005 |
| [3] |
VITALE S G, HAIMOVICH S, LAGANÀ A S, et al. Endometrial polyps. An evidence-based diagnosis and management guide[J]. Eur J Obstet Gynecol Reprod Biol, 2021, 260: 70-77. DOI:10.1016/j.ejogrb.2021.03.017 |
| [4] |
仝佳丽, 冯力民, 薛凤霞, 等. 子宫内膜息肉临床诊疗路径[J]. 中华妇产科杂志, 2022, 57(7): 491-495. TONG J L, FENG L M, XUE F X, et al. Clinical pathway for diagnosis and management of endometrial polyps[J]. Chin J Obstet Gynecol, 2022, 57(7): 491-495. DOI:10.3760/cma.j.cn112141-20220422-00269 |
| [5] |
刘彤华. 诊断病理学. 3版[M]. 北京: 人民卫生出版社, 2013. LIU T H. Diagnostic pathology[M]. Beijing: People's Medical Publishiny Press, 2013. |
| [6] |
乔杰, 马彩虹, 刘嘉茵, 等. 辅助生殖促排卵药物治疗专家共识[J]. 生殖与避孕, 2015, 35(4): 211-223. QIAO J, MA C H, LIU J Y, et al. A consensus of poor ovarian response[J]. Chin J Reprod Contracept, 2015, 35(4): 211-223. DOI:10.7669/j.issn.0253-357X.2015.04.0211 |
| [7] |
REINBLATT S L, ISHAI L, SHEHATA F, et al. Effects of ovarian endometrioma on embryo quality[J]. Fertil Steril, 2011, 95(8): 2700-2702. DOI:10.1016/j.fertnstert.2011.03.002 |
| [8] |
GARDNER D K, LANE M, STEVENS J, et al. Reprint of: Blastocyst score affects implantation and pregnancy outcome: towards a single blastocyst transfer[J]. Fertil Steril, 2019, 112(4 Suppl1): e81-e84. DOI:10.1016/j.fertnstert.2019.08.077 |
| [9] |
COOMARASAMY A, WILLIAMS H, TRUCHANOWICZ E, et al. A randomized trial of progesterone in women with recurrent miscarriages[J]. N Engl J Med, 2015, 373(22): 2141-2148. DOI:10.1056/NEJMoa1504927 |
| [10] |
孙赟, 刘平, 叶虹, 等. 黄体支持与孕激素补充共识[J]. 生殖与避孕, 2015, 35(1): 1-8. SUN Y, LIU P, YE H, et al. Luteal phase support with progesterone supplementation consensus[J]. Chin J Reprod Contracept, 2015, 35(1): 1-8. DOI:10.7669/j.issn.0253-357X.2015.01.0001 |
| [11] |
SHENG K K, LYONS S D. To treat or not to treat? An evidence-based practice guide for the management of endometrial polyps[J]. Climacteric, 2020, 23(4): 336-342. DOI:10.1080/13697137.2020.1742107 |
| [12] |
田文艳, 张慧英, 仝佳丽, 等. 子宫内膜息肉诊治中国专家共识(2022年版)[J]. 中国实用妇科与产科杂志, 2022, 38(8): 809-813. TIAN W Y, ZHANG H Y, TONG J L, et al. Chinese expert consensus on diagnosis and treatment of endometrial polyps(2022 edition)[J]. Chin J Pract Gynecol Obstet, 2022, 38(8): 809-813. DOI:10.19538/j.fk2022080112 |
| [13] |
石文静, 范俊梅, 杨佳, 等. 不孕症患者子宫内膜息肉危险因素分析及其对FET结局的影响[J]. 中华生殖与避孕杂志, 2023, 43(10): 997-1003. SHI W J, FAN J M, YANG J, et al. Risk factors analysis of endometrial polyps in infertile patients and its influence on FET outcome[J]. Chin J Reprod Contracept, 2023, 43(10): 997-1003. DOI:10.3760/cma.j.cn101441-20230212-00047 |
| [14] |
ANASTASIADIS P G, KOUTLAKI N G, SKAPHIDA P G, et al. Endometrial polyps: prevalence, detection, and malignant potential in women with abnormal uterine bleeding[J]. Eur J Gynaecol Oncol, 2000, 21(2): 180-183. DOI:10.1016/S0378-3782(99)00053-5 |
| [15] |
RAZIEL A, ARIELI S, BUKOVSKY I, et al. Investigation of the uterine cavity in recurrent aborters[J]. Fertil Steril, 1994, 62(5): 1080-1082. DOI:10.1016/s0015-0282(16)57080-0 |
| [16] |
DI SPIEZIO SARDO A, DI CARLO C, MINOZZI S, et al. Efficacy of hysteroscopy in improving reproductive outcomes of infertile couples: a systematic review and meta-analysis[J]. Hum Reprod Update, 2016, 22(4): 479-496. DOI:10.1093/humupd/dmw008 |
| [17] |
PEREIRA N, AMRANE S, ESTES J L, et al. Does the time interval between hysteroscopic polypectomy and start of in vitro fertilization affect outcomes[J]. Fertil Steril, 2016, 105(2): 539-544. DOI:10.1016/j.fertnstert.2015.10.028 |
| [18] |
PÉREZ-MEDINA T, BAJO-ARENASJ, SALAZAR F, et al. Endometrial polyps and their implication in the pregnancy rates of patients undergoing intrauterine insemination: a prospective, randomized study[J]. Hum Reprod, 2005, 20(6): 1632-1635. DOI:10.1093/humrep/deh822 |
| [19] |
ZHANG H X, HE X Q, TIAN W Y, et al. Hysteroscopic resection of endometrial polyps and assisted reproductive technology pregnancy outcomes compared with no treatment: a systematic review[J]. J Minim Invasive Gynecol, 2019, 26(4): 618-627. DOI:10.1016/j.jmig.2018.10.024 |
| [20] |
中华医学会生殖医学分会, 沈浣, 黄国宁, 等. 宫腔镜在不孕患者的应用推荐意见[J]. 中华生殖与避孕杂志, 2022, 42(8): 769-781. Chinese Society of Reproductive Medicine, SHEN H, HUANG G N, et al. Recommendations for hysteroscopy in infertile patients[J]. Chin J Reprod Contracept, 2022, 42(8): 769-781. DOI:10.3760/cma.j.cn101441-20220219-00074 |
| [21] |
NIJKANG N P, ANDERSON L, MARKHAM R, et al. Endometrial polyps: Pathogenesis, sequelae and treatment[J]. SAGE Open Med, 2019, 7: 2050312119848247. DOI:10.1177/2050312119848247 |
| [22] |
ELIAS R T, PEREIRA N, KARIPCIN F S, et al. Impact of newly diagnosed endometrial polyps during controlled ovarian hyperstimulation on in vitro fertilization outcomes[J]. J Minim Invasive Gynecol, 2015, 22(4): 590-594. DOI:10.1016/j.jmig.2014.12.170 |
| [23] |
SUN Y, ZHANG J, BAI W P. Higher prevalence of endometrial polyps in patients with fallopian tube obstruction: a case-control study[J]. J Minim Invasive Gynecol, 2019, 26(5): 935-940. DOI:10.1016/j.jmig.2018.07.024 |
| [24] |
曹万英, 徐妃. 子宫内膜息肉发生的危险因素分析[J]. 中国实用医药, 2019, 14(12): 11-13. CAO W Y, XU F. Analysis of risk factors for endometrial polyps[J]. China Pract Med, 2019, 14(12): 11-13. DOI:10.14163/j.cnki.11-5547/r.2019.12.005 |
| [25] |
WANG N N, ZHANG Y F, LIU B. Demographic and clinical features of endometrial polyps in patients with endometriosis[J]. Biomed Res Int, 2016, 2016: 1460793. DOI:10.1155/2016/1460793 |
| [26] |
YANG J H, YANG P K, CHEN M J, et al. Management of endometrial polyps incidentally diagnosed during IVF: a case-control study[J]. Reprod Biomed Online, 2017, 34(3): 285-290. DOI:10.1016/j.rbmo.2016.12.012 |
| [27] |
GUI Y, ZHANG J, YUAN L, et al. Regulation of HOXA-10 and its expression in normal and abnormal endometrium[J]. Mol Hum Reprod, 1999, 5(9): 866-873. DOI:10.1093/molehr/5.9.866 |
| [28] |
SARNO J L, KLIMAN H J, TAYLOR H S. HOXA10, Pbx2, and Meis1 protein expression in the human endometrium: formation of multimeric complexes on HOXA10 target genes[J]. J Clin Endocrinol Metab, 2005, 90(1): 522-528. DOI:10.1210/jc.2004-0817 |
| [29] |
TAYLOR H S, IGARASHI P, OLIVE D L, et al. Sex steroids mediate HOXA11 expression in the human peri-implantation endometrium[J]. J Clin Endocrinol Metab, 1999, 84(3): 1129-1135. DOI:10.1210/jcem.84.3.5573 |
| [30] |
WANG L F, LUO H Z, ZHU Z M, et al. Expression of HOXA11 gene in human endometrium[J]. Am J Obstet Gynecol, 2004, 191(3): 767-772. DOI:10.1016/j.ajog.2004.02.069 |
| [31] |
RACKOW B W, JORGENSEN E, TAYLOR H S. Endometrial polyps affect uterine receptivity[J]. Fertil Steril, 2011, 95(8): 2690-2692. DOI:10.1016/j.fertnstert.2010.12.034 |
| [32] |
DAIN L, OJHA K, BIDER D, et al. Effect of local endometrial injury on pregnancy outcomes in ovum donation cycles[J]. Fertil Steril, 2014, 102(4): 1048-1054. DOI:10.1016/j.fertnstert.2014.06.044 |
| [33] |
LASS A, WILLIAMS G, ABUSHEIKHA N, et al. The effect of endometrial polyps on outcomes of in vitro fertilization (IVF) cycles[J]. J Assist Reprod Genet, 1999, 16(8): 410-415. DOI:10.1023/a:1020513423948 |
| [34] |
TALAULIKAR V S, ARULKUMARAN S. Maternal, perinatal and long-term outcomes after assisted reproductive techniques (ART): implications for clinical practice[J]. Eur J Obstet Gynecol Reprod Biol, 2013, 170(1): 13-19. DOI:10.1016/j.ejogrb.2013.04.014 |
| [35] |
TALAULIKAR V S, ARULKUMARAN S. Reproductive outcomes after assisted conception[J]. Obstet Gynecol Surv, 2012, 67(9): 566-583. DOI:10.1097/OGX.0b013e31826a5d4a |
| [36] |
WALLACH E E. The uterine factor in infertility[J]. Fertil Steril, 1972, 23(2): 138-158. DOI:10.1016/s0015-0282(16)38772-6 |
| [37] |
FOSS B A, HORNE H W Jr, HERTIG A T. The endometrium and sterility[J]. Fertil Steril, 1958, 9(3): 193-205. DOI:10.1016/s0015-0282(16)33060-6 |
| [38] |
GALAMB Á, PETHÖ Boglárka, FEKETE D, et al. Uterine anomalies in women with recurrent pregnancy loss[J]. Orv Hetil, 2015, 156(27): 1081-1084. DOI:10.1556/650.2015.30136 |
| [39] |
田昭, 孙智晶. 育龄期妇女子宫内膜息肉管理[J]. 现代妇产科进展, 2023, 32(9): 708-710. TIAN Z, SUN Z J. Management of endometrial polyps in women of childbearing age[J]. Prog Obstet Gynecol, 2023, 32(9): 708-710. DOI:10.13283/j.cnki.xdfckjz.2023.09.011 |
| [40] |
POLICARPIO-NICOLAS M L C, HOU Y J, RABINOWITZ L O, et al. Endometrial polyp of the placental fetal membranes: report of a case[J]. Int J Gynecol Pathol, 2020, 39(6): e13-e15. DOI:10.1097/PGP.0000000000000640 |
| [41] |
GU F, ZHANG H X, RUAN S M, et al. High number of endometrial polyps is a strong predictor of recurrence: findings of a prospective cohort study in reproductive-age women[J]. Fertil Steril, 2018, 109(3): 493-500. DOI:10.1016/j.fertnstert.2017.11.029 |
| [42] |
WANG Z Y, WEN Y X, XIONG Y J, et al. Retrospective analysis of the endometrial preparation protocols for frozen-thawed embryo transfers in women with endometrial polyps[J]. Hum Fertil, 2022, 25(3): 534-539. DOI:10.1080/14647273.2020.1855368 |
| [43] |
张莉莉, 马晓玲, 石馨, 等. 子宫内膜息肉患者IVF周期妊娠结局的临床分析[J]. 生殖医学杂志, 2018, 27(4): 350-355. ZHANG L L, MA X L, SHI X, et al. Clinical analysis of endometrial polyp patients during IVF cycles[J]. J Reprod Med, 2018, 27(4): 350-355. DOI:10.3969/j.issn.1004-3845.2018.04.011 |




