术后肝损伤是手术患者在围术期可能发生的严重并发症之一[1],研究显示术后肝损伤发病率因手术类型而异,约为3.2%~72.22%[2-3]。围术期肝功能障碍病人易出现肾功能障碍,产生肝肾综合征、肾前性氮质血症或急性肾小管坏死,一旦肝功能持续恶化,常会出现黄疸进行性加重、严重凝血机制障碍、腹水、肝性脑病、肾功能不全加重等肝功能衰竭的表现[1],而急性肝衰竭虽发生率为1%~3%,其病死率高达60%~90%[4],会增加住院时间和病死率,影响术后长期存活率,因此围术期肝脏功能的监测和保护尤其重要。因受人为因素的干扰,使用传统评分工具建立的预测模型的临床实用性及评估效率降低,而随着近年来机器学习被广泛应用于疾病预测[5],医护人员利用机器学习方法在肝病学方面开展了大量研究。WANG等[6]纳入875例多中心患者数据进行回顾性队列研究,采用LightGBM算法对术后肝衰竭进行预测,在验证集得到较高模型效能(AUC:0.82),其相对于传统评分工具展现了更大的优势。然而,目前很少有研究使用机器学习来预测非肝脏手术患者术后并发症的风险。本研究将机器学习运用于术后肝损伤预测,进行早期风险评估,为术中麻醉管理和术后护理路径提供预警,以期提高围术期管理水平,降低各类手术术后肝损伤发生风险。
1 资料与方法 1.1 一般材料 1.1.1 数据来源数据来源于国内3家大型综合医院开发的数据库中2014年1月至2022年9月行非肝脏手术的患者,并通过3家医院伦理委员会批准:陆军军医大学第一附属医院(2014年1月至2022年9月,KY201936),四川大学附属华西医院(2019年5月至2020年1月,2021-349),中山大学附属第一医院(2019年6月至2019年12月,2019-385)。
1.1.2 研究对象阳性患者纳入标准:①年龄≥ 18岁;②接受除肝胆手术外任何类型的手术;③术后14 d内天门冬氨基酸转移酶(aspartate aminotransferase, AST)>200 U/L, 丙氨酸氨基转移酶(alanine aminotransferase, ALT)>200 U/L。排除标准:①年龄>75岁;②术前最近1次检验AST>200 U/L, ALT>200 U/L;③术前诊断为肝衰竭、肝损伤、肝功能不全者;④重要病例资料不全者。按照纳入、排除标准,共筛选出315例阳性患者。
阴性患者纳入排除标准:采用病例对照研究设计方案,纳入、排除标准同阳性病例,按统计学要求,按阳性∶阴性≈1 ∶3比例随机匹配同期术后未发生肝损伤的928例患者纳入非肝损伤组。
本研究将术后肝损伤定义为:在本次住院期间手术后14 d内AST、ALT均大于5倍正常值(200 U/L)[7]。患者收集流程图见图 1。
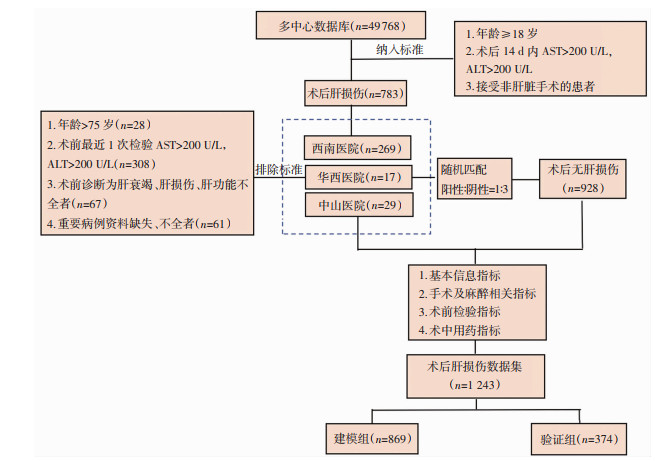
|
| 图 1 多中心数据库患者收集数量及模型集合划分 |
1.2 方法 1.2.1 建模选择指标
研究主要收集术前及术中临床指标,主要包括基础信息、病史、相关评分表、手术相关信息和实验室检查(术前最近1次结果)。基础信息包括年龄、性别、体质量指数(body mass idex, BMI);病史包括吸烟史、饮酒史、是否患有乙肝、合并症(高血压,糖尿病,心脏病,肺部疾病)、Child-Pugh评分;手术相关信息包括手术类型(上腹部手术、下腹部手术,心胸手术、脊柱手术、四肢手术、头面颈部手术、其他手术)、麻醉分级、急诊、手术时间、麻醉方式;实验室检查包括血红蛋白(Hb)、血小板计数/中性粒细胞计数(PLT/neu)、白细胞计数(WBC)、血小板计数(PLT)、凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、肌酐(Crea)、尿素(Urea)、钠(Na)、钙(Ca)、白蛋白(ALB)、白球比、AST、ALT、胆红素(BIL)、直接胆红素(DBIL)、间接胆红素(IBIL)及术中用药指标,包括红细胞使用量、血浆使用量、右美托嘧啶使用量、七氟烷使用量、丙泊酚使用量、舒芬太尼使用量、地佐辛使用量、利尿剂使用量。
1.2.2 数据预处理首先处理缺失数据,去掉纳入指标缺失超过30%的患者数据,去掉单一指标缺失超过30%的指标,剩余缺失数据进行k-近邻(k-nearest neighbor,KNN)填充,完成数据收集和填充后对所有指标行数据预处理,以便于提高机器学习计算效率。对于连续变量剔除近零方差变量,归一化标准化数据,处理后数据的均值为零,标准差为1。原始数据经过预处理后,各指标处于同一数量级,更加适合进行综合对比评价[8],针对分类变量(如性别),将其转化为因子。将纳入统计的数据,根据R语言设置的代码以7 ∶3的比例被随机拆分为建模组(n=869)和验证组(n=374)。由于大部分机器学习算法在不平衡数据集上表现不佳,为了数据的平衡,在建模组中采用Smote采样将其修正为平衡数据,使用LASSO方法进行特征选择并且进行十折交叉验证,筛选和确定独立且有效的危险因素。
1.2.3 预测模型构建与评估机器学习过程在R软件上进行。在R软件上运行tidymodels包、themis包,选择KNN、支持向量机(support vector machine linear,SVM)、逻辑回归(logistic regression,LR)、极端梯度提升(extreme gradient boosting,XGBoost)这4种机器学习建立模型。在建模组中,输入LASSO回归分析选择出来的预测指标,分别运行相应算法,进行监督学习,通过贝叶斯超化确定最优参数。在验证组中构建受试者工作特征曲线(receiver operating characteristic,ROC)和精准-召回曲线(percision-recall curve,P-R),通过曲线下面积(area under curve,AUC)来评价模型的区分度,
判断模型鉴别能力,其中0.5≤AUC < 0.7提示预测效果较差,0.7≤AUC < 0.9提示预测效果中等,AUC≥0.9提示预测效果非常好;通过构建校准曲线来评价模型的准确性;通过构建临床决策曲线来评价模型的临床效用。为了评估模型综合性能,模型的Kappa值、灵敏度、特异度、Brier评分、F1评分也被分析计算出来。预测模型预处理、开发和评估流程见图 2。
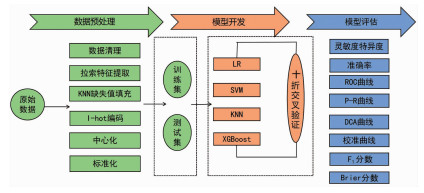
|
| 图 2 机器学习数据预处理、模型开发和模型评估流程图 |
1.3 统计学分析
采用SPSS 26.0软件进行统计分析。根据数据分布,正态分布的计量资料以x±s来表示,组间比较采用两独立样本t检验,而偏态分布的计量资料以M(P25,P75)表示,比较采用Mann-Whitney U检验。对于计数资料,组间比较采用χ2检验或Fisher确切概率。本研究统计检验均是双侧的,P<0.05表示差异具有统计学意义。
2 结果 2.1 组间患者一般资料比较最终纳入数据分析的患者有1 243例(肝损伤组315例,非肝损伤组928例),肝损伤组与非肝损伤组组间基本资料比较发现,手术部位、急诊、麻醉方式、年龄、麻醉分级、Child-Pugh评分、性别、合并症(高血压,心脏病)差异有统计学意义(P < 0.05,表 1)。对于术前检验指标及术中指标2组间比较发现Hb、WBC、PLT、PT、K、Ca、ALB、A/G、AST、ALT、BIL、IBIL、红细胞使用量、血浆使用量、七氟烷使用量、丙泊酚使用量、舒芬太尼使用量、地佐辛使用量、利尿剂使用量差异有统计学意义(P < 0.05,表 2)。
| 指标 | 肝损伤组(n=315) | 非肝损伤组(n=928) | P |
| 手术部位 | < 0.001 | ||
| 上腹部 | 32(10.15) | 65(7.00) | |
| 下腹部 | 80(25.39) | 349(37.61) | |
| 心胸 | 79(25.08) | 106(11.42) | |
| 头面颈 | 59(18.73) | 178(19.18) | |
| 脊柱 | 20(6.34) | 89(9.59) | |
| 四肢 | 39(12.38) | 125(13.47) | |
| 其他 | 6(1.9) | 16(1.73) | |
| 急诊 | < 0.001 | ||
| 是 | 52(16.51) | 57(6.14) | |
| 否 | 263(83.49) | 871(93.86) | |
| 麻醉方式 | 0.005 | ||
| 全麻 | 292(92.69) | 806(86.85) | |
| 非全麻 | 23(7.31) | 122(13.15) | |
| 年龄/岁 | 53(46,64) | 53(45,59) | 0.035 |
| BMI/(kg/m2) | 23.41(21.25,25.35) | 23.67(21.51,25.71) | 0.235 |
| 麻醉分级 | < 0.001 | ||
| Ⅰ | 2(0.63) | 44(4.74) | |
| Ⅱ | 210(66.68) | 832(89.65) | |
| Ⅲ | 73(23.17) | 45(4.85) | |
| Ⅳ | 30(9.52) | 7(0.76) | |
| Child-Pugh评分 | 2(2.00,3.00) | 2(2.00,2.00) | < 0.001 |
| 吸烟 | 108(34.29) | 307(33.08) | 0.695 |
| 饮酒 | 98(31.11) | 268(28.88) | 0.453 |
| 乙肝 | 25(7.93) | 88(9.48) | 0.418 |
| 女性 | 125(39.68) | 457(49.24) | 0.003 |
| 合并症 | |||
| 高血压 | 50(15.87) | 89(9.59) | 0.002 |
| 糖尿病 | 21(6.67) | 71(7.67) | 0.564 |
| 心脏病 | 50(15.87) | 55(5.92) | < 0.001 |
| 肺部疾病 | 4(1.27) | 11(1.18) | 1 |
| 指标 | 肝损伤组(n=315) | 非肝损伤组(n=928) | P |
| Hb/(g/L) | 130.00(116.00, 143.00) | 133.00(120.00, 144.00) | 0.028 |
| WBC/(×109/L) | 7.22(5.28, 9.03) | 6.27(5.20, 7.62) | < 0.001 |
| PLT/neu | 44.69(23.87, 63.59) | 56.02(40.52, 71.59) | < 0.001 |
| PLT/(×1012/L) | 189.00(150.00, 245.00) | 210.50(170.00, 249.75) | < 0.001 |
| PT/s | 11.00(10.40, 11.50) | 10.80(10.20, 11.30) | < 0.001 |
| APTT/s | 27.70(25.70, 29.40) | 27.45(25.80, 28.90) | 0.463 |
| Crea/(μmol/L) | 67.70(57.90, 77.80) | 66.10(57.20, 76.70) | 0.290 |
| Urea/(mmol/L) | 5.50(4.40, 6.62) | 5.30(4.30, 6.30) | 0.134 |
| K+/(mmol/L) | 3.93(3.75, 4.15) | 4.00(3.78, 4.21) | 0.004 |
| Na+/(mmol/L) | 139.97(138.30, 141.80) | 140.19(138.80, 141.70) | 0.285 |
| Ca+/(mmol/L) | 2.25(2.25, 2.33) | 2.31(2.24, 2.39) | < 0.001 |
| ALB/(g/L) | 39.70(36.00, 43.40) | 41.10(38.20, 44.10) | < 0.001 |
| A/G | 1.40(1.21, 1.58) | 1.48(1.31, 1.65) | < 0.001 |
| AST/(U/L) | 26.20(20.10, 36.70) | 19.95(17.00, 23.80) | < 0.001 |
| ALT/(U/L) | 22.60(15.6, 34.0) | 17.00(12.30, 23.70) | < 0.001 |
| BIL/(μmol/L) | 13.20(9.60, 17.20) | 11.54(8.80, 14.50) | < 0.001 |
| DBIL/(μmol/L) | 2.50(1.30, 3.38) | 2.30(1.80, 3.10) | 0.304 |
| IBIL/(μmol/L) | 10.69(7.60, 13.90) | 11.60(8.80, 15.00) | 0.001 |
| 术中指标 | |||
| 手术时间/min | 206.00(130.85, 296.00) | 158.5(93.25, 229.75) | < 0.001 |
| 血浆/mL | 0.00(0.00, 0.00) | 0.00(0.00, 0.00) | 0.002 |
| 红细胞/mL | 0.00(0.00, 0.00) | 0.00(0.00, 0.00) | 0.011 |
| 右美托嘧啶/μg | 50.00(20.00, 200.00) | 60.00(0.00, 120.00) | 0.135 |
| 七氟烷/mL | 10.00(0.00, 30.00) | 0.00(0.00, 20.00) | < 0.001 |
| 丙泊酚/mg | 1 000.00(500.00, 1500.00) | 900.00(300.00, 1200.00) | 0.004 |
| 舒芬太尼/μg | 50.00(50.00, 100.00) | 50.00(40.00, 50.00) | < 0.001 |
| 地佐辛/mg | 0.00(0.00, 10.00) | 5.00(0.00, 10.00) | 0.001 |
| 利尿剂/mg | 0.00(0.00, 0.00) | 0.00(0.00, 0.00) | < 0.001 |
2.2 特征变量筛选结果
在建模组中,采用LASSO回归分析方法对术后肝损伤相关术前指标进行筛选,选择1个具备优良性能但是自变量个数最少的模型。最终以λ=1se时筛选出的指标为建模指标,结果如表 3所示(λ=1se、λ=min均为0的指标未被归纳在表格中)。
| 指标 | λ=1se | λ=min | 指标 | λ=1se | λ=min | |
| 手术时间 | 0.176 696 653 | 0.263 577 507 | 糖尿病 | 0.000 | 7.12E-04 | |
| 七氟烷使用量 | 0.019 493 42 | 0.112 599 294 | PLT/neu | 0.000 | 0.079 201 455 | |
| 丙泊酚使用量 | 0.128 380 177 | 0.275 007 82 | WBC | 0.000 | 0.017 873 356 | |
| 地佐辛使用量 | -0.074 005 547 | -0.257 476 97 | Crea | 0.000 | 0.165 643 849 | |
| 急诊 | 0.000 | -0.098 048 028 | K | -0.015 824 943 | -0.159 965 583 | |
| 麻醉分级 | 0.519 049 477 | 0.759 328 022 | Na | 0.000 | -0.113 613 818 | |
| 年龄 | 0.000 | 0.058 555 839 | Ca | -0.120 546 355 | -0.242 606 667 | |
| BMI | 0.000 | -0.163 418 616 | ALB | 0.000 | -0.013 845 208 | |
| Child评分 | 0.074 847 974 | 0.098 753 818 | AST | 0.717 852 922 | 1.000 296 079 | |
| 麻醉方式 | 0.000 | 0.074 515 368 | ALT | 0.150 488 978 | 0.324 876 549 | |
| 吸烟史 | 0.000 | -0.153 421 658 | BIL | 0.142 650 682 | 0.500 096 103 | |
| 高血压 | 0.000 | 0.035 435 646 | IBIL | -0.204 759 453 | -0.670 462 206 |
2.3 预测模型的建立与验证
在R软件上,输入LASSO方法选出的特征指标,基于LR、SVM、KNN、XGBoost 4种不同算法构建肝损伤预测模型,对其模型效能进行评估。基于XGBoost算法开发的模型在验证组获得了最佳的鉴别能力(AUROC:0.916,AUPRC:0.841)、最佳的校准能力(Brier分数为0.097)和准确率(85.03%)、最高的灵敏度(78.95%)和相对较好的特异度(87.10%);在临床决策曲线中可看出使用XGBoost算法开发的模型能够获得最大的临床效益(图 3),模型综合性能比较见表 4。
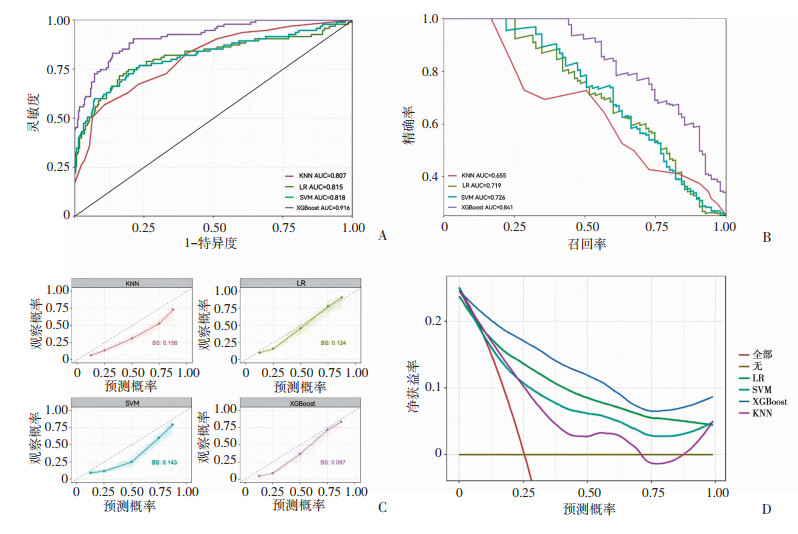
|
| A:各模型在验证组的ROC曲线图;B:各模型在验证组的P-R曲线图;C:各模型在验证组的校准曲线图;D:各模型在验证组的临床决策曲线图 图 3 机器学习各预测模型性能曲线对比 |
| 算法 | 组别 | 准确率/% | Kappa | 灵敏度/% | 特异度/% | Brier分数 | F1分数 | AUPRC | AUROC(95%CI) |
| KNN | 建模组 | 81.93 | 0.59 | 88.64 | 79.66 | 0.112 | 0.713 | 0.834 | 0.925 (0.906~0.943) |
| 验证组 | 74.60 | 0.39 | 67.37 | 77.06 | 0.156 | 0.574 | 0.655 | 0.807 (0.756~0.859) | |
| SVM | 建模组 | 91.02 | 0.76 | 81.36 | 94.30 | 0.092 | 0.821 | 0.879 | 0.925 (0.899~0.949) |
| 验证组 | 82.62 | 0.53 | 62.11 | 89.61 | 0.143 | 0.645 | 0.726 | 0.818 (0.762~0.875) | |
| XGBoost | 建模组 | 97.70 | 0.94 | 99.55 | 97.07 | 0.025 | 0.956 | 0.991 | 0.997 (0.995~0.999) |
| 验证组 | 85.03 | 0.63 | 78.95 | 87.10 | 0.097 | 0.728 | 0.841 | 0.916 (0.883~0.949) | |
| LR | 建模组 | 82.05 | 0.56 | 75.91 | 84.13 | 0.114 | 0.682 | 0.755 | 0.845 (0.811~0.879) |
| 验证组 | 79.95 | 0.516 | 72.63 | 82.44 | 0.124 | 0.648 | 0.719 | 0.815 (0.756~0.873) |
3 讨论 3.1 肝损伤的危险因素
术后肝损伤(肝功能障碍)是一种严重的并发症,但目前可供选择的治疗措施仍相对有限[9], 一旦发生易导致早期病死率和发病率增加[10]。在一项心脏手术术后肝损伤的研究中,肝损伤患者发生严重不良结局的比例远高于同期无肝损伤的患者(导致了更高的气管切开率、ECMO使用率、CRRT治疗和更高的住院死亡率)[11]。术后肝损伤的发生与术中出血、低血压、肝脏灌注不足、体外循环(cardiopulmonary bypas,CPB)引起的内脏血流减少、栓子以及全身炎症反应,围术期的肝毒性药物和血制品输注等多因素有关[12]。当CPB时间>180 min时,会发生肝脏代谢功能异常和肝细胞微结构的破坏[10],较长的CPB时间会导致更多的溶血,导致游离血红蛋白的增加,加速游离氰化物的立即释放,以及内源性物质的产生[13]。与此同时,在手术麻醉过程中使用的挥发性麻醉剂(如七氟烷),是公认的药物性肝损伤的原因[14],可引起药物性肝损伤,通常导致术后2~14 d ALT升高,并可表现为一系列疾病,如从无症状的肝脏生物化学紊乱[15]到急性严重肝炎。手术时间也是短期不良结局的独立预测因子,此外,反映肝脏代谢的血清指标,如AST、ALT和GGT,也常常被用于预测术后肝癌患者的生存率[16]。这些研究结果与本研究中经过LASSO回归筛选出的术后肝损伤的危险因素基本相符。尽管由于患者和手术的危险因素。术后并发症是不可避免的[17],但通过早期识别患者的危险因素和使用循证治疗方法(如在术后护理环境中及时使用抗生素[18]),并发症是可以改变和可预防的[19]。
3.2 机器学习对肝损伤的预测作用本研究在选取阴性患者时以1 ∶3的比例进行选取,既可以避免1 ∶1时可能会导致的检验效能不佳的问题,同时也可以减少大于1 ∶4的数据收集时可能增加的统计分析难度。尽管如此,阳性与阴性病例数仍相差较大,易导致训练集灵敏度较低,直接使用不平衡数据集运用KNN、SVM、XGBoost、LR4种算法构建模型进行分析,结果是不理想的,所以本研究采用了Smote算法来改善训练数据集中的数据不平衡以达到更好的结果。Smote算法就是对少数类别样本进行分析和模拟,并将人工模拟的新样本添加到数据集中,进而使原始数据中的类别不再严重失衡。
机器学习作为人工智能的重要分支,近年来已被广泛应用于医疗健康领域,在挖掘、处理医疗数据时具有极大潜力,不仅能够弥补线性模型的不足[20],并且可以为高危患者提供个性化的、智能的诊断和治疗方案。机器学习在肝病学中的应用主要包括:预测病毒性肝炎或非酒精性脂肪性肝病患者的纤维化;确定肝硬化患者是否存在食管静脉曲张;确定终末期肝病患者的预后[21],如WU等[22]采用多种机器学习方法(随机森林、朴素贝叶斯、人工神经网络和Logistic回归)对脂肪肝高危患者进行分类。经过十倍交叉验证的RF、NB、ANN和LR的受试者工作特征下面积分别为0.925、0.888、0.895和0.854;YANG等[23]应用7种ML方法预测肝移植后的急性肾损伤(acute kidney injury, AKI),梯度增压机模型的性能最佳,AUROC为0.90。这些结果表明,机器学习方法在预测特定的肝病方面具有较大的潜力,但这些研究多为单中心研究,研究人群主要针对单一移植或特定疾病的患者,对于手术患者及不同手术类型患者运用可能效果欠佳。本研究所采用的XGBoost是一种基于决策树的算法,是由Kaggle.com主办的机器学习和预测竞赛的最佳算法,它被认为是回归分析的一种有竞争力的替代方案,并成功用于预测临床不良结果[24]。结合本研究结果,综合模型灵敏度、特异度、F1分数、Brier分数、AUROC、AUPRC的比较,发现基于XGBoost算法建立预测非肝脏手术术后肝损伤风险模型为最适模型,在建模组和验证组中,基于XGBoost算法建立的模型的AUROC>0.9,AUPRC为0.841,灵敏度、特异度和F1分数皆比其他算法高,预测效能好。临床决策曲线分析用于确定在不同风险水平下执行各种不同ML模型的净获益率,以评估模型的决策效用[25],本研究中,基于XGBoost算法开发的预测模型表现出了最大的净获益率,即患者在使用该模型决策干预下能获得最大的收益。
本研究存在一定的局限性。首先,本研究的数据集虽然是多中心数据,但是均属于回顾性信息,纳入患者数量较少,且缺少外部验证;其次,本研究只对非肝脏手术这一大类手术进行了预测,未对具体手术类型进行细化研究;再次,由于病例时间跨度较大,部分纸质档病例存在字迹模糊,数据缺失,故术中血压等生命体征指标,在被选择为建模指标的过程中被舍弃,导致对术中出血和术中的生命体征变化这类肝损伤重要因素的关注度不够;最后,虽然机器学习可以分析大量的变量和数据,但由于数据量不足,可能会导致结果无效。
综上所述,本研究利用多中心数据基于多个机器学习算法开发了术后肝损伤预测模型,综合比较了各模型的预测性能和临床效益,最终筛选出了基于XGBoost算法开发的最佳预测模型,为术前肝损伤风险评估、指导围术期肝损伤预防性治疗提供可能。
| [1] |
栾正刚, 马晓春. 围手术期肝功能障碍类型及处理[J]. 中国实用外科杂志, 2014, 34(2): 123-126. LUAN Z G, MA X C. Perioperative liver dysfunction: types and management[J]. Chin J Pract Surg, 2014, 34(2): 123-126. |
| [2] |
CHETTY G, SHARPE D A, NANDI J, et al. Liver blood flow during cardiac surgery[J]. Perfusion, 2004, 19(3): 153-156. |
| [3] |
ALSHAHRANI A S, GONG G S, YOO M W. Comparison of long-term survival and immediate postoperative liver function after laparoscopic and open distal gastrectomy for early gastric cancer patients with liver cirrhosis[J]. Gastric Cancer, 2017, 20(4): 744-751. |
| [4] |
WANG H J, BAO Q Q, CAO D H, et al. Characteristics of computed tomography images for patients with acute liver injury caused by sepsis under deep learning algorithm[J]. Contrast Media Mol Imaging, 2022, 2022: 9322196. |
| [5] |
ESMAILY H, TAYEFI M, DOOSTI H, et al. A comparison between decision tree and random forest in determining the risk factors associated with type 2 diabetes[J]. J Res Health Sci, 2018, 18(2): e00412. |
| [6] |
WANG J T, ZHENG T L, LIAO Y, et al. Machine learning prediction model for post-hepatectomy liver failure in hepatocellular carcinoma: a multicenter study[J]. Front Oncol, 2022, 12: 986867. |
| [7] |
DIAB M, SPONHOLZ C, VON LOEFFELHOLZ C, et al. Impact of perioperative liver dysfunction on in-hospital mortality and long-term survival in infective endocarditis patients[J]. Infection, 2017, 45(6): 857-866. |
| [8] |
GARCÍA-ORDÁS M T, BENAVIDES C, BENÍTEZ-ANDRADES J A, et al. Diabetes detection using deep learning techniques with oversampling and feature augmentation[J]. Comput Methods Programs Biomed, 2021, 202: 105968. |
| [9] |
ÇAGLı K, BAȘAR F N, TOK D, et al. How to interpret liver function tests in heart failure patients?[J]. Turk J Gastroenterol, 2015, 26(3): 197-203. |
| [10] |
LIANG S H, LIU Y X, ZHANG B W, et al. Postoperative hepatic dysfunction after frozen elephant trunk for type A aortic dissection[J]. Front Cardiovasc Med, 2021, 8: 739606. |
| [11] |
LIN X F, XIE L F, JIANG D B, et al. Hepatic dysfunction and adverse outcomes after total arch repair of acute type A aortic dissection: application of the MELD-XI score[J]. BMC Cardiovasc Disord, 2022, 22(1): 491. |
| [12] |
黄海嵘, 景华. 心肺转流术后肝损伤机制的研究进展[J]. 医学研究生学报, 2007, 20(8): 885-889. HUANG H R, JING H. Research progress of the mechanism of hepatic injury after cardiopulmonary bypass[J]. J Med Postgrad, 2007, 20(8): 885-889. |
| [13] |
CHEUNG A T, CRUZ-SHIAVONE G E, MENG Q C, et al. Cardiopulmonary bypass, hemolysis, and nitroprusside-induced cyanide production[J]. Anesth Analg, 2007, 105(1): 29-33. |
| [14] |
LIN J, MOORE D, HOCKEY B, et al. Drug-induced hepatotoxicity: incidence of abnormal liver function tests consistent with volatile anaesthetic hepatitis in trauma patients[J]. Liver Int, 2014, 34(4): 576-582. |
| [15] |
NICOLL A, MOORE D, NJOKU D, et al. Repeated exposure to modern volatile anaesthetics may cause chronic hepatitis as well as acute liver injury[J]. BMJ Case Rep, 2012, 2012: bcr2012006543. |
| [16] |
WANG Y, JI C P, WANG Y, et al. Predicting postoperative liver cancer death outcomes with machine learning[J]. Curr Med Res Opin, 2021, 37(4): 629-634. |
| [17] |
HOLLINGER A, SIEGEMUND M, GOETTEL N, et al. Postoperative delirium in cardiac surgery: an unavoidable menace?[J]. J Cardiothorac Vasc Anesth, 2015, 29(6): 1677-1687. |
| [18] |
YOUNG P Y, KHADAROO R G. Surgical site infections[J]. Surg Clin N Am, 2014, 94(6): 1245-1264. |
| [19] |
BRATZLER D W, HOUCK P M. Antimicrobial prophylaxis for surgery: an advisory statement from the National Surgical Infection Prevention Project[J]. Am J Surg, 2005, 189(4): 395-404. |
| [20] |
BENKE K, BENKE G. Artificial intelligence and big data in public health[J]. Int J Environ Res Public Health, 2018, 15(12): E2796. |
| [21] |
FERRARESE A, SARTORI G, ORRÙ G, et al. Machine learning in liver transplantation: a tool for some unsolved questions?[J]. Transpl Int, 2021, 34(3): 398-411. |
| [22] |
WU C C, YEH W C, HSU W D, et al. Prediction of fatty liver disease using machine learning algorithms[J]. Comput Methods Programs Biomed, 2019, 170: 23-29. |
| [23] |
YANG M, PENG B, ZHUANG Q, et al. Models to predict the short-term survival of acute-on-chronic liver failure patients following liver transplantation[J]. BMC Gastroenterol, 2022, 22(1): 80. |
| [24] |
CHEN T Q, GUESTRIN C. XGBoost: a scalable tree boosting system, proceedings of the 22nd ACM SIGKDD International Conference on Knowledge Discovery and Data Mining, 2016[C]. California: ACM, 2016: 785-794. DOI: 10.1145/2939672.2939785.
|
| [25] |
VICKERS A J, HOLLAND F. Decision curve analysis to evaluate the clinical benefit of prediction models[J]. Spine J, 2021, 21(10): 1643-1648. |




