2. 637000 四川 南充,川北医学院附属医院肿瘤科;
3. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院普外科;
4. 400054 重庆, 重庆理工大学药学院
2. Department of Oncology, Affiliated Hospital of North Sichuan Medical College, Nanchong, Sichuan Province, 637000;
3. Department of General Surgery, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037;
4. College of Pharmacy, Chongqing University of Technology, Chongqing, 400054, China
胃癌作为全球范围内普遍的恶性消化道肿瘤之一,其发病率和致死率位居恶性肿瘤的前列[1-2]。在我国,胃癌的发病率及死亡率在所有恶性肿瘤中均排名第三,已成为严重威胁公共健康的主要因素之一[3]。胃癌好发于50岁以上的中老年人群,但近年来趋于年轻化。尽管医学技术的发展和医疗理念的更新促进了胃癌早期预防和诊断的进步,但在改善预后和治疗效果方面,仍面临诸多限制[4]。肿瘤精准治疗的发展对胃癌患者的临床治疗产生积极作用,但化疗相关的副作用问题依旧存在[5]。近年来,免疫治疗在肿瘤治疗领域的突破为胃癌治疗提供了新的方向,并揭示了利用胃癌患者的免疫系统以消除肿瘤具备极大的潜力[6-7]。
研究发现,胃癌组织微环境中的免疫细胞浸润对胃癌的发展和临床转归具有重要影响[8-9]。这些浸润的免疫细胞中,T细胞因其直接靶向杀伤肿瘤细胞的能力而受到广泛研究。然而,近期有研究表明,除了T细胞,B细胞亦可能在肿瘤的进程中发挥着不可忽视的作用[10]。研究显示不同肿瘤来源的B细胞发挥的作用有所不同[11-13]。一方面,B细胞能够分化为浆细胞,经抗体等促进肿瘤细胞的生长与转移;另一方面,B细胞可作为抗原递呈细胞,将其特异性识别的肿瘤抗原递呈给T细胞以促进抗肿瘤免疫应答。由此提示B细胞在肿瘤组织微环境中发挥着复杂多样的功能。尽管如此,B细胞是如何浸润至胃癌患者的肿瘤组织,以及其浸润至肿瘤组织后所发挥的免疫学作用尚不清楚。因此,本研究通过收集胃癌患者的手术样本,检测肿瘤组织和正常胃组织中B细胞的浸润分布,并分析其趋化因子受体与免疫球蛋白分子的表达情况。此外,本研究还通过体外趋化以及细胞共培养实验探究B细胞在肿瘤组织中浸润的可能途径以及肿瘤浸润B细胞对T细胞功能的调控作用。
1 资料与方法 1.1 研究对象本研究遵循的程序符合伦理学标准并经陆军军医大学第二附属医院伦理委员会审批批准(2020-YD075-01)。在患者自愿知情同意的原则上,于2021年6月至2022年6月期间,采集陆军军医大学第二附属医院普外科经手术切除的33例胃癌患者的肿瘤组织、正常胃组织以及外周血,不同类型的胃组织标本经病理学分析确认,胃癌患者的临床信息由陆军军医大学第二附属医院普外科按规定保存。
1.2 实验材料RPMI1640培养基、胎牛血清、青-链霉素、胶原酶Ⅳ均购自美国Gibco公司,DNA酶Ⅰ购自美国罗氏公司,细胞活性染料FVS700、流式染色缓冲液购自美国BD公司。PE-Cy7标记抗人CD45抗体、APC-H7标记抗人CD3抗体、BV421标记抗人CD19抗体、FITC标记抗人CXCR1抗体、PerCp-Cy5.5标记抗人CXCR2抗体、APC标记抗人CXCR3抗体、PE标记抗人CXCR4抗体、PerCp-Cy5.5标记抗人CXCR5抗体、PE标记抗人CXCR6抗体、APC标记抗人CXCR7抗体、FITC标记抗人Ki-67抗体、FITC标记抗人IgG抗体、PE标记抗人IgA抗体、PE标记抗人IgM抗体均购自美国Biolegend公司,淋巴细胞分离液购自美国GE公司,4%多聚甲醛购自武汉博士德公司,兔抗人CD19抗体购自英国Abcam公司,EZ-10总RNA小量提取试剂盒购买自上海生工公司,PrimeScriptTM RT reagent Kit试剂盒、TB Green® Premix Ex TaqTMⅡ试剂盒均购买自日本TaKaRa公司,人重组细胞因子CXCL12购自美国PeproTech公司,CD3、CD19磁珠分选试剂盒购自加拿大STEMCELL公司,Transwell趋化板购自美国康宁公司;实验使用仪器:显微镜购自日本Nikon公司,FACS Canto流式细胞仪购自美国BD公司,MACS组织分离器购自德国Miltenyi公司,生物安全柜均购自力康生物,水平离心机购自美国Beckman公司。
1.3 临床样本处理无菌条件下将收到的组织样本置于生物安全柜中,剔除脂肪组织和坏死组织,分别剪取部分组织冻于液氮和固定于4%多聚甲醛中备用。其余组织剪成米粒大小,装入含DNA酶Ⅰ(100 U/mL)、胶原酶Ⅳ(100 U/μL)和青-链霉素(1X)的RPMI1640培养基的组织分离管中。将组织分离管放入组织分离器器上混合均匀,之后转移至恒温孵箱,37 ℃孵育1 h。孵育完毕后,使用200目钢网和研磨棒,将组织稍加研磨后收集细胞悬液。将细胞悬液500×g室温离心10 min,去掉上清。外周血采用淋巴细胞分离液分离出单个核细胞,组织消化后的细胞悬液与外周血单个核细胞一同进行流式细胞术染色。
1.4 流式细胞术染色使用FVS700标记活细胞,FVS700按照1∶2 000稀释后同细胞共孵育,4 ℃,10 min。流式染色缓冲液洗涤1次,500×g室温离心5 min。使用PE-Cy7标记抗人CD45抗体、APC-H7标记抗人CD3抗体、BV421标记抗人CD19抗体标记组织和外周血中的B细胞,使用FITC标记抗人CXCR1抗体、PerCp-Cy5.5标记抗人CXCR2抗体、APC标记抗人CXCR3抗体、PE标记抗人CXCR4抗体、PerCp-Cy5.5标记抗人CXCR5抗体、PE标记抗人CXCR6抗体、APC标记抗人CXCR7抗体标记B细胞表面标志物;使用FITC标记抗人IgG抗体、PE标记抗人IgA抗体、PE标记抗人IgM抗体标记B细胞内的相应抗体。4 ℃,20 min孵育,流式染色缓冲液洗涤1次,500×g室温离心5 min。4%多聚甲醛固定,4 ℃,15 min。流式染色缓冲液洗涤1次,500×g室温离心5 min,弃上清,100 μL PBS重悬细胞后流式仪检测。
1.5 免疫组织化学染色将组织切片65 ℃烤片2 h,二甲苯脱蜡2次,每次15 min,之后进行酒精梯度水化(无水乙醇、无水乙醇、95%乙醇、85%乙醇、75%乙醇、50%乙醇,每次5 min)。使用柠檬酸钠修复液进行抗原修复,修复完毕后,用3%的H2O2溶液阻断过氧化物酶,室温10 min。再用5%的BSA封闭,37 ℃,30 min。使用兔抗人CD19抗体标记组织切片中的B细胞,稀释比例为1∶300,4 ℃孵育过夜。PBS洗涤3次,加入聚合HRP标记的抗兔/小鼠IgG二抗37 ℃孵育30 min。PBS洗涤3次,DAB显色液进行显色,苏木精复染细胞核。在光学显微镜下观察染色结果并采集图片,对B细胞进行计数,以平均每高倍镜视野(HPF,×400)中的CD19阳性细胞(棕色)数目来表示。
1.6 磁珠分选B细胞、T细胞根据磁珠分选试剂盒的说明书,使用CD19免疫磁珠分选试剂盒分离纯化出肿瘤组织与正常组织经消化后细胞悬液中的B细胞,使用CD3免疫磁珠分选试剂盒分离纯化出同一患者外周血的CD3+ T细胞。
1.7 RT-PCR采用EZ-10总RNA小量提取试剂盒,并按照其说明书提取肿瘤组织RNA,然后使用PrimeScriptTM RT reagent Kit试剂盒将得到的总RNA逆转录成cDNA,最后经TB Green® Premix Ex TaqTM Ⅱ试剂盒进行RT-PCR反应。以人GAPDH基因为内参基因进行归一化处理。引物由上海生工公司合成,CXCL12基因的引物序列为5′-TCAGCCTGAGCTACAGATGC-3′(上游);5′-CTTTAGCTTCGGGTCAATGC-3′(下游)。GAPDH基因的引物序列为5′-GCAAATTCCATGGCACCGT-3′(上游),5′-GCCCCACTTGATTTTGGAGG-3′(下游)。
1.8 趋化实验将趋化小室放入24孔细胞培养板中,在上室中加入100 μL含1×105个B细胞的RPMI1640不完全培养基,下室加入600 μL含5%血清的RPMI1640完全培养基,以此作为对照组。将下室加入重组人CXCL12(200 ng/mL)作为实验组。将细胞培养板放入孵箱37 ℃培养8 h后,对下室的B细胞进行计数。
1.9 B细胞和T细胞共培养实验在96孔平底板中包被CD3和CD28抗体(浓度分别为1、2 μg/mL),37 ℃孵育2 h。将磁珠分选出的肿瘤B细胞和正常B细胞分别与T细胞共培养。共培养体系中B细胞与T细胞的比例设置为1∶4,细胞培养3 d后进行流式染色,用APC-H7标记抗人CD3抗体标记T细胞,并用FITC标记的Ki-67检测T细胞的增殖能力。
1.10 统计学分析数据采用Prism 9.0软件进行统计分析,实验结果以x±s表示。两两之间采用t检验,P<0.05则为差异有统计学意义。
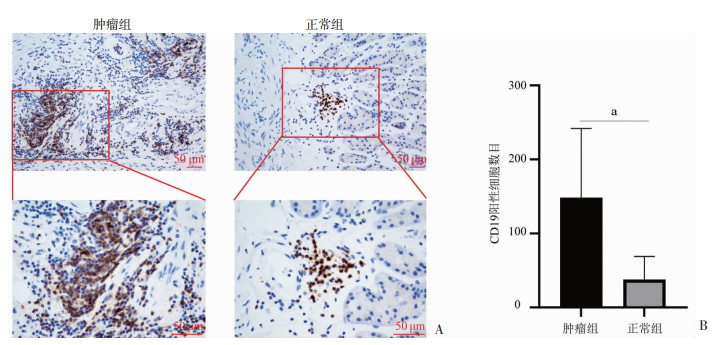
2 结果 2.1 B细胞在胃癌患者不同组织中的浸润水平采用免疫组织化学染色法,以定量评估胃癌患者不同组织中B细胞的浸润程度(图 1A),结果显示:肿瘤组织中有大量的CD19阳性细胞浸润(149/HPF),而正常组织中的CD19阳性细胞浸润数目相对较少(38/HPF);肿瘤组织中的CD19阳性细胞数目显著高于正常组织(P<0.01,图 1B),表明B细胞在胃癌患者的肿瘤组织中浸润增加。
|
| A: 胃癌患者肿瘤组织和正常组织的CD19免疫组织化学染色;B: 配对的肿瘤组织和正常组织中CD19阳性细胞数目统计(n=33,x±s) a: P<0.01 图 1 胃癌患者中不同组织中原位CD19+ B细胞免疫组织化学染色观察 |
2.2 CXCL12-CXCR4轴参与调控B细胞在肿瘤组织中的浸润
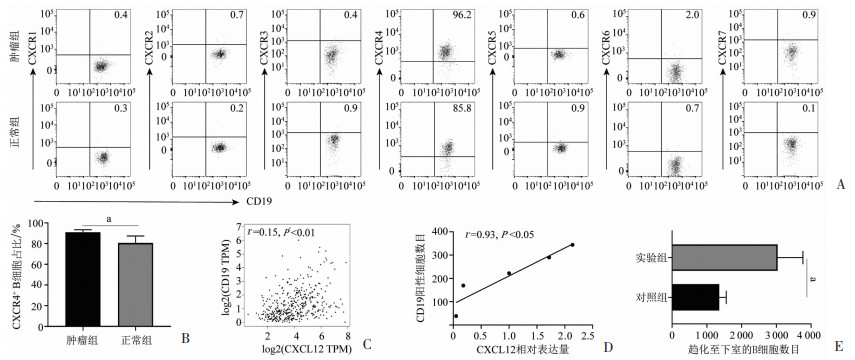
为探究胃癌患者肿瘤组织中B细胞浸润增加的潜在机制,本研究采用流式细胞术染色分析肿瘤组织及正常胃组织中B细胞的趋化因子受体表达水平,结果显示:肿瘤组织和正常组织中的B细胞均低表达趋化因子受体CXCR1、CXCR2、CXCR3、CXCR5、CXCR6、CXCR7,而CXCR4则在肿瘤组织和正常组织中的B细胞中高表达(图 2A)。与正常组织中的B细胞相比,肿瘤组织来源的B细胞表达更高水平的CXCR4(91.1% vs 80.8%,P<0.05,图 2B)。进一步对TCGA数据库分析发现,CXCR4的趋化因子配体CXCL12在肿瘤组织中的表达水平与CD19表达水平呈显著正相关(r=0.15,P<0.01, 图 2C)。此外,对临床样本的分析表明,肿瘤组织中CXCL12的水平与B细胞的浸润数目亦呈正相关(r=0.93,P<0.05,图 2D)。在趋化实验中,相较于对照组,加入CXCL12的实验组中趋化至下室的B细胞数目显著增加(3 039 vs 1 356,P<0.05,图 2E),由此提示肿瘤组织中B细胞浸润的增加可能由CXCL12-CXCR4趋化轴所介导。
|
| a: P<0.05 A:组织中B细胞表达趋化因子受体情况的流式图;B:组织中B细胞表达CXCR4的差异(n=4,x±s);C:TCGA数据库分析CD19和CXCL12在胃癌中的相关性;D: 肿瘤组织中CXCL12基因表达与B细胞浸润数目的相关性(n=5,x±s);E:趋化实验验证CXCL12-CXCR4轴系对胃癌患者B细胞的趋化(n=3,x±s) 图 2 B细胞趋化因子受体表达情况以及CXCL12与B细胞浸润相关性分析和趋化实验 |
2.3 肿瘤组织浸润B细胞表达IgG、IgM及IgA的水平分析
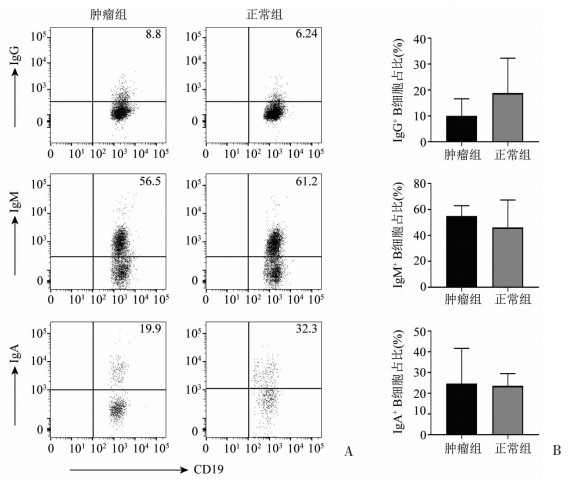
流式细胞术检测结果显示:在正常组织中,B细胞表达的IgG、IgM及IgA百分比分别为18.8%、46.2%、23.6%;在肿瘤组织中,B细胞表达的IgG、IgM及IgA百分比分别为10.0%、55.1%、24.7%。IgG、IgM及IgA在肿瘤组织和正常组织的B细胞中表达水平基本相当(图 3),提示胃癌组织微环境并未促使B细胞向浆细胞分化。
|
| A:组织中B细胞表达IgG、IgM、IgA水平的流式图;B:组织中B细胞抗体水平的差异统计(n=5,x±s) 图 3 组织中B细胞表达IgG、IgM、IgA情况 |
2.4 肿瘤组织浸润B细胞对T细胞增殖的影响
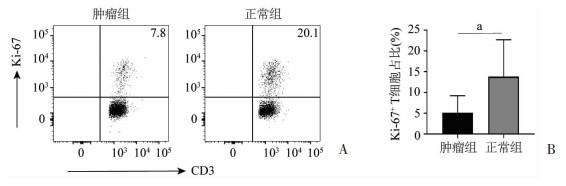
流式细胞术检测共培养体系中T细胞的增殖水平显示,与正常组织来源B细胞共培养的T细胞表达的Ki-67水平为13.9%,与肿瘤组织来源B细胞共培养的T细胞表达的Ki-67水平为5.1%,二者的差异比较具有统计学意义(P<0.01,图 4),表明肿瘤组织来源的B细胞具有抑制T细胞增殖的能力。
|
| A:与肿瘤组织和正常组织来源B细胞共培养的T细胞增殖效果流式图;B:与肿瘤组织和正常组织来源B细胞共培养的T细胞增殖效果统计结果(n=4,x±s) a: P<0.01 图 4 不同组织来源B细胞对自体外周T细胞增殖作用的影响 |
3 讨论
胃癌是严重威胁人类生命健康的恶性肿瘤之一。目前认为,胃癌的发生发展极为复杂,其肿瘤微环境中免疫细胞的浸润及功能改变已被公认为是影响疾病进程的关键,故揭示免疫细胞在胃癌微环境中的应答与调控是胃癌免疫研究的重要课题。早期关于胃癌免疫的研究主要聚焦于T细胞免疫,但随着研究的深入发现,仅依靠T细胞免疫并不能很好地预测和解释胃癌的复杂性和临床治疗效果,而B细胞作为胃癌组织浸润的另一类重要免疫细胞,其在胃癌免疫中的作用尚不清楚。
通过收集胃癌患者的临床样本,本研究发现肿瘤组织中B细胞的浸润数目明显高于正常胃组织,且高表达趋化因子受体CXCR4;同时趋化实验显示CXCR4的相应配体CXCL12对B细胞具有明显的趋化效应,提示B细胞在胃癌患者肿瘤组织中的浸润增加很可能由CXCL12-CXCR4轴所介导。文献报道在肝癌中,肿瘤来源的CXCL10可募集一群表达CXCR3的B细胞参与疾病的进程[14];而在结直肠癌[15]和头颈癌[16]中,CXCL13-CXCR5轴亦可促进B细胞向肿瘤组织中聚集。然而,胃癌患者肿瘤组织浸润的B细胞仅低表达趋化因子受体CXCR3和CXCR5,提示CXCR3和CXCR5并不参与调控B细胞在肿瘤组织中的浸润增加。
研究表明,B细胞在不同癌症患者肿瘤组织中的生物学功能有所不同。文献报道在肝癌中,肿瘤组织浸润的B细胞通过分泌IgG介导肝癌的免疫逃逸[19]。而在卵巢癌中,B细胞浸润至肿瘤组织后却利用IgA引导髓系细胞杀伤肿瘤细胞[20]。在本研究中,与正常胃组织中的B细胞相比,胃癌患者肿瘤组织中的B细胞表达的IgG与IgA水平均无明显差异,提示胃癌微环境并未促使B细胞向浆细胞分化以影响疾病的进程。然而,本研究利用胃癌患者不同组织中的B细胞与外周T细胞共培养发现,肿瘤组织来源的B细胞能够显著抑制T细胞的增殖能力,表明胃癌患者肿瘤组织浸润的B细胞发挥了免疫抑制功能。文献报道肿瘤组织浸润的B细胞可通过上调表达免疫抑制性分子PD-L1,或分泌调节性细胞因子IL-10、IL-35和TGF-β参与抑制T细胞的功能[21-23]。然而,由于临床样本收集不易,以及分离获得足够用于体外培养的B细胞具有一定的难度,本研究并没有验证胃癌患者肿瘤组织来源的B细胞抑制T细胞功能的具体机制,后续的研究将进一步探究肿瘤浸润B细胞是通过何种途径参与抑制T细胞的功能。
综上,本研究初步证实了胃癌患者肿瘤组织中的B细胞浸润增加并介导免疫抑制功能,由此导致胃癌的进展。后续研究将进一步扩大收集胃癌患者的临床样本,并深入探讨B细胞在胃癌组织发挥免疫抑制功能及其促疾病进展的分子机制,进而为探索胃癌免疫治疗新的潜在靶标提供实验证据。
| [1] |
SMYTH E C, NILSSON M, GRABSCH H I, et al. Gastric cancer[J]. Lancet, 2020, 396(10251): 635-648. |
| [2] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. |
| [3] |
CAO W, CHEN H D, YU Y W, et al. Changing profiles of cancer burden worldwide and in China: a secondary analysis of the global cancer statistics 2020[J]. Chin Med J, 2021, 134(7): 783-791. |
| [4] |
CHEONG J H, YANG H K, KIM H, et al. Predictive test for chemotherapy response in resectable gastric cancer: a multi-cohort, retrospective analysis[J]. Lancet Oncol, 2018, 19(5): 629-638. |
| [5] |
SASAKO M, SAKURAMOTO S, KATAI H, et al. Five-year outcomes of a randomized phase Ⅲ trial comparing adjuvant chemotherapy with S-1 versus surgery alone in stage Ⅱ or Ⅲ gastric cancer[J]. J Clin Oncol, 2011, 29(33): 4387-4393. |
| [6] |
O'DONNELL J S, TENG M W L, SMYTH M J. Cancer immunoediting and resistance to T cell-based immunotherapy[J]. Nat Rev Clin Oncol, 2019, 16(3): 151-167. |
| [7] |
PAN C X, LIU H T, ROBINS E, et al. Next-generation immuno-oncology agents: current momentum shifts in cancer immunotherapy[J]. J Hematol Oncol, 2020, 13(1): 29. |
| [8] |
PITT J M, MARABELLE A, EGGERMONT A, et al. Targeting the tumor microenvironment: removing obstruction to anticancer immune responses and immunotherapy[J]. Ann Oncol, 2016, 27(8): 1482-1492. |
| [9] |
DENKERT C, VON MINCKWITZ G, DARB-ESFAHANI S, et al. Tumour-infiltrating lymphocytes and prognosis in different subtypes of breast cancer: a pooled analysis of 3771 patients treated with neoadjuvant therapy[J]. Lancet Oncol, 2018, 19(1): 40-50. |
| [10] |
GARAUD S, BUISSERET L, SOLINAS C, et al. Tumor infiltrating B-cells signal functional humoral immune responses in breast cancer[J]. JCI Insight, 2019, 5(18): e129641. |
| [11] |
CABRITA R, LAUSS M, SANNA A, et al. Tertiary lymphoid structures improve immunotherapy and survival in melanoma[J]. Nature, 2020, 577(7791): 561-565. |
| [12] |
LU Y W, ZHAO Q Y, LIAO J Y, et al. Complement signals determine opposite effects of B cells in chemotherapy-induced immunity[J]. Cell, 2020, 180(6): 1081-1097.e24. |
| [13] |
GARNELO M, TAN A, HER Z, et al. Interaction between tumour-infiltrating B cells and T cells controls the progression of hepatocellular carcinoma[J]. Gut, 2017, 66(2): 342-351. |
| [14] |
WEI Y, LAO X M, XIAO X, et al. Plasma cell polarization to the immunoglobulin G phenotype in hepatocellular carcinomas involves epigenetic alterations and promotes hepatoma progression in mice[J]. Gastroenterology, 2019, 156(6): 1890-1904.e16. |
| [15] |
BINDEA G, MLECNIK B, TOSOLINI M, et al. Spatiotemporal dynamics of intratumoral immune cells reveal the immune landscape in human cancer[J]. Immunity, 2013, 39(4): 782-795. |
| [16] |
ZHANG S W, WANG B Z, MA F, et al. Characteristics of B lymphocyte infiltration in HPV+ head and neck squamous cell carcinoma[J]. Cancer Sci, 2021, 112(4): 1402-1416. |
| [17] |
NI Z L, XING D, ZHANG T M, et al. Tumor-infiltrating B cell is associated with the control of progression of gastric cancer[J]. Immunol Res, 2021, 69(1): 43-52. |
| [18] |
LIU H F, WU J, XU X Y, et al. Peritumoral TIGIT+CD20+ B cell infiltration indicates poor prognosis but favorable adjuvant chemotherapeutic response in gastric cancer[J]. Int Immunopharmacol, 2022, 108: 108735. |
| [19] |
CHEN M M, XIAO X, LAO X M, et al. Polarization of tissue-resident TFH-like cells in human hepatoma bridges innate monocyte inflammation and M2b macrophage polarization[J]. Cancer Discov, 2016, 6(10): 1182-1195. |
| [20] |
BISWAS S, MANDAL G, PAYNE K K, et al. IgA transcytosis and antigen recognition govern ovarian cancer immunity[J]. Nature, 2021, 591(7850): 464-470. |
| [21] |
SHALAPOUR S, LIN X J, BASTIAN I N, et al. Inflammation-induced IgA+ cells dismantle anti-liver cancer immunity[J]. Nature, 2017, 551(7680): 340-345. |
| [22] |
PYLAYEVA-GUPTA Y, DAS S, HANDLER J S, et al. IL35-producing B cells promote the development of pancreatic neoplasia[J]. Cancer Discov, 2016, 6(3): 247-255. |
| [23] |
HARRIS R J, WILLSMORE Z, LADDACH R, et al. Enriched circulating and tumor-resident TGF-β+ regulatory B cells in patients with melanoma promote FOXP3+ Tregs[J]. Oncoimmunology, 2022, 11(1): 2104426. |




