2. 400038 重庆,陆军军医大学(第三军医大学)药学与检验医学系微生物与生化药学教研室,国家免疫生物制品工程技术研究中心;
3. 050081 石家庄,陆军军医大学士官学校基础部
2. Department of Microbiology and Biochemical Pharmacy, National Engineering Research Center of Immunological Products, Faculty of Pharmacy and Laboratory Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Department of Basic Courses, Noncommissioned Officers School, Army Medical University (Third Military Medical University), Shijiazhuang, Hebei Province, 050081, China
《柳叶刀》最新报道金黄色葡萄球菌(Staphylococcus aureus, S. aureus,以下简称金葡菌)2019年在全球导致110万人死亡,位居33种人体主要致病菌首位[1]。与此同时,金葡菌也是我国临床感染风险最高的革兰氏阳性致病菌。长期以来金葡菌被认为是经典的胞外菌,大量相关研究主要针对于金葡菌效应蛋白特别是分泌蛋白与宿主细胞胞膜或胞外分子的互作,并发现了一系列具有裂解细胞作用的溶血素(如Hlα[2]、Hlγ[3]等)、杀白细胞素(如PVL[4]、LukED[5]、LukGH[6]等)、酚可溶性蛋白(如PSMα[7]、PSMβ[8]等)等膜打孔蛋白,同时也发现了一系列细胞黏附分子(如FnBP[9]、IsdA[10]等)、补体抑制因子Efb[11]等免疫逃逸分子。然而,相关机制的揭示并未有效解决金葡菌感染难题。
研究报道,金葡菌能在宿主上皮细胞、内皮细胞、成纤维细胞、角质细胞以及中性粒细胞、巨噬细胞等吞噬细胞中生长繁殖,其细胞内生存已被证明是金葡菌逃避免疫系统监视和抗生素杀伤的关键因素之一[12]。巨噬细胞是一类驻留在组织中寿命较长且可迁移进入体液循环的吞噬细胞,已被证实是大部分胞内菌如结核分枝杆菌、单核李斯特菌等的理想寄居场所[13]。然而金葡菌在巨噬细胞中生存繁殖机制尚不清楚。本研究拟以金葡菌、RAW264.7巨噬细胞系为实验对象,通过课题组前期构建的金葡菌分泌蛋白真核系统表达载体库[11],利用DNA转染表达技术,建立金葡菌胞内感染状态下的分泌蛋白高通量筛选体系,探索金葡菌胞内感染状态下所需的关键分泌蛋白。
1 材料与方法 1.1 实验菌株、质粒与试剂金葡菌RN4220、USA300/Eno-Antares2菌株、PBT2质粒由陆军军医大学饶贤才教授惠赠;金葡菌USA300菌株由上海交通大学李敏教授惠赠;DH5α大肠埃希菌购于北京天根(Tiangen)公司;高糖DMEM培养基、胰酶购自上海源培生物科技有限公司;胎牛血清购自Moregate Biotech;哥伦比亚血琼脂平板购自重庆庞统医疗器械有限公司;细菌培养用LB、TSB和TSA购自英国Oxoid公司;质粒抽提试剂盒购自康为世纪生物科技有限公司;INVI DNA RNA转染试剂购自美国Invigentech(英克)公司;溶葡球菌酶、庆大霉素、溶菌酶缓冲液以及Triton×100购自生工生物工程(上海)股份有限公司;防荧光淬灭剂购自默克Sigma公司;免疫荧光固定液、DAPI染色液、载玻片以及CCK-8试剂盒购自上海碧云天生物技术股份有限公司;荧光素酶底物hydrofurimazine (HFZ) 购自MCE公司;金葡菌分泌蛋白真核表达质粒库为本课题组构建[11]。
1.2 RAW264.7细胞质粒转染剂量探索取RAW264.7细胞系接种于提前铺好细胞爬片的24孔板中,每孔2×105 个细胞,次日转染pcDNA3.0-EGFP,转染量分别为0.5、1.0、2.0 μg/孔,每种剂量3个复孔。免疫荧光组转染24 h后弃去培养基,PBS清洗3次,每孔加入300 μL免疫荧光固定液,室温固定15 min,PBS清洗3次,再加入DAPI 300 μL避光染色5 min,PBS清洗3次后,用眼科镊夹取爬片倒扣在提前加好防荧光淬灭剂的载玻片上,保存于湿盒中,荧光显微镜488 nm查看蛋白表达情况,UV查看细胞数目情况;细胞活力组24孔板加入CCK-8溶液,每孔500 μL,于培养箱中孵育,待各组之间颜色有较明显差异时,每孔吸取100 μL至96孔板。以空白孔为对照,酶标仪设置波长450 nm测定各孔吸光度[D(450)]值,以相对应的平均D(450)值表示细胞转染后的活力大小。实验重复3次。
1.3 金葡菌RAW264.7细胞感染复数(multiplicity of infection,MOI)探索MOI设置为0.5、1.0、5.0、10.0,摸索USA300感染RAW264.7的最佳MOI。取RAW264.7接种于24孔板中,4×105/孔,次日接种经活化的USA300于37 ℃,5% CO2条件下感染1 h;弃上清,加入溶葡球菌酶的完全培养基于37 ℃孵箱中清除胞外菌30 min;弃上清,加入含25 μg/mL的庆大霉素和完全培养基维持细胞。分别在感染后的1、2、4、6、8 h弃去上清,PBS清洗3次,加入120 μL 0.05%Triton×100溶液,摇床缓慢震摇10 min,充分裂解细胞使其释放细胞内菌;将所有裂解液收集至无菌EP管中,稀释10~100倍,分别取5 μL滴于TSA培养板上,37 ℃倒置过夜,次日统计菌落个数。实验重复3次。
1.4 金葡菌胞内生存关键分泌蛋白筛选取RAW264.7接种于24孔板中,每孔2×105 个细胞,次日转染合适剂量对照质粒pcDNA3.0与质粒库中的78种质粒,第3天感染USA300,清菌、裂解、收样、稀释以及菌落统计与1.3一致。实验重复3次。
1.5 过表达菌株构建及其胞内生存实验从初筛结果中筛选出8种分泌蛋白,将其表达序列合成到本课题组前期开发的金葡菌过表达载体P1载体上[14]。将质粒电转入金葡菌RN4220中,涂布于含20 μg/mL氯霉素TSA平板筛选。抽提所得修饰后的质粒,电转入USA300/Eno-Antares2感受态中,37 ℃孵箱培养过夜,挑单克隆于含20 μg/mL氯霉素TSB中,培养后提质粒扩增并测序验证。得到具有相应分泌蛋白的过表达菌株及P1空载体菌株。后续感染、清菌及收样过程同1.3,将菌液分别加到不透光96孔板中,每孔50 μL,设3个复孔,再加入等体积100 μmol/L荧光素酶底物HFZ,震荡后立即测其化学发光值,荧光强度间接表明胞内菌的情况。
1.6 敲除菌株构建及其胞内生存实验合成筛选到的LukF-PV基因上下游1 000 bp片段至质粒PBT2中,采用同源重组的方式进行敲除菌的制作。将质粒电转入金葡菌RN4220中,涂布于含20 μg/mL氯霉素TSA平板筛选。抽提所得修饰后的质粒,电转入USA300感受态中,37 ℃孵箱培养过夜。挑单克隆于含20 μg/mL氯霉素TSB中,经培养后,提质粒酶切验证。所得阳性USA300菌株以1 ∶1 000比例接种于含20 μg/mL氯霉素TSB中,42 ℃培养过夜。提取基因组,PCR扩增筛选左臂或右臂重组的单克隆。将发生重组的菌液接种于无抗TSB中25 ℃过夜,再划线于无抗TSA平板上37 ℃过夜。挑取单克隆分别划线于无抗TSA和含20 μg/mL氯霉素TSA平板上,37 ℃培养。无抗平板上生长而氯霉素抗性平板上不生长的菌落即为疑似敲除株。提取疑似敲除菌株基因组,PCR扩增并将扩增产物送DNA测序,得到正确的敲除菌株。后续胞内生存实验与1.5一致。
1.7 金葡菌生长曲线将USA300和相应过表达菌株及敲除菌株分别挑取单克隆接种于5 mL TSB中,37 ℃过夜培养。次日按1 ∶10 000转接于1.5 mL EP管中,200 μL/孔加入96孔板中,放入微生物生长曲线测定仪中,每隔30 min测定菌液600 nm处吸光值[D(600)],检测至24 h。培养时间与D(600)值绘制生长曲线。
1.8 统计学分析本实验数据采用GraphPad Prism 8.0处理,结果用 x±s表示,各组间利用t检验进行统计学分析,P<0.05为差异有统计学意义。
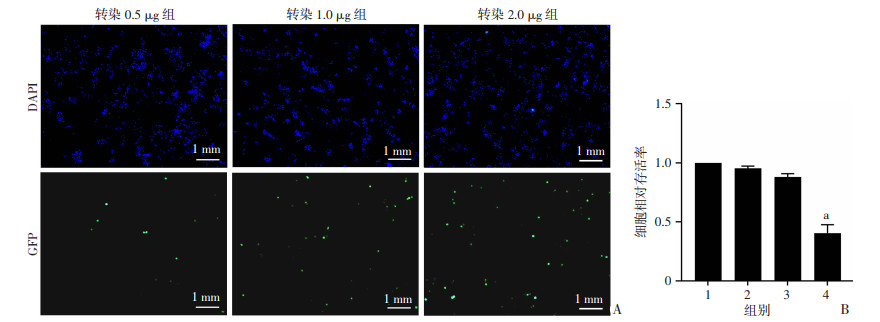
2 结果 2.1 RAW264.7细胞质粒转染剂量确定利用DNA转染技术可以实现低成本的高通量蛋白表达细胞阵列的构建,然而DNA转染会导致细胞生理状态的改变,需要探索合适的转染剂量。0.5、1.0、2.0 μg/孔pcDNA3.0-EGFP转染RAW264.7细胞24 h后,3个剂量组均有绿色荧光蛋白表达,且随着转染剂量的增加荧光蛋白表达强度变强。相同转染剂量的CCK-8实验结果显示,在转染剂量为2.0 μg时细胞活力明显下降,综合考虑转染效率和细胞活力,确定转染剂量为1.0 μg/孔(图 1)。
|
| A:RAW264.7转染不同剂量pcDNA3.0-EGFP后的荧光蛋白表达情况;B:RAW264.7转染不同剂量pcDNA3.0-EGFP后的细胞存活率差异(n=3,x±s) 1:未转染组;2:转染0.5 μg组;3:转染1.0 μg组;4:转染2.0 μg组;a:P<0.05,与未转染组比较 图 1 RAW264.7细胞质粒转染剂量探索 |
2.2 金葡菌感染RAW264.7细胞MOI的确定
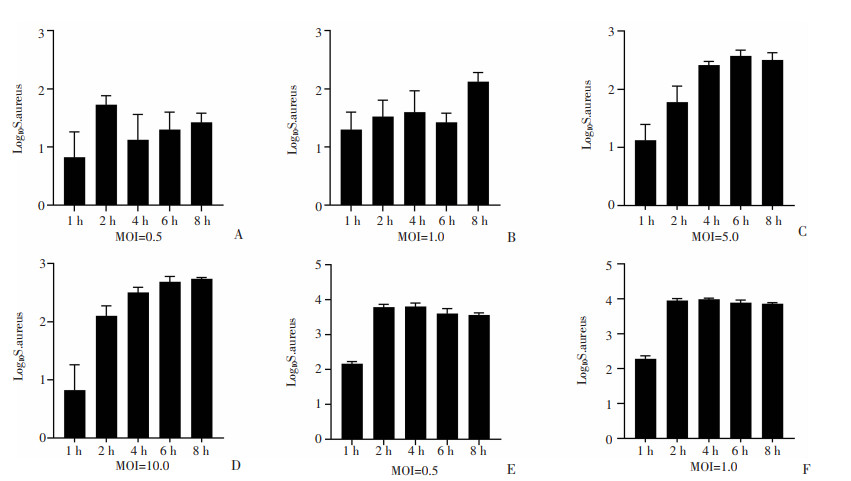
金葡菌感染复数直接影响细胞与胞内菌生存,过大会增加细胞清菌负荷导致其直接死亡,过小则可能达不到金葡菌合适生存数量阈值,需要探索合适的感染复数。如图 2A~D所示,细胞未转染空载质粒直接感染时,在MOI=5.0和10.0时,胞内菌的数目在4 h后持续增加,表明此时MOI过大,胞内菌的增殖不能被抑制,对于后续以胞内菌个数为基准的筛选实验可能造成假阳性的结果。当转染空载质粒时,后续选择MOI=0.5和1.0,如图 2E~F所示,胞内菌数量在4 h以后维持平稳,即巨噬细胞能够抑制细菌在胞内的增殖,综合考虑细菌在胞内发挥效应的条件,确定感染MOI为1.0,感染时间为4 h。
|
| A~D分别为MOI设置为0.5、1.0、5.0、10.0时未转染空载质粒的RAW264.7各时间点胞内菌的数量;E、F分别为MOI设置为0.5、1.0时转染空载质粒后RAW264.7各时间点胞内菌的数量 图 2 金葡菌感染RAW264.7细胞MOI的确定 (n=3,x±s) |
2.3 金葡菌胞内生存关键分泌蛋白筛选
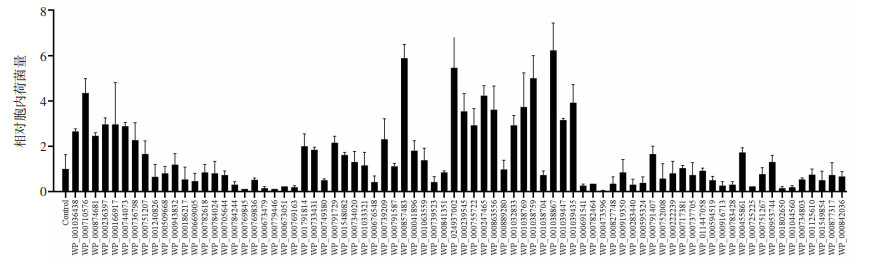
利用金葡菌分泌蛋白真核表达质粒库构建能够表达金葡菌分泌蛋白的RAW264.7细胞阵列,金葡菌感染4 h后,胞内生存关键分泌蛋白筛选结果如图 3所示,与空载质粒对照组相比,数个分泌蛋白表达质粒均能促进金葡菌在胞内的增殖。我们从中挑选了促进胞内菌增殖效果最显著的8个分泌蛋白表达质粒,分别是WP_001036438(hypothetical protein)、WP_000710576 (1-phosphatidylinositol phosphodiesterase)、WP_000874681 (Superoxide dismutase [Mn/Fe]2)、WP _000857483(alpha-hemolysin)、WP_024937002 (Panton-Valentine leukocidin, LukF-PV)、WP_000239545 (Panton-Valentine leukocidin, LukS-PV)、WP_001038759 (Serine protease E)、WP_001038867(Serine protease C),进行下一步实验。
|
| 图 3 金葡菌胞内生存关键分泌蛋白筛选结果 |
2.4 胞内生存关键分泌蛋白过表达金葡菌构建与验证
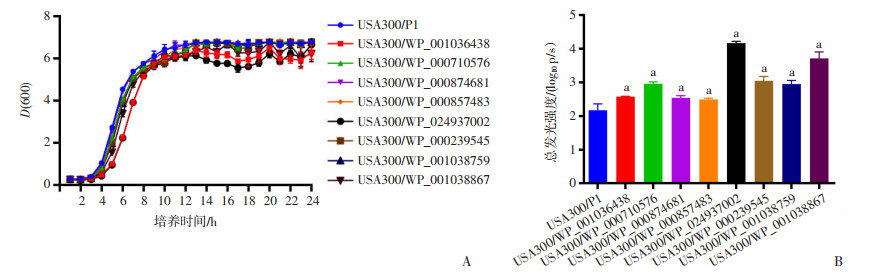
前期我们通过转染金葡菌分泌蛋白表达质粒从而促进金葡菌的胞内增殖,为了更准确模拟人体感染金葡菌后细菌发挥效应的过程,将实验1.4中筛选出来的8种分泌蛋白表达序列合成到本课题组前期构建的金葡菌过表达载体P1上,再分别电转到USA300/Eno-Antares2金葡菌中,对照组为P1空载体电转至USA300/Eno-Antares2金葡菌中。以不同过表达菌株直接感染细胞,进一步验证其促进胞内菌生长的能力。如图 4A所示,与对照组相比,8种过表达菌株24 h内在TSB培养基中生长无明显差异,表明正常条件下过表达上述基因对USA300菌株生长无影响。图 4B显示,8种过表达菌株感染后其荧光强度值与对照组相比均有差异,表明感染以上8种分泌蛋白过表达的菌株后,胞内菌的数量均有明显增加,表明上述分泌蛋白均能促进USA300在RAW264.7中的胞内增殖。
|
| A: USA300/P1及8种过表达菌株生长曲线; B: 8种过表达菌株感染RAW264.7后胞内菌荧光强度检测 a:P<0.05,与USA300/P1比较 图 4 胞内生存关键分泌蛋白过表达金葡菌构建与验证 (n=3,x±s) |
2.5 胞内生存关键分泌蛋白敲除菌构建与验证
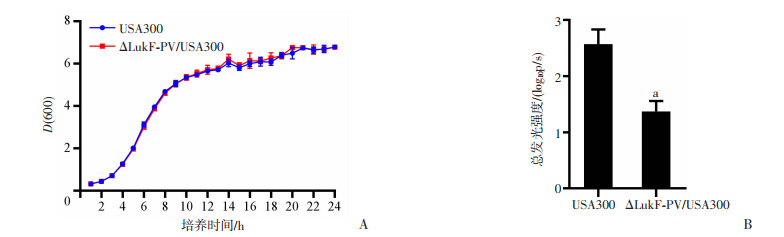
研究结果显示:WP_024937002分泌蛋白(LukF-PV)促进金葡菌胞内生存作用最强(图 4A),因此构建其敲除菌株ΔLukF-PV/USA300,进一步证实其在金葡菌在RAW264.7中增殖生存中起的重要作用。生长曲线(图 5A)可见:构建的敲除菌株与对照组相比,在TSB培养基中24 h内生长无明显差异,表明正常条件下敲除上述基因对USA300菌株生长无影响;ΔLukF-PV/USA300感染巨噬细胞后其荧光强度相比对照组明显降低(图 5B),表明LukF-PV在真实世界的感染中是金葡菌胞内生存的关键分泌蛋白。
|
| A:ΔLukF-PV/USA300细菌生长曲线;B:ΔLukF-PV/USA300感染RAW264.7后胞内菌荧光强度检测 a:P<0.05,与USA300比较 图 5 敲除菌株的构建及胞内生存实验 (n=3,x±s) |
3 讨论 3.1 构建金葡菌胞内生存关键分泌蛋白筛选体系的可行性
金黄色葡萄球菌是一种广泛存在并易定植于宿主体内的革兰氏阳性致病菌,由于其易产生多种抗生素抗性,具有扰乱宿主免疫系统并逃避被清除的能力,因此引起的感染而继发的多种相关并发症的发病率和致死率都较高,至今仍旧是困扰人类的重大临床难题。巨噬细胞是先天免疫系统中清除细菌病原体的重要细胞类型,它们的主要功能是维持抗菌免疫,摄取和杀死入侵的细菌,在感染部位释放炎症介质,以维持宿主的即时免疫反应并建立长期免疫适应性[15-16]。以往研究显示金葡菌可在巨噬细胞中生长繁殖,这可能是其躲避宿主免疫清除以及抗生素杀伤的重要策略,然而金葡菌在巨噬细胞中生存的机制仍不清楚。课题组前期通过生物信息学预测,发现不同金葡菌菌株可分泌86~125种分泌蛋白,其中还有许多具有未知的功能,但缺乏有效的高通量筛选手段。因此,建立有效的金葡菌胞内生存关键分泌蛋白高通量筛选体系,对于进一步阐明金葡菌胞内感染机制有重要意义。本实验初步建立了一种简便、重复性好的新方法来筛选有助于胞内金葡菌生存的关键蛋白。另外,我们的筛选结果以及过表达菌的验证实验中都显示,已知与金葡菌胞内生存有关的分泌蛋白α-hemolysin(WP_000857483)具有促进金葡菌胞内生存的功能,说明本实验的准确性好,实验方法可行[17]。
3.2 金葡菌胞内生存关键分泌蛋白筛选体系条件摸索质粒DNA转染是一种较为经济便捷的细胞表达外源蛋白的技术,然而外源侵入的DNA可激活巨噬细胞的相关免疫反应,导致细胞状态发生改变。因此我们首先筛选合适的转染剂量,以期达到既能让RAW264.7表达外源蛋白,又不明显影响其细胞活力的效果。以EGFP绿色荧光蛋白表达情况作为转染效率的观察,转染2.0 μg/孔时,蛋白表达水平最高,但细胞活力明显被抑制。转染0.5 μg/孔时,虽然细胞活力与对照组相比无显著性差异,但外源蛋白的表达水平较低可能造成某些分泌蛋白的漏筛。转染1.0 μg/孔时,蛋白表达情况可观,细胞活力受到的影响较小,因此综合外源蛋白表达水平及细胞活力两个因素确定质粒转染量为1.0 μg/孔。
病原分子相关模式等外源刺激可有效激活巨噬细胞,导致其吞噬杀伤功能的改变。因此质粒DNA的转染操作极有可能影响巨噬细胞吞噬和清除金葡菌的能力。我们的实验结果发现当未转染质粒,MOI为5.0和10.0时,RAW264.7不能控制金葡菌的增殖,说明此时感染复数过大,易导致筛选出现假阳性结果。另外发现转染pcDNA3.0后,RAW264.7吞噬金葡菌量增加,且随着时间增加,清除胞内菌的能力有所下降。因此对转染pcDNA3.0后的RAW264.7的MOI再次进行优化。最终确定MOI为1.0,感染后4 h观察金葡菌胞内生存差异较为合适。
3.3 金葡菌胞内生存关键分泌蛋白筛选体系的意义耐甲氧西林金葡菌可能永远与人类共存,正如2017年世卫组织报告所强调的那样,需要继续努力研发新抗生素和创新预防方法。因此,在抗生素耐药性不断增加的时代,了解金葡菌胞内生存关键分泌蛋白及其影响金葡菌在巨噬细胞内的存活至关重要,这些知识可以为开发新的治疗策略提供信息,以对抗金黄色葡萄球菌感染。本研究成功构建了有效且较为经济的金黄色葡萄球菌胞内生存关键分泌蛋白筛选体系,成功初步筛选出对金葡菌在胞内生存有作用的效应分泌蛋白,为金葡菌后续胞内感染机制研究提供了有效工具,同时也为其它胞内感染病原微生物的感染机制研究提供了可借鉴方法。
| [1] |
LEE A S, DE LENCASTRE H, GARAU J, et al. Methicillin-resistant Staphylococcus aureus[J]. Nat Rev Dis Primers, 2018, 4: 18033. DOI:10.1038/nrdp.2018.33 |
| [2] |
WILKE G A, BUBECK WARDENBURG J. Role of a disintegrin and metalloprotease 10 in Staphylococcus aureus alpha-hemolysin-mediated cellular injury[J]. Proc Natl Acad Sci U S A, 2010, 107(30): 13473-13478. DOI:10.1073/pnas.1001815107 |
| [3] |
PIVARD M, CALDELARI I, BRUN V, et al. Complex regulation of gamma-hemolysin expression impacts Staphylococcus aureus virulence[J]. Microbiol Spectr, 2023, 11(4): e0107323. DOI:10.1128/spectrum.01073-23 |
| [4] |
GILLET Y, TRISTAN A, RASIGADE J P, et al. Prognostic factors of severe community-acquired staphylococcal pneumonia in France[J]. Eur Respir J, 2021, 58(5): 2004445. DOI:10.1183/13993003.04445-2020 |
| [5] |
ALONZO F 3rd, KOZHAYA L, RAWLINGS S A, et al. CCR5 is a receptor for Staphylococcus aureus leukotoxin ED[J]. Nature, 2013, 493(7430): 51-55. DOI:10.1038/nature11724 |
| [6] |
BADARAU A, ROUHA H, MALAFA S, et al. Structure-function analysis of heterodimer formation, oligomerization, and receptor binding of the Staphylococcus aureus bi-component toxin LukGH[J]. J Biol Chem, 2015, 290(1): 142-156. DOI:10.1074/jbc.M114.598110 |
| [7] |
MATSUMOTO M, NAKAGAWA S, ZHANG L Z, et al. Interaction between Staphylococcus Agr virulence and neutrophils regulates pathogen expansion in the skin[J]. Cell Host Microbe, 2021, 29(6): 930-940.e4. DOI:10.1016/j.chom.2021.03.007 |
| [8] |
HU Z C, KOPPARAPU P K, EBNER P, et al. Phenol-soluble modulin α and β display divergent roles in mice with staphylococcal septic arthritis[J]. Commun Biol, 2022, 5(1): 910. DOI:10.1038/s42003-022-03839-2 |
| [9] |
PONTES D, INNOCENTIN S, DEL CARMEN S, et al. Production of fibronectin binding protein A at the surface of Lactococcus lactis increases plasmid transfer in vitro and in vivo[J]. PLoS One, 2012, 7(9): e44892. DOI:10.1371/journal.pone.0044892 |
| [10] |
ZAPOTOCZNA M, HEILBRONNER S, SPEZIALE P, et al. Iron-regulated surface determinant (Isd) proteins of Staphylococcus lugdunensis[J]. J Bacteriol, 2012, 194(23): 6453-6467. DOI:10.1128/JB.01195-12 |
| [11] |
ZHANG X K, XIONG T R, GAO L, et al. Extracellular fibrinogen-binding protein released by intracellular Staphylococcus aureus suppresses host immunity by targeting TRAF3[J]. Nat Commun, 2022, 13(1): 5493. DOI:10.1038/s41467-022-33205-z |
| [12] |
KUBICA M, GUZIK K, KOZIEL J, et al. A potential new pathway for Staphylococcus aureus dissemination: the silent survival of S. aureus phagocytosed by human monocyte-derived macrophages[J]. PLoS One, 2008, 3(1): e1409. DOI:10.1371/journal.pone.0001409 |
| [13] |
FLANNAGAN R S, HEIT B, HEINRICHS D E. Intracellular replication of Staphylococcus aureus in mature phagolysosomes in macrophages precedes host cell death, and bacterial escape and dissemination[J]. Cell Microbiol, 2016, 18(4): 514-535. DOI:10.1111/cmi.12527 |
| [14] |
LIU Q, LI D Y, WANG N, et al. Identification and application of a panel of constitutive promoters for gene over-expression in Staphylococcus aureus[J]. Front Microbiol, 2022, 13: 818307. DOI:10.3389/fmicb.2022.818307 |
| [15] |
THWAITES G E, GANT V. Are bloodstream leukocytes Trojan horses for the metastasis of Staphylococcus aureus?[J]. Nat Rev Microbiol, 2011, 9(3): 215-222. DOI:10.1038/nrmicro2508 |
| [16] |
郑文静, 张瀚, 霍毅, 等. 巨噬细胞吞噬检查点阻断在抗肿瘤免疫治疗中的应用[J/OL]. 空军军医大学学报, [2024-03-05]. http://kns.cnki.net/kcms/detail/61.1526.R.20240129.1508.004.html. ZHENG W J, ZHANG H, HUO Y, et al. Application of macrophage phagocytosis checkpoint blockade in anti-tumor immunotherapy[J/OL]. J Air Force Univ, [2024-03-05]. http://kns.cnki.net/kcms/detail/61.1526.R.20240129.1508.004.html. |
| [17] |
MESTRE M B, FADER C M, SOLA C, et al. Alpha-hemolysin is required for the activation of the autophagic pathway in Staphylococcus aureus-infected cells[J]. Autophagy, 2010, 6(1): 110-125. DOI:10.4161/auto.6.1.10698 |




