前列腺癌骨转移是临床面临的挑战,尽管过去几十年中针对转移性前列腺癌的系统治疗取得了诸多进展,患者的生存期不断延长,但病情进展仍然不可避免[1]。“种子和土壤”学说是前列腺癌特异性嗜骨转移的公认机制。在形成骨转移灶的过程中,前列腺癌细胞与骨微环境中细胞的交互对话起着核心作用[2]。
外泌体是新近发现的细胞间通讯载体。这是一类直径为40~160 nm,具有双层脂质结构的细胞外囊泡。其包含有细胞的许多成分,包括DNA、RNA、脂质、代谢物以及胞质和细胞表面蛋白等[3]。外泌体参与了多种生理与病理过程。在癌症研究中,外泌体不仅可以作为标记物,也能够影响肿瘤形成、生长、转移以及治疗抵抗。在肿瘤转移过程中,外泌体被认为介导了“种子和土壤”的相互作用[4]。
前列腺癌作为主动因素分泌外泌体,构建适宜肿瘤细胞生长的转移前生态已有研究证实[4]。前列腺癌骨转移的转移前生态中,一个重要的特征是存在过度活跃的成骨细胞。癌细胞通过外泌体传递miR-1275[5]、miR-940[6]、miR-375[7]等作用分子至骨微环境,通过相应靶基因促进间充质干细胞成骨分化或者直接激活成骨细胞。但是,外泌体作为一种双向传递介质,成骨细胞激活后其分泌的外泌体对前列腺癌细胞的反馈作用却鲜有研究。本项目探索了在前列腺癌中成骨细胞过度活跃的背景下,成骨细胞外泌体对前列腺癌细胞生物学特性的影响及内在机制。
1 材料与方法 1.1 材料 1.1.1 细胞人骨髓间充质干细胞购自浙江美森细胞科技有限公司,人前列腺癌细胞系C4-2B和LNCaP为大坪医院泌尿外科实验室自存细胞。
1.1.2 实验动物BALB/c雄性裸鼠购自北京维通利华实验动物技术有限公司[批件号:SYXK(京)2022-0052],8周龄,体质量为21~23 g,饲养在大坪医院动物实验中心标准SPF级动物房。
1.1.3 主要试剂间充质干细胞成骨诱导分化试剂(货号BI 05-440-1)购自上海逍鹏生物科技有限公司。miRNA提取试剂盒(货号RC201)购自南京诺唯赞生物科技股份有限公司。miRNA定量检测试剂盒(货号C10211)购自广州锐博生物技术有限公司。总RNA提取试剂盒(货号Z3100)、RNA反转录试剂盒(货号A2801)及定量检测试剂盒(货号A6001)购自普洛麦格(北京)生物技术有限公司。PKH67染色试剂盒(货号D0031)、EdU试剂盒(货号CA1170)购自北京索莱宝科技有限公司。细胞计数试剂盒(货号C0037)、凋亡检测试剂盒(货号C1062L)、APC过表达质粒购自上海碧云天生物技术有限公司。APC(兔抗,ab40778)、CD9(兔抗,ab236630)、TSG101(兔抗,ab125011)、β-actin(兔抗,ab8227)、β-tubulin(兔抗,ab179513)、山羊抗兔二抗抗体(ab205718)购自美国Abcam公司。miRNA-223过表达及对照慢病毒购自和元生物技术(上海)股份有限公司。
1.2 方法 1.2.1 成骨细胞诱导培养和鉴定人骨髓间充质干细胞培养于含10%胎牛血清的DMEM培养基中,在37 ℃,5%CO2的恒温培养箱培养,当细胞90%融合后更换为商品化成骨诱导培养基,2周后茜素红染色鉴定。
1.2.2 成骨细胞外泌体提取和鉴定将诱导的成骨细胞用PBS清洗后,加入无外泌体培养基中培养,36 h后收集上清。参照超速离心流程获得外泌体[8]。简要离心流程为:4 ℃下离心;300×g,10 min,去除细胞;2 000×g,10 min去除死细胞;10 000×g,30 min去除细胞碎片;100 000×g,120 min获得外泌体,120 min清洗外泌体颗粒(Hitachi CP100MX)。获得的外泌体通过透射电镜(Hitachi HT-7700,100 kV)观察外泌体形态及大小,粒径分析仪(NanoFCM N30E)分析外泌体的粒径分布。
1.2.3 Western blot检测使用含蛋白酶和磷酸酶抑制剂cocktail的蛋白裂解液(RIPA)提取蛋白,细胞和外泌体悬液直接裂解提取,组织样本经电动匀浆机研磨离心(15 000 r /min,4 ℃,20 min) 后取蛋白上清液。BCA法测定浓度后于4%~20% FuturePAGE预制胶中150 V恒压电泳分离蛋白,随后湿转法250 mA恒流将蛋白转至PVDF膜,10%脱脂奶粉封闭2 h,4 ℃摇床孵育一抗过夜(APC 1 ∶5 000、CD9 1 ∶1 000、TSG101 1 ∶2 000、β-actin 1 ∶5 000、β-tubulin 1 ∶1 000),室温孵育二抗2 h(1 ∶3 000),ECL化学发光显影,使用Bio-Rad显色仪显色成像。
1.2.4 肿瘤细胞培养和转染人前列腺癌细胞系C4-2B和LNCaP培养于含10%胎牛血清的RPMI 1640培养基中,培养条件为37 ℃恒温培养箱,5%CO2。miRNA mimics及inhibitors的转染试剂为riboFECTTM CP(广州锐博生物技术有限公司),质粒转染采用Lipofectamine 2000(美国Thermo Fisher Scientific公司),均按照说明书操作。转染48 h后收集细胞用于后续实验。
1.2.5 克隆形成实验将经预处理后的前列腺癌细胞接种至6孔板中,每孔细胞计数300个,细胞培养在含10%胎牛血清的RPMI 1640培养基中,3天换液一次。培养14天后去除培养基,PBS漂洗后4%多聚甲醛固定,0.1%结晶紫溶液染色,使用Image J统计直径超过3 mm的群落。克隆形成率≥3 mm的群落数/接种细胞数。
1.2.6 RT-qPCR检测、miRNA拷贝数计算miRNA提取使用MiPure Cell/Tissue miRNA Kit(南京诺唯赞生物科技股份有限公司),定量分析采用Bulge-Loop miRNA qRT-PCR Starter Kit(广州锐博生物技术有限公司),参考说明书进行操作。总RNA提取、逆转录、定量分析,分别采用北京普洛麦格试剂盒产品SV Total RNA Isolation System,GoScriptTM Reverse Transcription System和GoTaqⓇ qPCR Master Mix。qPCR数据分析使用2-ΔΔCt法,GAPDH/U6作为内参。使用标准品miRNA制备标准曲线,根据miR-223 qPCR的CT值估算miR-223拷贝数。qPCR引物序列如表 1。
| 基因 | 正向引物(5'-3') | 反向引物(5′-3′) |
| c-MYC | GCCAGAGGAGGAACGAG | GCTTGGACGGACAGGAT |
| CCND1 | AGAGGCGGAGGAGAACA | GAGAGGAAGCGTGTGAGG |
| HOXB9 | ATTTGCGAAGGAAGCGAGGA | CTACGGTCCCTGGTGAGGTA |
| FOSL1 | GCCTGTGCTTGAACCTGA | TGCTGCTACTCTTGCGATG |
| WISP1 | CAGCACACGCTCCTATCA | CAAGCCCATCAGGACACT |
| GAPDH | CAGGAGGCATTGCTGATGAT | GAAGGCTGGGGCTCATT |
| Pre-miR-223 | CCACGCTCCGTGTATTTGAC | CCGCACTTGGGGTATTTGAC |
1.2.7 膜交换及miRNA示踪实验
膜交换实验时将6孔板中的成骨细胞,0.25%胰酶消化液(含EDTA)消化后,250×g离心3 min,收集细胞。加入PKH67工作液, 37 ℃孵育5 min,4 ℃孵育15 min。离心去除工作液,PBS清洗3次。将细胞接种在0.4 μm的Transwell小室(美国Corning公司,货号3412)上室。在下层预铺前列腺癌细胞,共培养24小时后,荧光显微镜观察下层细胞中的膜染色情况。miRNA示踪实验方法同上,上层细胞为转染有FAM标记的miR-223(miR-223-FAM)24h后的成骨细胞。
1.2.8 CCK-8实验96孔板中每孔接种5 000个转染miR-223 mimics(miR-223组)、APC过表达质粒(过表达APC组)、miR-223 mimics+ APC过表达质粒(miR-223+过表达APC组)及对应阴性对照(NC组)的细胞。设置3复孔,分别在接种后0、24、48、72、96、120 h时加入10 μL CCK-8溶液,孵育2 h后使用酶标仪在450 nm处测定OD值。细胞活力计算公式为:细胞活力(%)= OD450 nm(时间点)/OD450 nm(初始时间点)。
1.2.9 EdU实验96孔板中每孔接种5 000个转染miR-223 mimics(miR-223组)和阴性对照(NC组)的C4-2B细胞,72 h后,每孔加入100 μL 50 μmol/L EdU培养基孵育2 h,PBS冲洗后4%多聚甲醛固定,再用2 mg/mL甘氨酸溶液孵育5 min,0.5%TritonX-100渗透10 min,1×Apollo反应液避光染色,0.5% TritonX-100再次渗透,甲醇清洗,DAPI染色,PBS清洗后使用荧光显微镜观察并拍照。
1.2.10 流式凋亡检测将转染miR-223 mimics(miR-223组)和阴性对照(NC组)48 h后的LNCaP和C4-2B细胞用25 nmol/L多西他赛诱导凋亡24 h,胰酶消化后PBS清洗3次,1 000 r/min离心5 min后弃上清,将细胞悬浮在结合缓冲液中,加入5 μL Annexin V-FITC和10 μL PI避光孵育20 min,流式细胞仪检测分析细胞凋亡。
1.2.11 迁移和侵袭实验迁移实验时在Transwell下室加入500 μL完全培养基,小室内种入转染miR-223 mimics(miR-223组)、APC过表达质粒(过表达APC组)、miR-223 mimics+ APC过表达质粒(miR-223+过表达APC组)及对应阴性对照(NC组)48 h后的细胞5×104个及200 μL无血清培养基。细胞培养箱孵育48 h,取出小室,结晶紫染色计数穿透小室膜的下层细胞。侵袭实验时用基质胶稀释液(基质胶∶培养基=1 ∶8) 预处理Transwell小室,其余步骤同迁移实验。
1.2.12 miRNA靶基因预测miR-233的潜在靶基因来自starbase2.0数据库(https://starbase.sysu.edu.cn/)[9],其中miRNA-Target模块中包含了多个工具(Target-Scan6.2、miRWalk、miRanda、miRmap、PITA、miRdb和microT)的预测结果。在mirTarPathway模块中对靶基因进行KEGG通路分析。靶基因GO分析采用在线分析工具sangerbox3.0(http://www.sangerbox.com/)的GO分析模块进行[10]。
1.2.13 慢病毒感染和动物实验使用miR-223过表达慢病毒及其对照病毒感染C4-2B细胞,杀稻瘟菌素S筛选稳转株细胞用于动物实验。稳定转染miR-223过表达慢病毒(Lv-miR-223组)及其对照慢病毒(Lv-NC组)的C4-2B细胞约1×107个分别悬浮在200 μL混合液中(PBS ∶水凝胶=1 ∶1)并注射到裸鼠左侧腹股沟皮下。对照组和实验组各5只,每周测量2次肿瘤大小,用修正椭圆公式(体积=长×宽2/2)计算肿瘤体积。当肿瘤长径达到15 mm时处死小鼠,解剖肿瘤并测定最终体积。动物研究项目得到陆军军医大学实验动物福利伦理审查委员会批准。
1.3 统计学分析采用GraphPad Prism 8.0软件进行统计学分析,两组间比较采用独立样本t检验,多组间比较采用方差分析,多组两两比较采用Bonferroni法。重复测量的时间序列数据使用SPSS26.0软件采用广义估算方程进行分析。P < 0.05表示差异有统计学意义。
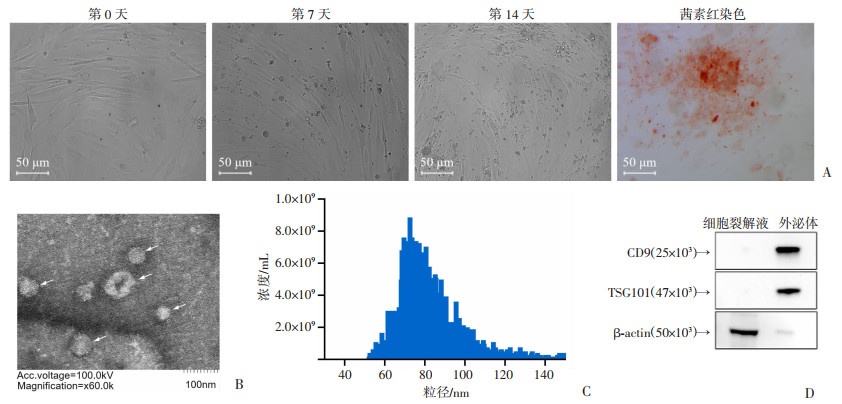
2 结果 2.1 人骨髓间充质干细胞成骨诱导分化及外泌体提取和鉴定人骨髓间充质干细胞经成骨诱导完全培养基培养14天后,使用茜素红染色法鉴定成骨细胞(图 1A);可见细胞中大量钙与茜素红复合物,提示成骨诱导成功。成骨细胞外泌体在透射电子显微镜下呈现出一致的圆形或者椭圆形膜囊泡形态(图 1B),粒径分布在50~150 nm之间(图 1C)。在细胞裂解液和外泌体中检测蛋白标记物,结果显示,外泌体中标记物CD9和TSG101高表达,而细胞骨架蛋白β-tubulin低表达(图 1D)。以上实验证实从成骨细胞中成功提取到外泌体。
|
| A: 人骨髓间充质干细胞成骨诱导分化;B: 透射电子显微镜下观察到的外泌体(白色箭头所示);C: 提取的成骨细胞外泌体粒径分布;D: Western blot检测外泌体及细胞裂解液蛋白标记 图 1 成骨细胞诱导及其外泌体提取和鉴定 |
2.2 成骨细胞外泌体促进前列腺癌细胞克隆形成
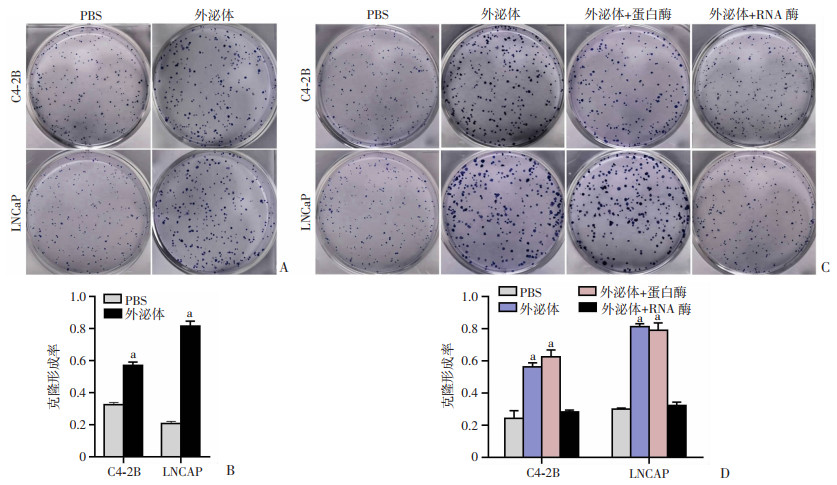
为研究成骨细胞外泌体能否促进前列腺癌细胞增殖成瘤,我们进行了克隆形成实验。结果表明,将成骨细胞外泌体加入前列腺癌细胞C4-2B和LNCaP中,癌细胞的克隆形成能力显著增强(图 2A、B)。为了明确外泌体中发挥主要作用的分子类型,我们用TritonX-100破膜外泌体后再分别加入蛋白酶和RNA酶,将处理过的外泌体加入前列腺癌细胞中。结果显示降解RNA后,外泌体对癌细胞克隆形成的促进作用显著降低,而降解蛋白后的变化不显著(图 2C、D)。这提示成骨细胞外泌体中对前列腺癌克隆形成起主要促进作用的成分可能是RNA。
|
| A、B: 加入成骨细胞外泌体后前列腺癌细胞系C4-2B和LNCaP的克隆形成;C、D: 蛋白酶、RNA酶降解外泌体中蛋白或RNA成分后对前列腺癌细胞克隆形成的影响a: P < 0.05,与PBS组比较 图 2 成骨细胞外泌体促进前列腺癌细胞克隆形成 |
2.3 成骨细胞外泌体传递功能分子miR-223至前列腺癌细胞
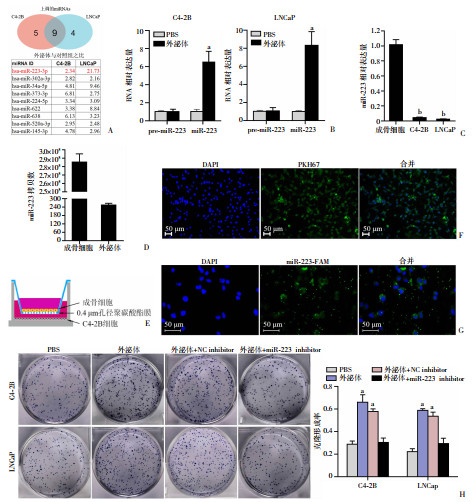
miRNA是外泌体RNA的主要组分,在外泌体传递的RNA分子中,对miRNA的研究最为成熟。为研究成骨细胞外泌体中的关键miRNA,我们用miRNA PCR芯片(miRACLE On-Call-Screen human cancer miRNA qPCR panel, 120001A1S, Genetimes)检测了外泌体处理前后前列腺癌细胞C4-2B和LNCaP中的miRNA表达。在芯片检测的420个肿瘤相关miRNAs中,9个miRNAs在两种前列腺癌细胞中表达上调(图 3A),其中我们关注到在骨髓中出现,与免疫反应、细胞炎症和恶性肿瘤转移密切相关的miR-223,并对其进行后续研究。qPCR检测外泌体处理后的C4-2B和LNCaP中miR-223成熟体及其前体表达发现,miR-223成熟体含量增加但前体变化不明显(图 3B),这提示外泌体传递的可能是miR-223的成熟体。qPCR对比成骨细胞和C4-2B、LNCaP中miR-223表达发现,miR-223在成骨细胞中的表达显著高于前列腺癌细胞(图 3C)。拷贝数结果表明miR-223在成骨细胞外泌体中富集(图 3D)。
|
| A: 加入成骨细胞外泌体后前列腺癌细胞中表达增高的miRNAs;B: 前列腺癌细胞加入外泌体后miR-223前体和成熟体的变化 a: P < 0.05, 与PBS组比较;C: 成骨细胞与前列腺癌细胞中miR-223的相对表达水平 b: P < 0.05,与成骨细胞比较;D:成骨细胞及其外泌体中miR-223拷贝数水平;E: 细胞共培养设计示意图;F: 膜交换实验观察下层C4-2B膜融合后的PKH67荧光;G: miR-223 FAM标记示踪在下层C4-2B细胞可见颗粒状FAM荧光;H: miR-223 inhibitors可逆转成骨细胞外泌体对前列腺癌细胞克隆形成的促进作用 a: P < 0.05,与PBS组比较 图 3 成骨细胞运载功能分子miR-223至前列腺癌细胞 |
为证实成骨细胞与前列腺癌细胞之间存在外泌体一类膜结构物质的交换以及miR-223在其中的传递,我们进行了膜交换实验和miRNA示踪。采用0.4 μm Transwell小室,共培养模式图如图 3E所示。在上层加入PKH67标记的成骨细胞后,荧光显微镜观察到PKH67绿色荧光标记的细胞膜性结构与下层C4-2B细胞融合,膜融合后的细胞局部或整体可见荧光(图 3F)。在上层加入预先转染FAM标记miR-223(miR-223-FAM)的成骨细胞后,下层C4-2B细胞中可以观察到细小、散在的荧光颗粒(图 3G)。以上实验表明,成骨细胞能够将膜结构物质及miR-223传递至前列腺癌细胞。
为验证miR-223是外泌体中的关键分子,我们在用成骨细胞外泌体处理前列腺癌细胞时同时转染miR-223的抑制剂(inhibitors)。如图 3H所示,成骨细胞外泌体能够促进C4-2B和LNCaP的克隆形成,但这种促进作用在转染miR-223 inhibitors后能够逆转。
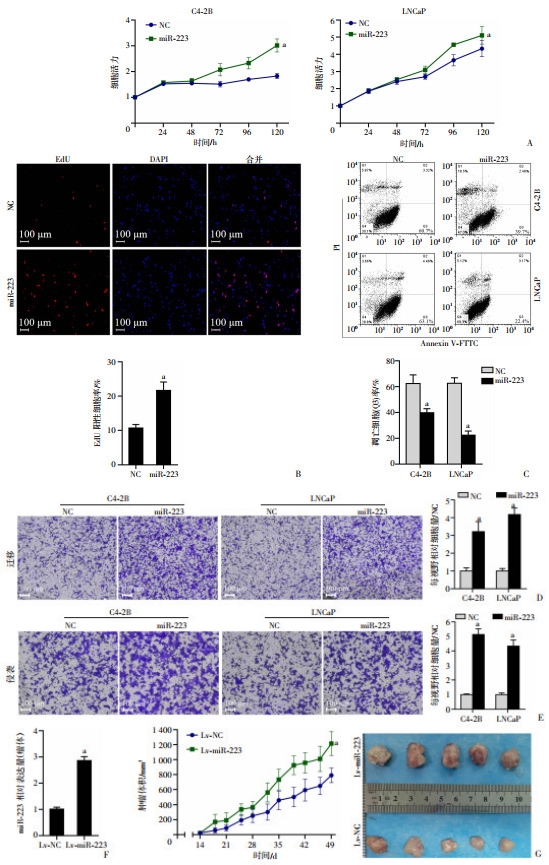
2.4 miR-223促进前列腺癌恶性表型为研究miR-223在前列腺癌细胞中的功能作用,我们向前列腺癌细胞C4-2B和LNCaP转染miR-223 mimics模拟miR-223过表达。CCK-8实验表明过表达miR-223后C4-2B细胞和LNCaP细胞增殖能力显著增强(图 4A);EdU实验发现过表达miR-223后DNA合成活跃的细胞显著增加(图 4B);使用多西他赛作为凋亡诱导剂,流式Annexin V/PI凋亡检测显示过表达miR-223组凋亡更少(图 4C);Transwell实验表明过表达miR-223后癌细胞迁移(图 4D)和侵袭(图 4E)能力显著增强。使用慢病毒构建稳定过表达miR-223的C4-2B细胞(图 4F),裸鼠皮下移植瘤模型生长曲线显示miR-223过表达组的瘤体生长速度显著高于对照组(图 4G)。
|
|
a: P < 0.05,与NC组比较,A: CCK-8检测miR-223对前列腺癌细胞增殖的影响;B: EdU实验检测miR-223对细胞DNA合成的影响;C: 流式Annexin V/PI检测miR-223对多西他赛处理后的前列腺癌细胞凋亡的影响 a: P < 0.05,与NC组比较; D、E: Transwell实验检测miR-223对前列腺癌细胞迁移和侵袭能力的影响;F: C4-2B慢病毒稳转株miR-223过表达效率;G:裸鼠皮下成瘤模型瘤体生长曲线(左)及肿瘤大体观(右) 图 4 miR-223促进前列腺癌细胞恶性表型 |
2.5 miR-223通过靶向APC提高WNT通路的活性
使用Starbase2.0数据库获取miR-223在多个预测工具中的靶基因(图 5A),对至少在4个分析工具中出现的96个交集靶基因进行后续GO通路分析。GO生物学过程(Gene Ontology: Biological Process, GO: BP)分析表明,这些靶基因主要参与了细胞形态发生、细胞对激素刺激的反应和骨化等过程。GO分子功能(Molecular Function, MF)分析目标基因主要参与酶结合、转录因子结合、染色质结合等分子功能(图 5B)。Starbase2.0数据库中对miR-223靶基因的KEGG Pathway分析结果显示,靶基因在WNT通路中富集明显(图 5C)。同时,在4个靶基因预测工具中均提示WNT通路抑制分子APC可能是miR-223的靶点。图 5D上显示了Targetscan6.2预测的miR-223种子区与APC 3′-UTR预测结合位点。过表达miR-223后,前列腺癌细胞和移植瘤中APC的表达降低(图 5D下)。图 5E显示qPCR检测多个WNT通路下游基因WISP1、CCND1、HOXB9、FOSL1和c-MYC表达增高。
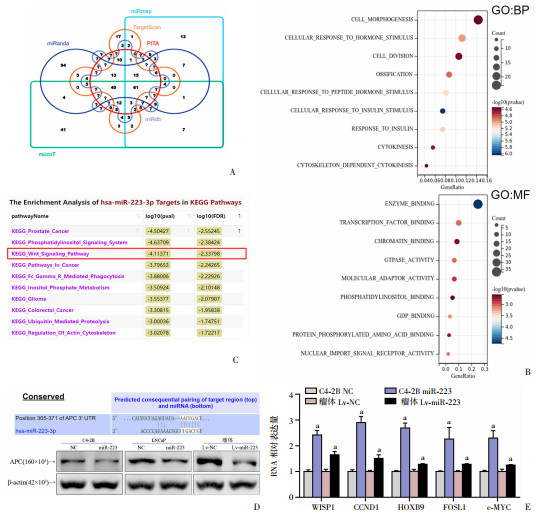
|
| A: miR-223在6个预测工具中的靶基因Venn图;B: miR-223靶基因GO分析;C: miR-223预测靶基因KEGG Pathway分析;D: Targetscan6.2预测miR-223与APC结合位点(上)、Western Blot检测细胞和移植瘤中miR-223对APC表达水平的影响(下);E: RT-qPCR检测细胞和移植瘤中miR-223对WNT通路下游基因表达水平的影响 a: P < 0.05,与NC组比较 图 5 miR-223抑制APC表达增强WNT通路活性 |
2.6 miR-223通过APC增强前列腺癌细胞恶性表型
为验证miR-223通过其靶基因APC发挥功能作用,我们进行了Rescue实验。CCK-8实验显示,过表达miR-223对前列腺癌细胞增殖的促进作用能够被过表达APC所逆转(图 6A)。类似的趋势也表现在Transwell迁移和侵袭实验中,过表达APC减弱了过表达miR-223对前列腺癌细胞迁移(图 6B)和侵袭(图 6C) 的促进作用。以上实验表明,miR-223对前列腺癌恶性行为的影响可能是通过抑制APC来实现的。
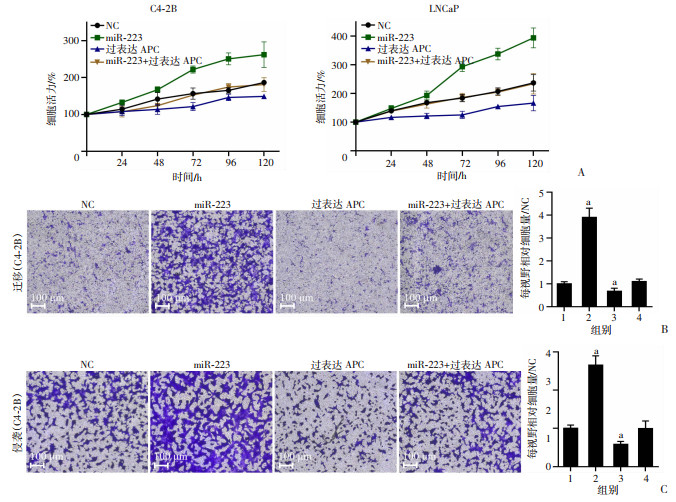
|
| A: 过表达APC可以逆转miR-223对前列腺癌细胞增殖的促进作用;B、C:过表达APC可以抑制miR-223对肿瘤细胞迁移(B)和侵袭(C)的促进作用 a: P < 0.05,与NC组比较, 1: NC, 2: miR-223; 2: 过表达APC; 4: miR-233+过表达APC 图 6 miR-223通过抑制APC促进前列腺癌恶性表型 |
3 讨论
在全球,转移性前列腺癌每年导致约40万患者死亡,且这一数字正在逐年上升[11]。特异性嗜骨转移和成骨转移是前列腺癌骨转移的显著特征。对前列腺癌骨转移的机制研究认为,癌细胞与骨微环境的相互作用是其发生的主要原因。在本研究中,我们发现成骨细胞外泌体是前列腺癌的促癌因子,外泌体中的miR-223可能是关键的功能分子。研究证实了成骨细胞与前列腺癌细胞的体外交互作用,包括细胞之间膜的交换和miR-223的传递。同时在细胞中研究了miR-223的功能作用和靶向分子。
骨微环境的稳态由成骨细胞和破骨细胞这两类主要的细胞维持[12]。破骨细胞由骨髓造血干细胞来源的单核/巨噬前体细胞融合分化而来,具有溶解、吸收骨组织的能力。而间充质干细胞来源的成骨细胞则通过分泌细胞外基质并使其矿化成新骨来完成骨的重建。成骨细胞与破骨细胞本身依靠核因子κB受体活化因子(receptor activator of nuclear factor-κB, RANK)和核因子κB受体活化因子配体(receptor activator of nuclear factor -κB ligand, RANKL)信号通路互相牵制。破骨细胞介导的骨吸收为癌细胞归巢并形成转移前生态提供了先决条件[13]。同时,破骨细胞分泌的多种促癌因子也能够增强肿瘤细胞的恶性表型[14]。因此破骨细胞被认为是前列腺癌骨转移的潜在治疗靶点。但目前针对破骨细胞的药物如双膦酸盐和地诺单抗等没有显著的延长患者的生存期[15]。
前列腺癌细胞能够通过多种机制使骨微环境中成骨细胞过度激活[16]。但成骨细胞激活后对前列腺癌细胞的反馈影响却鲜有研究。一些基于分泌因子的研究显示,成骨细胞能够协助前列腺癌细胞在骨部位的休眠[17]。但癌细胞从播散至骨到形成转移灶,需要经过一个复杂的过程,这个过程包括定植、休眠、重新激活、重建,其中的具体机制有待深入探究。我们的研究初步证实了来自成骨细胞的外泌体对前列腺癌的增殖具有促进作用。
外泌体的出现,极大地丰富了人们对细胞通讯的理解。现在外泌体被认为是肿瘤细胞与转移灶微环境之间的关键信使。在转移前小室的形成和肿瘤发展过程中,外泌体在血管渗漏、嗜器官部位的基质细胞生长以及骨髓衍生细胞培养和募集中发挥着不同的作用[18]。例如,前列腺癌细胞分泌的外泌体可能在骨转移微环境中诱导成骨细胞和破骨细胞之间的失衡,导致骨转移发生及进展[19]。当下靶向外泌体的治疗有着一定的应用前景:磺胺异恶唑(Sulfisoxazole)是一种抗生素,可显著抑制癌症细胞中外泌体的生成,并对癌症生长和骨转移表现出抑制作用[20]。本研究发现成骨细胞外泌体的促癌作用,有望成为前列腺癌转移治疗的靶点。
外泌体作为信使,能够传递多种信息物质。这些信息物质中miRNA的研究最为成熟[21],经外泌体的传递被认为是miRNA能在循环中稳定存在的重要机制[22]。miRNA是小内源性非编码RNA,通过与下游靶基因的3′-UTR中的特定序列结合,发挥转录后调控作用,导致mRNA降解或抑制mRNA翻译,进而影响细胞的各项生理过程;其经外泌体传递引起的异常表达与肿瘤的生长、转移、耐药等密切相关[23]。通过高通量筛选,我们发现miR-223可能是成骨细胞中的关键功能分子,通过靶向APC发挥功能作用。miR-223作为一种在脊椎动物中高度保守表达的microRNA,在其他恶性肿瘤中已被证实可通过调控WNT通路影响肿瘤的进展和转移[24]。本研究的结果证实了经成骨细胞外泌体传递的miR-223可以通过抑制APC蛋白增强前列腺癌细胞的增殖、迁移和侵袭能力,并抑制癌细胞凋亡。这些结果可能有助于开发新的应对转移性前列腺癌的治疗方案。
综上所述,本研究通过一系列实验证明了成骨细胞外泌体对前列腺癌生长的促进作用,其中miR-223是关键的功能分子,它通过抑制APC表达,影响WNT通路活性,进而促进前列腺癌细胞恶性表型,从另一个角度揭示了前列腺癌骨转移灶进展的机制。
| [1] |
ACHARD V, PUTORAP M, OMLIN A, et al. Metastatic prostate cancer: treatment options[J]. Oncology, 2022, 100(1): 48-59. |
| [2] |
GANGULY SS, LI X H, MIRANTI C K. The host microenvironment influences prostate cancer invasion, systemic spread, bone colonization, and osteoblastic metastasis[J]. Front Oncol, 2014, 4: 364. |
| [3] |
KALLURI R, LEBLEU V S. The biology, function, and biomedical applications of exosomes[J]. Science, 2020, 367(6478): eaau6977. |
| [4] |
SABER S H, ALI H E A, GABALLA R, et al. Exosomes are the driving force in preparing the soil for the metastatic seeds: lessons from the prostate cancer[J]. Cells, 2020, 9(3): 564. |
| [5] |
ZOU Z H, DAI RR, DENG N, et al. Exosomal miR-1275 secreted by prostate cancer cells modulates osteoblast proliferation and activity by targeting the SIRT2/RUNX2 cascade[J]. Cell Transplant, 2021, 30: 9636897211052977. |
| [6] |
HASHIMOTO K, OCHI H, SUNAMURA S, et al. Cancer-secreted hsa-miR-940 induces an osteoblastic phenotype in the bone metastatic microenvironment via targeting ARHGAP1 and FAM134A[J]. Proc Natl Acad Sci U S A, 2018, 115(9): 2204-2209. |
| [7] |
LIU Y, YANG C M, CHEN SS, et al. Cancer-derived exosomal miR-375 targets DIP2C and promotes osteoblastic metastasis and prostate cancer progression by regulating the Wnt signaling pathway[J]. Cancer Gene Ther, 2023, 30(3): 437-449. |
| [8] |
COUGHLAN C, BRUCE K D, BURGY O, et al. Exosome isolation by ultracentrifugation and precipitation and techniques for downstream analyses[J]. Curr Protoc Cell Biol, 2020, 88(1): e110. |
| [9] |
LI J H, LIU S, ZHOU H, et al. starBase v2.0: decoding miRNA-ceRNA, miRNA-ncRNA and protein-RNA interaction networks from large-scale CLIP-Seq data[J]. Nucleic Acids Res, 2014, 42(Database issue): D92-D97. |
| [10] |
SHEN W T, SONG Z G, ZHONG X, et al. Sangerbox: a comprehensive, interaction-friendly clinical bioinformatics analysis platform[J]. iMeta, 2022, 1(3): e36. |
| [11] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. |
| [12] |
FORNETTI J, WELM A L, STEWART S A. Understanding the bone in cancer metastasis[J]. J Bone & Mineral Res, 2018, 33(12): 2099-2113. |
| [13] |
HOSHINO A, COSTA-SILVA B, SHEN T L, et al. Tumour exosome integrins determine organotropic metastasis[J]. Tumour exosome integrins determine organotropic metastasis. Nature, 2015, 527(7578): 329-335. |
| [14] |
POLAVARAM N S, DUTTA S, ISLAM R, et al. Tumor-and osteoclast-derived NRP2 in prostate cancer bone metastases[J]. Bone Res, 2021, 9(1): 24. |
| [15] |
KONG D P, YE C, ZHANG C X, et al. Procoxacin bidirectionally inhibits osteoblastic and osteoclastic activity in bone and suppresses bone metastasis of prostate cancer[J]. J Exp Clin Cancer Res, 2023, 42(1): 45. |
| [16] |
ZHANG X Y. Interactions between cancer cells and bone microenvironment promote bone metastasis in prostate cancer[J]. Cancer Commun (Lond), 2019, 39(1): 76. |
| [17] |
YU-LEE L Y, YU G Y, LEE Y C, et al. Osteoblast-secreted factors mediate dormancy of metastatic prostate cancer in the bone via activation of the TGFβRIII-p38MAPK-pS249/T252RB pathway[J]. Cancer Res, 2018, 78(11): 2911-2924. |
| [18] |
VALADI H, EKSTRÖM K, BOSSIOS A, et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells[J]. Nat Cell Biol, 2007, 9(6): 654-659. |
| [19] |
PONZETTI M, RUCCI N. Switchinghomes: how cancer moves to bone[J]. Int J Mol Sci, 2020, 21(11): 4124. |
| [20] |
IM E J, LEE C H, MOON P G, et al. Sulfisoxazole inhibits the secretion of small extracellular vesicles by targeting the endothelin receptor A[J]. Nat Commun, 2019, 10(1): 1387. |
| [21] |
MELO S A, SUGIMOTO H, O'CONNELL J T, et al. Cancer exosomes perform cell-independent microRNA biogenesis and promote tumorigenesis[J]. Cancer Cell, 2014, 26(5): 707-721. |
| [22] |
CHENG L, SHARPLES R A, SCICLUNA B J, et al. Exosomes provide a protective and enriched source of miRNA for biomarker profiling compared to intracellular and cell-free blood[J]. J Extracell Vesicles, 2014, 3(1): 23743. |
| [23] |
LI B W, CAO Y, SUN M J, et al. Expression, regulation, and function of exosome-derived miRNAs in cancer progression and therapy[J]. FASEB J, 2021, 35(10): e21916. |
| [24] |
HAN L Z, LI Z G, JIANG Y Q, et al. SNHG29 regulates miR-223-3p/CTNND1 axis to promote glioblastoma progression via Wnt/β-catenin signaling pathway[J]. Cancer Cell Int, 2019, 19: 345. |




