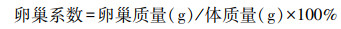近几十年来,随着工业化程度加速,环境污染、生活压力、心理行为因素等影响,人类的生育力急速下降[1]。我国不孕症发生率由20年前的9%增加到现在的15%[2-3],而女性因素占50%,其中早发性卵巢功能不全(premature ovarian insufficiency,POI)的发病率逐渐升高且呈低龄化的趋势。约20%的POI患者潜在的病因为自身免疫性疾病(其中最常见的是甲状腺),然而更多的患者对病因尚不清楚[4]。针对免疫所致女性生育力下降的研究有助于揭示其病因学,而目前免疫因素对卵巢功能的影响及其潜在机制仍知之甚少。
巨噬细胞是卵巢组织中数量最多的免疫细胞[5],其功能障碍是导致女性卵巢储备降低进而表现为不孕不育的主要原因之一[6]。有研究报道,巨噬细胞分泌的炎症小体NLRP3(NLR family pyrin domain containing 3)可诱导卵巢颗粒细胞凋亡,驱动卵巢纤维化促进卵巢的衰老,导致卵巢功能障碍[7]。跨膜4域亚家族A成员6D(membrane-spanning 4-domains subfamily A member 6D,MS4A6D)主要表达在巨噬细胞表面,可以通过结合巨噬细胞膜表面的VSIG4(V-set and immunoglobulin domain-containing 4),影响NLRP3和IL-1β的表达,负向调节巨噬细胞介导的炎症反应[8],表明MS4A6D在巨噬细胞介导的炎症反应中具有独特的生物学作用。
鉴于巨噬细胞炎症程度对卵巢卵子发育成熟过程的重要影响,可预见MS4A6D同样在卵子形成和发育过程中承担着关键的作用。因此,Ms4a6d基因敲除小鼠能够作为研究卵巢中巨噬细胞对雌性生育力影响的理想工具。本研究利用Ms4a6d基因敲除小鼠模型,通过巨噬细胞免疫荧光染色、生育力比较、卵巢形态学分析以及小鼠血清激素检测,探究雌鼠Ms4a6d基因缺失后,卵巢巨噬细胞对小鼠生育力的影响。
1 材料与方法 1.1 主要材料 1.1.1 实验动物Ms4a6d基因敲除(Ms4a6d-/-)小鼠由陆军军医大学陈永文教授惠赠,野生型(Ms4a6d+/+)雄鼠和雌鼠均购自并饲养于陆军军医大学动物实验中心,12 h的明暗循环,并保持在20~25 ℃的室温下,自由获取食物和水。陆军军医大学实验动物福利伦理审查委员会已批准实验中涉及的动物实验操作(AMUWEC20223672)。
1.1.2 实验试剂抗MS4A6D抗体由陈永文教授惠赠,PBS、4%多聚甲醛固定液、HE染色试剂盒等购自上海碧云天生物技术公司;免疫荧光一抗F4/80(28463-1-AP)购自美国Proteintech公司,免疫荧光二抗AF488(bs-0295G-AF488)、AF594(bs-0296G-AF594)均购自北京Bioss公司,血清抗缪勒管激素(anti-müllerian hormone,AMH)化学发光免疫检测试剂盒(E-EL-M3015)购自武汉Elabscience公司,PCR试剂盒购自美国Bimake公司。
1.2 Ms4a6d-/-小鼠基因型鉴定剪取小鼠耳朵并置于1.5 mL离心管中,并加入300 μL 1%蛋白酶的Buffer溶液,置于55 ℃恒温箱中过夜,按照DNA提取试剂盒提取DNA,提取后按照说明书进行PCR扩增反应。PCR反应体系为:DNA提取液2 μL,引物F 2 μL,引物R 2 μL,2×Taq PCR Mix 25 μL,ddH2O补至50 μL。PCR扩增条件:95 ℃ 3 min,(95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min)×30个循环,72 ℃ 5 min。取10 μL PCR扩增产物加入琼脂糖凝胶(1%)上样孔中,经120 V电泳35 min后,于凝胶成像仪观察并明确小鼠基因型。鉴定引物根据图 1A设计:选择外显子1和2作为敲除靶点,在其两外侧设计物F和引物R用于扩增野生型(长度3 678 bp和680 bp),然后在2个靶点之间设计引物He-R和引物F用于扩增敲除基因(长度为602 bp)[9]。引物由擎科生物公司合成,具体的序列如下:F 5′-CATGTCCAGACTGTAAGCGCCACT-3′;R 5′-TGTATTGGCCTGACTAAAGCAGAAATCA-3′;He-R 5′-TGCAGTGAGCACAGAAGAAGGAAG-3′。
|
|
A:小鼠Ms4a6d基因敲除示意图;B:用引物F和R鉴定基因型 M:标准;1~3:小鼠编号;C:用引物F和He-R鉴定基因型 M:标准;1~3:小鼠编号 图 1 Ms4a6d-/-基因型鉴定 |
1.3 小鼠体质量和卵巢系数测定
选择8周龄Ms4a6d+/+和Ms4a6d-/-雌鼠各18只,根据其体质量和双侧卵巢质量按公式[10]计算卵巢系数。
1.4 卵巢组织切片及HE染色脱颈处死小鼠并分离卵巢,快速放入4%多聚甲醛溶液中,室温固定24 h,常规石蜡包埋后行组织切片(厚度4 μm),按照试剂说明书进行HE染色。使用M8光学显微镜(precipoint)扫描切片,利用View Point BETA软件观察Ms4a6d+/+小鼠卵巢与Ms4a6d-/-小鼠卵巢组织形态结构特征,并分别对原始卵泡、初级卵泡、次级卵泡、窦卵泡、黄体、闭锁卵泡进行计数。
1.5 生育力实验将8~9周龄Ms4a6d-/-、Ms4a6d+/+雌性小鼠各6只分别与生育力正常的成年Ms4a6d+/+雄性小鼠按照1 ∶1(雄性/雌性)的比例合笼,重复3次,记录雌鼠妊娠及每窝产仔数[11],并行统计学分析。
1.6 免疫荧光检测卵巢组织石蜡切片脱蜡后,浸没于改良型柠檬酸钠抗原修复液中,在微波炉内高温进行抗原修复7 min后取出冷却至室温。室温下用5%BSA封闭切片1 h后,将F4/80多克隆抗体(1 ∶100,美国Proteintech公司)和抗MS4A6D抗体(1 ∶100)滴加于卵巢组织切片表面,4 ℃孵育过夜。洗涤后,加入荧光二抗Alexa Fluor 594(1 ∶200)和Alexa Fluor 488(1 ∶200),37 ℃孵育1 h;10 μg/ mL DAPI复染5 min,抗荧光淬灭剂密封,荧光显微镜(蔡司LSM 700)下,在496、590 nm波长下观察并拍照。
1.7 AMH水平的测定取2、4、8周龄Ms4a6d+/+小鼠与Ms4a6d-/-小鼠(各年龄段各3只),眼球取血收集于1.5 mL EP管,37 ℃水浴锅孵育1 h,待血液彻底凝固后,4 000 r/min离心10 min,吸取上层血清至于新EP管中,-80 ℃冻存备用。按AMH检测试剂盒说明书(E-EL-M3015,武汉Elabscience公司)检测各样本中的AMH含量。
1.8 统计学分析利用PRISM 9.0统计软件包对实验结果进行统计分析。数据以x±s表示,采用独立样本t检验分析组间差异的显著性,P<0.05为差异具有统计学意义。
2 结果 2.1 小鼠基因型鉴定根据前文描述的基因敲除小鼠构建方法(图 1A)以及基因型鉴定方法,PCR扩增后得到680 bp大小的F/R产物和602 bp大小的F/He-R产物,经1%琼脂糖凝胶电泳后,曝光后得到图像,对比分析可以知道2号是纯合突变小鼠,1号和3号为杂合突变小鼠(图 1B、C)。
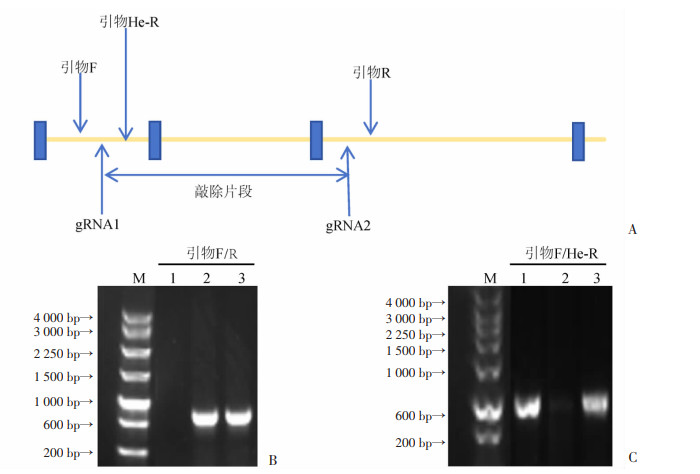
2.2 卵巢组织中MS4A6D定位分析为明确MS4A6D在正常卵巢组织中的定位情况,进行了免疫荧光染色,通过使用亲和纯化的兔多克隆MS4A6D抗体,该抗体可特异性结合巨噬细胞膜外的MS4A6D抗原序列,同时添加F4/80抗体用以标记卵巢巨噬细胞。结果显示,MS4A6D主要定位于卵巢间质,与巨噬细胞特异性标志F4/80存在共定位(图 2)。提示卵巢中MS4A6D主要在巨噬细胞表达。
|
| A:F4/80在卵巢中的定位;B:MS4A6D在卵巢中的定位;C:F4/80和MS4A6D在卵巢中的共定位 图 2 MS4A6D在正常雌性小鼠卵巢中的表达情况 |
2.3 Ms4a6d敲除对卵巢巨噬细胞数量的影响
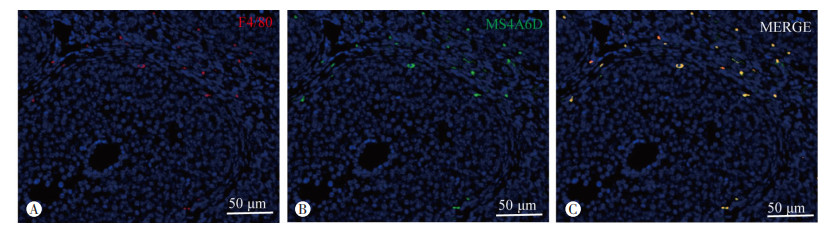
由于MS4A6D与巨噬细胞密切相关,为探究Ms4a6d-/-雌鼠卵巢中巨噬细胞数量的变化,利用巨噬细胞特异性标志物F4/80的抗体对卵巢石蜡组织切片进行免疫荧光实验并在显微镜下拍照(图 3A),通过使用Image J对图像进行免疫荧光强度分析。结果显示,2、4周龄Ms4a6d-/-雌鼠卵巢组织中阳性细胞数(即巨噬细胞)数量显著低于Ms4a6d+/+小鼠(P<0.01),而8周龄卵巢组织中的巨噬细胞数量差异无统计学意义(图 3B)。表明Ms4a6d敲除引起雌鼠青春期前卵巢巨噬细胞数量的显著减少。
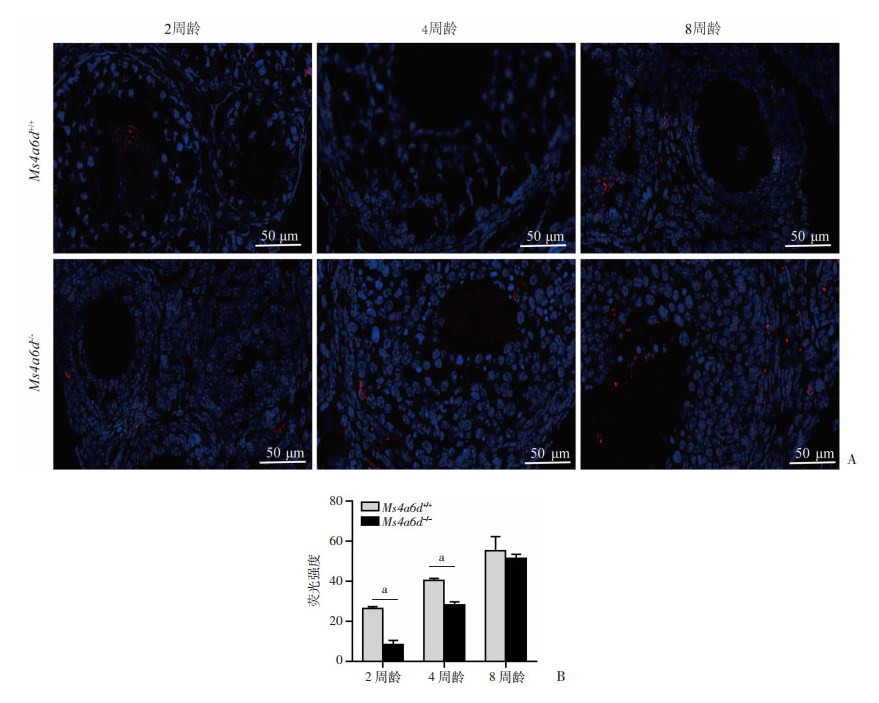
|
|
A: F4/80免疫荧光染色 B:F4/80平均免疫荧光强度定量(n=5) a: P<0.01 图 3 不同周龄Ms4a6d-/-小鼠卵巢免疫荧光染色及分析 |
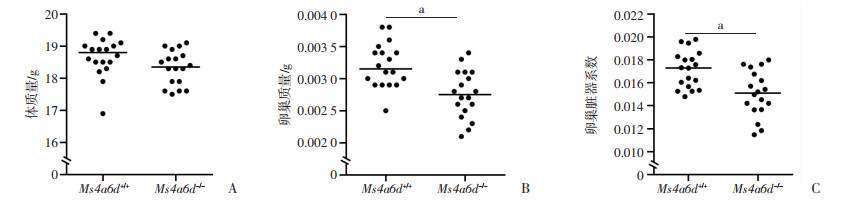
2.4 Ms4a6d-/-雌鼠平均体质量及卵巢脏器系数
为明确Ms4a6d对成年雌鼠卵巢发育的影响,测量成年Ms4a6d-/-雌鼠的体质量和卵巢质量, 并计算卵巢的脏器系数。结果显示,2组雌鼠平均体质量差异无统计学意义(图 4A);成年Ms4a6d-/-雌鼠卵巢平均质量显著低于成年Ms4a6d+/+雌鼠(P<0.01, 图 4B),成年Ms4a6d-/-雌鼠卵巢脏器系数显著低于成年野生型雌鼠(P<0.01, 图 4C)。表明Ms4a6d敲除后会导致成年雌鼠的卵巢脏器系数降低。
|
| a: P<0.01 图 4 Ms4a6d-/-雌性小鼠体质量(A)、卵巢质量(B)及卵巢脏器系数(C) |
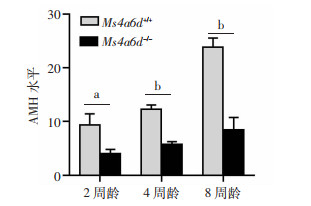
2.5 AMH水平的测定
为评估Ms4a6d-/-基因敲除对小鼠卵巢储备的影响,检测各个年龄雌性小鼠血清AMH水平。AMH由卵巢小卵泡的颗粒层细胞分泌,同时发挥着抑制原始卵泡的募集和窦卵泡的发育,具有防止卵泡过度耗竭的功能,临床上通过AMH检测来评估女性的卵巢储备。结果显示,2、4、8周龄的Ms4a6d-/-雌鼠和Ms4a6d+/+雌鼠的血清中AMH逐渐增加,但各年龄段Ms4a6d-/-雌鼠的血清AMH均显著低于Ms4a6d+/+雌鼠(P<0.05, 图 5)。提示Ms4a6d基因敲除导致雌性小鼠卵巢储备减少。
|
| a: P<0.05, b: P<0.01 图 5 2、4、8周龄雌性小鼠血清AMH水平的测定 |
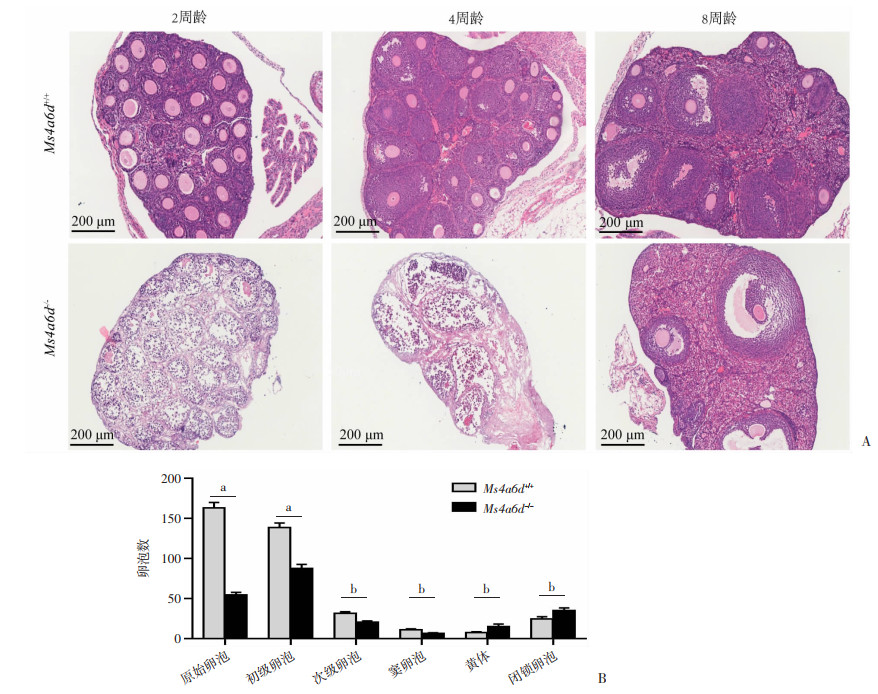
2.6 成年Ms4a6d-/-雌鼠各级卵泡减少
为进一步了解Ms4a6d-/-基因敲除对小鼠卵巢组织发育的影响,运用组织病理切片染色技术,观察分析野生型和基因敲除雌鼠的卵巢组织形态特征(图 6A)。结果发现,与Ms4a6d+/+雌鼠比较,2、4周龄的Ms4a6d-/-雌性小鼠卵巢组织中原始卵泡中颗粒细胞排列欠整齐,8周龄时卵巢组织中原始卵泡、初级卵泡、次级卵泡和窦卵泡数量显著低于同龄Ms4a6d+/+雌鼠(P<0.05,图 6B)。提示Ms4a6d基因敲除导致成年雌性小鼠卵巢储备降低。
|
| A:HE染色观察2、4、8周龄小鼠的卵巢形态;B:8周龄小鼠卵巢各级卵泡计数 a: P<0.05,b: P<0.01 图 6 Ms4a6d-/-雌性小鼠卵巢HE染色及各级卵泡计数 |
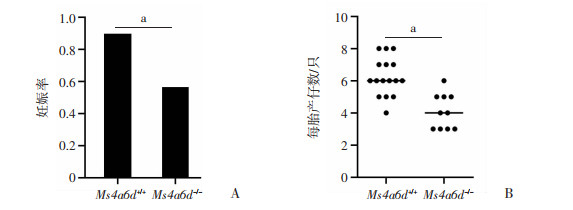
2.7 Ms4a6d-/-雌鼠生育力降低
成年Ms4a6d-/-雌鼠的平均妊娠率(56%)显著低于Ms4a6d+/+雌鼠(89%),Ms4a6d-/-雌鼠的每胎产仔数[(4.1±1.1)只]显著低于Ms4a6d+/+雌鼠[(6.3±1.2)只,P<0.01,图 7]。表明Ms4a6d敲除会导致成年雌鼠生育力减弱。
|
| a: P<0.01 图 7 Ms4a6d-/-雌鼠和Ms4a6d+/+雌鼠平均妊娠率(A)与产仔数(B)比较 |
3 讨论
MS4A家族参与不同细胞间的信号传导,在调解细胞激活、生长和发育中发挥着关键作用。目前对该家族的研究主要集中于MS4A1(CD20)、MS4A2(FcεRIβ)、MS4A3(HTm4)等成员,仍有许多MS4A蛋白的功能不为人知。有研究表明MS4A6D在骨髓来源的巨噬细胞表面表达,负向调节巨噬细胞介导的炎症反应,表明MS4A6D在巨噬细胞介导的炎症反应中具有独特的生物学作用,但MS4A6D在卵巢生殖系统中表达和功能尚不清楚。
本研究表明,卵巢组织中巨噬细胞表达MS4A6D分子,且在敲除基因Ms4a6d后,与野生型雌鼠比较,Ms4a6d-/-雌鼠在2、4周龄时卵巢巨噬细胞数量降低,且此时期的卵巢卵泡结构异常。有研究表明,免疫细胞在HPO性腺轴在多个层面干预着卵泡发育、排卵、黄体形成和胚胎着床等过程。与年龄相关的卵巢功能损害是由免疫系统的损害引起的[12]。新生小鼠行胸腺切除后卵巢发育不全,回输孕鼠胸腺细胞、正常的Treg细胞[13]或干细胞等可以阻断卵巢发育不全。但免疫细胞参与卵泡发育的机制、免疫异常与生育力减退等系列问题尚不明确[14-15]。其中巨噬细胞是卵巢组织中数量最多的免疫细胞。多项研究通过巨噬细胞的标记物(如F4/80、CD68、Ⅱ类MHC、CD11b等)追踪卵巢巨噬细胞,发现在卵巢间质、滤泡膜、黄体及闭锁卵泡中均存在不同标记类型的巨噬细胞[16-18]。在卵泡发育期,巨噬细胞数量逐渐增加,定位于卵泡的内细胞层,通过分泌生长因子(EGF、IGF、VGF、TGF-α、TGF-β等)、细胞因子(IL-1/6/10/12、IFN、TNF、TNF-α、GM-CSF等)、趋化因子(MCP-1/3、ENA-78等),发挥促进细胞增殖和抑制卵泡凋亡的作用,并参与排卵过程[19]。8周龄的Ms4a6d-/-雌鼠卵巢巨噬细胞数量恢复,但此时卵巢可见各级卵泡,但原始卵泡、初级卵泡、次级卵泡、窦卵泡数量显著减少,暗示8周龄的Ms4a6d-/-雌鼠卵巢中巨噬细胞可能是由骨髓单核细胞经血液循环定植在卵巢组织中,但是补充的巨噬细胞并不能完全挽救卵泡细胞的减少,提示巨噬细胞可能在青春期前对卵巢的原始卵泡池有重要影响,具体的细胞和分子机制仍需进一步研究。
AMH主要由卵巢卵泡的颗粒层细胞分泌,具有抑制原始卵泡的募集和窦卵泡的发育,具有防止卵泡过度耗竭的功能,常用评估女性的卵巢储备。本研究发现各年龄段Ms4a6d-/-雌鼠血清AMH均显著低于野生型雌鼠,表明Ms4a6d-/-基因敲除鼠会导致小鼠卵巢卵泡发育障碍,致使成年小鼠卵巢储备降低,类似于CSF-1基因的自然突变鼠[20]、限制大鼠的进食模型鼠[21]以及卵巢巨噬细胞耗竭模型鼠[22]等,最终表现为雌性小鼠的妊娠率和每胎产仔数降低,提示Ms4a6d-/-雌鼠的生育力下降可能是由卵泡过度激活,卵巢储备降低导致。
有研究表明,MS4A6D主要表达在巨噬细胞上,与本研究结果一致,同时能与巨噬细胞表面的VSIG4结合形成表面抑制复合物,降低炎症小体NLRP3的表达[8],能调控其所在的免疫微环境。Ms4a6d敲除后,是否会导致卵巢高炎症,改变卵巢不同类型巨噬细胞的数量及其比例等很大程度是未知的。但是在卵巢衰老相关研究中又发现,卵巢中NLRP3增多,卵巢逐渐纤维化,卵巢储备降低[7, 23-24],表明NLRP3增多可能是巨噬细胞导致卵巢储备降低的原因之一,结合以往文献报道MS4A6D和NLRP3的关系,说明MS4A6D可能通过调控NLRP3途径调控卵泡发育,但其具体的分子机制有待进一步验证。
卵巢是女性生育调控的中枢,也是机体多个器官衰老的始动因素,即“机体衰老的起搏器”[25]。卵巢衰老的典型表现为生育力减退,与卵巢卵泡数量和质量的下降密切相关[26]。深入研究原始卵泡的形成、募集进入生长卵泡及其动态变化等内在机制,对阐明生殖衰老、建立有效的干预手段,切实保护生育力具有非常重要的意义。本研究表明,全身性Ms4a6d敲除后,青少年时期的雌鼠卵巢巨噬细胞数量降低,成年时期恢复,但成年时期的卵巢储备显著减少,同时其平均妊娠率与每胎产子数均显著降低,鉴于卵巢巨噬细胞对卵巢卵泡发育调控的广泛作用,靶向MS4A6D可能为延缓卵巢衰老、增加卵巢储备提供新的思路。
| [1] |
宗璇, 乔杰. 女性生育力及其影响因素[J]. 中国实用妇科与产科杂志, 2022, 38(6): 580-585. ZONG X, QIAO J. Female fertility and its influencing factors[J]. Chin J Pract Gynecol Obstet, 2022, 38(6): 580-585. |
| [2] |
CHE Y, CLELAND J. Infertility in Shanghai: prevalence, treatment seeking and impact[J]. J Obstet Gynaecol, 2002, 22(6): 643-648. |
| [3] |
ZHOU Z, ZHENG D, WU H, et al. Epidemiology of infertility in China: a population-based study[J]. BJOG, 2018, 125(4): 432-441. |
| [4] |
DOMNIZ N, MEIROW D. Premature ovarian insufficiency and autoimmune diseases[J]. Best Pract Res Clin Obstet Gynaecol, 2019, 60: 42-55. |
| [5] |
BEST C L, PUDNEY J, WELCH W R, et al. Localization and characterization of white blood cell populations within the human ovary throughout the menstrual cycle and menopause[J]. Hum Reprod, 1996, 11(4): 790-797. |
| [6] |
ZHANG Z J, HUANG L, BRAYBOY L. Macrophages: an indispensable piece of ovarian health[J]. Biol Reprod, 2021, 104(3): 527-538. |
| [7] |
NAVARRO-PANDO J M, ALCOCER-GÓMEZ E, CASTEJÓN-VEGA B, et al. Inhibition of the NLRP3 inflammasome prevents ovarian aging[J]. Sci Adv, 2021, 7(1): eabc7409. |
| [8] |
HUANG X Y, FENG Z Q, JIANG Y Z, et al. VSIG4 mediates transcriptional inhibition of Nlrp 3 and Il-1β in macrophages[J]. Sci Adv, 2019, 5(1): eaau7426. |
| [9] |
刘俊璇, 曾继涛, 何畏. 跨膜4域亚家族成员6D基因敲除致雄性小鼠生育力降低实验研究[J]. 陕西医学杂志, 2023, 9(10): 1283-1288. LIU J X, ZENG J T, HE W. Experimental study of Ms4a6d gene knockout leads to reduced fertility in male mice[J]. Shaanxi Med J, 2023, 9(10): 1283-1288. |
| [10] |
田小芸, 恽时锋, 周森妹, 等. C57BL/KsJ-db/db、+/db小鼠主要脏器重量及脏器系数的测定[J]. 中国比较医学杂志, 2006, 16(4): 220-222. TIAN X Y, YUN S F, ZHOU S M, et al. The weight of main organs and organ coefficient in db/db and +/db mice[J]. Chin J Comp Med, 2006, 16(4): 220-222. |
| [11] |
LIU M Y, LI W Z, ZHOU X W, et al. Cell-free fat extract improves ovarian function and fertility in mice with advanced age[J]. Front Endocrinol, 2022, 13: 912648. |
| [12] |
BUKOVSKY A, CAUDLE M R, VIRANT-KLUN I, et al. Immune physiology and oogenesis in fetal and adult humans, ovarian infertility, and totipotency of adult ovarian stem cells[J]. Birth Defects Res C Embryo Today, 2009, 87(1): 64-89. |
| [13] |
DONG Y J, LI H M, LI Y Y, et al. The role of regulatory T cells in thymectomy-induced autoimmune ovarian disease[J]. Am J Reprod Immunol, 2017, 78(4): 10. |
| [14] |
PASTORE L M, CHRISTIANSON M S, STELLING J, et al. Reproductive ovarian testing and the alphabet soup of diagnoses: dor, POI, POF, POR, and FOR[J]. J Assist Reprod Genet, 2018, 35(1): 17-23. |
| [15] |
BUKOVSKY A, CAUDLE M R. Immunoregulation of follicular renewal, selection, POF, and menopause in vivo, vs. neo-oogenesis in vitro, POF and ovarian infertility treatment, and a clinical trial[J]. Reprod Biol Endocrinol, 2012, 10: 97. |
| [16] |
CAPRARA G, ALLAVENA P, ERRENI M. Intestinal macr-ophages at the crossroad between diet, inflammation, and cancer[J]. Int J Mol Sci, 2020, 21(14): 4825. |
| [17] |
RIZOV M, ANDREEVA P, DIMOVA I. Molecular regulation and role of angiogenesis inreproduction[J]. J Obstet Gynecol, 2017, 56(2): 127-132. |
| [18] |
LU E H, LI C J, WANG J, et al. Inflammation and angiogenesis in the corpus luteum[J]. J Obstet Gynaecol Res, 2019, 45(10): 1967-1974. |
| [19] |
ZHANG Z H, WANG F, ZHANG Y. Expression and contribution of NLRP3 inflammasome during the follicular development induced by PMSG[J]. Front Cell Dev Biol, 2019, 7: 256. |
| [20] |
COHEN P E, ZHU L Y, NISHIMURA K, et al. Colony-stimulating factor 1 regulation of neuroendocrine pathways that control gonadal function in mice[J]. Endocrinology, 2002, 143(4): 1413-1422. |
| [21] |
HARTENSTEIN V, MARTINEZ P. Phagocytosis in cellular defense and nutrition: a food-centered approach to the evolution of macrophages[J]. Cell Tissue Res, 2019, 377(3): 527-547. |
| [22] |
ONO Y, NAGAI M, YOSHINO O, et al. CD11c+ M1-like macrophages (MΦs) but not CD206+ M2-like MΦ are involved in folliculogenesis in mice ovary[J]. Sci Rep, 2018, 8(1): 8171. |
| [23] |
WANG Y, YANG J Y, WANG Y, et al. Upregulation of TXNIP contributes to granulosa cell dysfunction in polycystic ovary syndrome via activation of the NLRP3 inflammasome[J]. Mol Cell Endocrinol, 2023, 561: 111824. |
| [24] |
HOU J Y, LEI Z M, CUI L L, et al. Polystyrene microplastics lead to pyroptosis and apoptosis of ovarian granulosa cells via NLRP3/Caspase-1 signaling pathway in rats[J]. Ecotoxicol Environ Saf, 2021, 212: 112012. |
| [25] |
WISE P M, KRAJNAK K M, KASHON M L. Menopause: the aging of multiple pacemakers[J]. Science, 1996, 273(5271): 67-70. |
| [26] |
PEPLING M E, SUNDMAN E A, PATTERSON N L, et al. Differences in oocyte development and estradiol sensitivity among mouse strains[J]. Reproduction, 2010, 139(2): 349-357. |