2. 400038 重庆,陆军军医大学(第三军医大学):第一附属医院烧伤科;
3. 400038 重庆,陆军军医大学(第三军医大学):基础医学院免疫学教研室
2. Department of Burns, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Department of Immunology, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038, China
慢性肾脏病(chronic kidney disease, CKD)进展至肾衰竭的最常见病理表现是肾脏纤维化,其特征为肾小球硬化、肾小管萎缩和肾间质纤维化[1-2]。由于缺乏靶向治疗来延缓肾纤维化,患有CKD的患者常面临着不良的预后和沉重的经济负担。其中,肾小管上皮细胞的上皮-间质转化(epithelial-mesenchymal transition,EMT) 是触发肾纤维化形成的关键机制,然而目前临床上尚缺乏特异性生物标志物和有效治疗靶点。因此积极寻找调控肾小管上皮细胞EMT发生的关键靶分子,对于进一步揭示肾纤维化病理机制尤显重要[3-4]。
HES5(hairy and enhancer of split 5)是碱性-螺旋-环-螺旋(basic helix-loop-helix,bHLH)超家族成员,作为一个重要转录因子广泛参与了细胞分化、凋亡、增殖乃至肿瘤发生等生理病理过程[5-7]。前期研究对于HES5的关注点主要集中在神经分化和恶性肿瘤,而最近的研究开始聚焦在肾脏领域。研究发现,注射丹参芍药散血清可以抑制Notch信号通路,治疗组的Jagged1、Notch1、HES5、NICD、α-SMA和Vimentin的蛋白和mRNA水平显著降低,从而改善肾小管细胞上皮-间充质转化[8]。另有研究显示:在小鼠的单侧输尿管梗阻模型中,HES5的mRNA表达上调,同时伴随着IL-22的上调;而HES5在正常小鼠的肝脏和肾脏中的表达较低[9]。一系列研究证实,Notch信号通路促进肾纤维化的进展[10-11]。而HES5是Notch通路的下游靶基因,其参与多种肾脏疾病,但在肾纤维化中的作用及机制尚不清楚。
EMT是一个动态而复杂的过程,包括TGF-β信号通路、Wnt信号通路、RAAS信号通路和Notch信号通路参与[11-13]。除此,磷脂酰肌醇-3-激酶/蛋白激酶B(phosphoinositide 3-kinase/protein kinase B, PI3K/AKT)信号通路的激活也是发生EMT的一个关键驱动因素[14-15]。研究证实,TGF-β1可以激活PI3K,导致其下游效应分子AKT发生磷酸化,从而激活肾间质纤维化进展[16-17]。综上所述,本研究主要通过建立肾小管上皮-间质转化模型, 探究HES5是否参与肾小管上皮细胞转分化和细胞凋亡;进一步探讨敲低HES5抑制肾小管上皮细胞发生EMT的机制是否与PI3K/AKT信号通路有关。
1 材料与方法 1.1 差异表达基因的筛选从基因表达综合数据库(Gene Expression Omnibus, GEO)下载序列号为GSE66494的基因表达谱。GSE66494数据包括正常肾活检组织样本(8个)和CKD患者肾活检组织样本(53个)。以|log2FC|≥1和P<0.05作为筛选标准选出差异表达基因(differentially expressed gene,DEG)后,利用R语言,借助ggplot2绘制火山图,并且注释出NOTCH信号通路下游的靶基因。
1.2 输尿管梗阻模型(unilateral uretera obstruction,UUO)建立16只8周龄雄性C57BL/6背景野生型小鼠,体质量20~23 g,购自江苏集萃药康生物科技股份有限公司,饲养于陆军军医大学免疫学研究所的层流动物房,恒温、恒湿条件下自由饮水,实验方案由陆军军医大学实验动物福利伦理委员会批准(AMUWEC20210702)。实验分组如下: 假手术组(Sham组)、手术组(UUO组),每组8只。建立小鼠UUO模型,即给予1%戊巴比妥钠腹腔注射麻醉之后,取腹部正中1 cm切口,逐层分离至左侧肾脏及输尿管,充分暴露输尿管,6-0丝线结扎后自中间剪断输尿管,观察无明显出血后关闭腹腔。假手术组仅分离输尿管,不结扎剪断,其余步骤同手术组。保温毯上复苏小鼠后,分笼饲养并每日观察小鼠状态。14 d后,收集小鼠左侧肾脏用于下一步实验。
1.3 肾小管上皮-间质转化模型的构建HK-2细胞(武汉普诺赛生命科技有限公司) 在37 ℃、5%CO2的孵箱中培养,2~3 d换液1次。当细胞铺板后达到约70%密度时,将HK-2细胞饥饿24 h,接着用终浓度为0、5、10、15 ng/mL TGF-β1(武汉爱博泰克生物科技有限公司)分别处理24 h或者用终浓度为10 ng/mL TGF-β1分别刺激0、24、48、72 h。最后,使用倒置显微镜(日本尼康公司)观察细胞的形态和Western blot检测纤连蛋白(Fibronectin,FN)、胶原蛋白Ⅰ(Collagen Ⅰ)和波形蛋白(Vimentin)蛋白。
1.4 质粒及siRNA设计通过qRT-PCR扩增合成HES5的编码序列,并克隆到T载体质粒上。T-HES5构建体后,T-HES5和pcDNA3.1+经BamHⅠ和EcoRⅠ双重酶切。将靶标HES5片段和pcDNA3.1+骨架连接起来,随后转入大肠杆菌感受态细胞。选择单克隆菌落后,鉴定重组的pcDNA3.1-HES5构建体,并由上海生物工程公司测序。
根据人HES5信使RNA(mRNA)序列设计了3种HES5特异性siRNA,并由上海生物工程公司合成。这些靶向序列如下:HES5-207:CGAGCAGCUGAAGCUG-CUGCUTT;HES5-354:CCAGGACUACAGCGAAGGCU-ATT和HES5-420:CGCCAGCGACACGCAGAUGAATT。设置Control组、siNC组、siHES5-3组、siHES5-2组、siHES5-1组,运用qRT-PCR和Western blot鉴定最有效的siRNA。一种无关的双链RNA,UUCUCCGAACG-UGUCACGUTT被用作阴性对照。
1.5 瞬时转染当HK-2细胞达到70%~80%汇合率时,通过Lipofectamine 3000(Invitrogen,美国)以转染指定的质粒或小干扰RNA(siRNA)。用pcDNA 3.1-HES5转染HK-2细胞48 h构建过表达模型,设置对照组(Control组)、空载组(Vector组)、HES5组(HES5质粒转染组);用HES5 siRNA敲低处理HK-2细胞24 h后,使用在浓度为10 ng/mL TGF-β1的培养基或者普通培养基继续诱导其24 h,设置Control组、siHES5组、TGF-β1组、siHES5+TGF-β1组(TGF-β1诱导转染HES5 siRNA的HK-2细胞组),以备后续实验。
1.6 RNA分离和qRT-PCR检测借助TRIzol试剂盒(Invitrogen,美国)提取各组HK-2细胞的总RNA,然后参考制造商的方案,逆转录为cDNA后进行扩增,通过比较循环阈值并以β-tubulin作为内参计算, 检测各组细胞中HES5的mRNA相对表达水平。HES5上游引物:5′-ACCGCATCAACAG-CAGCATT-3′,下游引物:5′-AGGCTTTGCTGTGCTTCA-GGT-3′;β-tubulin上游引物:5′-ATCCAGAGCAGGGA-AAGCTG-3′,下游引物:5′-CTCAGGCCGTTGTTCTA-GGG-3′。
1.7 蛋白质印迹分析使用含磷酸酶抑制剂的裂解缓冲液(Thermo Fisher Scientific,美国)提取细胞总蛋白,并测定浓度后保存。将蛋白样品依次进行电泳、转膜、封闭后,分别予以一抗HES5(中国ABclonal,1∶500)、Bax(美国CST,1∶1 000)、Bcl2(美国CST,1∶1 000)、Fibronectin(美国Bioworld,1∶1 000)、Vimentin(美国Bioworld,1∶3 000)、Collagen Ⅰ(美国CST,1∶1 000)、p-PI3K(中国Bioss,1∶1 000)、PI3K(中国Bioss,1∶1 000)、p-AKT(中国Bioss,1∶1 000)、AKT(中国Bioss,1∶1 000)、β-tubulin(美国Bioworld,1∶3 000)。在4 ℃下过夜。次日复温、洗涤后,孵育二抗,显影。最后,将各条带灰度值直接与内参β-tubulin相比,并将3次独立实验所得结果进行统计分析。
1.8 免疫荧光及TUNEL检测在6孔板里制备细胞爬片,转染或加药处理一定时间后,用4%甲醛固定细胞30 min后透化、封闭、一抗过夜。次日,将细胞与Cy3/Dylight488偶联的二抗(Biolegend,美国)避光孵育1 h。最后,用Hoechst 33258(Beyotime,中国)对细胞核进行共染色,并使用荧光显微镜(奥林巴斯,日本)观察并采集图像。
用4%甲醛固定制备的细胞爬片30 min,然后根据制造商(Beyotime,中国)的说明进行TUNEL测定。最后,通过荧光显微镜观察并采集图像。
1.9 流式细胞仪检测细胞凋亡率根据需求处理各组实验细胞,用0.25%胰蛋白酶(不含EDTA)处理后,利用Annexin V-FITC细胞凋亡检测试剂盒(BestBio,中国)及流式细胞仪(BD,美国) 检测凋亡的HK-2细胞。
1.10 统计学分析所有实验按3次独立实验进行,应用GraphPad Prism 8.0进行数据分析,计量资料以x±s表示。组间比较采用非配对t检验。P<0.05认为差异有统计学意义。
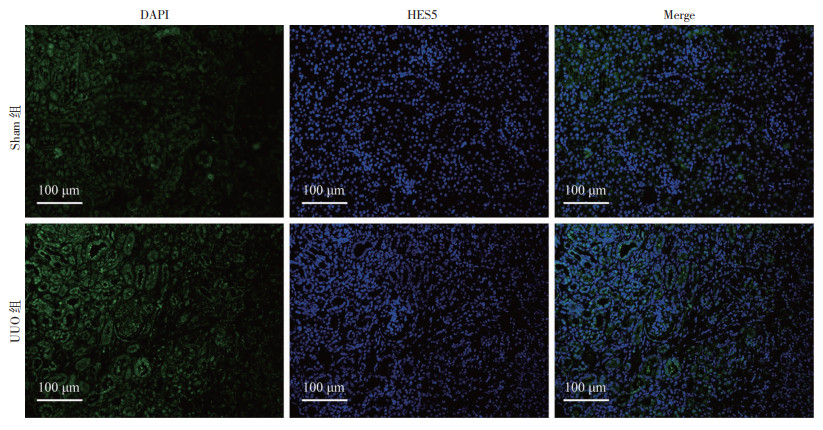
2 结果 2.1 HES5在慢性肾脏病中的差异性表达根据GSE66494芯片的分析结果绘制成火山图(图 1)。在GSE66494数据集中注释出Notch通路的一系列下游靶基因:HES1、HES4、HES5、HES6、HES7、HEYL、HEY2。不难发现,其中HES5是在CKD中显著上调的差异性基因(P<0.05)。并且,在小鼠的UUO模型中也得到相似的结论:与Sham组相比,HES5在纤维化的肾组织中表达明显增加(图 2)。

|
| 图 1 GSE66494中DEG的火山图 |
|
| 图 2 HES5高表达于UUO诱导的小鼠纤维化肾组织中 |
2.2 HES5在TGF-β1处理的HK-2细胞中表达显著上调
HK-2细胞在终浓度为0、5、10、15 ng/mL的TGF-β1刺激24 h后,纤连蛋白(Fibronectin,FN)、胶原蛋白Ⅰ(Collagen Ⅰ)和波形蛋白(Vimentin)均以剂量依赖性方式上调(图 3A),结果显示10 ng/mL TGF-β1能明显诱导HK-2细胞的转分化。因此,本研究以10 ng/mL TGF-β1分别处理HK-2细胞0、24、48、72 h,其中24 h组显示3种纤维化相关因子的表达上调均具有统计学意义(P<0.05,图 3B)。综合考虑,选用10 ng/mL TGF-β1处理HK-2细胞24 h作为后续实验建立体外肾纤维化模型的条件。

|
| A:不同浓度TGF-β1对FN、Collagen Ⅰ及Vimentin蛋白表达的影响 a:P<0.05,与0 ng/mL比较;B:不同刺激时间TGF-β1对FN、Collagen Ⅰ及Vimentin蛋白表达的影响 b:P<0.05,与0 h比较 图 3 TGF-β1诱导肾小管上皮细胞发生EMT |
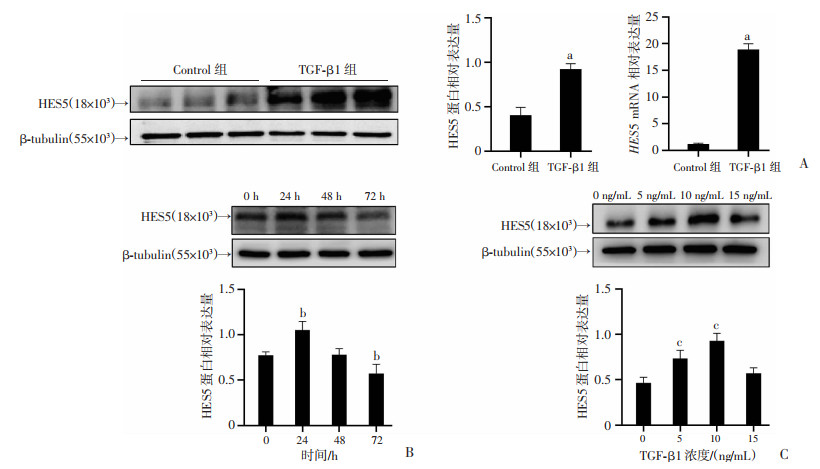
本研究首先运用qRT-PCR和Western blot检测TGF-β1(10 ng/mL)处理HK-2细胞24 h后HES5的表达,结果显示:TGF-β1处理后,HES5在基因和蛋白水平的表达均显著上调(P<0.05,图 4A)。除此,研究发现TGF-β1以时间和剂量依赖性方式诱导HES5的蛋白表达(图 4B、C)。以上结果表明,HES5在TGF-β1诱导的HK-2细胞中表达显著上调。不难发现,HK-2细胞的成纤维细胞样改变越明显,HES5表达越高,结果提示两者可能存在着某种联系。
|
| A:TGF-β1(10 ng/mL)处理HK-2细胞24 h后HES5的蛋白和基因表达情况 a: P<0.05,与Control组比较;B:不同刺激时间TGF-β1对HES5蛋白表达的影响 b:P<0.05,与0 h比较;C:不同浓度TGF-β1对HES5蛋白表达的影响c:P<0.05,与0 ng/mL比较 图 4 TGF-β1诱导的HK-2细胞中HES5表达的情况 |
2.3 过表达HES5促进肾小管上皮细胞转分化和凋亡
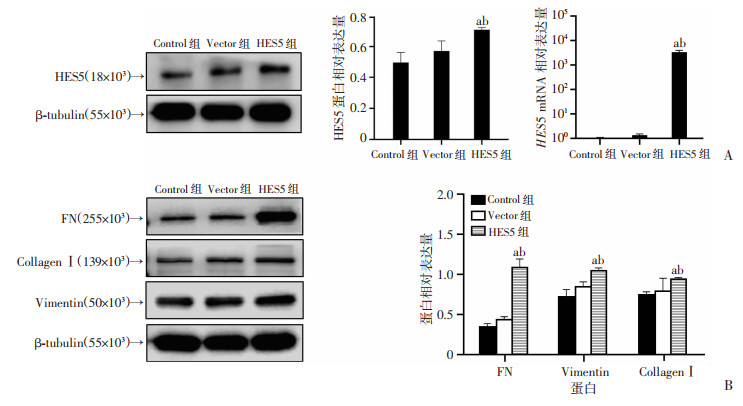
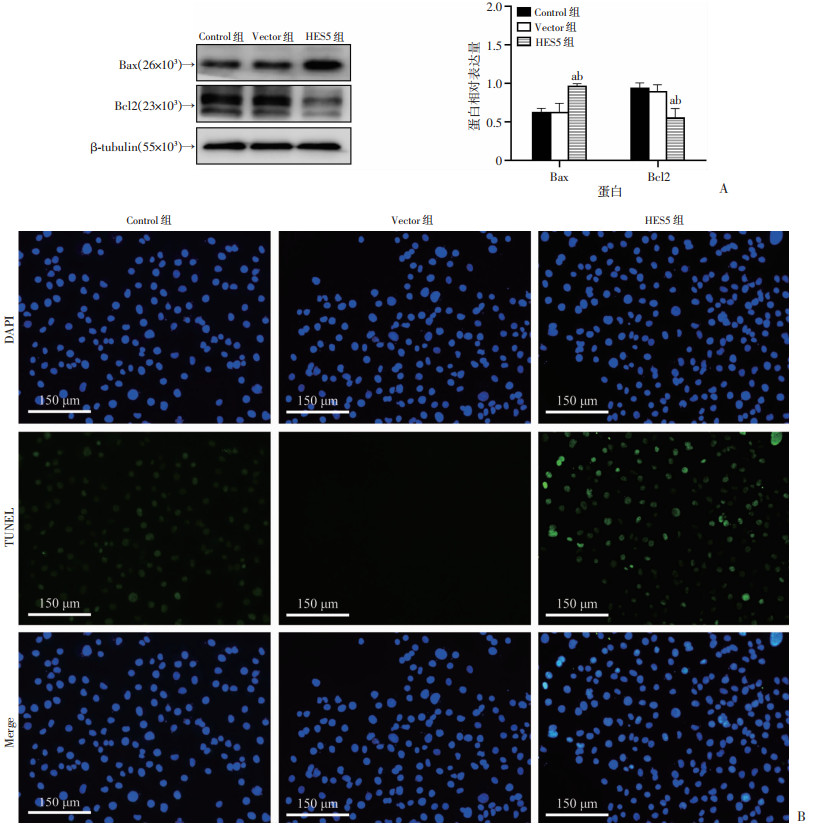
为了验证这一推测,本研究将含有HES5的质粒瞬时转染到HK-2细胞中。首先,通过Western blot和qRT-PCR验证质粒构建的有效性,结果显示:在转染pcDNA3.1-HES5的HK-2细胞中,HES5蛋白表达量高于对照组(Control组)和空载体组(Vector组),并具有统计学意义;与Control及Vector组相比,HES5组mRNA表达量明显升高(P<0.05,图 5A),以上结果均说明成功构建了过表达HES5的HK-2细胞模型。其次,本研究运用Western blot评估了每组FN、Collagen Ⅰ、Vimentin的表达水平。结果显示:HES5组的FN、Collagen Ⅰ、Vimentin的蛋白表达与Control组相比明显增加(P<0.05,图 5B)。此外,与Control组相比,HES5过表达组显示出Bax表达的增加和Bcl2表达的减少,结果具有统计学意义(P<0.05,图 6A)。通过TUNEL进一步验证,HES5组的细胞凋亡与Control组相比明显增加(图 6B)。以上结果证实,过表达HES5触发了肾小管上皮-间质转化和细胞凋亡的开关。
|
|
a:P<0.05,与Control组比较; b: P<0.05,与Vector组比较 A:质粒转染48 h后检测HES5的蛋白及mRNA的表达情况;B:各组细胞中FN、Collagen Ⅰ及Vimentin蛋白表达的影响 图 5 过表达HES5诱导肾小管上皮细胞发生EMT |
|
| A:各组细胞Bax、Bcl2蛋白表达的情况 a:P<0.05,与Control组比较;b: P<0.05,与Vector组比较;B:TUNEL荧光染色观察各组肾小管上皮细胞凋亡情况 图 6 过表达HES5诱导肾小管上皮细胞凋亡 |
2.4 敲低HES5减轻了TGF-β1诱导的肾小管上皮细胞转分化和凋亡
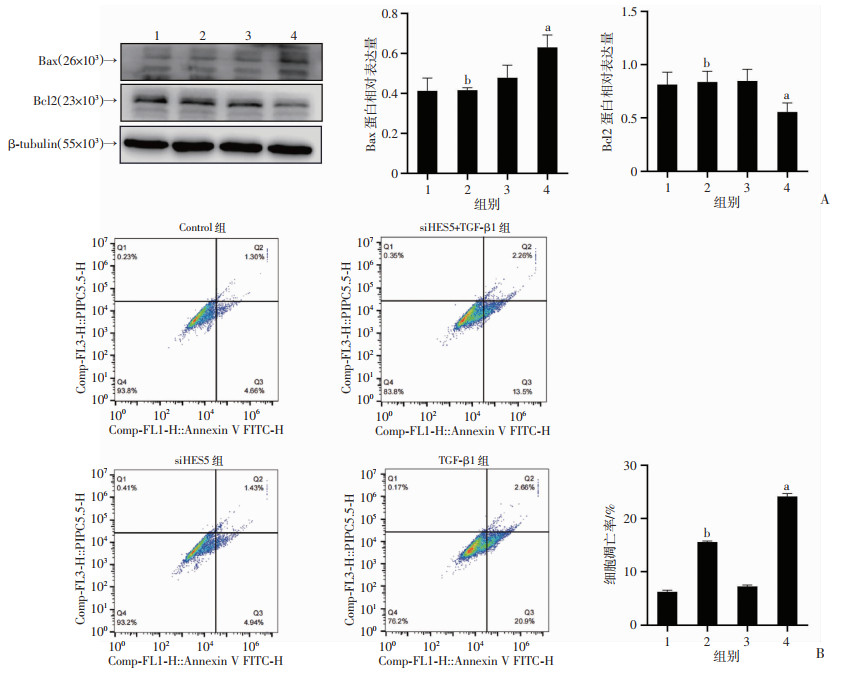
为了进一步验证HES5在肾纤维化中的作用,本研究通过Western blot和qRT-PCR筛选最有效的干扰序列,结果显示:并非所有HES5 siRNA均能有效地抑制HES5蛋白的表达,相较于其他2组HES5的干扰序列,HES5 siRNA-1的抑制效果最佳(P<0.05),其抑制率约为50%(图 7A)。通过Western blot检测证实,与TGF-β1刺激野生型HK-2细胞相比,用TGF-β1刺激HES5敲低的HK-2细胞,其FN、Collagen Ⅰ、Vimentin的表达均下调(图 7B)。免疫荧光检测得出了一致的结论(图 7C)。另外,Western blot和流式细胞术的结果表明,HES5基因的敲低削弱了TGF-β1诱导的HK-2细胞凋亡(P<0.05,图 8)。以上实验结果证实,敲低HES5可以在体外显著抑制肾小管上皮-间质转化和细胞凋亡。

|
|
a:P<0.05,与Control组比较;b:P<0.05,与TGF-β1组比较;c:P<0.05,与siNC组比较 A:siHES5转染48 h后检测HES5的蛋白及mRNA表达情况 1:Control组;2:siNC组;3:siHES5-3组;4:siHES5-2组;5:siHES5-1组;B:Western blot检测各组细胞中FN、Collagen Ⅰ、Vimentin蛋白表达的影响 1:Control组;2:siHES5+TGF-β1组;3:siHES5组;4:TGF-β1组;C:免疫荧光检测各组细胞中FN表达的情况 图 7 敲低HES5对TGF-β1诱导肾小管上皮细胞发生EMT的影响 |
|
|
1:Control组;2:siHES5+TGF-β1组;3:siHES5组;4:TGF-β1组;a:P<0.05,与Control组比较;b:P<0.05,与TGF-β1组比较 A:Western blot检测各组细胞中Bax、Bcl2蛋白表达的情况;B:流式细胞仪检测各组HK-2细胞凋亡情况 图 8 敲低HES5对TGF-β1诱导肾小管上皮细胞凋亡影响 |
2.5 调控HES5对TGF-β1激活的PI3K/AKT信号通路的影响
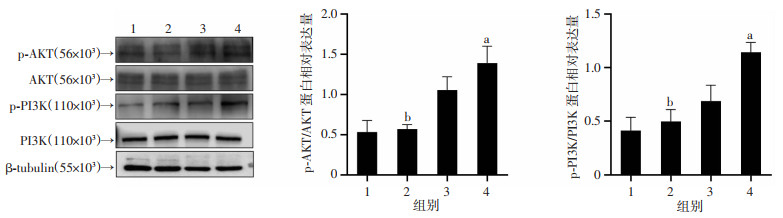
本研究在细胞层面进一步探讨HES5调控上皮-间质转分化的信号机制。由于PI3K/AKT信号通路与肾纤维化的发展过程密切相关,因此对PI3K/AKT信号通路相关指标的表达进行检测。Western blot检测结果显示,与TGF-β1组比较,用TGF-β1刺激HES5敲低组的p-PI3K、p-AKT蛋白表达量明显减少(P<0.05),提示HES5基因敲低使TGF-β1诱导的HK-2细胞内PI3K/AKT信号通路的激活程度降低(图 9)。通过加入PI3K抑制剂后,Vimentin的表达较单纯HES5组明显降低(图 10),说明PI3K/AKT信号通路可能与肾小管上皮-间质转化有关。
|
| 1:Control组;2:siHES5+TGF-β1组;3:siHES5组;4:TGF-β1组;a: P<0.05,与Control组比较;b:P<0.05,与TGF-β1组比较 图 9 敲低HES5对TGF-β1激活的PI3K/AKT信号通路的影响 |

|
| 图 10 PI3K/AKT信号通路抑制剂对HES5诱导的Vimentin影响 |
3 讨论
慢性肾脏病定义为各种原因引起的肾脏结构或功能损害(≥3个月),具有病程长、预后差、并发症多及经济负担重等特点,迄今由于缺乏有效治疗手段而面临严峻挑战[2]。肾脏纤维化是慢性肾病的共性,与疾病的进展密切相关。最近的一些重要进展已经阐明了上皮-间质转化(EMT)在肾纤维化背后的核心地位,可作为一种延缓肾纤维化的潜在治疗靶标[3-4]。因此,探索调控肾小管上皮细胞EMT发生的核心靶分子,对于防治慢性肾脏病,延缓肾纤维化进展具有重要临床意义。
既往研究证实,Notch信号通路参与IgA肾病、糖尿病肾病、高血压肾病的肾纤维化进程,而HES5作为Notch通路下游的靶基因是否参与肾纤维化尚无定论[13, 18-19]。本研究首先借助基因的差异性和UUO模型分析得出:HES5的表达在CKD和小鼠纤维化肾组织中均显著上调,这与以往研究结论相似[8-9]。接着,研究发现TGF-β1以剂量依赖性和时间依赖性的方式上调HES5的蛋白表达,HES5表达的增加伴随着FN、Collagen Ⅰ、Vimentin等促纤维化指标的表达增加,故本研究通过建立过表达或敲低HES5的细胞模型来进一步探讨HES5在肾小管EMT中的作用。研究发现,HES5过表达可以促进肾小管上皮细胞EMT的进展,体现在与野生型HK-2细胞相比,质粒组的HK-2细胞中FN、Collagen Ⅰ、Vimentin表达较高。此外,敲低HES5显著抑制TGF-β1诱导HK-2细胞发生EMT,降低了FN、Collagen Ⅰ、Vimentin的表达。这些结果进一步支持HES5参与了EMT的发生发展且可以独立于TGF-β1发挥作用。
除此,HES5已被报道参与多种细胞的凋亡过程,如精原细胞、肝细胞、肠上皮细胞、神经元等[20-22]。有研究表明,在非酒精性脂肪性肝病中HES5抑制的LIGHT转录可能有助于肝细胞凋亡[20];而在高同型半胱氨酸血症中可以通过下调HES1和HES5表达来诱导嗅球神经元的凋亡[21]。本研究利用基因转染技术调控HES5的表达,借助Western blot、TUNEL及流式细胞术等实验技术探究HES5对肾小管上皮细胞凋亡的调控作用。实验发现质粒组的HK-2细胞中Bax蛋白增加和Bcl2蛋白减少;流式细胞术结果提示敲低HES5表达降低了TGF-β1诱导HK-2细胞凋亡率。肾间质炎症反应、肾小管上皮细胞凋亡和进行性纤维化是慢性肾损伤的主要表现,其中细胞凋亡与肾纤维化关系密切[23]。大量研究证实,抑制或逆转细胞凋亡可延缓肾纤维化的进程,改善CKD患者的预后,提示细胞凋亡在肾纤维化的演变过程中扮演着重要的角色[24-25]。本研究揭示HES5是肾细胞调控凋亡的重要分子,并且敲低HES5有可能通过减少细胞凋亡来参与阻止肾纤维化的进展。
肾小管上皮细胞被认为是EMT的参与者,也是受害者,其失去自身的细胞特性而获得肌成纤维细胞特性的过程在各类CKD发生肾纤维化中起重要作用[12, 26]。既往研究证实,PI3K的激活触发其下游的关键激酶AKT的活化,从而促进肾小管上皮细胞发生EMT[14-16]。PI3K/AKT信号通路的激活可以对肾组织产生不同的生物学效应,包括细胞凋亡、脂质代谢和EMT等。有研究发现,抑制Notch途经可以通过下调PI3K/AKT途径来减轻高糖诱导的足细胞凋亡,从而对糖尿病肾病起保护作用[27];槲皮素通过靶向抑制PI3K/AKT途径可能最大限度地减轻大鼠的肾纤维化和细胞凋亡[28]。本研究结果显示TGF-β1会诱导HK-2细胞中PI3K/AKT通路表达上调,而敲低HES5可抑制TGF-β1诱导的PI3K/AKT通路的激活。通过使用PI3K抑制剂处理过表达HES5组后,Vimentin表达的促进作用被减弱。以上研究结果表明,敲低HES5有可能通过降低PI3K/AKT的活化程度发挥其抗纤维化的作用。
综上所述,本研究发现HES5可能在肾小管上皮细胞的EMT进程中扮演关键的角色。敲低HES5的表达可抑制肾小管上皮细胞转分化和凋亡,这可能与PI3K/AKT信号通路活性降低有关。在一定程度上,有望为慢性肾脏病患者抗纤维化治疗提供新思路和有效靶点,但具体机制还有待进一步探讨。
| [1] |
JHA V, GARCIA-GARCIA G, ISEKI K, et al. Chronic kidney disease: global dimension and perspectives[J]. Lancet, 2013, 382(9888): 260-272. |
| [2] |
WEBSTER A C, NAGLER E V, MORTON R L, et al. Chronic kidney disease[J]. Lancet, 2017, 389(10075): 1238-1252. |
| [3] |
HUMPHREYS B D. Mechanisms of renal fibrosis[J]. Annu Rev Physiol, 2018, 80: 309-326. |
| [4] |
LIU Y H. Cellular and molecular mechanisms of renal fibrosis[J]. Nat Rev Nephrol, 2011, 7(12): 684-696. |
| [5] |
BANSOD S, KAGEYAMA R, OHTSUKA T. Hes5 regulates the transition timing of neurogenesis and gliogenesis in mammalian neocortical development[J]. Development, 2017, 144(17): 3156-3167. |
| [6] |
GU S D, ZHANG R, GU J, et al. HES5 promotes cellular proliferation of non-small cell lung cancer through STAT3 signaling[J]. Oncol Rep, 2017, 37(1): 474-482. |
| [7] |
LUIKEN S, FRAAS A, BIEG M, et al. NOTCH target gene HES5 mediates oncogenic and tumor suppressive functions in hepatocarcinogenesis[J]. Oncogene, 2020, 39(15): 3128-3144. |
| [8] |
LI X B, NIU C L, CHEN W Y, et al. Effect of Danggui-Shaoyao-San-Containing serum on the renal tubular epithelial-mesenchymal transition of diabetic nephropathy[J]. Curr Pharm Biotechnol, 2020, 21(12): 1204-1212. |
| [9] |
WEIDENBUSCH M, RODLER S, SONG S Q, et al. Gene expression profiling of the Notch-AhR-IL22 axis at homeostasis and in response to tissue injury[J]. Biosci Rep, 2017, 37(6): BSR20170099. |
| [10] |
TANG R, XIAO X C, LU Y, et al. Interleukin-22 attenuates renal tubular cells inflammation and fibrosis induced by TGF-β1 through Notch1 signaling pathway[J]. Ren Fail, 2020, 42(1): 381-390. |
| [11] |
YU C, XIONG C X, TANG J H, et al. Histone demethylase JMJD3 protects against renal fibrosis by suppressing TGFβ and Notch signaling and preserving PTEN expression[J]. Theranostics, 2021, 11(6): 2706-2721. |
| [12] |
YUAN Q, TANG B, ZHANG C. Signaling pathways of chronic kidney diseases, implications for therapeutics[J]. Signal Transduct Target Ther, 2022, 7(1): 182. |
| [13] |
MA T K, LI X, ZHU Y H, et al. Excessive activation of Notch signaling in macrophages promote kidney inflammation, fibrosis, and necroptosis[J]. Front Immunol, 2022, 13: 835879. |
| [14] |
WANG Z H, CHEN Z, LI B S, et al. Curcumin attenuates renal interstitial fibrosis of obstructive nephropathy by suppressing epithelial-mesenchymal transition through inhibition of the TLR4/NF-кB and PI3K/AKT signalling pathways[J]. Pharm Biol, 2020, 58(1): 828-837. |
| [15] |
WANG J, ZHU H B, HUANG L Q, et al. Nrf2 signaling attenuates epithelial-to-mesenchymal transition and renal interstitial fibrosis via PI3K/AKT signaling pathways[J]. Exp Mol Pathol, 2019, 111: 104296. |
| [16] |
XU Z X, JIA K Q, WANG H, et al. METTL14-regulated PI3K/AKT signaling pathway via PTEN affects HDAC5-mediated epithelial-mesenchymal transition of renal tubular cells in diabetic kidney disease[J]. Cell Death Dis, 2021, 12(1): 32. |
| [17] |
YANG S B, ZHONG S, DENG Z J, et al. Hyperforin regulates renal fibrosis via targeting the PI3K-AKT/ICAM1 axis[J]. Cell Signal, 2023, 108: 110691. |
| [18] |
MUREA M, PARK J K, SHARMA S, et al. Expression of Notch pathway proteins correlates with albuminuria, glomerulosclerosis, and renal function[J]. Kidney Int, 2010, 78(5): 514-522. |
| [19] |
XIAO M, BAI S J, CHEN J, et al. CDKN2B-AS1 participates in high glucose-induced apoptosis and fibrosis via NOTCH2 through functioning as a miR-98-5p decoy in human podocytes and renal tubular cells[J]. Diabetol Metab Syndr, 2021, 13(1): 107. |
| [20] |
MIAO X L, GUO Y, ZENG S, et al. HES5-mediated repression of LIGHT transcription may contribute to apoptosis in hepatocytes[J]. Cell Death Discov, 2021, 7(1): 308. |
| [21] |
ZHANG J W, PANG B, ZHAO Q, et al. Hyperhomocysteinemia induces injury in olfactory bulb neurons by downregulating Hes1 and Hes5 expression[J]. Neural Regen Res, 2018, 13(2): 272-279. |
| [22] |
WANG H, YUAN Q Q, NIU M H, et al. Transcriptional regulation of P63 on the apoptosis of male germ cells and three stages of spermatogenesis in mice[J]. Cell Death Dis, 2018, 9(2): 76. |
| [23] |
HE P, LI D T, ZHANG B R. Losartan attenuates renal interstitial fibrosis and tubular cell apoptosis in a rat model of obstructive nephropathy[J]. Mol Med Rep, 2014, 10(2): 638-644. |
| [24] |
CHEN Y K, MU L, XING L L, et al. Rhein alleviates renal interstitial fibrosis by inhibiting tubular cell apoptosis in rats[J]. Biol Res, 2019, 52(1): 50. |
| [25] |
DOCHERTY N G, O'SULLIVAN O E, HEALY D A, et al. Evidence that inhibition of tubular cell apoptosis protects against renal damage and development of fibrosis following ureteric obstruction[J]. Am J Physiol Renal Physiol, 2006, 290(1): F4-F13. |
| [26] |
DJUDJAJ S, BOOR P. Cellular and molecular mechanisms of kidney fibrosis[J]. Mol Aspects Med, 2019, 65: 16-36. |
| [27] |
WANG X M, YAO M, LIU S X, et al. Interplay between the Notch and PI3K/AKT pathways in high glucose-induced podocyte apoptosis[J]. Am J Physiol Renal Physiol, 2014, 306(2): F205-F213. |
| [28] |
TU H T, MA D H, LUO Y Y, et al. Quercetin alleviates chronic renal failure by targeting the PI3K/AKT pathway[J]. Bioengineered, 2021, 12(1): 6538-6558. |




