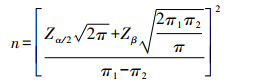当前随着人口老龄化趋势的加重,癌症负担也同样日益加重,其中胃癌作为一种高侵袭性和异质性的恶性肿瘤,在全部恶性肿瘤中发病居第6位,死亡居第3位[1]。东亚地区是胃癌的高发区,其新发病率可达59.86%。我国更是胃癌的重灾区,2020年仅我国的新发胃癌就占全球胃癌的43.94%,死亡率更是高达48.62%[2]。在胃癌分期中,早期胃癌治疗后5年生存率可达90%以上,进展期胃癌5年生存率则不到30%[2],因而尽早发现及干预,是直接提高患者生存率和改善预后的有效手段[3]。但目前我国胃癌早诊率仅10%,与韩国、日本的50%、70%仍有较大差距[2]。而在胃早癌的筛查中,对于息肉精确评估也逐渐提到更高的认识阶段。
息肉具有来自不同细胞和组织的异质起源性,可发生在胃的所有部位。根据世界卫生组织分类,胃底腺息肉(fundic gland polyps,FGPs)、增生性息肉(hyperplastic polyps,HPs)和腺瘤性息肉(adenomatous polyps,APs)是胃息肉最常见的3种亚型,不同亚型的患病率、癌变率差异很大[4]。随着质子泵抑制剂(proton pump inhibitors, PPI)的广泛应用,FGPs在息肉中达到70%以上,近年随着其异型增生病例报道的增加[5-6],同样表现出癌变风险上升,特别是在高胃泌素血症及家族性腺瘤病中[7-8]。HPs是胃及其周围黏膜癌发展风险增加的标志,1%~20%的HPs可发生异型增生,2%~6%可能通过异型增生-癌途经发生恶性转化[9]。而APs更是明确的胃腺癌前体,其恶性转化率最高可达70%[10-11]。
随着逐渐进入除菌后时代,越来越多的息肉缺乏典型镜下表现,难以在普通内镜下准确判断其恶变风险,常规使用的普通白光内镜(white light image,WLI)尚无法清晰观察息肉表面微结构特点[12],进行内镜下诊断及活检更多会依赖于内镜医师经验水平,而为了尽可能避免息肉癌变漏诊,通常对于内镜检查发现的胃息肉均予切除回收,进行组织病理学检查后方可明确其性质、肿瘤特性及严重程度,其中相当比例的息肉经组织病理评估为非肿瘤性病变且恶性程度极低,无需处理及送检[12]。探头式共聚焦激光显微内镜(probe-based confocal laser endomicroscopy,pCLE)这种新型成像技术可提供消化道上皮及上皮下放大1 000倍的横截面图像,可对细胞、亚细胞结构做出实时的“光学活检”,能快速、无创地鉴别出胃息肉的类型及恶性转化风险,在很大程度上可以减少患者经历活检、手术创伤、穿孔、出血等风险,从而避免过度治疗或治疗不足的情况[13],有效地指导下一步的临床诊治工作。因此,本研究采用pCLE观察胃底腺息肉的特点,为临床诊断胃底腺息肉提供参考。
1 资料与方法 1.1 研究对象本研究为前瞻性研究,本试验为配对设计的计数资料,通过配对卡方样本量估算公式(如下)计算所需样本量为60例。
共纳入63例患者,胃息肉病灶67处(FGPs 55处、HPs 11处、APs 1处),满足估算样本量。纳入标准:①2023年6-12月于陆军军医大学第一附属医院消化内科常规普通白光内镜下初步考虑诊断为胃息肉拟进一步住院治疗的患者;②年龄18~80岁;③自愿参加研究并签署知情同意书。排除标准:①胃部手术史、急性消化道出血、肝肾功能不全、凝血功能障碍、食管胃底静脉曲张、荧光素钠过敏等禁忌证;②孕妇及哺乳期女性患者。本研究已通过陆军军医大学第一附属医院伦理委员会审核批准[(A)KY2023090]。
1.2 仪器与造影剂仪器使用探头式共聚焦激光显微内镜为法国Mauna Kea Technologies公司的Cellvizio微探头共聚焦激光显微内镜,探头直径2.5 mm,长3 m,可通过内镜活检管道,扫描速度为12帧/s,扫描范围为300~600 μm,侧面分辨率1~3.5 μm,扫描深度55~65 μm。
血管造影剂使用荧光素钠注射液历设得(美国爱尔康,5 mL∶500 mg,10%),取0.1 mL荧光素钠原液,用0.9%氯化钠注射液稀释至5 mL(0.2%)用于术前过敏试验;5 mL荧光素钠原液(10%)用于探头式共聚焦激光显微内镜检查。
1.3 内镜检查固定1名消化内镜医师参与WLI、窄带成像内镜(narrow band imaging,NBI)和pCLE的操作过程。该内镜医师已独立完成超过20例的pCLE操作,熟练掌握消化内镜操作流程和操作技术,能够独立处理操作过程中的突发事件,熟练掌握本研究疾病的内镜下诊断标准,检查完成后能独立诊断并准确书写消化内镜检查报告,由助手监督并记录留取所有影像资料。后期由1名5年以上内镜操作经验医师对影像资料再次进行诊断,该内镜医师事先对病变组织病理诊断并不知晓,若该内镜医师与操作医师诊断意见不同,则由高年资内镜医师阅读影像资料并做出最终内镜诊断。
操作前充分告知患者相关风险并签署知情同意书。患者行内镜检查前均完成胃肠道内镜检查术前准备,静脉注射5 mL浓度为0.2%的荧光素钠溶液进行过敏性测试。过敏者不能继续参与本研究。首先在WLI及NBI下对目标病变进行鉴别并做出初步诊断。静脉注射10%荧光素钠5 mL后,将pCLE探头通过内镜活检通道送至胃内,将探头置于黏膜表面,并减少因镜头移动及患者呼吸所造成的图像伪影,使得内镜与黏膜紧贴并维持在一个相对稳定的位置,启动扫描按钮进行观察,获得病变处清晰的录像。pCLE检查时,由内镜医师详细描述每位患者的影像学特征,并根据Miami分类标准得出诊断。pCLE检查完毕后,对病变区域常规切除治疗及留取组织病理学标本,最终由病理科给予组织病理学诊断。
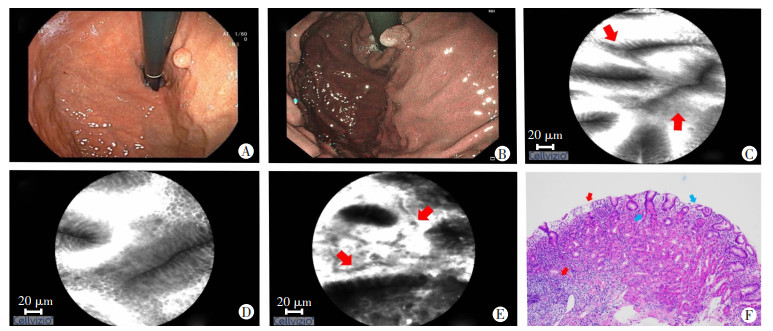
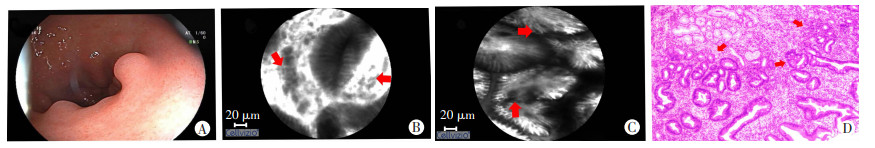
1.4 诊断标准增生性息肉、腺瘤性息肉pCLE诊断标准参考Miami分类及齐鲁医学院对胃黏膜浅表病变分类标准。增生性息肉在共聚焦激光显微内镜下可见隐窝上皮显著增生,排列规则;伸长、扩张的隐窝,单个视野隐窝数目减少;间质荧光素渗出及炎细胞浸润;细胞核无增大,位于上皮细胞基底部(图 1)。腺瘤性息肉在共聚焦激光显微内镜下可见异常的腺上皮较细长,荧光亮度较暗,而周围间质荧光亮度较亮,呈现明显不同于周围非瘤胃黏膜上皮细胞的征象,腺上皮细胞排列不规则,大小及形状不一致,呈嵴状或绒毛状排列,可见不规则扩张、弯曲及大小不一的腺管或腺体开口(图 2)。
|
| A: WLI镜下表现;B: NBI镜下表现;C: pCLE下可见伸长的胃小凹开口,小凹上皮增生,排列规则(红色箭头);D: pCLE下可见间质间血管屈曲;E: pCLE下可见间质间荧光素渗出,部分小凹结构破坏(红色箭头);F: 病理可见小凹伸长扭曲、扩张(蓝色箭头),部分小凹结构破坏,间质水肿伴大量炎症细胞浸润(红色箭头)(HE×20) 图 1 增生性息肉内镜下表现及组织病理学观察 |
|
| A: WLI镜下表现;B: pCLE下可见腺上皮较细长,周围大量荧光素渗出(红色箭头);C: 腺上皮细胞排列不规则,大小及形状不一致,呈绒毛状排列,可见不同不规则扩张、弯曲及大小不一的腺管或腺体开口,可见杯状细胞(红色箭头);D: 病理可见腺体增生伴分布不均,部分腺管可见杯状细胞,大量炎性细胞浸润(红色箭头)(HE×100) 图 2 腺瘤性息肉内镜下表现及组织病理学观察 |
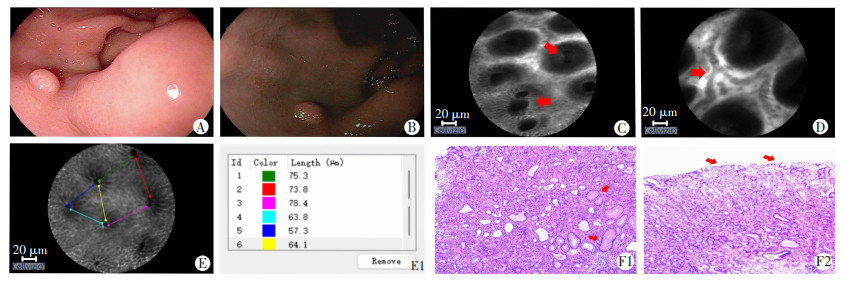
结合胃底腺息肉病理基础及内镜中心前期共聚焦内镜基础,评估胃底腺息肉pCLE下特点,包括胃小凹开口伸长、胃小凹间距不等、“手牵手样”胃小凹开口、小凹开口周围血管规则、无荧光素渗出等5个方面(图 3)。
|
| A: WLI镜下表现;B: NBI镜表现;C: pCLE下可见胃小凹开口改变,部分胃小凹密集相连,形似“手牵手样”(红色箭头);D: pCLE下可见胃小凹周围血管相对规整(红色箭头);E: pCLE下可见胃小凹间距不等;E1: 胃小凹间距测量;F1: 病理下可见增生、扩张的胃底腺,胃底腺管密集改变(红色箭头)(HE×40);F2: 胃底腺表面小凹变短或缺如,小凹间距改变(红色箭头)(HE×20) 图 3 胃底腺息肉内镜下表现及组织病理学观察 |
1.5 统计学分析
采用SPSS 26.0统计学软件对数据进行分析,计数资料以频数(%)表示;计量资料以x±s表示。以组织病理学结果作为金标准,分别计算WLI、NBI和pCLE对胃息肉鉴别诊断的灵敏度、特异性、准确度以及一致性。绘制接受者操作特性曲线(receiver operating characteristic curve,ROC),并计算曲线下面积(area under the curve,AUC)。取95%置信区间(confidence interval,CI)。诊断效能之间的比较采用MecNemar检验。一致性采用Kappa检验,≤0.40为一致性差,>0.40~0.60为一致性一般,>0.60~0.80为一致性较好,>0.80为一致性满意。
2 结果 2.1 一般资料63例胃息肉患者中男性18例,女性45例;年龄分别为(50.44±10.91)、(51.96±9.97)岁,男女年龄差异无统计学意义。共计67处胃息肉病灶,分布于贲门(2.99%)、胃窦(1.49%)、胃体(73.13%)、胃底(22.39%)。患者均于日间病房接受内镜治疗,其中术后病理诊断为胃底腺息肉55处,增生性息肉(包括炎性息肉)11处,腺瘤性息肉1处。
2.2 胃底腺息肉在共聚焦内镜下的特点病理明确诊断为胃底腺息肉病灶共55处,其中胃小凹开口伸长52(94.55%)处,胃小凹开口间距不等55(100%)处,“手牵手样”胃小凹结构47(85.45%)处,出现血管不规则5(9.09%)处,荧光素渗出5(9.09%)处。因观察所有病灶可见胃小凹开口间距改变,故不具有特异性,进一步验证胃小凹开口伸长、“手牵手样”胃小凹结构、血管规整、荧光素渗出4个pCLE镜下特点与胃底腺息肉的相关性,结果提示胃小凹开口伸长、“手牵手样”胃小凹结构、血管规整与胃底腺息肉的相关性具有统计学意义(P < 0.05, 表 1),荧光素渗出与胃底腺息肉呈负相关,考虑胃底腺息肉无明显荧光素渗出。
| 特征 | 皮尔逊卡方 | 连续性修正 | 费希尔精确检验 | 斯皮尔曼相关性 | Kappa一致性 | ||||||
| χ2 | P | χ2 | P | χ2 | P | χ2 | P | ||||
| 胃小凹开口伸长 | 16.810 | < 0.001 | 13.197 | < 0.001 | 0.001 | 0.501 | < 0.001 | 0.494 | < 0.001 | ||
| 手牵手样胃小凹结构 | 19.013 | < 0.001 | 15.955 | < 0.001 | < 0.001 | 0.533 | < 0.001 | 0.520 | < 0.001 | ||
| 血管规整 | 12.014 | 0.001 | 9.217 | 0.002 | 0.003 | 0.423 | < 0.001 | 0.423 | 0.001 | ||
| 荧光素渗出 | 31.248 | < 0.001 | 27.122 | < 0.001 | < 0.001 | -0.683 | < 0.001 | -3.220 | < 0.001 | ||
对满足这4项pCLE镜下特点的误诊率进行分析,发现仅满足其中1项的误诊率在25%~50%之间,当满足2项特征时,其误诊率降低为16.67%~33.33%,当同时满足3项或4项特征时,其对胃底腺息肉的误诊率几乎接近于0。
2.3 WLI、NBI、pCLE对胃息肉的诊断效能分析将胃息肉分为胃底腺息肉、增生性息肉(包含炎性息肉)、腺瘤性息肉,利用配对四格表分别计算WLI、NBI、pCLE的诊断效能(表 2)。
| WLI | 病理 | 合计 | WLI | 病理 | 合计 | WLI | 病理 | 合计 | |||
| FGPs | 非FGPs | HPs | 非HPs | APs | 非APs | ||||||
| FGPs | 40 | 3 | 43 | HPs | 8 | 13 | 21 | APs | 0 | 0 | 0 |
| 非FGPs | 15 | 9 | 21 | 非HPs | 3 | 40 | 43 | 非APs | 1 | 66 | 67 |
| 合计 | 55 | 12 | 67 | 合计 | 11 | 56 | 67 | 合计 | 1 | 66 | 67 |
| NBI | 病理 | 合计 | NBI | 病理 | 合计 | NBI | 病理 | 合计 | |||
| FGPs | 非FGPs | HPs | 非HPs | APs | 非APs | ||||||
| FGPs | 48 | 2 | 50 | HPs | 9 | 8 | 17 | APs | 0 | 0 | 0 |
| 非FGPs | 7 | 10 | 17 | 非HPs | 2 | 48 | 50 | 非APs | 1 | 66 | 67 |
| 合计 | 55 | 12 | 67 | 合计 | 11 | 56 | 67 | 合计 | 1 | 66 | 67 |
| pCLE | 病理 | 合计 | pCLE | 病理 | 合计 | pCLE | 病理 | 合计 | |||
| FGPs | 非FGPs | HPs | 非HPs | APs | 非APs | ||||||
| FGPs | 51 | 1 | 52 | HPs | 10 | 3 | 13 | APs | 1 | 1 | 2 |
| 非FGPs | 4 | 11 | 15 | 非HPs | 1 | 53 | 54 | 非APs | 0 | 65 | 65 |
| 合计 | 55 | 12 | 67 | 合计 | 11 | 56 | 67 | 合计 | 1 | 66 | 67 |
结果显示WLI的灵敏度、特异度、准确度分别为72.73%、75.00%、73.13%(胃底腺息肉),81.82%、71.43%、71.64%(增生性息肉)。NBI的灵敏度、特异度、准确度分别为87.27%、83.33%、86.57%(胃底腺息肉);81.82%、85.71%、85.07%(增生性息肉)。pCLE的灵敏度、特异度、准确度分别为92.73%、91.67%、92.53%(胃底腺息肉),90.91%、94.64%、94.03%(增生性息肉)。以组织病理学结果为金标准,WLI、NBI内镜对胃底腺息肉、增生性息肉的诊断与活检组织学一致性一般(Kappa≤0.6),而pCLE对2种息肉的诊断与活检组织学诊断的一致性均较好(Kappa=0.769、0.797,表 3)。
| 诊断效能 | WLI诊断效能 | NBI诊断效能 | pCLE诊断效能 | |||||
| FGPs | HPs | FGPs | HPs | FGPs | HPs | |||
| 灵敏度/% | 72.73(62.07~83.39) | 81.82(72.58~91.06) | 87.27(79.29~95.25) | 81.82(72.58~91.06) | 92.73(86.51~98.95) | 90.91(84.03~97.79) | ||
| 特异度/% | 75.00(64.63~85.37) | 71.43(60.61~82.25) | 83.33(74.41~92.25) | 85.71(77.33~94.09) | 91.67(85.05~98.29) | 98.15(94.92~101.38) | ||
| 阳性预测值/% | 93.02(86.92~99.12) | 38.10(26.47~49.73) | 96.00(91.31~100.69) | 52.94(40.99~64.89) | 98.08(94.79~101.37) | 76.92(66.83~87.01) | ||
| 阴性预测值/% | 42.86(31.01~54.71) | 93.02(86.92~99.12) | 58.82(47.04~70.6) | 96.00(91.31~100.69) | 73.33(62.74~83.92) | 98.15(94.92~101.38) | ||
| 准确度/% | 73.13(61.41~82.35) | 71.64(59.85~81.09) | 86.57(76.18~92.99) | 85.07(74.46~91.88) | 92.54(83.32~97.14) | 94.03(85.20~98.09) | ||
| 诊断指数/% | 147.73 | 153.25 | 170.60 | 167.53 | 184.39 | 189.06 | ||
| Youden指数/% | 47.73 | 53.25 | 70.60 | 67.53 | 84.39 | 89.09 | ||
| Kappa值 | 0.343 | 0.354 | 0.673 | 0.554 | 0.769 | 0.797 | ||
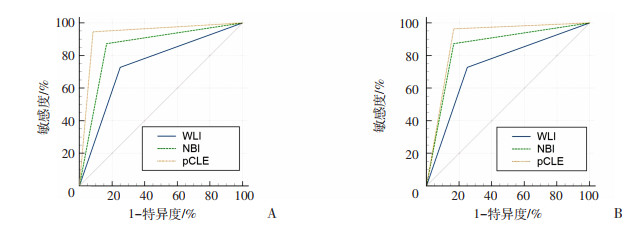
同样以病理组织学为金标准,对WLI、NBI与pCLE鉴别胃息肉病变的ROC曲线进行分析,比较ROC曲线下的面积(AUC),结果显示:WLI与NBI的AUC面积及其95%置信区间分别为0.739(0.617~0.838)、0.853(0.745~0.928),其中对胃底腺息肉,pCLE同WLI相比较,AUC分别为0.931(0.830~0.973)和0.739(0.617~0.838),差异具有统计学意义(P=0.029,图 4)。在随机入组的患者中发现1例腺瘤性息肉,WLI、NBI内镜下均未明确鉴别,于pCLE下可明确提示其腺瘤特点。可见pCLE灵敏度、特异度、准确度以及与病理诊断的一致性均优于WLI及NBI。
|
| A:WLI、NBI与pCLE对FGPs诊断的ROC曲线;B:WLI、NBI与pCLE对HPs诊断的ROC曲线 图 4 不同内镜对胃息肉的诊断效能对比 |
2.4 胃底腺息肉特殊镜下表现及病理结果
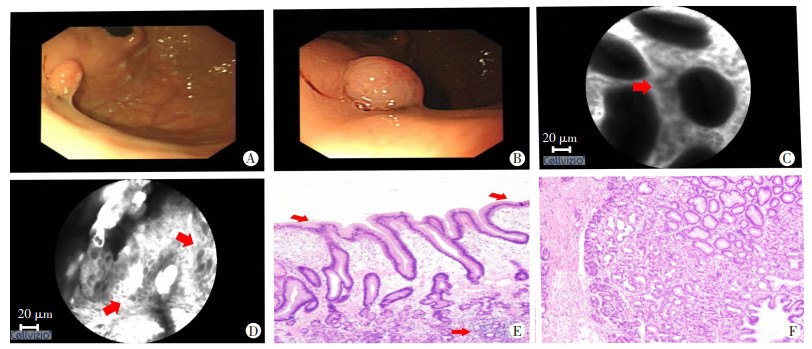
对本组1例1 cm大小的胃底腺息肉进行pCLE观察,可见胃小凹周围血管明显屈曲不规整,部分表面可见胃小凹结构破坏,大量荧光素渗出,术后病理提示该胃底腺息肉部分表面上皮细胞不连续,少量表皮细胞聚集,不同于常规胃底腺息肉病理特点,其部分区域可见局灶炎症细胞浸润(图 5)。
|
| A、B:WLI镜下表现;C:pCLE下可见胃小凹开口周围血管明显屈曲伴不规则;D:pCLE下可见部分表面胃小凹结构破坏及炎症细胞浸润,大量荧光素渗出(红色箭头);E、F:病理下可见部分表面上皮细胞不连续,疑似少量表皮细胞聚集,部分区域可见局限炎症细胞浸润(红色箭头)(HE×40,HE×100) 图 5 1例胃底腺息肉内镜下表现及组织病理学观察 |
2.5 pCLE检查的安全性
部分患者pCLE检查过程中出现轻度皮肤黄染,术后嘱患者多饮水,黄染均消退;患者均未观察到肝肾功能障碍、全身过敏反应等严重不良反应。
3 讨论胃癌的早期识别需要关注背景黏膜-肉眼型-组织型三要素,这是1980年提出的著名胃癌三角理论,但由于当时的局限性,尚未明确幽门螺杆菌(Helicobacter pylori, Hp)感染同胃癌的相关性,对于胃底腺型胃癌、神经内分泌瘤等一些胃癌类型尚未涉及。随着对Hp认识的逐渐加深,为了理解胃癌的成立,进一步结合了背景黏膜-肉眼型-组织型-Hp感染状态四要素,即胃癌四角理论。目前对于胃癌的发生途经仍缺乏统一的认知,胃癌四角理论的引出也仅提示了Hp在胃癌形成过程中具有的重要影响。随着认知水平的不断提高及质子泵抑制剂(PPI)的广泛应用,除菌得到普及后,Hp现症感染已相对减少,胃癌背景黏膜发生了戏剧化改变,但Hp除菌后胃癌仍呈现上升趋势,因此应重视对除菌后胃癌的识别。
息肉作为一大类疾病的统称,具有一定癌变潜能。结直肠癌中约70%从息肉发展而来[14],而不同的胃息肉癌变潜能不同。目前消化内镜下胃息肉的检出率为2%~8%,主要包括胃底腺息肉、增生性息肉、腺瘤性息肉等,其中胃底腺息肉既往通常被认为系胃良性病变,其癌变风险极低,但通过近年相关文献检索发现,既往一些罕见的散发型FGPs进展成胃腺癌的病例报道较前有所增加[5-6],多数胃息肉被认为是Hp感染、胆汁反流、遗传环境等多种因素造成黏膜上皮或部分腺体过度增生形成的良性病变,但胃底腺息肉发生背景多为非Hp感染黏膜,不同于以往认知的Hp-胃癌相关途经,因而其癌变的途径尚需进一步研究[15-16]。
根据目前全球范围内提出的胃息肉管理指南[17-18],大于1 cm的息肉或有症状(出血、梗阻)的胃息肉,应完全切除并送检组织病理,而小于1 cm的息肉,应先行病理活检;单纯的胃底腺息肉通常无需切除;所有的腺瘤性息肉或合并有异性增生的息肉需要切除。但当前国内内镜覆盖率较低,患者常规体检随访胃镜的意识较弱,对早期癌变的漏诊和误诊有可能最终发展成为预后较差的进展期胃癌,尤其是对于无蒂息肉病变,不能仅根据内镜下观察精准区分其亚型。因此国内多数内镜中心更趋向于积极予以内镜下的息肉切除,但其中相当一部分属于良性病变无需进行处理,这在一定程度上增加了医疗负担、时间成本、患者的潜在损伤风险及焦虑等。
pCLE技术应用于临床时间尚短,其发展的一个重要考虑因素是减少对非肿瘤性疾病的过度腔内治疗的潜力,从而改善手术相关并发症,优化随诊间隔,并限制对无关紧要病变的组织学分析。为了允许组织激发,pCLE需要使用荧光素钠,荧光素钠是pCLE中最常用的静脉内染料,已通过FDA批准。当将pCLE与WLI结合时,可有效解决一些WLI无法得出明确结论的诊断难题[19-21]。2019年KUNOVSKÝ等[22]对14例食管远端病变白光诊断不明确的患者进行pCLE诊断,其内镜下诊断同病理诊断的一致性可达78.6%;2021年CHU等[23]对2015-2017年的226例患者进行回顾性研究,发现应用pCLE辅助内镜诊断对高级别上皮内瘤变、肠化生等误诊率可大大降低。本研究总结验证了胃底腺息肉在pCLE镜下特点,评估pCLE对胃息肉的诊断价值,以期减少不必要的手术治疗。
目前尚无相关研究机构对胃底腺息肉进行pCLE观察,本内镜中心对胃底腺息肉进行pCLE内镜成像发现其存在胃小凹开口拉长、“手牵手样”胃小凹开口、小凹开口周围血管规则、无荧光素渗出4个特点。针对胃底腺息肉的精准诊断,与WLI、NBI内镜相比,pCLE诊断具有更高的灵敏度、特异度、一致性,相较于WLI的71.64%与NBI的85.07%,其准确率高达94.03%。本研究中63例患者均顺利完成pCLE检查,未出现呼吸困难、休克等过敏反应,可见pCLE具有较高的安全性及可靠性。
本研究为单中心前瞻性研究,纳入的研究样本量较小,且主要局限于日间病房胃息肉患者,不同类型息肉数量相差悬殊,可能会对试验结果产生影响,有待多中心、大样本的研究进一步探索pCLE对于胃癌前病变的诊断价值。当前,随着逐渐步入除菌后时代,息肉类型谱已较前有所改变,一些息肉内镜下特点也越来越不典型,这给我们进一步明确息肉类型、评估其恶变潜能增加了难度,散发型FGPs伴不典型增生的病例报道较前增多,既往FGPs无癌变的观点是否也需要更新,尚需进一步大样本的研究。但在本研究中发现1例FGPs伴炎性浸润及表面组织结构破坏的患者,可能对胃底腺息肉癌变评估有提示价值,甚至可为其胃癌机制途经提供新的思路。
综上,本研究完善补充了胃底腺息肉在pCLE镜下特点,证明其可有效区分胃良性病变,且诊断效能优于WLI、NBI。
| [1] |
ZHANG X Y, ZHANG P Y. Gastric cancer: somatic genetics as a guide to therapy[J]. J Med Genet, 2017, 54(5): 305-312. |
| [2] |
闫超, 陕飞, 李子禹. 2020年全球胃癌负担分析: 聚焦中国流行现状[J]. 中国肿瘤, 2023, 32(3): 161-170. YAN C, SHAN F, LI Z Y. Analysis of global burden of gastric cancer in 2020: focusing on the statistics in China[J]. China Cancer, 2023, 32(3): 161-170. |
| [3] |
HAMASHIMA C, OGOSHI K, OKAMOTO M, et al. A community-based, case-control study evaluating mortality reduction from gastric cancer by endoscopic screening in Japan[J]. PLoS One, 2013, 8(11): e79088. |
| [4] |
SONNENBERG A, GENTA R M. Prevalence of benign gastric polyps in a large pathology database[J]. Dig Liver Dis, 2015, 47(2): 164-169. |
| [5] |
NAWATA Y, ICHIHARA S, HIRASAWA D, et al. A case of gastric adenocarcinoma considered to originate from a sporadic fundic gland polyp in a Helicobacter pylori-uninfected stomach[J]. Clin J Gastroenterol, 2020, 13(5): 740-745. |
| [6] |
SANO W, INOUE F, HIRATA D, et al. Sporadic fundic gland polyps with dysplasia or carcinoma: clinical and endoscopic characteristics[J]. World J Gastrointest Oncol, 2021, 13(7): 662-672. |
| [7] |
TAZAKI S, NOZU F, YOSIKAWA N, et al. Sporadic fundic gland polyp-related adenomas occurred in non-atrophic gastric mucosa without helicobacter pylori infection[J]. Dig Endosc, 2011, 23(2): 182-186. |
| [8] |
VELÁZQUEZ-DOHORN M E, LÓPEZ-DURAND C F, GAMBOA-DOMÍNGUEZ A. Changing trends in gastric polyps[J]. Rev Invest Clin, 2018, 70(1): 40-45. |
| [9] |
TERADA T. Malignant transformation of foveolar hyperplastic polyp of the stomach: a histopathological study[J]. Med Oncol, 2011, 28(4): 941-944. |
| [10] |
WALDUM H, FOSSMARK R. Gastritis, gastric polyps and gastric cancer[J]. Int J Mol Sci, 2021, 22(12): 6548. |
| [11] |
JASS J R, SOBIN L H, WATANABE H. The World Health Organization's histologic classification of gastrointestinal tumors: a commentary on the second edition[J]. Cancer, 1990, 66(10): 2162-2167. |
| [12] |
GODDARD A F, BADRELDIN R, PRITCHARD D M, et al. The management of gastric polyps[J]. Gut, 2010, 59(9): 1270-1276. |
| [13] |
PILONIS N D, JANUSZEWICZ W, DI PIETRO M. Confocal laser endomicroscopy in gastro-intestinal endoscopy: technical aspects and clinical applications[J]. Transl Gastroenterol Hepatol, 2022, 7: 7. |
| [14] |
SHAUKAT A, KAHI C J, BURKE C A, et al. ACG clinical guidelines: colorectal cancer screening 2021[J]. Am J Gastroenterol, 2021, 116(3): 458-479. |
| [15] |
VOS S, VAN DER POST R S, BROSENS L A A. Gastric epithelial polyps: when to ponder, when to panic[J]. Surg Pathol Clin, 2020, 13(3): 431-452. |
| [16] |
CARMACK S W, GENTA R M, SCHULER C M, et al. The current spectrum of gastric polyps: a 1-year national study of over 120, 000 patients[J]. Am J Gastroenterol, 2009, 104(6): 1524-1532. |
| [17] |
GODDARD A F, BADRELDIN R, PRITCHARD D M, et al. The management of gastric polyps[J]. Gut, 2010, 59(9): 1270-1276. |
| [18] |
ASGE STANDARDS OF PRACTICE COMMITTEE, EVANS J A, CHANDRASEKHARA V, et al. The role of endoscopy in the management of premalignant and malignant conditions of the stomach[J]. Gastrointest Endosc, 2015, 82(1): 1-8. |
| [19] |
ZHANG H H, HE Z Y, JIN Z Y, et al. The development and clinical application of microscopic endoscopy for in vivo optical biopsies: Endocytoscopy and confocal laser endomicroscopy[J]. Photodiagnosis Photodyn Ther, 2022, 38: 102826. |
| [20] |
ZHANG M M, ZHONG N, GU X, et al. In vivo real-time diagnosis of endoscopic ultrasound-guided needle-based confocal laser endomicroscopy in gastric subepithelial lesions[J]. J Gastroenterol Hepatol, 2020, 35(3): 446-452. |
| [21] |
ZHANG H J, VYAS K, YANG G Z. Line scanning, fiber bundle fluorescence HiLo endomicroscopy with confocal slit detection[J]. J Biomed Opt, 2019, 24(11): 1. |
| [22] |
KUNOVSKÝ L, KALA Z, KROUPA R, et al. Confocal laser endomicroscopy in the diagnostics of esophageal diseases: a pilot study[J]. Vnitr Lek, 2020, 66(5): 62-68. |
| [23] |
CHU L H, ZHAO J L, SHENG C, et al. Confocal laser endomicroscopy under propofol-based sedation for early gastric cancer and pre-cancerous lesions is associated with better diagnostic accuracy: a retrospective cohort study in China[J]. BMC Anesthesiol, 2021, 21(1): 97. |