2. 400016 重庆,重庆医科大学附属第一医院: 实验研究中心
2. Experimental Research Center, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
椎间盘退变是导致下背部疼痛最常见的原因,影响数百万人的生活质量,给社会造成巨大的经济损失[1]。椎间盘退变的病因复杂,其中细胞外基质的丢失、机械性损伤、髓核细胞过度凋亡、炎症等在椎间盘退变的发生发展中起着非常重要的作用[2]。椎间盘由髓核组织、纤维环和软骨终板组成。髓核细胞产生细胞外基质,主要由Ⅱ型胶原(Collagen Ⅱ)和聚蛋白多糖(Aggrecan)组成。在椎间盘退变过程中,细胞外基质的生成减少,基质金属蛋白酶(MMP)升高,从而导致椎间盘退变。
YAP(Yes-associated protein)蛋白是一种关键的机械信号传感器,是Hippo信号通路的下游效应分子,具有调节细胞增殖、分化、凋亡,参与组织生长、发育和修复的功能[3-4]。DENG等[5]报道YAP在骨关节炎进展过程中减缓软骨退变。此外,有报道称,过表达YAP可逆转PMMA诱导的髓核细胞变性[6]。因此,YAP可能与椎间盘退变密切相关。
自噬是一种保守的细胞自我保护机制,可以通过改善各种类型的细胞应激来维持细胞的自稳定性。自噬是免疫、感染、炎症、肿瘤、心血管和神经退行性疾病发生的重要机制,同时自噬与椎间盘退变密切相关[7-8]。许多研究表明,自噬减缓椎间盘细胞外基质退变[9-10]。YAP参与自噬的调控[11]。研究报道,YAP/TAZ的下调通过促进自噬抑制类风湿关节炎成纤维细胞滑膜细胞的迁移和侵袭[12]。然而,YAP在椎间盘退变中的作用及与自噬的关系目前还尚不清楚。本研究拟探讨YAP对人髓核细胞退变的作用及自噬可能的分子机制,以期为椎间盘退变性疾病的预防和治疗提供新的思路。
1 材料与方法 1.1 材料 1.1.1 标本的获取人髓核组织来自2021年3月至2022年7月重庆医科大学附属第一医院骨科接受腰椎手术患者。相对正常的椎间盘组织取自5例腰椎骨折患者(正常组),年龄27~35岁;椎间盘退变的椎间盘组织取自8例椎间盘退变病患者(退变组),年龄48~80岁。根据术前MRI检测结果,采用Pfirrmann分级评价椎间盘退变的程度[13],其中退变组为Ⅲ~Ⅳ级,正常组为0~Ⅰ级。本研究经重庆医科大学伦理委员会批准(2020-150)。
1.1.2 动物雄性Sprague-Dawley大鼠购自重庆医科大学实验动物中心,由重庆医科大学动物房代养。
1.1.3 试剂主要有DMEM/F12培养基(HyClone,USA),胎牛血清(Gibco,USA),Ⅱ型胶原酶(Sigma,USA),YAP抗体、MMP-3抗体、MMP-13抗体、Aggrecan抗体(CST,USA),Collagen Ⅱ抗体(Abcam,USA),LC3抗体(Sigma,USA),LV-YAP、LV-NC慢病毒、YAP-siRNA、negative control-siRNA以及siRNA专用转染试剂(Invitrogen,USA)。
1.2 方法 1.2.1 原代髓核细胞培养将在术中取得的无菌髓核组织置于冰盒保存,并立即带回实验室处理,反复洗涤髓核组织,将其剪碎成1 mm3小块,转移到15 mL无菌离心管中。离心管中加入0.25%胰酶,置于37 ℃培养箱中作用30 min。然后在离心管中加入2 g/L Ⅱ型胶原酶,在37 ℃培养箱中作用4 h。将离心管中的混合物通过200目过滤器进行过滤。细胞悬液在含20%胎牛血清的DMEM/F12培养基中培养。细胞培养至80%~90%融合后进行传代。
1.2.2 药物、病毒转染以及分组将培养的原代髓核细胞分为5组:对照组、IL-1β组、IL-1β+LV-YAP组、IL-1β+YAP-siRNA组和IL-1β+ LV-YAP+3-MA组。对照组不做处理;IL-1β组采用10 ng/mL IL-1β处理髓核细胞24 h;IL-1β+LV-YAP组和IL-1β+YAP-siRNA组分别向髓核细胞中转染适量的过表达慢病毒LV-YAP或敲低慢病毒YAP-siRNA处理48 h后,再予以10 ng/mL IL-1β处理髓核细胞24 h;IL-1β+LV-YAP+3-MA组向髓核细胞中转染过表达慢病毒LV-YAP处理48 h后,予以5 mmol/L自噬抑制剂3-MA预处理2 h,再予以10 ng/mL IL-1β处理髓核细胞24 h。
1.2.3 GFP-LC3转染将髓核细胞接种于共聚焦皿中。髓核细胞培养24 h后,加入腺病毒GFP-LC3(中国汉恒生物)孵育24 h。DAPI在室温下染色20 min。使用激光共聚焦显微镜(TCS-SP5,德国)捕获图像。绿色荧光点的数量表示自噬的水平。
1.2.4 Western blot检测人髓核组织和处理后的髓核细胞蛋白在RIPA缓冲液中进行裂解。用BCA蛋白法测定蛋白质含量。通过SDS-PAGE对蛋白质进行分离,然后转移到PVDF膜上。取出PVDF膜放至5%脱脂奶粉中封闭1 h。然后,将PVDF膜与一抗在4 ℃下孵育过夜。随后,将膜与相对应的二抗孵育。最后,加入ECL显影剂进行显影。
1.2.5 大鼠椎间盘退变模型建立及MRI检查将SD大鼠通过简单随机法分为3组,每组5只:假手术组、穿刺组和穿刺+LV-YAP组。采用腹腔注射对大鼠进行麻醉,假手术组用30号针针头垂直穿入皮下,但不穿入椎间盘。穿刺组将30号针针头插入大鼠的尾椎6/7、7/8椎间盘内,穿刺针保持与终板平行,穿剌进入椎间盘约5 mm的深度,穿刺成功后静置约1 min。穿刺+LV-YAP组为穿刺成功后4周采用微型注射器将2 μL的LV-YAP(1.5 μg/μL)穿刺注射到原来标记的椎间盘内。术后2个月MRI检查椎间盘,采用Pfirrmann分级评价其退变程度。
1.2.6 免疫组化染色从患者和大鼠获得的髓核组织样品用4%多聚甲醛固定,石蜡包埋,切片。患者和大鼠切片进行免疫组化染色,切片进行常规脱蜡、水化,高温修复后5% BSA封闭液室温阻断20 min,加入适当浓度YAP和LC3抗体,4 ℃过夜。第2天复温洗涤后滴加山羊抗兔辣根过氧化物酶标记的二抗,DAB显色,苏木精复染后脱水、封片、镜检。最后,利用Image J软件对结果进行分析。
1.2.7 阿利新蓝染色从大鼠获得的髓核组织样品用4%多聚甲醛固定,石蜡包埋,切片,然后进行常规脱蜡、水化后,按照说明书配置Alcian染色液,滴加Alcian染色液到髓核组织切片上,放入37 ℃烘箱中30 min,接着用自来水冲洗5 min,用梯度酒精脱水,二甲苯透明,中性树胶封片,最后光学显微镜观察并拍照。
1.3 统计学分析采用SPSS 20.0进行统计分析。数据以x±s表示,组间差异比较采用Student’s t检验或单因素方差分析。P<0.05为差异有统计学意义。
2 结果 2.1 YAP在正常和退变的椎间盘组织中的表达通过临床收集相对正常和退变的椎间盘组织(图 1A),进行免疫组化染色结果显示,相对正常椎间盘组织中YAP阳性表达率为(47.87± 3.51)%,高于退变的椎间盘组织[(12.36±2.43)%,P<0.05,图 1B]。同时,Western blot结果也显示,退变的椎间盘组织中YAP、CollagenⅡ及Aggrecan蛋白表达水平明显降低(P<0.05,图 1C)。这些结果表明,YAP可能与椎间盘退变密切相关。
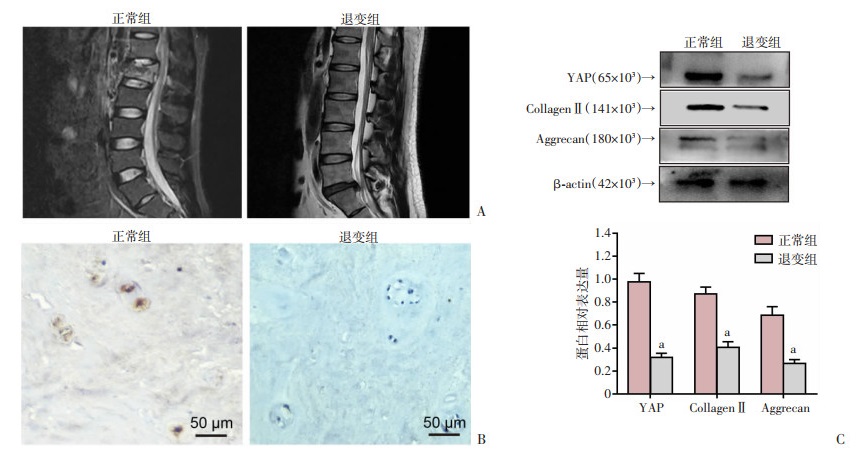
|
| A:MRI表现;B:免疫组化染色观察YAP的表达;C:Western blot检测相关蛋白的表达及半定量分析 a:P<0.05,与正常组比较 图 1 正常和退变椎间盘影像表现及其组织中YAP的表达 |
2.2 YAP抑制人髓核细胞外基质的降解
通过使用LV-YAP和YAP-siRNA转染人髓核细胞。Western blot结果显示,转染LV-YAP或YAP-siRNA可明显过表达或下调人髓核细胞中YAP蛋白的表达(P<0.05,图 2A)。过表达YAP可显著提高IL-1β诱导的髓核细胞中Collagen Ⅱ与Aggrecan的蛋白表达,同时降低MMP-3和MMP-13的蛋白表达(P<0.05,图 2B)。然而,YAP敲低则进一步加剧IL-1β诱导的髓核细胞外基质降解(P<0.05,图 2B)。结果表明,YAP过表达能抑制人髓核细胞外基质的降解。
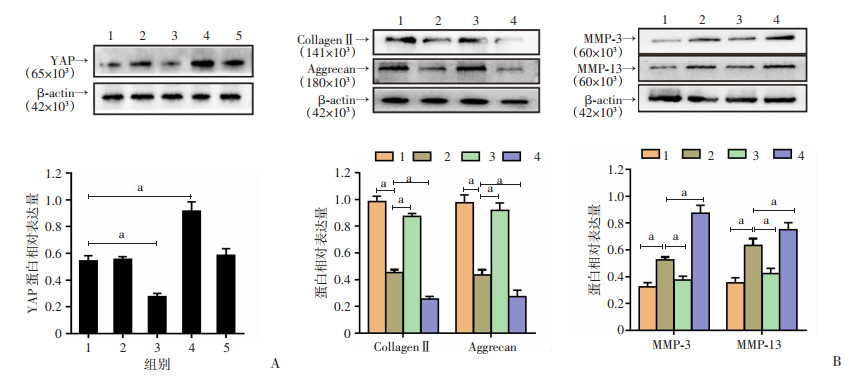
|
|
a:P<0.05 A:慢病毒转染YAP后蛋白表达及半定量分析 1: Control; 2: NC-siRNA; 3: YAP-siRNA; 4: LV-YAP; 5: LV-NC;B:转染YAP慢病毒后Collagen Ⅱ、Aggrecan、MMP-3和MMP-13的蛋白表达及半定量分析 1:对照组;2:IL-1β组;3:IL-1β+LV-YAP组:4:IL-1β+YAP-siRNA组 图 2 Western blot检测YAP转染后的表达及对髓核细胞外基质相关蛋白表达的影响 |
2.3 YAP促进髓核细胞自噬抑制椎间盘退变
为进一步探讨自噬在YAP保护椎间盘退变中的作用,采用Western blot和GFP-LC3腺病毒转染检测髓核细胞的自噬水平。Western blot结果显示,YAP过表达显著增加LC3-Ⅱ表达(P<0.05,图 3A)。同样,YAP过表达增加髓核细胞中GFP-LC3阳性颗粒数量(图 3B)。为进一步明确YAP诱导的自噬对髓核细胞外基质降解的影响,采用自噬抑制剂3-MA处理髓核细胞。3-MA预处理后显著降低LC3-Ⅱ蛋白表达,表明3-MA抑制LV-YAP诱导的自噬水平(P<0.05,图 3C)。此外,与IL-1β+LV-YAP组相比,3-MA预处理后Collagen Ⅱ和Aggrecan蛋白表达明显降低,而MMP-3和MMP-13蛋白表达明显升高(P<0.05,图 3C)。结果表明YAP通过促进自噬抑制髓核细胞外基质的降解。

|
|
1:对照组;2:IL-1β组;3:IL-1β+LV-YAP组;4:IL-1β+YAP-siRNA组;5:IL-1β+LV-YAP+3-MA组;a:P<0.05 A:Western blot检测LC3蛋白表达及半定量分析;B:共聚焦荧光显微镜检测GFP-LC3转染情况;C:Western blot检测LC3、Collagen Ⅱ、Aggrecan、MMP-3、MMP-13的蛋白表达及半定量分析 图 3 YAP促进人髓核细胞自噬及其对细胞外基质相关蛋白表达的影响 |
2.4 YAP在体内抑制大鼠椎间盘退变
为了进一步在体内验证YAP在椎间盘退变中的作用,采用针刺法建立椎间盘退变的大鼠模型。MRI检查结果显示,穿刺+LV-YAP组的T2加权信号值明显高于穿刺组(P<0.05,图 4A、B)。阿利新蓝染色结果显示,在穿刺组中,椎间盘的结构显示出明显退化特征,髓核细胞消失并被混乱的纤维组织取代,而予以LV-YAP转染处理后髓核细胞得以恢复(图 4C)。免疫组化染色结果显示,与假手术组相比,穿刺组YAP和LC3的表达降低。而与穿刺组相比,穿刺+LV-YAP组YAP和LC3的表达明显增加(图 4D)。结果表明YAP在体内可能是通过激活自噬,减轻大鼠椎间盘退变。
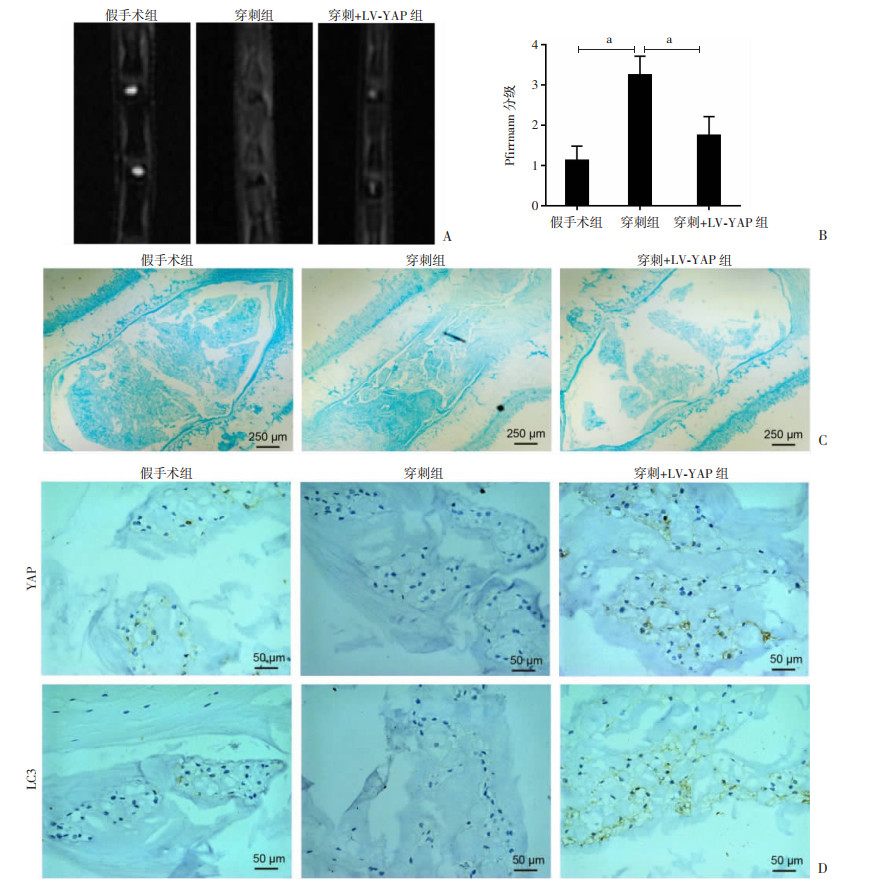
|
| A、B:MRI观察大鼠椎间盘退变及退变程度定量分析 a:P<0.05;C:阿利新蓝染色观察大鼠椎间盘退变;D:免疫组化染色检测大鼠椎间盘YAP和LC3的表达 图 4 体内YAP转染后对大鼠椎间盘退变及YAP和LC3表达的影响 |
3 讨论
椎间盘退变是腰痛的主要原因,但椎间盘退变的分子机制尚不十分清楚。目前,普遍认为椎间盘退变是椎间盘生物力学改变、细胞过度凋亡、炎症因子增加、营养物质减少、基质降解酶增加等多种原因导致的椎间盘细胞长期、进行性破坏的结果[14-16]。YAP是一种机械信号分子,能够检测到细胞形状变化引起的肌动蛋白细胞骨架的变化,并将机械信息传递给细胞核[17]。有报道称,在大鼠椎间盘退变过程中,YAP表达逐渐降低[18]。然而,目前尚不清楚YAP是否也与人类椎间盘退变有关。在本研究中,免疫组化染色和Western blot结果显示,YAP在人椎间盘退变中表达水平降低,表明YAP参与人椎间盘退变的过程。
YAP是一种调节多种转录因子活性进而参与调控细胞功能的转录辅助激活因子,参与细胞增殖、凋亡、自噬和组织修复的调控[19-21]。椎间盘退变的主要病理特征是细胞外基质中Ⅱ型胶原蛋白和聚蛋白多糖合成减少,基质金属蛋白酶合成增加。研究发现,在骨关节炎发病过程中,YAP可以抑制基质降解酶的表达和软骨降解[5]。此外,研究报道软骨素合酶3缺失可通过介导髓核细胞中的YAP激活导致自发性椎间盘退变[22]。同时研究发现DNMT3B通过COX2-YAP轴促进髓核细胞增殖和细胞外基质的合成[23]。本研究结果表明,过表达YAP可显著提高Ⅱ型胶原和聚蛋白多糖的表达,降低MMP-3和MMP-13的表达,这表明YAP能够抑制人髓核细胞细胞外基质的降解。
自噬是一种高度保守的细胞内分解代谢机制,通过清除细胞中不需要的蛋白质或分子来维持细胞稳态。自噬在多种退行性疾病的病理进展中起重要作用,如神经退行性、退行性骨关节炎、椎间盘退变等[24-26]。CHEN等[27]报道褪黑素可通过激活自噬抑制椎间盘细胞外基质退变。研究表明,YAP参与自噬过程的调控[28]。ZHAO等[29]报道YAP通过上调HMGB1促进胶质瘤的自噬和进展。ZHOU等[30]也报道YAP通过RAC1-ROS- mTOR通路促进肝癌多药耐药,抑制自噬相关细胞死亡。然而,椎间盘退变中YAP与自噬之间的关系尚不清楚。本研究结果表明,YAP过表达显著增加髓核细胞自噬水平,而自噬是一把双刃剑。为了进一步评价YAP诱导的自噬对细胞外基质降解的影响,本研究采用自噬抑制剂3-MA处理髓核细胞。发现3-MA预处理显著加重IL-1β+LV-YAP组细胞外基质的降解,表明YAP通过诱导自噬抑制人髓核细胞外基质的降解。为了进一步证实YAP在体内椎间盘退变中的作用,通过建立大鼠椎间盘退变模型,然后在体内将过表达YAP慢病毒注射到退变的大鼠髓核组织中,因为慢病毒可以将稳定的基因整合到宿主基因组中,具有广泛的组织向性,转染后且不表达病毒蛋白,是一种高效、稳定的载体,广泛应用于椎间盘变性的基因治疗。体内通过MRI、阿利新蓝及免疫组化检测结果表明,YAP过表达可显著抑制大鼠椎间盘退变,同时促进椎间盘自噬。
综上所述,YAP通过促进人髓核细胞的自噬,从而抑制IL-1β诱导的细胞外基质的降解,这说明YAP有望成为治疗椎间盘退变疾病的潜在靶点。但在YAP调控髓核细胞自噬的信号通路方面还有待于进一步研究。
| [1] |
WU T D, JIA X B, FENG H, et al. ACTG1 regulates intervertebral disc degeneration via the NF-κB-p65 and Akt pathways[J]. Biochem Biophys Res Commun, 2021, 545: 54-61. |
| [2] |
ZHANG C, WANG F, XIE Z Y, et al. AMOT130 linking F-actin to YAP is involved in intervertebral disc degeneration[J]. Cell Prolif, 2018, 51(6): e12492. |
| [3] |
PICCOLO S, DUPONT S, CORDENONSI M. The biology of YAP/TAZ: hippo signaling and beyond[J]. Physiol Rev, 2014, 94(4): 1287-1312. |
| [4] |
PEI T J, HUANG X, LONG Y, et al. Increased expression of YAP is associated with decreased cell autophagy in the eutopic endometrial stromal cells of endometriosis[J]. Mol Cell Endocrinol, 2019, 491: 110432. |
| [5] |
DENG Y J, LU J Q, LI W L, et al. Reciprocal inhibition of YAP/TAZ and NF-κB regulates osteoarthritic cartilage degradation[J]. Nat Commun, 2018, 9(1): 4564. |
| [6] |
GE J, YANG H L, CHEN Y F, et al. PMMA bone cement acts on the hippo/YAP pathway to regulate CTGF and induce intervertebral disc degeneration[J]. ACS Biomater Sci Eng, 2019, 5(7): 3293-3302. |
| [7] |
GONG C Y, ZHANG H H. Autophagy as a potential therapeutic target in intervertebral disc degeneration[J]. Life Sci, 2021, 273: 119266. |
| [8] |
ZHANG S J, YANG W, WANG C, et al. Autophagy: a double-edged sword in intervertebral disk degeneration[J]. Clin Chimica Acta, 2016, 457: 27-35. |
| [9] |
ZHANG Y, HE F, CHEN Z, et al. Melatonin modulates IL-1β-induced extracellular matrix remodeling in human nucleus pulposus cells and attenuates rat intervertebral disc degeneration and inflammation[J]. Aging (Albany NY), 2019, 11(22): 10499-10512. |
| [10] |
CHEN J, MA Y F, YANG Z J, et al. TNFAIP3 ameliorates the degeneration of inflammatory human nucleus pulposus cells by inhibiting mTOR signaling and promoting autophagy[J]. Aging (Albany NY), 2020, 12(23): 24242-24254. |
| [11] |
WANG D Y, HE J X, HUANG B Y, et al. Emerging role of the Hippo pathway in autophagy[J]. Cell Death Dis, 2020, 11(10): 880. |
| [12] |
ZHOU W, SHEN Q, WANG H, et al. Knockdown of YAP/TAZ inhibits the migration and invasion of fibroblast synovial cells in rheumatoid arthritis by regulating autophagy[J]. J Immunol Res, 2020, 2020: 9510594. |
| [13] |
PFIRRMANN C W A, METZDORF A, ZANETTI M, et al. Magnetic resonance classification of lumbar intervertebral disc degeneration[J]. Spine, 2001, 26(17): 1873-1878. |
| [14] |
DOWDELL J, ERWIN M, CHOMA T, et al. Intervertebral disk degeneration and repair[J]. Neurosurgery, 2017, 80(3S): S46-S54. |
| [15] |
YANG S D, ZHANG F, MA J T, et al. Intervertebral disc ageing and degeneration: the antiapoptotic effect of oestrogen[J]. Ageing Res Rev, 2020, 57: 100978. |
| [16] |
ZHANG X B, HU Y C, CHENG P, et al. Targeted therapy for intervertebral disc degeneration: inhibiting apoptosis is a promising treatment strategy[J]. Int J Med Sci, 2021, 18(13): 2799-2813. |
| [17] |
PUTS R, RIKEIT P, RUSCHKE K, et al. Functional regulation of YAP mechanosensitive transcriptional coactivator by Focused Low-Intensity Pulsed Ultrasound (FLIPUS) enhances proliferation of murine mesenchymal precursors[J]. PLoS One, 2018, 13(10): e0206041. |
| [18] |
ZHANG C, WANG F, XIE Z Y, et al. Dysregulation of YAP by the Hippo pathway is involved in intervertebral disc degeneration, cell contact inhibition, and cell senescence[J]. Oncotarget, 2018, 9(2): 2175-2192. |
| [19] |
CHEN W, BAI Y X, PATEL C, et al. Autophagy promotes triple negative breast cancer metastasis via YAP nuclear localization[J]. Biochem Biophys Res Commun, 2019, 520(2): 263-268. |
| [20] |
MOYA I M, HALDER G. Hippo-YAP/TAZ signalling in organ regeneration and regenerative medicine[J]. Nat Rev Mol Cell Biol, 2019, 20(4): 211-226. |
| [21] |
ZHU J, ZHAO B X, XIONG P G, et al. Curcumin induces autophagy via inhibition of Yes-associated protein (YAP) in human colon cancer cells[J]. Med Sci Monit, 2018, 24: 7035-7042. |
| [22] |
WEI L X, CAO P, XU C, et al. Chondroitin synthase-3 regulates nucleus pulposus degeneration through actin-induced YAP signaling[J]. FASEB J, 2020, 34(12): 16581-16600. |
| [23] |
LUO Z Q, MA Y C, DI T N, et al. DNMT3B decreases extracellular matrix degradation and alleviates intervertebral disc degeneration through TRPA1 methylation to inhibit the COX2/YAP axis[J]. Aging (Albany NY), 2021, 13(16): 20258-20276. |
| [24] |
CORTI O, BLOMGREN K, POLETTI A, et al. Autophagy in neurodegeneration: new insights underpinning therapy for neurological diseases[J]. J Neurochem, 2020, 154(4): 354-371. |
| [25] |
DUAN R, XIE H, LIU Z Z. The role of autophagy in osteoarthritis[J]. Front Cell Dev Biol, 2020, 8: 608388. |
| [26] |
ZHANG T W, LI Z F, DONG J, et al. The circadian rhythm in intervertebral disc degeneration: an autophagy connection[J]. Exp Mol Med, 2020, 52(1): 31-40. |
| [27] |
CHEN F, LIU H, WANG X, et al. Melatonin activates autophagy via the NF-κB signaling pathway to prevent extracellular matrix degeneration in intervertebral disc[J]. Osteoarthr Cartilage, 2020, 28(8): 1121-1132. |
| [28] |
TOTARO A, ZHUANG Q Y, PANCIERA T, et al. Cell phenotypic plasticity requires autophagic flux driven by YAP/TAZ mechanotransduction[J]. Proc Natl Acad Sci U S A, 2019, 116(36): 17848-17857. |
| [29] |
ZHAO M, ZHANG Y, JIANG Y, et al. YAP promotes autophagy and progression of gliomas via upregulating HMGB1[J]. J Exp Clin Cancer Res, 2021, 40(1): 99. |
| [30] |
ZHOU Y, WANG Y B, ZHOU W H, et al. YAP promotes multi-drug resistance and inhibits autophagy-related cell death in hepatocellular carcinoma via the RAC1-ROS-mTOR pathway[J]. Cancer Cell Int, 2019, 19: 179. |




