2. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院血液病医学中心,全军临床重点专科,创伤与化学中毒全国重点实验室,重庆市临床重点专科,血液病与微环境重庆市重点实验室;
3. 401329 重庆, 金凤实验室
2. State Key Laboratory of Trauma and Chemical Poisoning, Medical Center of Hematology, Military Key Clinical Specialty, Chongqing Key Clinical Specialty, Chongqing Key Laboratory of Hematology and Microenvironment, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037, China;
3. Jinfeng Laboratory, Chongqing, 401329, China
外周T细胞淋巴瘤(peripheral T-cell lymphomas,PTCL)是一组起源于胸腺成熟T淋巴细胞的非霍奇金淋巴瘤,异质性强,恶性程度高,预后差。在西方国家,PTCL占非霍奇金淋巴瘤(non-Hodgkin lymphoma, NHL)的5%~10%,在亚洲及南美国家更高,为15%~20%[1],由于PTCL异质性强,目前尚缺乏标准治疗手段,CHOP或CHOP样方案仍然是该类型的主要治疗方案,然而患者5年生存率仅有25%~35%,且复发/难治性患者的预后极差[2-3]。因此,寻找能体现PTCL恶性生物学特征的生物标志物具有重要的临床意义。
代谢重编程是肿瘤发生发展的重要特征之一,主要包括糖代谢、脂代谢、氨基酸代谢等代谢途径,其与肿瘤的转移及耐药密切相关[4]。相对于体液中含量微小的蛋白与DNA,含量丰富、变化明显的代谢产物更易于检测,且在疾病早期即出现变化,是监测肿瘤发生发展潜在的生物学标志物[5]。
目前,针对淋巴瘤患者的疗效检测手段主要包括血清指标(如乳酸脱氢酶)、CT或PET/CT,但由于多种疾病状态都会造成乳酸脱氢酶水平的异常升高,其特异性较差,不能较好地反映患者的肿瘤负荷;另外,影像学手段具有一定的放射损伤,可能对患者的健康造成一定的影响,其中作为目前检测金标准的PET/CT又易受到免疫治疗药物的影响从而出现假阳性的结果,同时PET/CT只能对特定时间点的肿瘤进行检测,无法动态反映肿瘤的演进。而代谢产物在人体内含量丰富、变化明显,且在肿瘤发生发展的任何阶段都发生着改变。因此,与其他组学相比,代谢组学更适于标志物和临床特征相关性的研究。目前关于PTCL代谢组学及相关作用机制的研究较少,因此利用代谢组学的方法分析血清能量代谢产物的变化水平,寻找PTCL早期诊断的理想生物标志物,具有广泛的临床应用潜力。
1 资料与方法 1.1 研究对象选取2020年11月至2021年12月在陆军军医大学第二附属医院血液病医学中心初诊的16例外周T细胞淋巴瘤患者及招募的10名健康志愿者。在接受治疗前获取其外周血。本研究遵照《赫尔辛基宣言》的原则实施,并经陆军军医大学第二附属医院医学伦理委员会审批(2022-研第174-01)。
纳入标准:①经组织病理学确诊为外周T细胞淋巴瘤,根据2016年的世界卫生组织(WHO)造血与淋巴组织肿瘤诊断标准进行诊断与分类;②先前未接受过化疗;③血液或尿液妊娠试验阴性;④血生化各项检查指标正常(由PTCL导致的脏器功能或生化指标异常除外);⑤无严重全身重要脏器功能损害者;⑥能独立签署研究相关的知情同意书。排除标准:①合并有其他恶性肿瘤需要治疗的患者;②合并严重心、肾或肝功能不全的患者;③合并严重的精神性疾病或脑功能紊乱的临床症状。
1.2 血样采集与预处理 1.2.1 样本收集患者及健康志愿者使用真空采血管收集外周血4 mL,血液采集后立即颠倒混匀,样本均在4 ℃条件下以1 500 r/min离心5 min,保留上清存放于-80 ℃备用。
1.2.2 代谢物提取将收集的样品从-80 ℃取出,放置于4 ℃条件下融化,100 μL样本加入400 μL预冷甲醇乙腈溶液(体积比为1 ∶1),涡旋60 s,置于-20 ℃沉淀1 h,然后在4 ℃条件下以14 000 r/min离心20 min,取上清冷冻干燥。
1.3 血样的色谱-质谱分析 1.3.1 Agilent 1290 Infinity LC超高效液相色谱以超高效液相色谱系统(UHPLC)分离能量代谢产物。样品盘温度: 4 ℃;进样量: 2 μL;色谱柱:ACQUITY UPLC BEH Amide 1.7 μm;柱温:45 ℃;流速: 300 μL/min。流动相为10 mmol/L乙酸铵/乙腈,0~18 min,乙腈比例从90%梯度降低至40%,18~18.1 min,乙腈比例从40%梯度上升至90%;18.1~23 min,乙腈比例维持为90%,以能量代谢产物标准品混合物校正保留时间。
1.3.2 质谱分析在负离子模式下以5500 QTRAP质谱仪(AB SCIEX)进行质谱分析。5500 QTRAP ESI源条件如下:源温度450 ℃,离子源气1(雾化气Gas1): 45,离子源气2(辅助气Gas2): 45,气帘气(CUR): 30,离子喷雾电压浮动(ISVF)-4500 V;采用质谱多反应监测(MRM)模式检测待测离子对。选择性反应/多反应监测技术(selected/multiple reaction monitoring,SRM/MRM)是基于已知或假定的反应离子信息,即以标准品为参照,对符合规则的离子对进行信号记录,去除不符合规则离子信号的干扰,从而对特定代谢物群进行有针对性、特异性地检测与分析,并可获得目标代谢物的绝对定量结果。
1.3.3 数据处理采用Multiquant软件提取保留时间和色谱峰面积,采用能量代谢产物标准品矫正保留时间,并鉴定能量代谢产物。
1.4 统计学分析采用SPSS 25.0统计软件进行分析,数据以x±s表示,组间临床特征比较采用t检验,变量之间的线性相关性采用Pearson相关分析,描述性统计用于分析人口统计学和临床因素等特征,P < 0.05认为差异有统计学意义。
2 结果 2.1 患者基线特征共纳入16例外周T细胞淋巴瘤患者,年龄24~78岁,中位年龄50.5岁,其中男性11例,女性5例;结外NK/T细胞淋巴瘤患者10例,血管免疫母细胞性T细胞淋巴瘤(angioimmunoblastic T-cell lymphoma, AITL)6例;存在B症状的患者4例,不存在B症状的12例;根据淋巴瘤的国际预后指数IPI评分标准及NK/T细胞淋巴瘤预后评分系统PINK评分标准,低危组8例,中危组5例,高危组3例;根据Ann Arbor临床分期标准,早期(Ⅰ+Ⅱ)10例,晚期(Ⅲ+Ⅳ)6例;根据ECOG(患者一般体能情况)评分标准,0分11例,1分4例,2分1例;LDH升高的患者7例,LDH降低的患者9例;中期疗效评估结果为完全缓解/部分缓解(CR/PR)5例,疾病稳定(SD)11例。
2.2 外周T细胞淋巴瘤患者差异能量代谢产物采用SRM/MRM对患者和健康志愿者的血清中能量相关代谢产物进行检测,主要包括糖酵解、三羧酸循环和氧化磷酸化途径在内的代谢物共32种,其中表达量可以进行定量分析的代谢物包含:6-磷酸葡萄糖、乳酸、苹果酸、环磷腺苷、α-酮戊二酸、磷酸二羟丙酮、草酰乙酸、琥珀酸、6-磷酸果糖、顺乌头酸、柠檬酸和异柠檬酸共12种(图 1)。
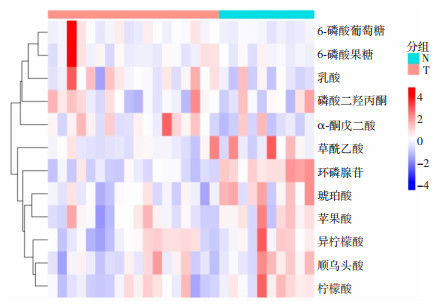
|
| N: 健康对照;T:患者 图 1 患者及健康对照血清代谢产物热图 |
2.3 PTCL患者不同能量代谢产物的变化
对于可定量分析的12种代谢物,与健康对照相比,外周T细胞淋巴瘤患者外周血中的环磷腺苷、琥珀酸、柠檬酸、顺乌头酸水平显著降低(P < 0.05, P < 0.01),6-磷酸葡萄糖水平升高(P < 0.05),而6-磷酸果糖、草酰乙酸、磷酸二羟丙酮、苹果酸、α-酮戊二酸、乳酸和异柠檬酸在健康对照和患者之间差异无统计学意义(表 1)。
| 组别 | n | 环磷腺苷 | 琥珀酸 | 6-磷酸葡萄糖 | 顺乌头酸 | 柠檬酸 | 草酰乙酸 |
| 健康对照 | 10 | 0.161±0.005 | 7.801±1.794 | 0.599±0.021 | 1.063±0.244 | 14.239±4.424 | 192.436±158.317 |
| PTCL患者 | 16 | 0.147±0.004 | 5.629±1.059 | 0.634±0.048 | 0.839±0.184 | 8.614±3.610 | 117.044±49.968 |
| P值 | < 0.01 | < 0.01 | < 0.05 | < 0.05 | < 0.01 | >0.05 | |
| 组别 | n | 异柠檬酸 | α-酮戊二酸 | 磷酸二羟丙酮 | 乳酸 | 苹果酸 | 6-磷酸果糖 |
| 健康对照 | 10 | 0.839±0.170 | 4.877±4.748 | 6.048±0.457 | 1 245.177±273.237 | 6.251±1.106 | 0.798±0.024 |
| PTCL患者 | 16 | 0.722±0.141 | 7.949±4.907 | 6.051±0.432 | 1 455.262±293.969 | 5.437±1.076 | 0.805±0.038 |
| P值 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | |
2.4 PTCL患者能量代谢产物变化与临床特征的关系
进一步分析差异代谢产物环磷腺苷、琥珀酸、柠檬酸、顺乌头酸和6-磷酸葡萄糖与患者临床特征的相关性,结果显示,外周T细胞淋巴瘤患者血清中的柠檬酸和琥珀酸水平与临床分期呈负相关,即Ⅰ~Ⅱ期患者柠檬酸(r=-0.577,P < 0.05)和琥珀酸(r=-0.857,P < 0.01)的表达水平显著高于Ⅲ~Ⅳ期患者,而其他3种差异代谢物与外周T细胞淋巴瘤的临床分期均无明显相关性(P>0.05),见图 2A;同时,患者外周血中柠檬酸(r=-0.716,P < 0.05)与琥珀酸水平(r=-0.940,P < 0.05)和患者的疾病危险度分级呈显著负相关(图 2B);苹果酸、柠檬酸水平与患者中期疗效评估结果也表现出明显的相关性(苹果酸r=-0.625,柠檬酸r=-0.605, P < 0.01,图 2C)。
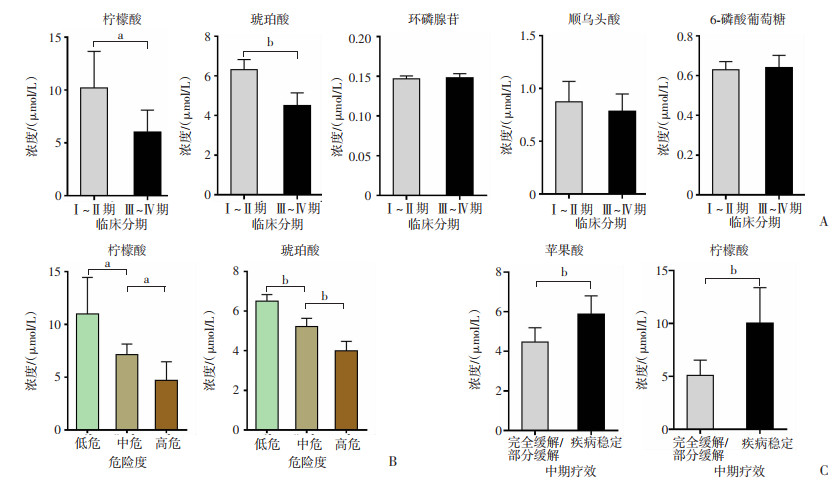
|
|
a: P < 0.05, b: P < 0.01 A:差异代谢产物与患者临床分期的相关性;B:差异代谢产物与患者疾病危险度的相关性;C:差异代谢产物与患者中期疗效评估结果的相关性 图 2 PTCL患者差异代谢产物与临床特征的相关性 |
2.5 结外NK/T细胞淋巴瘤患者亚组能量代谢产物的变化
与健康对照相比,结外NK/T细胞淋巴瘤患者外周血中的环磷腺苷(P < 0.01)、琥珀酸(P < 0.01)、顺乌头酸(P < 0.05)、柠檬酸(P < 0.05)和异柠檬酸(P < 0.05)水平明显降低,而6-磷酸果糖、6-磷酸葡萄糖、草酰乙酸、α-酮戊二酸、磷酸二羟丙酮、苹果酸以及乳酸在两者之间差异无统计学意义(P>0.05)。
随后分析上述5种差异代谢产物与患者临床特征的相关性,发现柠檬酸与琥珀酸的水平与结外NK/T细胞淋巴瘤的临床分期呈负相关,即Ⅰ~Ⅱ期患者外周血中柠檬酸(r=-0.637,P < 0.05)和琥珀酸(r=-0.947,P < 0.01)的水平显著高于临床分期为Ⅲ~Ⅳ期的患者,其他3种差异代谢物的水平与结外NK/T细胞淋巴瘤的临床分期均无明显相关性(P>0.05);同时琥珀酸(P < 0.01)和柠檬酸(P < 0.05)的水平与结外NK/T细胞淋巴瘤患者的中期疗效评估结果表现出明显的负相关(图 3)。
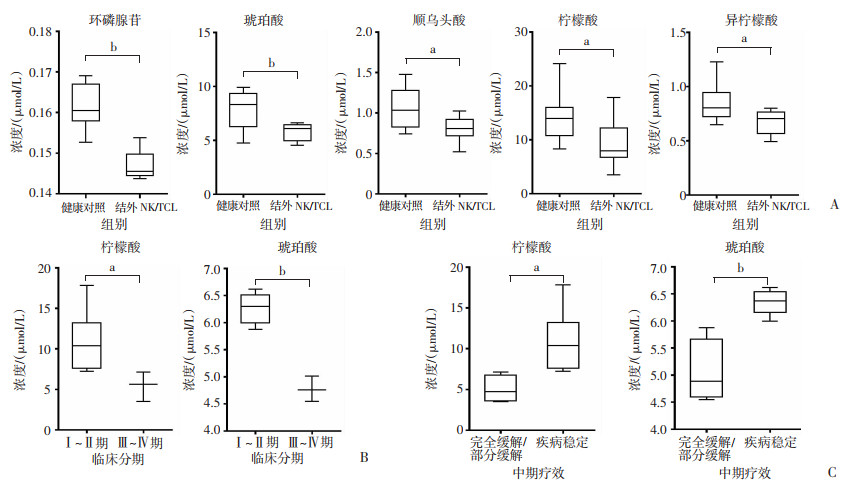
|
|
a: P < 0.05, b: P < 0.01 A:差异代谢产物较健康对照的变化;B:差异代谢产物与患者临床分期的相关性;C:差异代谢产物与患者中期疗效评估结果的相关性 图 3 结外NK/T细胞淋巴瘤患者差异代谢产物的变化特征 |
2.6 AITL患者能量代谢产物的变化
AITL患者外周血中的环磷腺苷(P < 0.01)、柠檬酸(P < 0.01)、琥珀酸(P < 0.05)水平相较于健康对照明显降低,而6-磷酸葡萄糖(P < 0.05)水平升高。其他几种如草酰乙酸、磷酸二羟丙酮、苹果酸、乳酸、琥珀酸、柠檬酸、异柠檬酸和6-磷酸果糖在两者之间并无统计学差异(P>0.05);其中,琥珀酸与患者的临床分期(r=-0.819,P < 0.05)和疾病危险度分级(r=-0.999,P < 0.01)都表现出明显的负相关(图 4)。
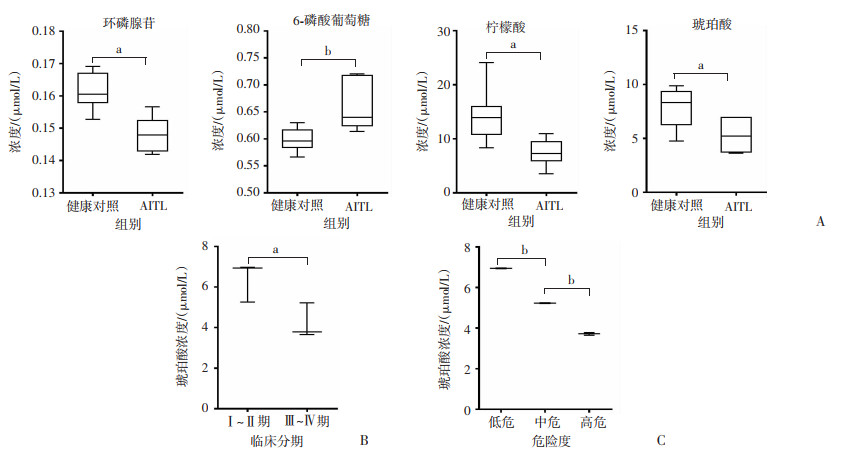
|
|
a: P < 0.05,b:P < 0.01; AITL: 血管免疫母细胞性T细胞淋巴瘤 A:差异代谢产物较健康对照的变化;B:琥珀酸与患者临床分期的相关性;C:琥珀酸与患者危险度分层的相关性 图 4 AITL细胞淋巴瘤患者能量代谢产物的变化特征 |
3 讨论
PTCL是一种临床侵袭性疾病,具有广泛的形态学差异和免疫表型的异常[3],目前PTCL在临床上主要通过血清学指标结合影像学检查进行诊断,但由于检测的灵敏度和特异性较差、成本昂贵等一系列问题,大多数患者在明确诊断时已发展至晚期,且患者也经常表现出对标准化疗方案的耐药性,甚至最终发展为难治性PTCL,因此找到对诊断PTCL具有较高特异性的血清生物标志物具有十分重要的临床意义[6]。
本研究发现PTCL患者血清中琥珀酸、柠檬酸、环磷腺苷、异柠檬酸表达水平显著降低,6-磷酸葡萄糖表达水平升高,可将琥珀酸、柠檬酸、环磷腺苷、异柠檬酸和6-磷酸葡萄糖作为辅助诊断PTCL的血清特异性标志物;同时差异代谢产物琥珀酸、柠檬酸与PTCL患者的临床分期和疾病危险度呈负相关,即其表达水平越低,PTCL患者的分期越晚、恶性程度越高,且苹果酸、柠檬酸表达水平高的PTCL患者在中期疗效评价时的CR率较低,表明其可以提示患者对治疗的反应。上述研究结果提示差异代谢产物琥珀酸、柠檬酸及苹果酸在预测PTCL患者的临床进程、监测患者肿瘤的恶性程度及患者的治疗反应方面具有良好的参考价值。在结外NK/T细胞淋巴瘤亚型中,琥珀酸、柠檬酸、环磷腺苷、异柠檬酸、顺乌头酸外周血水平低于健康对照,同样地,琥珀酸和柠檬酸水平与结外NK/T细胞淋巴瘤患者的临床分期呈显著负相关,且琥珀酸和柠檬酸的水平可以提示结外NK/T细胞淋巴瘤患者对治疗的反应;AITL患者外周血中的6-磷酸葡萄糖浓度高于健康对照,环磷腺苷、柠檬酸和琥珀酸水平较健康对照降低,其中琥珀酸、柠檬酸水平与AITL患者的临床分期和疾病危险度也表现出明显的负相关。
琥珀酸普遍存在于人、动植物以及微生物的代谢中,参与三羧酸循环、糖酵解和氧化磷酸化等多种生化反应途径,脑脊液的代谢组学发现琥珀酸可以治疗创伤性脑损伤,从而推测这可能可以应用到中枢神经系统淋巴瘤的治疗当中[7]。ERTUGRUL等[8]通过体外实验发现,琥珀酸可通过抑制急性淋巴细胞白血病细胞增殖和凋亡, 从而抑制其生长,提示琥珀酸相关代谢通路有望成为急性淋巴细胞白血病的潜在治疗靶点。而柠檬酸作为三羧酸循环途径中的中间体,在调节细胞增殖、代谢以及信号传导等生物学过程发挥重要作用[9],ZHAO等[10]综述了柠檬酸可通过促进多种肿瘤细胞过度脂质合成和细胞衰老抑制肿瘤发生发展。研究表明高浓度柠檬酸抑制间皮瘤、胃癌、卵巢癌和结肠癌等多种肿瘤生长,促进细胞凋亡,增强细胞对顺铂治疗的敏感性,抑制糖酵解和某些关键信号通路[11],也与本研究结果一致。XU等[12]发现柠檬酸通过靶向HIF-1α信号通路发挥抗急性单核细胞白血病的作用,有望成为一种有前景的临床疗法。总之,本研究结果表明,琥珀酸和柠檬酸有希望成为预测PTCL患者肿瘤分期、疾病危险度分级以及治疗反应的理想生物标志物,可用于PTCL诊断、预测预后和个体化精准治疗。
代谢重编程作为恶性肿瘤发生发展过程中的重要标志之一,为其生长提供了必需的物质和能量基础[13]。Warburg效应表明肿瘤细胞即使在氧气充足的情况下,仍然侧重于无氧糖酵解途径供能,而非氧化磷酸化途径,是大部分肿瘤自主调控代谢重编程的代表性事件之一[14]。本研究发现三羧酸循环相关代谢产物在PTCL患者与健康对照之间存在显著性差异,提示PTCL可能主要是依赖三羧酸循环来产生能量以及合成肿瘤生长所需的一些营养物质。乳酸脱氢酶作为糖酵解过程中的酶,是目前临床上判断淋巴瘤肿瘤负荷最常用的生化指标,但急性心肌梗死、肝脏疾病及肌肉相关疾病等多种情况皆可导致其异常升高,且本研究结果显示糖酵解相关代谢产物在PTCL患者与健康对照之间并无明显差异,而三羧酸循环相关代谢产物表现出明显差异,并且其与患者的临床特征表现出明显的相关性,提示在PTCL患者中,三羧酸循环相关代谢产物可能具有更好的临床价值。因此,与传统的生物学标志物乳酸脱氢酶相比,琥珀酸、柠檬酸对于诊断PTCL具有更强的特异性,为PTCL的临床分期、肿瘤恶性程度的监测及患者治疗反应的预测提供了良好的参考依据。本研究仍存在一定的局限性,后续有待扩大样本量、优化检测流程、进一步探索造成以上几种差异代谢物改变的具体生物学进程,并且本研究入组患者病理亚型为结外NK/T细胞淋巴瘤和血管免疫母细胞性T细胞淋巴瘤,对于PTCL其他亚型仍需进一步探索,验证上述代谢产物与其临床特征的关系是否存在普遍性。目前,针对PTCL的治疗仍面临较大挑战,尤其是缺乏针对特定靶点的药物,通过深入研究这些差异代谢物在PTCL发生发展中的作用,对于发现新的治疗靶点,从而开发更有效的治疗方案具有重要的临床意义。
总之,本研究从能量代谢的角度探索代谢产物作为预测性生物标志物在PTCL中的可行性和临床应用潜力,为PTCL的早期诊断和个体化精准治疗提供了有效证据,从而能够更好地服务于临床工作。
作者贡献声明 段一硕、饶军参与本研究的研究方案设计、样本收集、数据处理、文章撰写及修改,夏菁、马娜丫、蔺诗佳、李甫、唐书翰、周沙、曾韫璟参与本文数据的修改及样本的收集,李炘檑、黄德智、李琼、刘帮洞、赵先兰参与本文的修改,魏锦、张曦参与本研究的研究方案设计及文章修改
| [1] |
ZHANG P, ZHANG M Z. Epigenetic alterations and advancement of treatment in peripheral T-cell lymphoma[J]. Clin Epigenetics, 2020, 12(1): 169. |
| [2] |
SALEH K, MICHOT J M, RIBRAG V. Updates in the treatment of peripheral T-cell lymphomas[J]. J Exp Pharmacol, 2021, 13: 577-591. |
| [3] |
RODRÍGUEZ M, ALONSO-ALONSO R, TOMÁS-ROCA L, et al. Peripheral T-cell lymphoma: molecular profiling recognizes subclasses and identifies prognostic markers[J]. Blood Adv, 2021, 5(24): 5588-5598. |
| [4] |
SURI G S, KAUR G, CARBONE G M, et al. Metabolomics in oncology[J]. Cancer Rep (Hoboken), 2023, 6(3): e1795. |
| [5] |
TAN W F, HE J Q, DENG J L, et al. Small molecule metabolite biomarkers for hepatocellular carcinoma with bile duct tumor thrombus diagnosis[J]. Sci Rep, 2018, 8(1): 1-9. |
| [6] |
FOSS F M, ZINZANI P L, VOSE J M, et al. Peripheral T-cell lymphoma[J]. Blood, 2011, 117(25): 6756-6767. |
| [7] |
GENG H M, TSANG M, SUBBARAJ L, et al. Tumor metabolism and neurocognition in CNS lymphoma[J]. Neuro-oncology, 2021, 23(10): 1668-1679. |
| [8] |
ERTUGRUL B, IPLIK E S, CAKMAKOGLU B. In vitro inhibitory effect of succinic acid on T-cell acute lymphoblastic leukemia cell lines[J]. Arch Med Res, 2021, 52(3): 270-276. |
| [9] |
PATIL S A, MAYOR J A, KAPLAN R S. Citrate transporter inhibitors: possible new anticancer agents[J]. Future Med Chem, 2022, 14(9): 665-679. |
| [10] |
ZHAO Y J, LIU X, SI F S, et al. Citrate promotes excessive lipid biosynthesis and senescence in tumor cells for tumor therapy[J]. Adv Sci (Weinh), 2022, 9(1): e2101553. |
| [11] |
ICARD P, COQUEREL A, WU Z R, et al. Understanding the central role of citrate in the metabolism of cancer cells and tumors: an update[J]. Int J Mol Sci, 2021, 22(12): 6587. |
| [12] |
XU X W, LI B W, HUANG P J, et al. Citrate induces apoptosis of the acute monocytic leukemia U937 cell line through regulation of HIF-1α signaling[J]. Mol Med Rep, 2013, 8(5): 1379-1384. |
| [13] |
FAUBERT B, SOLMONSON A, DEBERARDINIS R J. Metabolic reprogramming and cancer progression[J]. Science, 2020, 368(6487): eaaw5473. |
| [14] |
WARBURG O, WIND F, NEGELEIN E. The metabolism of tumors in the body[J]. J Gen Physiol, 1927, 8(6): 519-530. |




