2. 671000 大理,大理大学研究生院
2. Graduate School of Dali University, Dali, Yunnan Province, 671000, China
异基因造血干细胞移植在血液病的治疗中占有重要地位,而单倍型相合供者干细胞是异基因造血干细胞的主要来源之一,移植物抗宿主病(graft versus host disease,GVHD)是单倍型相合移植常见的并发症之一,严重影响单倍型相合移植的临床疗效。目前预防单倍型相合移植GVHD的方法有:体外去T[1]、抗胸腺细胞球蛋白(antithymocyte globulin,ATG)、移植后应用大剂量环磷酰胺(post transplantation cyclophosphamide,PTCY),尤以后两种方法应用较广泛,但各有优缺点,本研究将ATG方案与PTCY方案进行融合,扬长避短,优化单倍型相合移植GVHD预防方案,以期更好地控制GVHD的同时克服单独应用任一方案的固有不足。
1 资料与方法 1.1 研究对象收集2022年1月至2023年2月在中国人民解放军联勤保障部队第九二〇医院血液科行单倍型相合移植的90例患者资料,按照研究对象接受不同的GVHD预防方案分为研究组和对照组,研究组为低剂量ATG联合低剂量PTCY组,总共47例;对照组为标准剂量PTCY组,总共43例。纳入标准:行单倍型相合移植的血液系统疾病患者。排除标准:病例资料不完整者。本研究经中国人民解放军联勤保障部队第九二〇医院伦理委员会审批通过[伦审2023-150(科)-01]。
1.2 方法 1.2.1 预处理方案两组预处理方案相同,预处理方案根据不同疾病制定:①再生障碍性贫血、阵发性睡眠性血红蛋白尿症:氟达拉滨40 mg/m2×5 d[移植前第6天(d-6)至d-2]+环磷酰胺50 mg/kg×2 d(d-6、d-4) +美法仑100 mg/m2×1 d(d-2);②急性白血病、骨髓增生异常综合征、地中海贫血及噬血细胞综合征:氟达拉滨40 mg/m2×5 d(d-6至d-2)+白消安130 mg/m2×1 d(d-6)+美法仑100 mg/m2×1 d(d-2)。
1.2.2 GVHD预防方案研究组:ATG2 mg/kg,d-1;1 mg/kg,粒细胞植入当天。PTCY 25 mg/kg,移植后第4天(d4)。同时给予芦可替尼5 mg,bid,d-1至d21;2.5 mg,bid,d22至d28;2.5 mg,qd,d29至d35。环孢素从d5开始使用,2 mg/(kg· d),d100后逐渐减量,d180停用。甲氨蝶呤:5 mg/m2,d3。麦考酚钠肠溶片10 mg/kg,tid,d5至d35预防GVHD。对照组:PTCY 50 mg/kg,d3、d4。同时给予芦可替尼、环孢素、甲氨蝶呤、麦考酚钠肠溶片预防GVHD,芦可替尼、环孢素、甲氨蝶呤、麦考酚钠肠溶片的给药剂量及给药时间与研究组相同。根据急性移植物抗宿主病国际联盟分级标准对急性GVHD进行诊断和临床分级[2]。根据美国国立卫生研究院共识标准对慢性GVHD进行诊断和分度[3]。
1.2.3 干细胞动员及采集干细胞动员前供者均进行移植前常规检查,明确无禁忌证后于d-4给予粒细胞集落刺激因子5 μg/(kg·d)皮下注射进行干细胞动员,连续使用4 d,于移植当天(d0)采用血细胞分离机采集供者外周血造血干细胞。
1.2.4 并发症防治及其他支持治疗所有患者完成移植前全身评估,药浴后进入百级层流病房,移植过程中预防真菌感染、细菌感染、卡氏肺孢子菌肺炎、抗病毒等。d5开始予粒细胞集落刺激因子促进粒细胞植入,当中性粒细胞绝对值≥0.5×109/L时停用,当血红蛋白<60 g/L、血小板<20×109/L或伴活动性出血或严重凝血功能障碍时,积极输注血制品。
1.2.5 造血重建标准粒细胞植入标准为患者外周血中性粒细胞连续监测3 d绝对值≥0.5×109/L;血小板植入标准为不依赖输血,血小板计数连续7 d≥20×109/L[4]。
1.2.6 观察指标两组患者的一般临床资料、植入情况、急性移植物抗宿主病(acute graft versus host disease,aGVHD)和慢性移植物抗宿主病(chronic graft versus host disease,cGVHD)的发生情况、其他移植相关并发症的发生情况、生存情况。
1.2.7 随访方式主要采用门诊复诊、住院治疗及电话随访,当患者出现死亡、失访或研究停止时随访结束。
1.3 统计学分析应用SPSS 27.0统计软件进行分析,符合正态分布的计量资料以x±s表示,采用独立样本t检验;符合偏态分布的计量资料以中位数表示,采用Mann-Whitney U检验;计数资料以例(%)表示,采用χ2检验;采用Kaplan-Meier生存曲线分析两组患者的总体生存情况。检验水准α=0.05。
2 结果 2.1 一般临床资料两组患者的性别、疾病种类、移植前疾病状态、供受者关系、供受者性别等指标相比,差异均无统计学意义(P>0.05)。两组患者的一般临床资料比较见表 1。
| 指标 | 研究组 (n=47) |
对照组 (n=43) |
χ2值 | P值 |
| 患者性别 | 0.004 | 0.947 | ||
| 男 | 20(42.6) | 18(41.9) | ||
| 女 | 27(57.4) | 25(58.1) | ||
| 疾病种类 | 0.239 | 0.888 | ||
| AML | 20(42.5) | 17(39.5) | ||
| ALL | 17(36.2) | 15(34.9) | ||
| 其他 | 10(21.3) | 11(25.6) | ||
| 移植前疾病状态 | 0.233 | 0.630 | ||
| CR | 37(78.7) | 32(74.4) | ||
| NR | 10(21.3) | 11(25.6) | ||
| 供受者关系 | 0.354 | 0.838 | ||
| 父母 | 20(42.5) | 18(41.9) | ||
| 子女 | 13(27.7) | 10(23.2) | ||
| 同胞 | 14(29.8) | 15(34.9) | ||
| 供受者性别 | 0.004 | 0.947 | ||
| 女供男 | 20(42.6) | 18(41.9) | ||
| 其他 | 27(57.4) | 25(58.1) |
2.2 植入情况
两组患者均成功植入,研究组中性粒细胞植入的中位时间为11 d,显著短于对照组(17 d,P < 0.05,图 1A);研究组血小板植入的中位时间为12 d,显著短于对照组(20 d,P < 0.05,图 1B)。
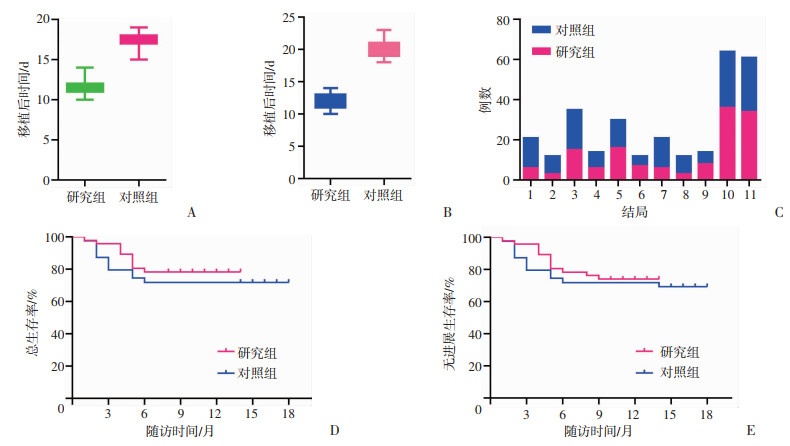
|
| A:中性粒细胞植入时间;B:血小板植入时间;C:移植结局1: Ⅱ~Ⅳ度aGVHD;2: Ⅲ~Ⅳ度aGVHD;3:轻度cGVHD;4:中重度cGVHD;5: EBV再激活;6: CMV再激活;7: HC;8: NRM;9:复发;10:总生存;11:无进展生存;D:总生存曲线;E:无进展生存曲线 图 1 两组患者的生存情况 |
2.3 GVHD发生情况
研究组Ⅱ~Ⅳ度、Ⅲ~Ⅳ度aGVHD的发生率均显著低于对照组[12.8%(6/47)vs 34.9%(15/43),χ2=6.141,P=0.013;6.4%(3/47)vs 20.9%(9/43),χ2=4.112,P=0.043]。两组轻度、中重度cGVHD的发生率差异均无统计学意义[31.9%(15/47)vs 46.5%(20/43),χ2=2.013,P=0.156;12.8%(6/47)vs 18.6%(8/43),χ2=0.583,P=0.445]。见图 1C。
2.4 其他移植相关并发症的发生情况两组EB病毒(Epstein-Barr virus,EBV)及巨细胞病毒(cytomegalovirus,CMV)再激活率均无显著差异[34.0%(16/47)vs 32.6%(14/43),χ2=0.022,P=0.881;14.9%(7/47)vs 11.6%(5/43),χ2=0.207,P=0.649]。研究组出血性膀胱炎(hemorrhagic cystitis,HC)的发生率显著低于对照组[12.8%(6/47)vs 34.9%(15/43);χ2=6.141,P=0.013]。见图 1C。
2.5 生存情况截止随访结束,研究组中位随访时间为11个月,显著短于对照组15个月(P < 0.05),研究组非复发死亡(non-recurrent mortality,NRM)率显著低于对照组[6.4%(3/47)vs 20.9%(9/43),χ2=4.112,P=0.043]。两组复发率、总生存率、无进展生存率差异均无统计学意义[17.0%(8/47)vs 13.9%(6/43),χ2=0.161,P=0.688;76.6%(36/47)vs 65.1%(28/43),χ2=1.44,P=0.23;72.3%(34/47)vs 62.8%(27/43),χ2=0.938,P=0.33]。见图 1C~E。
3 讨论北京方案和PTCY方案是目前常用的单倍型相合移植GVHD预防方案。北京方案以ATG为核心,是我国常用的GVHD预防方案,植入成功率较高、复发率较低,但GVHD发生率、感染发生率较高,国内研究者通过大量的临床试验探索ATG的最佳剂量,剂量范围为4.5~10.0 mg/kg,发现总量7.5 mg/kg是目前最佳的剂量,实现了较低的GVHD发生率及CMV/EBV相关死亡率[5-6]。
PTCY方案是国外常用的GVHD预防方案,GVHD发生率较低,但植入失败率及复发率较高[7]。标准剂量PTCY 50 mg/kg(d3、d4)有较高的心脏毒性、3~4级黏膜炎、出血性膀胱炎发生率[8-9]。由于PTCY标准剂量伴有较多的毒副作用,有研究者探索降低PTCY用量的可行性。WACHSMUTH等[10]在动物实验中发
现PTCY 25 mg/kg(d3、d4)是最佳剂量,能有效预防致命性GVHD的发生。一项关于PTCY不同剂量用于单倍型相合移植的Ⅰ/Ⅱ期研究,比较了PTCY 3种剂量(50 mg/kg,d3、d4;25 mg/kg,d3、d4;25 mg/kg,d4)的疗效,发现PTCY减量至25 mg/kg(d3、d4)和25 mg/kg (d4)是可行的,能有效预防严重aGVHD的发生,同时能获得更快的植入,且移植后早期毒性较小、持续时间较短[11]。
国内外的移植中心尝试将上述两种方案进行结合[12-17],ATG在移植前及移植后均有应用,但大多数在移植前应用, 剂量范围在2.5~10.0 mg/kg,PTCY在移植后d3、d4使用,剂量范围在29~100 mg/kg。结果显示Ⅱ~Ⅳ度aGVHD的发生率为11.5%~34.6%,Ⅲ~Ⅳ度aGVHD的发生率为1.4%~8.9%,与标准剂量ATG或标准剂量PTCY方案相比,低剂量ATG联合低剂量PTCY方案具有更好的GVHD预防效果,但两者联用时最佳的给药剂量及给药时机尚未明确。
本研究选取研究报道中较低剂量的ATG(总量3 mg/kg)联合报道中最低剂量的PTCY(25 mg/kg×1 d) 预防GVHD,ATG在移植前1 d(d-1)使用2 mg/kg,兼具促进植入、降低移植排斥和GVHD的多重作用,在粒细胞植入当天再使用1 mg/kg,主要目的是继续清除供者T细胞,进一步降低GVHD的发生。结果显示与对照组标准剂量PTCY方案相比,低剂量ATG联合低剂量PTCY方案具有更低的GVHD发生率,Ⅱ~Ⅳ度aGVHD的发生率从34.9%降到12.8%,Ⅲ~Ⅳ度aGVHD的发生率从20.9%降到6.4%。在植入方面,研究组植入更快,中性粒细胞植入的中位时间从17 d缩短到11 d,血小板植入的中位时间从20 d缩短到12 d。此外,研究组具有更低的非复发死亡率和出血性膀胱炎发生率,且不增加EBV及CMV感染风险。因ATG和PTCY均能较好地预防cGVHD,研究组PTCY剂量虽低于对照组,但加入了ATG协同预防cGVHD,两组总体的免疫抑制强度相差不大,所以两组cGVHD发生率差异无统计学意义。因此ATG与PTCY联用时,在剂量方面,ATG可安全减量至总量3 mg/kg,比研究报道的最低剂量2.5 mg/kg略高,ATG是否还能继续减量值得进一步探索。PTCY剂量可安全降至25 mg/kg×1 d,是目前研究报道中的最低剂量,预防GVHD的效果比较满意。在应用时机方面,ATG可在移植前及移植后应用,PTCY可只在移植后第4天(d4)应用。
综上所述,低剂量ATG联合低剂量PTCY预防单倍型相合移植GVHD有效且优于标准剂量PTCY方案。因本研究属于回顾性研究,样本量偏少,随访时间不够长,有一定的局限性,尚需更多前瞻性、大样本、多中心、随机对照试验证明该方案的优选性。
| [1] |
DIAZ M A, GASIOR M, MOLINA B, et al. "Ex-vivo" T-cell depletion in allogeneic hematopoietic stem cell transplantation: new clinical approaches for old challenges[J]. Eur J Haematol, 2021, 107(1): 38-47. |
| [2] |
SCHOEMANS H M, LEE S J, FERRARA J L, et al. EBMT-NIH-CIBMTR Task Force position statement on standardized terminology & guidance for graft-versus-host disease assessment[J]. Bone Marrow Transplant, 2018, 53(11): 1401-1415. |
| [3] |
CUVELIER G D E, SCHOETTLER M, BUXBAUM N P, et al. Toward a better understanding of the atypical features of chronic graft-versus-host disease: a report from the 2020 National Institutes of Health Consensus Project Task Force[J]. Transplant Cell Ther, 2022, 28(8): 426-445. |
| [4] |
HUTT D. Engraftment, graft failure, and rejection[M]//KENYON M, BABIC A. The European blood and marrow transplantation textbook for nurses: under the auspices of EBMT. Cham(CH): Springer, 2018: 259-270. DOI: 10.1007/978-3-319-50026-3_13.
|
| [5] |
CHANG Y J, WU D P, LAI Y R, et al. Antithymocyte globulin for matched sibling donor transplantation in patients with hematologic malignancies: A multicenter, open-label, randomized controlled study[J]. J Clin Oncol, 2020, 38(29): 3367-3376. |
| [6] |
WANG Y, LIU Q F, LIN R, et al. Optimizing antithymocyte globulin dosing in haploidentical hematopoietic cell transplantation: long-term follow-up of a multicenter, randomized controlled trial[J]. Sci Bull, 2021, 66(24): 2498-2505. |
| [7] |
SUGITA J, KAGAYA Y, MIYAMOTO T, et al. Myeloablative and reduced-intensity conditioning in HLA-haploidentical peripheral blood stem cell transplantation using post-transplant cyclophosphamide[J]. Bone Marrow Transplant, 2019, 54(3): 432-441. |
| [8] |
OMAR A, SEONGHO K, ANUPAMA K, et al. Incidence, risk factors and outcomes of cardiac toxicity in haploidentical peripheral stem cell transplantation with high dose cyclophosphamide[J]. Blood, 2020, 136(Supplement 1): 35-36. |
| [9] |
MODI D, ALBANYAN O, KIM S, et al. Toxicities after high dose post-transplant cyclophosphamide in haploidentical donor transplants: risk factors and impact on survival[J]. J Clin Oncol, 2020, 38(15_suppl): 7545. |
| [10] |
WACHSMUTH L P, PATTERSON M T, ECKHAUS M A, et al. Posttransplantation cyclophosphamide prevents graft-versus-host disease by inducing alloreactive T cell dysfunction and suppression[J]. J Clin Investig, 2019, 129(6): 2357-2373. |
| [11] |
MCADAMS M J, HYDER M, DIMITROVA D, et al. Phase Ⅰ/Ⅱ study of reduced dosing of post-transplantation cyclophosphamide (PTCy) after HLA-haploidentical bone marrow transplantation[J]. Blood, 2021, 138(Supplement 1): 101. |
| [12] |
BARKHORDAR M, KASAEIAN A, JANBABAI G, et al. Modified combination of anti-thymocyte globulin (ATG) and post-transplant cyclophosphamide (PTCy) as compared with standard ATG protocol in haploidentical peripheral blood stem cell transplantation for acute leukemia[J]. Front Immunol, 2022, 13: 921293. |
| [13] |
ZHANG W L, GUI R R, ZU Y L, et al. Reduced-dose post-transplant cyclophosphamide plus low-dose post-transplant anti-thymocyte globulin as graft-versus-host disease prophylaxis with fludarabine-busulfan-cytarabine conditioning in haploidentical peripheral blood stem cell transplantation: a multicentre, randomized controlled clinical trial[J]. Br J Haematol, 2023, 200(2): 210-221. |
| [14] |
ZU Y L, LI Z, GUI R R, et al. Low-dose post-transplant cyclophosphamide with low-dose antithymocyte globulin for prevention of graft-versus-host disease in first complete remission undergoing 10/10 HLA-matched unrelated donor peripheral blood stem cell transplants: a multicentre, randomized controlled trial[J]. Bone Marrow Transplant, 2022, 57(10): 1573-1580. |
| [15] |
WANG Y, WU D P, LIU Q F, et al. Low-dose post-transplant cyclophosphamide and anti-thymocyte globulin as an effective strategy for GVHD prevention in haploidentical patients[J]. J Hematol Oncol, 2019, 12(1): 88. |
| [16] |
SALAS M Q, PREM S, ATENAFU E G, et al. Reduced intensity allogeneic stem cell transplant with anti-thymocyte globulin and post-transplant cyclophosphamide in acute myeloid leukemia[J]. Eur J Haematol, 2019, 103(5): 510-518. |
| [17] |
MAKANGA D R, GUILLAUME T, WILLEM C, et al. Posttransplant cyclophosphamide and antithymocyte globulin versus posttransplant cyclophosphamide as graft-versus-host disease prophylaxis for peripheral blood stem cell haploidentical transplants: comparison of T cell and NK effector reconstitution[J]. J Immunol, 2020, 205(5): 1441-1448. |




