耐力表现,尤其是长时间的耐力运动能力,对运动员的代谢和营养要求更高。长跑运动员在训练期间面临严峻的挑战,科学合理的饮食策略可以在一定程度上改善耐力表现和身体健康。脂肪是耐力运动中重要的能量来源之一,尤其在长时间、低至中等强度的运动中提供持久的能量。近年来,高脂饮食对耐力运动表现的影响受到了广泛关注。有研究表明,相比于脂肪供能比为15%的饮食,脂肪供能比提高到32%~55%的饮食可以提升耐力运动表现[1]。同时,低碳高脂饮食还可以通过增加全身脂肪分解来提高生理效益。这种饮食可以增加游离脂肪酸和肌肉内甘油三酯含量,而不会对碳水化合物的储存产生影响,并支持更高水平的脂肪氧化,最终让耐力运动员获得更多的能量[2]。另外一项人群研究发现,高碳水饮食组和高脂饮食组在跑步计时赛中表现无明显差异,但高脂饮食可能导致耐力运动期间的氧气消耗增加[3]。
需要注意的是,大多数研究并没有限制高脂饮食的总能量摄入,或保持不同干预组的能量摄入一致。由于碳水化合物和脂肪对于机体能量代谢具有较大影响,并且不同体质量的个体能量消耗不同,即使绝对量相同的能量摄入对于不同个体能量消耗的满足程度也是不同的。为明确等能量高脂饮食对机体能量代谢的影响,本研究将在保持大鼠摄入能量(以单位体质量计)相同的前提下,研究脂肪供能比为45%的高脂饮食对大鼠代谢及耐力运动能力的影响,并从能量代谢底物变化的角度探讨其中的相关机制。
1 材料与方法 1.1 实验动物及分组6周龄的雄性SD大鼠(n=24)购自重庆莱彼特生物科技有限公司,初始体质量为(261.7±4.4)g。将每只大鼠单独饲养在光暗循环(12~12 h昼夜循环光照,20~25 ℃、45%~55%恒温恒湿)的受控环境中。实验程序遵循陆军军医大学学术研究伦理审查委员会大鼠护理和使用指导原则并获得该委员会批准(批准号:AMUWEC20228026)。大鼠采用随机数字表法分为4组:常规喂养组(CON组)、高脂喂养组(HFD组)、常规喂养+训练组(CONT组)、高脂喂养+训练组(HFDT组),每组各6只。
1.2 动物喂饲与干预大鼠自由饮水。CON组、CONT组给予脂肪供能比为12%的常规饲料,HFD组、HFDT组给予脂肪供能比为45%的高脂饲料。高脂饲料(批号:20230315)和常规饲料(批号:23030118)购于江苏协同生物科技有限公司。大鼠饲料能量供应配比见表 1。
| 能量构成 | CON/CONT组 | HFD/HFDT组 | |||
| kJ/kg | kJ/% | kJ/kg | kJ/% | ||
| 蛋白质 | 3 043.8 | 20.6 | 3 964.9 | 20.0 | |
| 脂肪 | 1 771.0 | 12.0 | 8 897.0 | 45.0 | |
| 碳水化合物 | 9 960.4 | 67.4 | 6 744.9 | 35.0 | |
| 合计 | 14 779.4 | 100.0 | 19 606.8 | 100.0 | |
每2天对所有大鼠进行称量,并给予CON组及CONT组大鼠每周期(2 d)足够的饲料量(100~150 g/只),使其自由进食,48 h后称量未食用的饲料量(餐盘上剩余饲料量)。为确保各组大鼠均为等能量饲养,每只单独饲养的高脂喂养大鼠(HFD/HFDT组)均按常规喂养大鼠(CON/CONT组)的平均每克体质量摄食能量动态分配不同质量的饲料[4]。高脂喂养大鼠饲料供应量计算如下。
每周期CON/CONT组平均饲料摄入量(g)=饲料供应量-剩余饲料量
常规喂养大鼠的每周期单位体质量能量摄入(kJ/g)=每周期饲料摄入量(g)×14.8(kJ/g)/常规喂养大鼠组体质量(g)
高脂喂养大鼠的每周期应提供饲料量(g)=常规喂养大鼠组的每周期单位体质量能量摄入(kJ/g)×体质量(g)/19.6(kJ/g)
其中,14.8、19.6 kJ/g分别为常规饲料、高脂饲料能量密度。
1.3 耐力训练 1.3.1 动物耐力训练方法干预前1周,CONT组和HFDT组大鼠在TSE Calo Treadmill跑台上进行5 d的适应性训练,方法参考前期研究[5]。第2周开始对大鼠进行运动干预,每周运动5 d,休息2 d,共计6周。跑台速度设为20 m/min,第1天运动训练时间为20 min,随后每天增加10 min至每天60 min,并保持至干预结束(动物训练及饮食干预如图 1)。
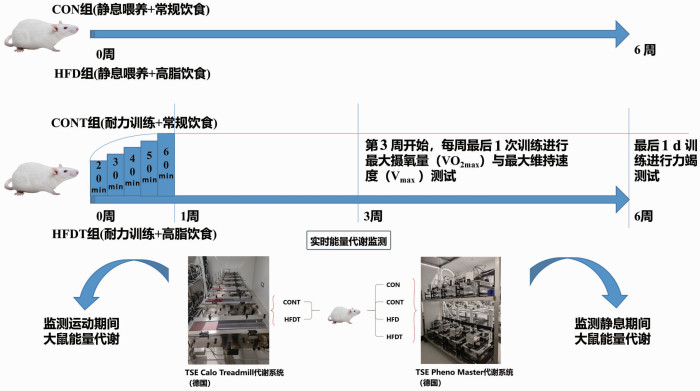
|
| 图 1 动物干预模式 |
1.3.2 最大速度(Vmax)、最大摄氧量(VO2max)测试
第3周开始,每周耐力训练最后1 d进行Vmax和VO2max测试[6],并以此为基础,进行耐力训练。采用单纯增速方案,坡度为5°,初始强度为15 m/min,以每3 min增加3 m/min的加速度进行加速,直至大鼠不能维持本级速度。符合下列任意2个条件即判断为达到VO2max标准,并终止测试:①伴随运动负荷的增加摄氧量不再继续增加而出现平台或变化幅度不超过5%;②呼吸商(respiratory exchange ratio, RER)>1.0;③大鼠不能或者不愿意继续跑下去,达到力竭判定标准(大鼠跟不上预定跑台速度,腹部与跑道面接触,后肢蹬地无力,电流刺激或气流驱赶无效,无力继续运动)。
1.3.3 力竭测试最后1次Vmax测试后休息2 d进行力竭测试。以第6周最后1次VO2max测试为依据,每只大鼠以各自60% VO2max时的速度进行运动,达到力竭后停止,并记录力竭时间。力竭判定标准同上。
1.3.4 旷场实验于力竭测试后即刻将大鼠放入代谢笼中,记录其在12 min内的活动轨迹。中心区域设置为食物放置区,以中心区域红外线打断次数在总打断次数中的比例定义为摄食行为比例。
1.4 能量消耗监测能量消耗使用TSE Pheno Master系统根据Weir的气体交换计算。每隔3 min测量氧气消耗量(VO2)和二氧化碳产生量(VCO2)。VO2和VCO2值以mL/(h·kg) 为单位。对于每只大鼠,静息总能量消耗(total energy expenditure, TEE)为20 h内400个3 min采样测量的总和(排除运动前1 h及运动后2 h)。计算各组大鼠的平均值。基础代谢率(basal metabolic rate, BMR)根据20 h监测期内3 min能量消耗值的4个最低值的平均值计算得出[7]。
脂肪氧化率(fat oxidation rate,FOR)和碳水化合物(carbohydrate oxidation rate,COR)的氧化速率根据以下公式[8]计算。
COR[kJ/(h·kg)]=[(4.585×VCO2)-(3.226×VO2)]×4.186
FOR[kJ/(h·kg)]=[(1.695×VO2)-(1.70×VCO2)]×4.186
1.5 大鼠体成分测量自实验开始,每周对大鼠进行1次活体体成分测定(QMR06-090M,江苏纽迈)。大鼠处死后即刻解剖大鼠并分离整个肝脏、心脏、肾脏及骨骼肌(腓肠肌、比目鱼肌),并记录其质量。取部分腓肠肌、比目鱼肌组织即刻使用体成分分析仪(QMR06-090M,江苏纽迈)对其进行成分分析。
脏体比=脏器质量(g)÷动物体质量(g)×100%
1.6 标本采取在力竭测试后2 d,以2%戊巴比妥钠溶液麻醉大鼠后终止实验。腹腔注射麻醉剂后,通过眼球摘取法于内眦动脉采血后脱颈法处死大鼠。4 ℃静置血液1.5 h后,1 500×g离心10 min,取血浆。将血浆放置于-80 ℃的条件下保存。
1.7 血浆生化分析采用全自动生化分析仪(日立)测定血浆葡萄糖、甘油三酯、胆固醇、高密度脂蛋白、低密度脂蛋白、β羟基丁酸(βHB)、天冬氨酸转氨酶、丙氨酸转氨酶、白蛋白、血尿素、肌酐、肌酸激酶、乳酸脱氢酶和肌酸激酶同工酶水平。
1.8 统计学分析计量资料以x±s表示。多组数据比较采用单因素方差分析,组间两两比较采用LSD法检验,P < 0.05为差异有统计学意义。
2 结果 2.1 大鼠摄食及体成分比较在为期6周的实验过程中,大鼠对45%高脂饮食的适应性较好,给予的饲料剩余量保持在总体供给量的5%以内,并且各组之间的单位体质量平均能量摄入水平(kJ/g)没有统计学差异。所有大鼠的体质量在实验期间都有增长,不同组之间的体质量及体成分没有统计学差异表 2。
| 组别 | 能量摄入/(kJ/g) | 体质量/g | 肌肉质量/g | 脂肪质量/g | 肌肉含量/% | 脂肪含量/% |
| CON组 | 2.16±0.52 | 430.8±17.4 | 313.3±43.0 | 8.9±6.1 | 70.1±11.4 | 1.6±1.1 |
| HFD组 | 2.10±0.51 | 401.3±79.7 | 268.1±29.7 | 8.0±3.7 | 70.6±6.4 | 2.6±1.3 |
| CONT组 | 2.36±0.67 | 426.3±23.8 | 295.7±37.9 | 12.8±7.2 | 69.9±12.0 | 1.8±2.0 |
| HFDT组 | 2.28±0.65 | 374.5±46.0 | 253.8±15.4 | 7.3±8.2 | 68.9±11.3 | 3.5±1.8 |
不同能量配比结构的饮食和耐力训练对SD大鼠心脏、肝脏及肾脏的脏体比以及骨骼肌(腓肠肌、比目鱼肌)质量未造成显著影响(图 2A~E)。而在腓肠肌中,HFDT组的脂肪率显著低于CONT组(P < 0.05,图 2F)。
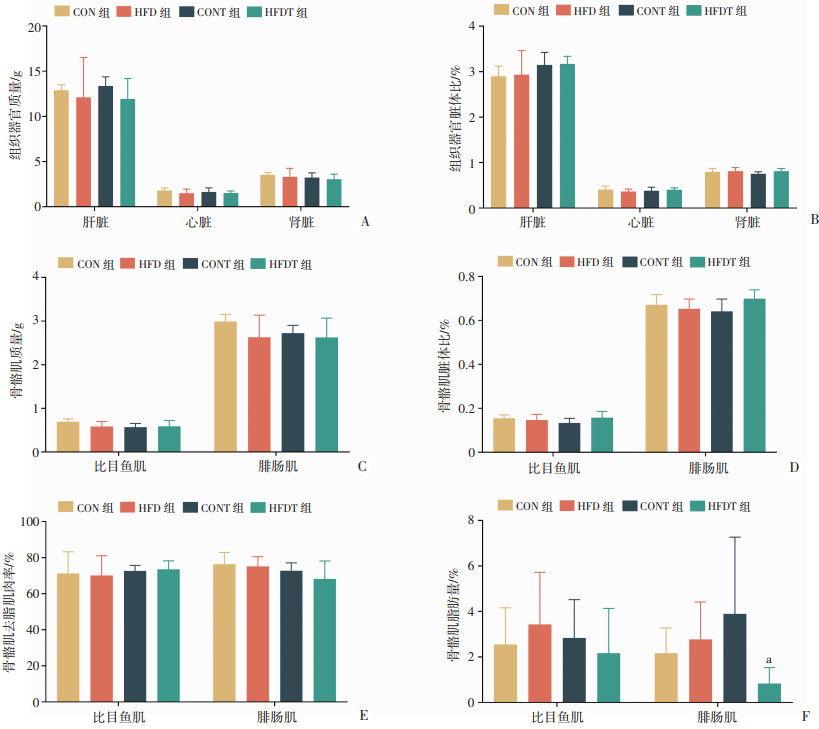
|
|
a:P < 0.05,与CONT组比较 A:大鼠肝脏、心脏、肾脏质量;B:大鼠肝脏、心脏、肾脏体比;C:大鼠骨骼肌质量;D:大鼠骨骼肌脏体比;E:大鼠骨骼肌量;F:大鼠骨骼肌脂肪量 图 2 干预6周后各组大鼠体成分分析(n=6) |
2.2 等能量高脂饮食对大鼠运动耐力的影响 2.2.1 高脂饮食增强大鼠的运动耐力
尽管3周以后HFDT组大鼠VO2max有所降低,至干预结束时,其VO2max、Vmax与常规饮食大鼠相比没有统计学差异(图 3A、B)。6周后进行力竭测试时,两组大鼠进行中等强度(以6周时60%VO2max对应的速度)耐力运动,HFDT组的大鼠摄氧量(VO2)较CONT组大鼠有所降低(P < 0.05,图 3C)。此外,HFDT组在耐力表现上明显优于CONT组。在进行力竭测试时,HFDT组的力竭时间为(198.0±45.9)min,而CONT组仅为(116.2±29.1)min(P < 0.01,图 3D)。
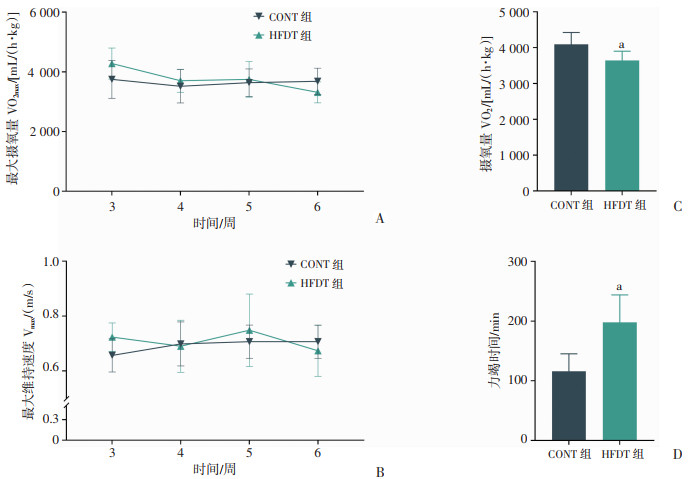
|
|
a:P < 0.05,与CONT组比较 A:各组大鼠最大摄氧量(VO2max)随时间变化情况;B:各组大鼠最大维持速度(Vmax)随时间变化情况;C:各组大鼠力竭测试摄氧量(VO2max);D:各组大鼠力竭时间 图 3 CONT组和HFDT组大鼠摄氧量与力竭运动时间比较(n=6) |
2.2.2 高脂饮食提高大鼠运动后恢复能力
力竭测试后12 min内,HFDT组较CONT组移动距离显著增加(P < 0.05,图 4A),但摄食活动无明显差别(图 4B)。
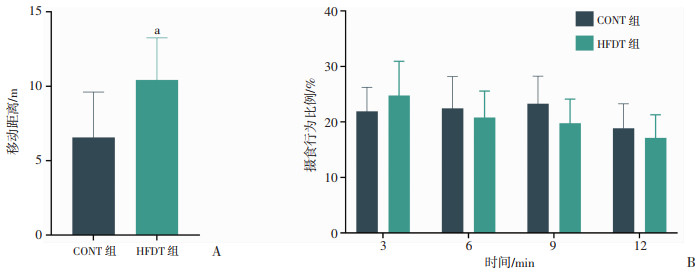
|
|
a:P < 0.05,与CONT组比较 A:大鼠力竭测试后即刻至12 min内大鼠运动总距离;B:大鼠旷场实验中摄食行为所占比例 图 4 CONT组和HFDT组大鼠运动后恢复情况 |
2.2.3 运动期间大鼠能量代谢底物变化
在运动期间,尽管HFDT组和CONT组大鼠在1~6周的碳水化合物和脂肪总氧化率差异无统计学意义(图 5A),但HFDT组大鼠的RER始终较低(P < 0.05,图 5D、G)。HFDT组和CONT组在耐力运动过程中对底物的代谢率不同(P < 0.01,图 5B、C)。HFDT组更倾向于以脂肪代谢为主要能量来源(P < 0.01,图 5I),而CONT组则以碳水化合物代谢为主(P < 0.01,图 5H)。此外,两组在训练过程中碳水化合物和脂肪的代谢率均有所升高(图 5E、F)。
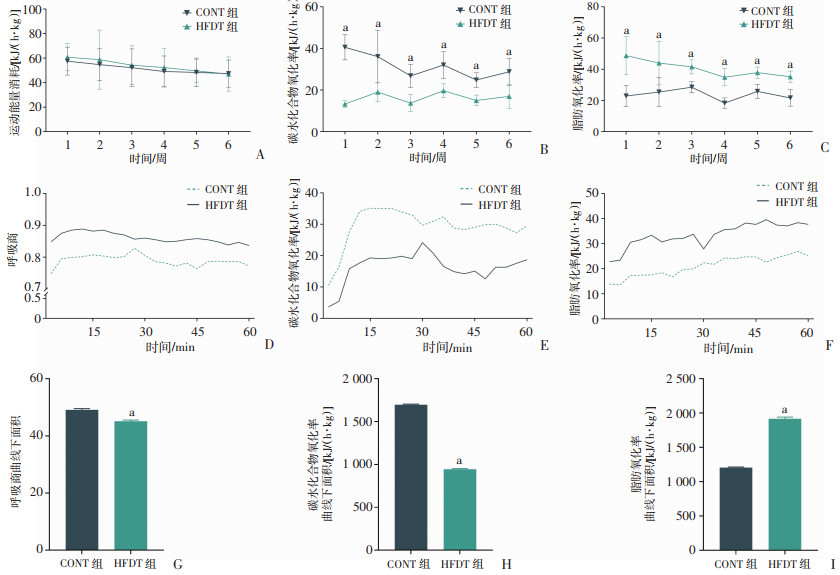
|
|
a:P < 0.05,与CONT组比较 A:运动能量消耗(EE)随耐力训练过程改变情况;B:碳水化合物代谢率(COR)随耐力训练过程改变情况;C:脂肪代谢率(FOR)随耐力训练过程改变情况;D:6周时各组在运动过程RER变化;E:6周时各组在运动过程中的COR;F:6周时各组在运动过程中的FOR;G:运动时RER曲线下面积统计;H:运动时COR曲线下面积统计;I:运动时FOR曲线下面积统计 图 5 CONT组和HFDT组大鼠运动过程中能量代谢底物氧化率变化(n=6) |
2.3 大鼠静息能量代谢率及总能量消耗的变化
静息时,大鼠的BMR会随着周龄的变化而变化。在第1周,HFDT组的BMR一过性升高而后降低,至实验结束时,各组之间无统计学差异(图 6A)。同时,饮食模式和耐力训练对大鼠的TEE没有统计学影响(图 6B)。
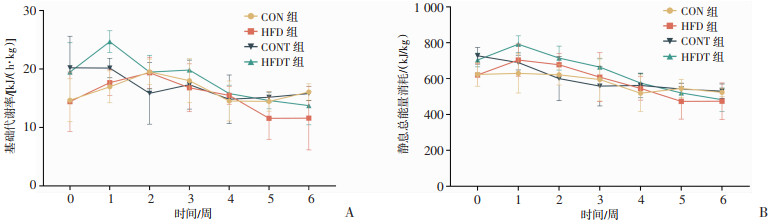
|
| A:各组大鼠基础代谢率;B:各组大鼠静息总能量消耗 图 6 大鼠静息期间能量代谢率比较(n=6) |
通过代谢成分分析后发现,各组的碳水化合物和脂肪代谢率随着饮食干预和耐力训练的进行而发生显著变化。HFD组自饮食干预开始显示出较高的脂肪代谢率和较低的碳水化合物代谢率,并在5~6周的适应后,其COR逐渐升高,FOR逐渐降低,最终与CON组代谢模式趋于一致(图 7A、B)。在HFDT组,其碳水化合物代谢率呈下降趋势,且始终低于CONT组,而脂肪代谢率保持较高水平。经过耐力训练后,虽然CONT组的脂肪代谢率有所提高,但与HFDT组仍存在显著差异(P < 0.01,图 7C、D)。
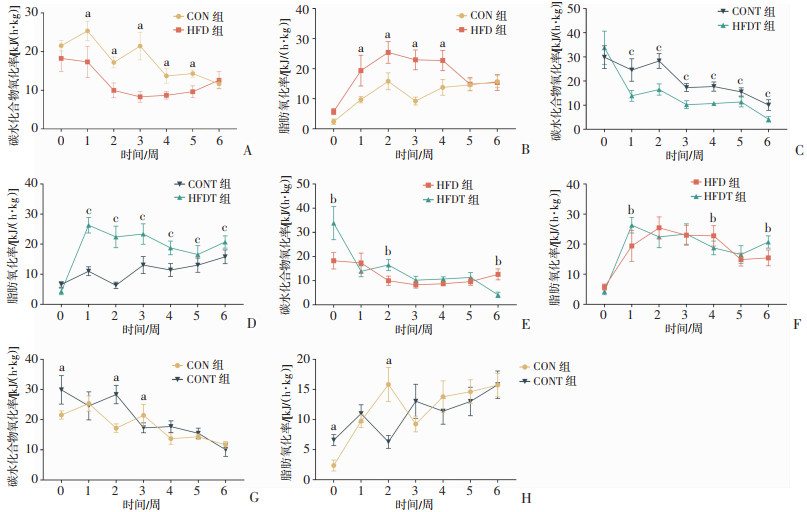
|
|
a:P < 0.05,与CON组比较;b:P < 0.05,与HFD组比较;c:P < 0.05,与CONT组比较 A、B:饮食结构对未训练大鼠COR和FOR的影响;C、D:饮食结构对经耐力训练大鼠的COR和FOR的影响;E、F:耐力训练对高脂饮食大鼠COR和FOR的影响;G、H:耐力训练对常规饮食大鼠COR和FOR的影响 图 7 饮食和运动对各组大鼠底物代谢率的影响(n=6) |
耐力训练可以使高脂饮食喂养的大鼠底物代谢的变化更加持久(P < 0.05,图 7E、F),而在常规饲料喂养的大鼠中,CONT组大鼠在4周后与CON组底物代谢趋近一致(图 7G、H)。
2.4 等能量高脂饮食对大鼠血糖、血脂的影响高脂饮食大鼠的血脂水平较常规饮食大鼠升高,而同时进行耐力训练可以使血脂水平有所降低,尤其是LDL-C水平(P < 0.05,图 8B~E)。此外,CONT组大鼠LDL-C较CON组大鼠显著升高(P < 0.05,图 8E)。在耐力训练的大鼠中,高脂喂养使大鼠的血糖和βHB水平显著升高(P < 0.05,图 8A、F)。
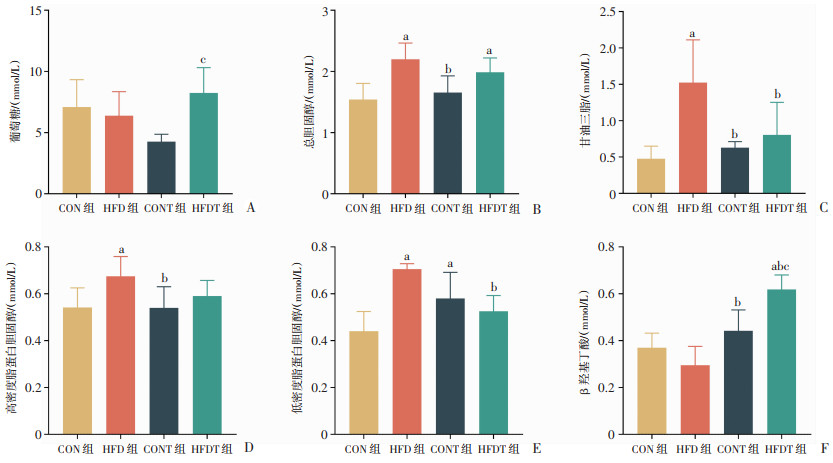
|
|
a:P < 0.05,与CON组比较;b:P < 0.05,与HFD组比较;c:P < 0.05,与CONT组比较 A:各组血糖水平;B:各组血清总胆固醇水平;C:各组血清甘油三酯水平;D:各组血清高密度脂蛋白胆固醇;E:各组血清低密度脂蛋白胆固醇;F:各组血清β羟基丁酸水平 图 8 各组大鼠血清糖脂代谢指标比较(n=6) |
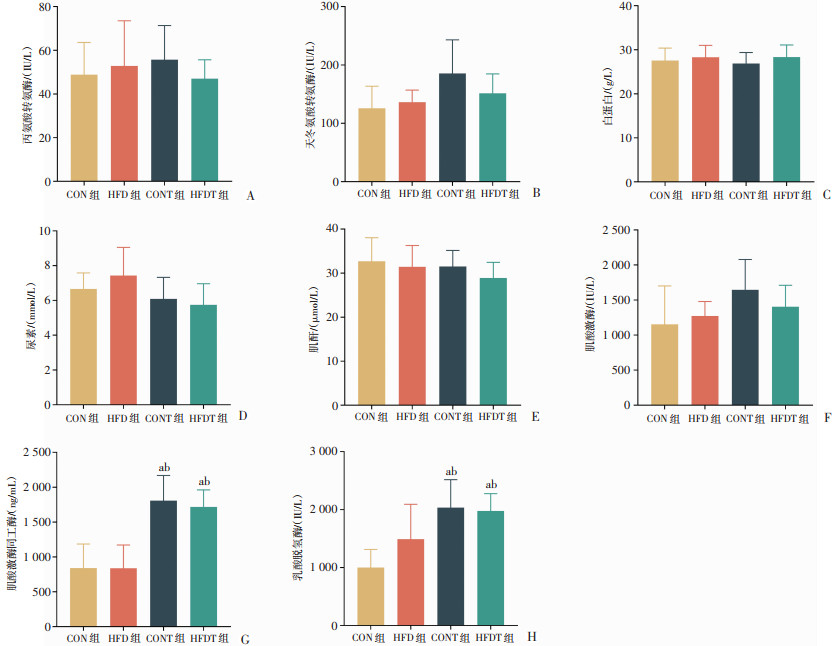
2.5 等能量高脂饮食对肝肾功能及肌肉状态的影响
相较于CON组,无论是否进行耐力训练,等能量摄入下的不同饮食结构(即高脂饮食与常规饮食)对大鼠的肝肾功能以及肌肉状态没有产生显著性差异(图 9A~E)。在耐力训练后的大鼠中,不论采用哪种饮食方案,经过训练的大鼠血清中的CKMB和LDH水平较未接受训练的大鼠都有所升高(P < 0.05,图 9G、H),而CK没有明显变化(图 9F)。
|
|
a:P < 0.05,与CON组比较;b:P < 0.05,与HFD组比较 A:各组血清丙氨酸转氨酶浓度;B:各组血清天冬氨酸转氨酶浓度;C:各组血清白蛋白浓度;D:各组血清尿素浓度;E:各组血清肌酐浓度;F:各组血清肌酸激酶浓度;G:各组血清肌酸激酶同工酶浓度;H:各组血清乳酸脱氢酶浓度 图 9 各组大鼠血清肝肾功能及肌肉损伤生化指标比较(n=6) |
3 讨论
本研究发现,使用等能量45%高脂饮食喂养的大鼠,其耐力运动能力显著优于常规饮食喂养的大鼠,可能与高脂饮食大鼠的能量代谢底物改变有关。运动强度在47%~75% VO2max之间时,脂肪作为主要能源之一,可以被最高效率氧化[9-11]。在限制碳水供应时,主要由脂肪氧化供应肌肉活动所需能量。研究表明,在50%VO2max的稳定运动状态下,减少碳水化合物的供应直接下调了肌肉活动期间的脂肪氧化[12]。由于碳水化合物可用性相对较低,HFDT组的大鼠在整个运动过程中表现出比CONT组更高的脂肪代谢率。更高的脂肪代谢率与更优秀的耐力训练成绩相关[13]。由于脂肪作为持久性能源的特点,高脂饮食可以提高大鼠的耐力运动时间,即高脂饮食增加了脂肪作为能源的持久性,从而提高了大鼠的耐力水平。由于相同的能量摄入,因此大鼠的身体组成并未发现显著差异。同时HFDT组大鼠的腓肠肌脂肪含量有所降低,提示在等能量高脂饮食下大鼠脂肪代谢率提高。碳水化合物和脂肪代谢之间的平衡是由运动强度而不是运动时间决定的,肌肉内储存的脂肪和碳水化合物将决定在给定强度下的最大耐力运动时间[11]。此外,本研究结果表明,耐力训练使高脂喂养的动物血浆βHB显著升高,提示在高脂饮食的大鼠中,酮体在运动过程中的供能可能更具有优势。酮体主要来自脂肪酸的氧化,并输出到周围组织供能。βHB是酮体的主要存在形式,大约占75%。酮体在一定条件下(如饥饿)可以作为重要的能量底物,调节碳水化合物和脂质代谢[14-15]。外源性酮体的摄入使糖酵解代谢受到抑制,保存了肌肉糖原,减少支链氨基酸的脱氨分解,增加运动中对肌内甘油三酯的依赖[16-17]。
本研究发现,在静息期间,等能量的不同饮食结构和耐力训练对大鼠代谢改变较大。自干预开始,常规喂养的大鼠(CON、CONT组)主要以碳水化合物作为能量代谢的底物来源,而高脂喂养的大鼠(HFD、HFDT组)则以脂肪为主要的能量代谢底物。在静息喂养的大鼠中,大鼠的能量底物代谢在5~6周后趋于一致,与其他研究相符[18-19],即经过耐力训练后的大鼠在不同饮食结构下,其代谢改变持续存在,提示有氧运动训练使大鼠的底物代谢产生差异,从而增强代谢灵活性。
本研究采用旷场实验作为评估运动性疲劳程度的有效方法[20]。在力竭测试后的12 min内,HFDT组相比CONT组移动距离显著增加,提示HFDT组的活动水平更高,并且恢复速度更快。研究结果还表明,不论是否经历过耐力训练,大鼠的食物摄入量和自发活动并没有显著差异,而自发活动被认为是TEE的主要决定因素。
本研究表明尽管摄入的能量相同,相比常规饮食,高脂饮食显著升高了大鼠的血脂水平,而高脂饮食的同时进行耐力训练则没有出现血脂水平的明显升高。高脂低碳饮食在中长期应用的一个弊端是对机体的血脂有不利影响,而规律运动则可能削弱或逆转这种影响。研究表明,有氧运动可以降低血清TG水平,并改善高脂喂养动物的血清血脂水平和肝脏脂肪变性[21-22]。经过耐力训练后的血脂水平受多种因素影响,包括训练时间长度和其他不可控变量[23]。根据本研究结果,CONT组大鼠的LDL-C水平高于CON组,这表明训练时间和血脂水平之间存在一定的关联。
UREA、CREA被用作肾脏损伤的标志,同时前者还是运动耐量的指标,它也是蛋白质降解的标志物。而ALT、AST则是肝脏功能的重要标志物[24-26]。本研究结果显示高脂饮食和耐力训练对于大鼠肝、肾功能没有造成损伤。CK和LDH通常被用作肌肉损伤标志物,CKMB是心肌特有的肌酸激酶,使心肌产生ATP,通常在长时间运动后升高明显,主要用于辅助判断心肌膜是否有损伤。本研究结果显示,在力竭测试2 d后,CKMB以及LDH水平仍有所升高,而不同饮食之间的大鼠并没有显著差异,提示力竭运动对于肌肉可能造成损伤,而等能量高脂饮食并没有显示出保护作用。
综上所述,本研究发现,给予等能量45%高脂饮食的大鼠在耐力运动方面表现优异,可能与能量代谢底物改变有关。高脂饮食大鼠表现出更高的脂肪代谢率和酮体代谢率,以提高耐力水平,同时并未对身体组成和肝肾功能带来负面影响。该研究为通过饮食干预提高运动耐力提供了科学实验依据。
| [1] |
PURDOM T, KRAVITZ L, DOKLADNY K, et al. Understanding the factors that effect maximal fat oxidation[J]. J Int Soc Sports Nutr, 2018, 15: 3. |
| [2] |
WALDMAN H S, KRINGS B M, BASHAM S A, et al. Effects of a 15-day low carbohydrate, high-fat diet in resistance-trained men[J]. J Strength Cond Res, 2018, 32(11): 3103-3111. |
| [3] |
BURKE L M, WHITFIELD J, HEIKURA I A, et al. Adaptation to a low carbohydrate high fat diet is rapid but impairs endurance exercise metabolism and performance despite enhanced glycogen availability[J]. J Physiol, 2021, 599(3): 771-790. |
| [4] |
SHI D, HAN T S, CHU X, et al. An isocaloric moderately high-fat diet extends lifespan in male rats and Drosophila[J]. Cell Metab, 2021, 33(3): 581-597.e9. |
| [5] |
郑佳伟, 刘武剑, 朱俊东, 等. 紫檀芪和跑台运动诱导大鼠白色脂肪棕色化的作用[J]. 第三军医大学学报, 2020, 42(4): 367-374. ZHENG J W, LIU W J, ZHU J D, et al. Pterostilbene and treadmill exercise induce white adipose browning in rats[J]. J Third Mil Med Univ, 2020, 42(4): 367-374. |
| [6] |
覃飞, 董亚南, 王松涛, 等. 10月龄Wistar大鼠最大摄氧量测试方案的比较研究[J]. 中国体育科技, 2018, 54(5): 65-69. QIN F, DONG Y N, WANG S T, et al. The comparative study on the maximum oxygen uptake test of 10-month old wistar rats[J]. China Sport Sci Technol, 2018, 54(5): 65-69. |
| [7] |
TOURON J, PERRAULT H, JULIAN V, et al. Impact of eccentric or concentric training on body composition and energy expenditure[J]. Med Sci Sports Exerc, 2019, 51(9): 1944-1953. |
| [8] |
WANG L Q, XU F, SONG Z F, et al. A high fat diet with a high C18: 0/C16: 0 ratio induced worse metabolic and transcriptomic profiles in C57BL/6 mice[J]. Lipids Health Dis, 2020, 19(1): 172. |
| [9] |
HARGREAVES M, SPRIET L L. Skeletal muscle energy metabolism during exercise[J]. Nat Metab, 2020, 2(9): 817-828. |
| [10] |
FRITZEN A M, LUNDSGAARD A M, KIENS B. Tuning fatty acid oxidation in skeletal muscle with dietary fat and exercise[J]. Nat Rev Endocrinol, 2020, 16(12): 683-696. |
| [11] |
MANA M D, HUSSEY A M, TZOUANAS C N, et al. High-fat diet-activated fatty acid oxidation mediates intestinal stemness and tumorigenicity[J]. Cell Rep, 2021, 35(10): 109212. |
| [12] |
BRUN J F, MYZIA J, VARLET-MARIE E, et al. Beyond the calorie paradigm: taking into account in practice the balance of fat and carbohydrate oxidation during exercise?[J]. Nutrients, 2022, 14(8): 1605. |
| [13] |
HETLELID K J, PLEWS D J, HEROLD E, et al. Rethinking the role of fat oxidation: substrate utilisation during high-intensity interval training in well-trained and recreationally trained runners[J]. BMJ Open Sport Exerc Med, 2015, 1(1): e000047. |
| [14] |
PUCHALSKA P, CRAWFORD P A. Multi-dimensional roles of ketone bodies in fuel metabolism, signaling, and therapeutics[J]. Cell Metab, 2017, 25(2): 262-284. |
| [15] |
EVANS M, COGAN K E, EGAN B. Metabolism of ketone bodies during exercise and training: physiological basis for exogenous supplementation[J]. J Physiol, 2017, 595(9): 2857-2871. |
| [16] |
MCSWINEY F T, WARDROP B, HYDE P N, et al. Keto-adaptation enhances exercise performance and body composition responses to training in endurance athletes[J]. Metabolism, 2018, 83: e1-e2. |
| [17] |
MURPHY N E, CARRIGAN C T, MARGOLIS L M. High-fat ketogenic diets and physical performance: a systematic review[J]. Adv Nutr, 2021, 12(1): 223-233. |
| [18] |
RYNDERS C A, BLANC S, DEJONG N, et al. Sedentary behaviour is a key determinant of metabolic inflexibility[J]. J Physiol, 2018, 596(8): 1319-1330. |
| [19] |
BAUGH M E, BOWSER S M, MCMILLAN R P, et al. Postprandial skeletal muscle metabolism following a high-fat diet in sedentary and endurance-trained males[J]. J Appl Physiol, 2020, 128(4): 872-883. |
| [20] |
MA S H, HUANG Q Y, YADA K, et al. An 8-week ketogenic low carbohydrate, high fat diet enhanced exhaustive exercise capacity in mice[J]. Nutrients, 2018, 10(6): 673. |
| [21] |
PETRIDOU A, MOUGIOS V. Exercise to lower postprandial lipemia: why, when, what and how[J]. Int J Sports Med, 2022, 43(12): 1013-1022. |
| [22] |
RUAN L, LI F H, LI S B, et al. Effect of different exercise intensities on hepatocyte apoptosis in HFD-induced NAFLD in rats: the possible role of endoplasmic reticulum stress through the regulation of the IRE1/JNK and eIF2α/CHOP signal pathways[J]. Oxid Med Cell Longev, 2021, 2021: 6378568. |
| [23] |
MUSCELLA A, STEFÀNO E, MARSIGLIANTE S. The effects of exercise training on lipid metabolism and coronary heart disease[J]. Am J Physiol Heart Circ Physiol, 2020, 319(1): H76-H88. |
| [24] |
BÁRÁNY P. Muscle abnormalities with kidney failure[J]. Clin J Am Soc Nephrol, 2021, 16(11): 1613-1614. |
| [25] |
MILLS S, CANDOW D G, FORBES S C, et al. Effects of creatine supplementation during resistance training sessions in physically active young adults[J]. Nutrients, 2020, 12(6): 1880. |
| [26] |
BOENO F P, PATEL J, MONTALVO R N, et al. Effects of exercise preconditioning on doxorubicin-induced liver and kidney toxicity in male and female rats[J]. Int J Mol Sci, 2023, 24(12): 10222. |




