阿尔茨海默症(Alzheimer’s disease, AD)是一种以进行性认知功能降低和行为损害为特征的中枢神经系统(central nervous system, CNS)退行性疾病,是最常见的痴呆症。随着全球人口老龄化加剧,预计到2050年,全球痴呆患者人数可达1.53亿[1]。我国是世界上老龄化最快的国家之一,截至2019年,AD在我国的死因排名上升至第5位,死亡率达23.3/10万,患病率达788.3/10万,残疾调整生命年率达368.5/10万,均高于全球水平[2]。积极探索并推广AD防治的有效措施,对提高我国居民健康水平、减轻社会负担具有重要意义。
越来越多的研究认为,慢性神经炎症在AD发展中发挥重要作用。小胶质细胞作为CNS的固有免疫细胞,占健康成人脑实质细胞总数的10%~15%[3],是慢性神经炎症的核心参与者。生理状态下,小胶质细胞呈静息态,一旦收到内源性危险信号就会被激活呈多种表型,而慢性的感染或损伤会使其逐渐向经典激活表型(M1型)极化,后者不但吞噬作用较弱,而且还表现为以NLRP3炎症小体激活为主的神经炎症毒性反应[5-6];Aβ沉积也可激活NLRP3炎症小体,进一步加重神经炎症[7]。而抗炎因子可以诱导小胶质细胞向替代激活表型(M2型)极化,大大提升吞噬能力并产生多种抗炎因子抑制炎症,促进组织损伤修复[8-9]。诱导小胶质细胞向M2极化可以改善脊髓损伤急性期炎症反应[10];抗炎因子IL-4在体外可以抵消Aβ诱导的小胶质细胞的神经毒性[11]。
n-3 PUFAs主要包括来源于植物性食物的α-亚麻酸(α-linolenic acid, ALA)和来源于深海鱼类的EPA、DHA。EPA和DHA既是神经细胞的重要组成成分,也在促进大脑发育、维持神经细胞膜流动性、增强突触可塑性等神经功能调控中起关键作用。越来越多的研究认为n-3 PUFAs因其较强的抗炎作用,具有较好的神经保护作用。然而有关n-3 PUFAs是否通过调节中枢小胶质细胞激活及极化来改善AD相关的病理和学习记忆障碍的研究还比较少。
APPPS1小鼠因携带APP、Psen1基因使得小鼠在6~8周就开始出现大脑淀粉样变性的病理学变化,在8个月后可以表现出认知功能障碍[12],成为研究AD最常见的动物模型。同时,Fat-1小鼠因其携带的fat-1基因可以天然而稳定地将体内n-6 PUFAs转化为n-3 PUFAs[13],近年来被越来越多的学者当作研究n-3 PUFAs的基本动物模型。本研究采用Fat-1、Fat-1/APPPS1、APPPS1 3种转基因小鼠开展体内研究以及BV2细胞开展体外研究,其中Fat-1/APPPS1小鼠来源于APPPS1小鼠与Fat-1小鼠杂交繁育获得,为研究n-3 PUFAs能否通过调节小胶质细胞激活及极化有效改善AD提供理论依据。
1 材料与方法 1.1 动物及分组从哈佛医学院脂类医学与技术研究中心(美国)引进8~10周龄Fat-1纯合子雄性小鼠,适应3 d后与3月龄C57BL/6J雌性小鼠交配,经基因鉴定筛选获得子一代Fat-1杂合子雄性小鼠。将子一代小鼠培育至8~10周龄,与8~10周龄APPPS1杂合子雌性小鼠(莱比特,重庆)杂交获得子二代雄性小鼠,经基因鉴定筛选后将动物分为4组,即WT组、Fat-1组、Fat-1/APPPS1组、APPPS1组,每组动物8只。根据文献调研,选择将上述4组子二代小鼠饲养至9月龄后开展实验[12, 14]。所有小鼠饲养于陆军军医大学免疫学研究所无特定病原体(SPF)级层流动物房,恒温、恒湿条件下自由摄食、饮水。动物实验程序均严格按照《实验动物护理与使用指南》和动物福利条例进行,并经陆军军医大学动物管理和使用委员会批准[SYXK(渝)20170002]。Morris水迷宫实验完成后处死小鼠,获取小鼠脑组织(含海马),左半脑于4%多聚甲醛中固定,右半脑于-80 ℃中冻存备用。
1.2 小鼠基因鉴定采用鼠尾直接PCR试剂盒(Bimake,美国),所有实验步骤根据说明书进行(引物序列见表 1)。
| 基因 | 引物序列(5′→3′) |
| fat-1 | 上游:CGGCTTGATGCTCGTCATTG |
| 下游:TACTCTAGAACGGCACGGGA | |
| APP | 上游:GACTGACCACTCGACCAGGTTCTG |
| 下游:CTTGTAAGTTGGATTCTCATATCCG | |
| Psen1 | 上游:AATAGAGAACGGCAGGAGCA |
| 下游:GCCATGAGGGCACTAATCAT | |
| Iba-1 | 上游:ATTATGTCCTTGAAGCGAATGC |
| 下游:TCTCAAGATGGCAGATCTCTTG | |
| CD86 | 上游:ACGGAGTCAATGAAGATTTCCT |
| 下游:GATTCGGCTTCTTGTGACATAC | |
| CD206 | 上游:CCTATGAAAATTGGGCTTACGG |
| 下游:CTGACAAATCCAGTTGTTGAGG | |
| iNOS | 上游:AGCAAACCACCAAGTGGAGGA |
| 下游:GCTGGCACCACTAGTTGGTTGT | |
| IL-6 | 上游:CTCCCAACAGACCTGTCTATAC |
| 下游:CCATTGCACAACTCTTTTCTCA | |
| TGF-β | 上游:CCAGATCCTGTCCAAACTAAGG |
| 下游:CTCTTTAGCATAGTAGTCCGCT | |
| NLRP3 | 上游:GCCGTCTACGTCTTCTTCCTTTCC |
| 下游:CATCCGCAGCCAGTGAACAGAG | |
| Caspase-1 | 上游:AGAGGATTTCTTAACGGATGCA |
| 下游:TCACAAGACCAGGCATATTCTT | |
| IL-1β | 上游:CACTACAGGCTCCGAGATGAACAAC |
| 下游:TGTCGTTGCTTGGTTCTCCTTGTAC | |
| IL-18 | 上游:AGACCTGGAATCAGACAACTTT |
| 下游:TCAGTCATATCCTCGAACACAG | |
| β-actin | 上游:GTGCTATGTTGCTCTAGACTTCG |
| 下游:ATGCCACAGGATTCCATACC |
1.3 Morris水迷宫实验
4组小鼠满9月龄后开展Morris水迷宫实验测试其学习记忆能力。Morris水迷宫由摄像监视系统、直径为120 cm的圆形水池、直径为9 cm的水下平台以及smart分析软件构成,水下平台位于第一象限,离池壁30 cm,低于水平面约1 cm。用二氧化钛粉末使池内水变成乳白色混悬液,水温控制在21~25 ℃,并由摄像监视系统拍摄记录小鼠找到水下平台的潜伏期和轨迹。水环境适应(无平台,2 min/只)1 d后,连续训练5 d,每只小鼠每天分别从4个象限进入水迷宫1次,每次训练60 s,若60 s内未找到水下平台,则潜伏期记为60 s,并将其引导至水下平台上停留20 s。第7天将水下平台撤去,记录60 s每只小鼠的水下平台搜索运动轨迹。
1.4 脑组织中长链脂肪酸分析采用Trace 1310-ISQ 7000气-质联用仪(Thermo,美国)平台对小鼠脑组织进行中长链脂肪酸绝对定量分析。脂肪酸混标溶液由正己烷溶解配制。称取约50 mg/样本在一定条件下研磨、酯化、萃取得到待检测溶液,进入Thermo Trace 1300(Thermo,美国)气相系统进行检测。
1.5 免疫组织化学 1.5.1 制片将浸泡在多聚甲醛中的组织捞出进行常规石蜡包埋脱水。抗原修复后阻断内源性过氧化物酶,采用BSA血清室温封闭30 min。然后加入Aβ抗体(60342-1-Ig,1 ∶100)湿盒内4 ℃孵育过夜。PBS洗涤3次后加入二抗(GB23303,1 ∶200)室温孵育50 min。PBS洗涤3次后滴加新鲜配制的DAB显色液,显微镜下控制显色时间,自来水冲洗切片终止显色。苏木精复染细胞核,流水冲洗,脱水封片。
1.5.2 成像及统计在明场白光显微镜下成像(版本OLYMPUS VS-ASW),运用Fiji Image J对图像进行平均光密度值统计分析。
1.6 组织免疫荧光 1.6.1 组织免疫荧光制片将浸泡在多聚甲醛中的组织捞出进行常规石蜡包埋脱水。抗原修复后双氧水封闭,10%的兔血清室温封闭后加入CD206抗体(AF2535,1 ∶1 000)湿盒内4 ℃孵育过夜。PBS洗涤3次后滴加二抗(GB23204,1 ∶500)室温孵育50 min。BSA血清室温封闭后加入Iba-1抗体(234011,1 ∶100)、CD86抗体(PA5-88284,1 ∶500)的混合试剂,湿盒内4 ℃孵育过夜。PBS洗涤后滴加二抗(GB21301,1 ∶300;GB25303,1 ∶400)室温孵育50 min。滴加DAPI复染细胞核避光室温孵育10 min,加入自发荧光淬灭剂并流水冲洗,抗荧光淬灭剂封片。
1.6.2 成像及统计激发光波长分别为405、488、543、633 nm,采用LSM 880 AxioObserver(Plan-Apochromat)显微镜采集图像,ZEN2012 black edition(Carl Zeiss Microscopy GmbH)系统进行平均荧光强度统计。
1.7 ELISA采用Iba-1、IL-6、iNOS、TGF-β试剂盒(云克隆,武汉),所有实验步骤根据相应说明书进行。
1.8 细胞实验与分组BV2细胞购自赛百慷(上海)生物技术公司,培养条件为含10% FBS、100 U/mL青霉素和0.1 mg/mL链霉素的高糖培养基DMEM(HyClone,美国),温度37 ℃,含5% CO2。
n-3 PUFAs的干预分为4组,即Control组、DHA+EPA(25 μmol/mL ∶25 μmol/mL)组、DHA+EPA+LPS(25 μmol/mL ∶25 μmol/mL ∶1 μg/mL)组以及LPS(1 μg/mL)组,干预剂量根据文献[14-15]与1.9细胞活力检测结果综合得到。干预时10% FBS换为1% BSA-V(索莱宝,北京)以排除FBS中含有的脂肪酸对实验结果造成影响。DHA+EPA+LPS组的处理:提前1 h采用DHA+EPA对BV2细胞进行预处理,后再加入LPS干预24 h。其中DHA购于MCE(美国),EPA购于MCE(美国),LPS购于Sigma-Aldrich(美国)。
1.9 细胞活力检测将BV2细胞以1×104/孔(100 μL/孔)接种于96孔板上:①暴露于0、0.05、0.1、0.2、0.4、0.8、1、2、4 μg/mL的LPS中24 h;②暴露于0、10、50、100、200 μmol/mL的DHA或EPA中24 h;③暴露于0、20、50、100、150、200 μmol/mL(DHA ∶EPA=1 ∶1)的DHA+EPA混合试剂中1 h后,各组再加入1 μg/mL LPS暴露24 h。上述各组的后续实验步骤根据CCK-8试剂盒(碧云天,上海)说明书进行。
1.10 细胞免疫荧光将BV2细胞以2×104/孔(500 μL/孔)接种于24孔板上,按1.8干预后,采用免疫荧光染色固定液(碧云天,上海)室温固定,含0.1% Triton X-100的PBST室温通透,山羊血清(碧云天,上海)室温封闭,加入Iba-1抗体(234011, 1 ∶1 000)、CD86抗体(PA5-88284, 1 ∶1 000)和CD206抗体(AF2535, 1 ∶1 000)的混合试剂,湿盒内4 ℃孵育过夜。0.2% PBST清洗后滴加用荧光素标记的3种二抗(A0423, 1 ∶200; A0473, 1 ∶200; A0502, 1 ∶200)混合试剂室温避光孵育1 h。0.2% PBST避光浸洗后滴加DAPI染色液(碧云天,上海),避光室温孵育,乙醇溶液浸洗,抗荧光淬灭封片液封片。成像及统计同1.6.2所述。
1.11 Western blot检测BV2细胞在含有1%的蛋白酶抑制剂和磷酸酶抑制剂的细胞裂解缓冲液(Sigma-Aldrich,美国)中裂解。用BCA试剂盒(碧云天,上海)测定蛋白质浓度。而后进行蛋白质印迹实验,将电泳后的分离胶转移到聚偏二氟乙烯膜上。用5%脱脂牛奶封闭膜1 h,加入NLRP3抗体(68102-1-Ig,1 ∶1 000)、TGF-β抗体(ab179695, 1 ∶1 000)4 ℃孵育过夜。含TBST缓冲液清洗后,用辣根过氧化物酶(碧云天,上海)标记的二抗室温孵育1 h,清洗后的免疫染色条带用Fusion FX(Vilber Lourmat,法国)和Immobilon Western化学发光HRP底物(Millipore,美国)显示和测定。利用Image J软件分析蛋白表达水平,并根据内参蛋白GADPH计算蛋白相对表达量。
1.12 qRT-PCR检测小鼠脑组织或BV2细胞加入RNAiso Plus(TaKaRa,日本),分离总的RNA,利用核酸蛋白测定仪NanoDrop2000检测各样本RNA浓度。用TaKaRa反转录酶试剂盒,逆转录合成cDNA。按照SYBR Green Master Mix说明书配制反应体系,PCR反应体系为20 μL,采用实时荧光定量PCR仪(Thermo,美国)完成反应,测定基因mRNA的表达水平。以β-actin作为内参,用2-ΔΔCt方法分析基因的相对表达量。引物序列见表 1。
1.13 统计学分析采用OriginPro 2021 9.8.0.200绘制标准曲线,SPSS Statistics R26.0进行数据统计分析,数据以x±s表示。符合正态分布以及方差齐的多组数据之间比较采用单因素方差分析、双因素方差分析。P<0.05认为差异有统计学意义。
2 结果 2.1 携带fat-1基因小鼠脑内源性n-3 PUFAs水平测量小鼠脑组织中长链脂肪酸含量发现,各组小鼠因基因型不同而PUFAs的水平存在差异。与WT小鼠相比,APPPS1小鼠的总PUFAs含量有所降低(P<0.05),而n-6/n-3比值没有明显变化;Fat-1/APPPS1小鼠的总PUFAs含量较APPPS1小鼠明显提升(P<0.05),n-6/n-3比值明显降低(P<0.05);Fat-1小鼠总PUFAs含量最高,n-6/n-3比值最低(P<0.05)。见图 1。
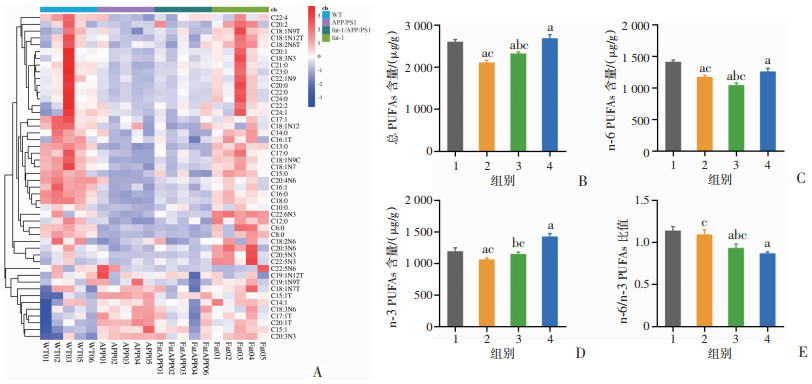
|
|
1:WT组;2:APPPS1组;3:Fat-1/APPPS1组;4:Fat-1组;a:P < 0.05,与WT组比较;b:P < 0.05,与APPPS1组比较;c:P < 0.05,与Fat-1组比较 A:中长链脂肪酸水平热图;B:总PUFAs;C:n-6 PUFAs;D:n-3 PUFAs;E:n-6/n-3 PUFAs比值 图 1 不同基因型小鼠脑内源性n-3 PUFAs (n=5) |
在主要的PUFAs中,APPPS1小鼠与Fat-1/APPPS1小鼠的差异主要体现在DHA和花生四烯酸(arachidonic acid,AA)上(P<0.05),而ALA、EPA、DPA、亚油酸(linoleic acid,LA)在这2组小鼠之间没有明显差异。见表 2。
| PUFAs | WT组 | APPPS1组 | Fat-1/APPPS1组 | Fat-1组 |
| n-3 | ||||
| 总n-3 | 1 193.782±55.671 | 1 065.508±22.746ac | 1 150.471±31.594bc | 1 428.273±45.937a |
| ALA | 2.124±0.219 | 1.730±0.163c | 1.970±0.257c | 2.785±1.050 |
| EPA | 3.931±0.521 | 3.434±0.367c | 3.557±0.623c | 8.749±2.694a |
| DPA | 15.811±2.555 | 14.036±1.111c | 15.375±1.217c | 26.518±5.575a |
| DHA | 1 171.398±60.362 | 1 045.613±23.501ac | 1 114.236±53.548bc | 1 393.864±39.558a |
| n-6 | ||||
| 总n-6 | 1 413.435±28.809 | 1 173.666±27.723ac | 1 046.436±32.973abc | 1 260.885±51.630a |
| LA | 49.960±7.749 | 45.793±5.134 | 41.962±4.364 | 49.605±7.422 |
| AA | 1 065.521±17.874 | 878.834±18.234a | 782.265±28.784abc | 890.881±66.669a |
| n-6/n-3比值 | 1.141±0.047 | 1.097±0.055c | 0.935±0.047abc | 0.871±0.016a |
| AA/EPA+DPA+DHA比值 | 0.868±0.037 | 0.823±0.036c | 0.735±0.054abc | 0.658±0.011a |
| a:P < 0.05,与WT组比较;b:P < 0.05,与APPPS1组比较;c:P < 0.05,与Fat-1组比较 | ||||
上述实验结果表明,携带fat-1基因的Fat-1、Fat-1/APPPS1小鼠能在自身体内有效地将n-6 PUFAs转化为n-3 PUFAs。
2.2 内源性n-3 PUFAs可改善APPPS1小鼠的学习记忆障碍 2.2.1 定位航行能力测试定位航行训练发现,各组小鼠的逃逸潜伏期(找到水下平台所需时间)随着训练次数的增加均有不同程度的缩短。第5天训练时,各组小鼠之间的逃逸潜伏期差异更加显著,与WT组相比,APPPS1组的逃逸潜伏期显著延长,Fat-1/APPPS1组较APPPS1组明显缩短,Fat-1组耗时最短(P < 0.05)。见图 2A、B。
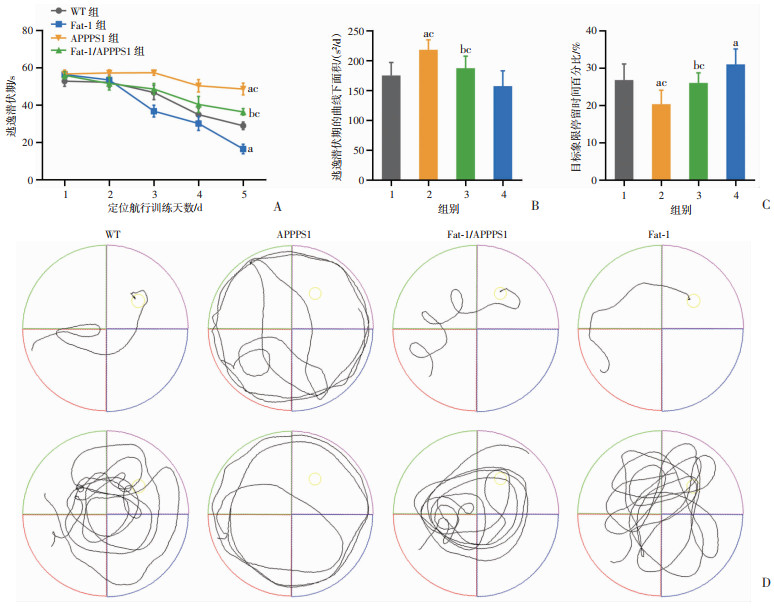
|
|
1:WT组;2:APPPS1组;3:Fat-1/APPPS1组;4:Fat-1组;a:P < 0.05,与WT组比较;b:P < 0.05,与APPPS1组比较;c:P < 0.05,与Fat-1组比较 A、B:定向航行训练期-逃逸潜伏期及曲线下面积;C:空间探索实验期-目标象限停留时间百分比;D:d5-定向航行实验运动轨迹(上排)和空间探索实验运动轨迹(下排) 图 2 内源性n-3 PUFAs对小鼠学习记忆能力的影响(n=8) |
2.2.2 空间探索能力测试
空间探索实验发现,与WT组相比,APPPS1组在目标象限停留时间百分比明显缩短,Fat-1/APPPS1组较APPPS1组明显提升,Fat-1组明显延长(P < 0.05)。见图 2C。
2.2.3 轨迹图分析在定位航行训练后期及空间探索测试中,APPPS1小鼠的平台搜索策略多为外圈绕池壁航行,明显区别于另外3组的内圈环形或对角线直线穿越搜索策略。见图 2D。
综合上述实验结果发现,APPPS1小鼠学习记忆能力最差,Fat-1/APPPS1小鼠有所改善,而Fat-1小鼠的记忆能力最好,甚至优于WT小鼠,这表明内源性n-3 PUFAs可有效改善APPPS1小鼠的学习记忆障碍。
2.3 内源性n-3 PUFAs可降低APPPS1小鼠海马区Aβ沉积对小鼠脑组织进行组织免疫化学染色发现,APPPS1小鼠海马区Aβ沉积较WT小鼠明显增多(P < 0.05),Fat-1/APPPS1小鼠虽高于WT和Fat-1小鼠(P < 0.05),但相比APPPS1小鼠明显下降(P < 0.05),WT和Fat-1小鼠差别不大。这表明内源性n-3 PUFAs可以显著减少APPPS1小鼠海马区的Aβ沉积。见图 3。
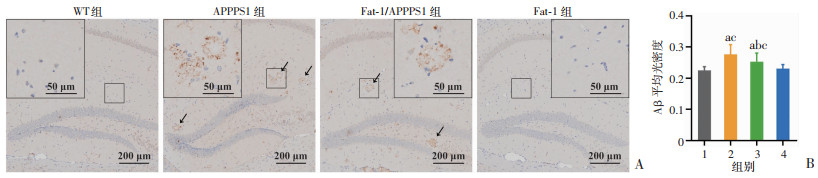
|
| A:脑组织Aβ的组织免疫化学染色;B:Aβ平均光密度值1:WT组;2:APPPS1组;3:Fat-1/APPPS1组;4:Fat-1组; a:P < 0.05,与WT组比较;b:P < 0.05,与APPPS1组比较;c:P < 0.05,与Fat-1组比较 图 3 内源性n-3 PUFAs对小鼠海马区Aβ沉积的影响(n=6) |
2.4 内源性n-3 PUFAs可调节小胶质细胞激活及极化,抑制中枢神经炎症 2.4.1 小胶质细胞激活及极化水平变化
组织免疫荧光共染小鼠大脑发现,APPPS1小鼠的海马区小胶质细胞表达Iba-1、CD86、CD206较WT组显著升高(P < 0.05);而Fat-1/APPPS1组表达Iba-1较APPPS1小鼠显著降低(P < 0.05),仍高于Fat-1组(P < 0.05),同时Fat-1/APPPS1小鼠表达CD206较APPPS1小鼠显著升高(P < 0.05),其CD206/CD86比值较APPPS1小鼠明显升高(P < 0.05)。上述实验结果表明,APPPS1小鼠的小胶质细胞呈高水平激活且整体激活水平偏M1型,Fat-1/APPPS1小鼠的小胶质细胞激活程度较APPPS1小鼠明显降低,且整体激活水平偏M2型,这提示内源性n-3 PUFAs可有效抑制APPPS1小鼠中枢小胶质细胞激活,并调节小胶质细胞向M2型转化。见图 4。
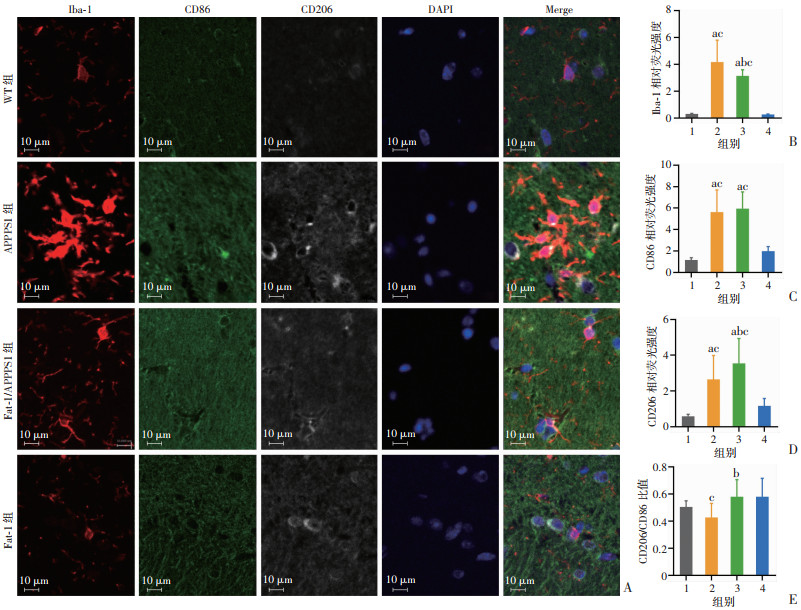
|
|
1:WT组;2:APPPS1组;3:Fat-1/APPPS1组;4:Fat-1组;a:P < 0.05,与WT组比较;b:P < 0.05,与APPPS1组比较;c:P < 0.05,与Fat-1组比较 A:海马区组织免疫荧光化学染色;B:Iba-1平均荧光强度;C:CD86平均荧光强度;D:CD206平均荧光强度;E:CD206/CD86荧光强度比值 图 4 内源性n-3 PUFAs对小鼠中枢小胶质细胞激活及极化水平的影响(n=6) |
2.4.2 中枢神经炎症水平变化
qRT-PCR结果显示,APPPS1小鼠大脑的NLRP3、Caspase-1、IL-1β、IL-18 mRNA表达水平较WT小鼠显著升高(P < 0.05),Fat-1/APPPS1小鼠大脑的NLRP3、Caspase-1、IL-1β、IL-18 mRNA表达水平较APPPS1小鼠明显降低(P < 0.05),仍高于Fat-1小鼠(P < 0.05)。ELISA结果显示,APPPS1小鼠大脑的Iba-1、IL-6、iNOS表达水平较WT小鼠显著升高(P < 0.05),TGF-β表达水平显著降低(P < 0.05);而Fat-1/APPPS1小鼠大脑的Iba-1、IL-6、iNOS表达水平较APPPS1小鼠显著降低(P < 0.05),TGF-β表达水平显著升高(P < 0.05)。上述实验结果表明,APPPS1小鼠的中枢呈高神经炎症水平,促炎因子表达增加,抗炎因子表达降低;Fat-1/APPPS1小鼠的中枢神经炎症水平较APPPS1小鼠明显降低,促炎因子水平降低,抗炎因子水平升高。提示内源性n-3 PUFAs可显著降低中枢神经炎症水平。见图 5。
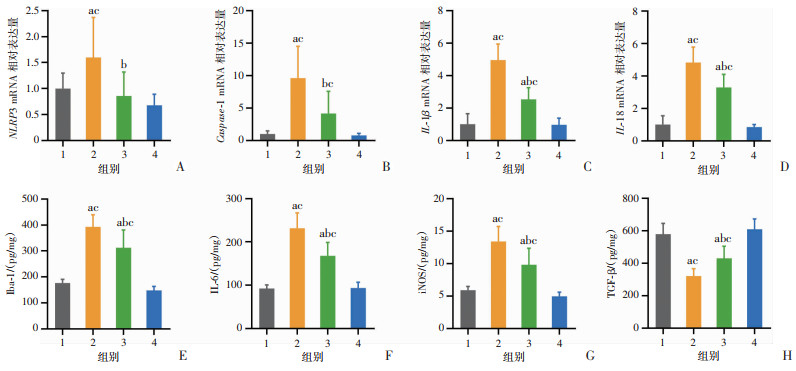
|
|
1:WT组;2:APPPS1组;3:Fat-1/APPPS1组;4:Fat-1组;a:P < 0.05,与WT组比较;b:P < 0.05,与APPPS1组比较;c:P < 0.05,与Fat-1组比较 A:NLRP3 mRNA转录水平;B:Caspase-1 mRNA转录水平;C:IL-1β mRNA转录水平;D:IL-18 mRNA转录水平;E:Iba-1表达水平;F:IL-6表达水平;G:iNOS表达水平;H:TGF-β表达水平 图 5 内源性n-3 PUFAs对小鼠中枢神经炎症水平的影响(n=8) |
2.5 DHA+EPA预处理对LPS诱导的BV2细胞损伤的影响
与Control(0 μg/mL LPS)比较,经LPS处理24 h后,BV2的细胞活力呈剂量依赖性地明显下降(P < 0.05),而采用20~150 μmol/mL(浓度比1 ∶1)DHA+EPA预处理BV2细胞后可明显减轻LPS诱导的细胞损伤(P < 0.05),这种保护效应呈现明显的剂量效应关系,在DHA ∶EPA的浓度为25 μmol/mL ∶25 μmol/mL时,保护效应最明显。见图 6。
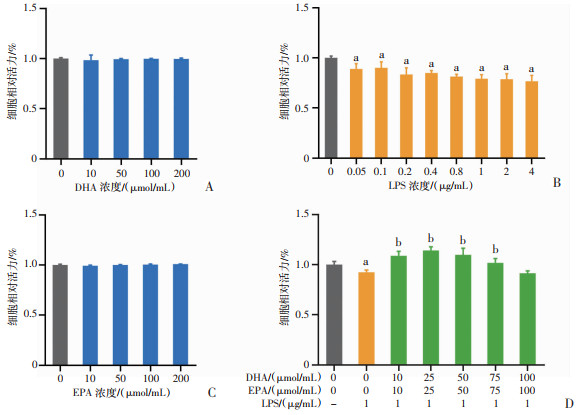
|
|
a:P < 0.05,与Control(0 μg/mL LPS)比较;b:P < 0.05,与LPS干预比较 A:DHA的CCK-8结果(n=6);B:LPS的CCK-8结果(n=6);C:EPA的CCK-8结果(n=6);D:DHA+EPA+LPS的CCK-8结果(n=4) 图 6 DHA、EPA对LPS诱导的细胞损伤的保护作用 |
2.6 DHA+EPA预处理可调节LPS诱导的BV2细胞激活及极化,抑制LPS诱导的BV2细胞炎症 2.6.1 BV2细胞激活及极化水平变化
免疫荧光共染BV2细胞发现,LPS组表达Iba-1、CD86、CD206较Control组显著升高(P < 0.05),DHA+EPA+LPS组表达Iba-1、CD86较LPS组显著降低(P < 0.05);而各组两两比较CD206/CD86比值均有统计学差异(P < 0.05)。qRT-PCR结果与免疫荧光共染类似,LPS组的Iba-1、CD86 mRNA表达水平较Control组显著升高(P < 0.05),CD206 mRNA表达水平显著降低(P < 0.05),DHA+EPA+LPS组的Iba-1、CD86 mRNA表达水平较LPS组显著降低(P < 0.05),CD206 mRNA表达水平显著升高(P < 0.05)。上述实验结果表明,LPS处理后的BV2细胞呈高水平激活且整体激活水平偏M1型,而经DHA+EPA预处理的BV2细胞在受到LPS刺激后激活程度明显降低,同时整体激活水平偏M2型,这提示DHA+EPA可有效抑制BV2细胞激活,并调节BV2细胞向M2型转化。见图 7。
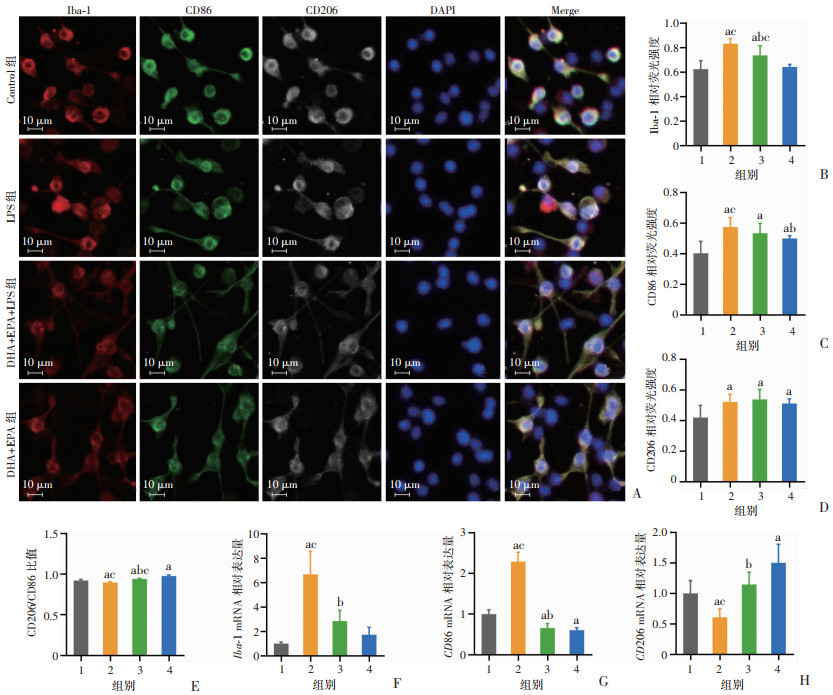
|
|
1:Control组;2:LPS组;3:DHA+EPA+LPS组;4:DHA+EPA组;a:P < 0.05,与Control组比较;b:P < 0.05,与LPS组比较;c:P < 0.05,与DHA+EPA组比较(A~E:n=6;F~H:n=4) A:细胞免疫荧光化学;B:Iba-1平均荧光强度;C:CD86平均荧光强度;D:CD206平均荧光强度;E:CD206/CD86荧光强度比值;F:Iba-1 mRNA转录水平;G:CD86 mRNA转录水平;H:CD206 mRNA转录水平 图 7 DHA+EPA对LPS诱导的BV2细胞激活及极化水平的影响 |
2.6.2 BV2细胞炎症水平变化
qRT-PCR结果显示,LPS组的NLRP3、Caspase-1、IL-1β、IL-18、IL-6、iNOS mRNA表达水平较Control组显著升高(P < 0.05),DHA+EPA+LPS组的NLRP3、Caspase-1、IL-1β、IL-18、IL-6、iNOSmRNA表达水平较LPS组明显降低(P < 0.05)。蛋白质印迹实验结果显示,与Control组相比,LPS处理可显著上调NLRP3蛋白表达、下调TGF-β蛋白表达(P < 0.05);而经DHA+EPA预处理的BV2细胞在被LPS诱导后NLRP3蛋白表达下降、TGF-β蛋白表达上升(P < 0.05)。上述实验结果表明,DHA+EPA的预处理可以抑制LPS对BV2细胞的炎症诱导作用,降低促炎因子表达,提高抗炎因子表达,提高细胞抗炎水平,从而起到保护BV2细胞的作用。见图 8。
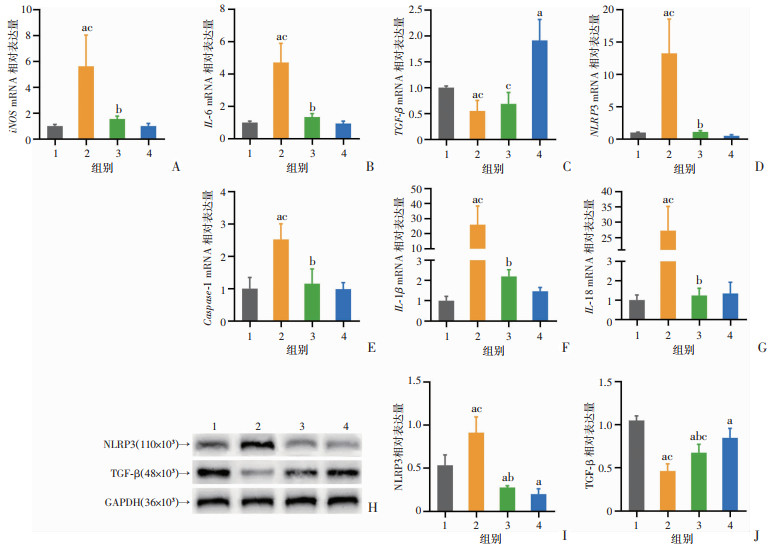
|
|
1:Control组;2:LPS组;3:DHA+EPA+LPS组;4:DHA+EPA组;a:P < 0.05,与Control组比较;b:P < 0.05,与LPS组比较;c:P < 0.05,与DHA+EPA组比较 A:iNOS mRNA转录水平;B:IL-6 mRNA转录水平;C:TGF-β mRNA转录水平;D:NLRP3 mRNA转录水平;E:Caspase-1 mRNA转录水平;F:IL-1β mRNA转录水平;G:IL-18 mRNA转录水平;H:Western blot检测结果;I:NLRP3相对表达水平;J:TGF-β相对表达水平 图 8 DHA+EPA对LPS诱导的BV2细胞炎症水平的影响(n=4) |
3 讨论
目前,对于口服补充n-3 PUFAs对AD患者是否确切有益尚存争议,但主流观点认为n-3 PUFAs可以延缓轻中度AD患者的认知与行为功能障碍。也有部分研究认为,人们需要同时摄入如B族维生素、维生素E和类胡萝卜素等其他营养素才能充分发挥n-3 PUFAs的神经保护作用[16-17]。这些人群干预的研究结论与绝大部分实验室结果或流行病学的观察结果并不一致,可能与不同受试人群膳食本底、n-3 PUFAs来源及干预剂量等混杂因素有关。为了排除外源性n-3 PUFAs剂量比例及其他膳食混杂营养成分干预所导致的实验结果不稳定的情况,本研究采用以能够自身合成内源性n-3 PUFAs的Fat-1基因小鼠为基础构建Fat-1/APPPS1转基因小鼠作为体内研究模型,再辅以DHA+EPA预处理及LPS诱导损伤BV2细胞作为体外研究模型进行细胞水平的验证,从多个维度提升该研究结论的可信度。然而本研究中作为阴性对照的WT、Fat-1小鼠,不论是n-6/n-3 PUFAs比值还是AA/EPA+DPA+DHA比值都显著异于文献[13]报道的比值。仔细对比发现,既往研究模型大多为8~12周龄小鼠,而本研究中均为9月龄小鼠,我们推测,PUFAs表达以及fat-1基因的作用与小鼠年龄存在一定相关性,这有待进一步研究证实。
慢性神经炎症是AD发展中的重要环节,沉积的Aβ周围聚集了多种炎症介质,浓集区域也与神经退行性变的区域高度相关。有意思的是,炎症反应是一个动态变化的过程,表现出与小胶质细胞极化类型密切相关的时空特异性,激活的小胶质细胞的极化表型之间并不是绝对孤立的,它们之间可以因微环境的变化而相互转化,具有高度的异质性和可塑性,以满足在炎症反应的不同阶段执行不同的功能。而在AD的不同模型以及发病的不同阶段,激活的小胶质细胞也会表现为不同的表型,以发挥不同的病理作用,其中APPPS1小鼠主要表现为M1型[18]。在APPPS1小鼠的海马中发现,吞噬能力较强的M2型仅局限于Aβ沉积周围,此时小鼠的神经炎症反应较轻;而在神经炎症反应较重的APPPS1小鼠脑内,M1型还扩展到没有Aβ沉积的其他脑区[19]。随着机体年龄的增长、Aβ沉积增多以及持续的慢性炎症,小胶质细胞的吞噬能力显著降低[20]。然而ITALIANI等[21]发现人类单核细胞极化为M1型后,可以随着培养条件的连续变化而转变为M2型;LI等[6]发现依达拉奉可以通过抑制NLRP3炎症小体通路,调节小胶质细胞的极化,抑制BV2细胞的炎症反应,改善LPS诱导的多巴胺能神经元损伤和帕金森模型大鼠的运动障碍;YANG等[22]发现白藜芦醇可以激活SIRT1,上调过氧化物酶体增殖物激活受体(PPAR)-1α,抑制小胶质细胞激活,促进M1向M2型转化,从而改善BV2细胞炎症反应。这些研究均表明,诱导M1型小胶质细胞向M2型转化,可以产生促进损伤修复、组织再生等积极作用,减弱神经炎症的毒性反应。
MARCUS等[23]发现DHA可以抑制γ-分泌酶和β-分泌酶-1,增加并激活α-分泌酶,使淀粉样前蛋白代谢途径从淀粉样蛋白生成途径向非淀粉样蛋白生成途径转变,从而减少Aβ沉积;除此之外,GRIMM等[24]还发现DHA、EPA均能增强胰岛素降解酶活性,促进其介导的Aβ降解。LUKIW等[25]发现DHA与其衍生物之一的神经保护素D1能显著上调抗凋亡家族信号蛋白Bcl-xl、Bcl-2和Bfl-1(A1)表达,从而减少神经元凋亡;同时阻断NF-κB介导的小胶质细胞激活,下调促炎细胞因子IL-1β、TNF-α以及环氧化酶COX-2表达,从而降低中枢神经系统炎症水平。MINOGUE等[26]发现大鼠短期内摄入大量EPA可抑制Aβ对IL-1β的诱导和长时程增强的抑制,上调PPARγ使Aβ诱导的小胶质细胞的毒性作用降低。这些研究与本研究有关内源性n-3 PUFAs可以抑制Aβ沉积和小胶质细胞激活的结论并不矛盾。进一步发现内源性n-3 PUFAs可以调节M1/M2的极化比例,抑制NLRP3分泌,促进TGF-β分泌,从而降低CNS炎症水平,改善APPPS1小鼠的学习记忆障碍。让人意外的是,Fat-1/APPPS1组与APPPS1组小鼠大脑EPA水平差异并不明显,而DHA水平差异很明显(P<0.05),我们推测可能对于老年APPPS1小鼠来说DHA比EPA作用更大,这或许与XIA等[27]发现DHA与EPA虽均能逆转老年SD大鼠海马区M1/M2的极化失衡,但DHA的作用比EPA更大的结论具有相似之处,而这可能与DHA、EPA下调NLRP3表达,上调TGF-β表达的具体作用机制通路有关,尚需进一步研究。
本研究通过在Fat-1/APPPS1三基因小鼠与BV2细胞模型上的系列实验,证实了内源性n-3 PUFAs可抑制Aβ沉积和小胶质细胞激活,同时可通过调节M1/M2的极化比例,降低CNS炎症水平,改善APPPS1小鼠的学习记忆障碍。这对于加深人们对AD病理机制的认识,进一步揭示n-3 PUFAs改善AD的抗炎作用机制具有重要意义,可为后续通过膳食营养途径防治AD提供理论支撑。
| [1] |
GBD Dementia Forecasting Collaborators. Estimation of the global prevalence of dementia in 2019 and forecasted prevalence in 2050: an analysis for the Global Burden of Disease Study 2019[J]. Lancet Public Health, 2022, 7(2): e105-e125. |
| [2] |
REN R J, QI J L, LIN S H, et al. The China Alzheimer report 2022[J]. Gen Psychiatr, 2022, 35(1): e100751. |
| [3] |
CARSON M J, DOOSE J M, MELCHIOR B, et al. CNS immune privilege: hiding in plain sight[J]. Immunol Rev, 2006, 213: 48-65. |
| [4] |
PIERRE W C, SMITH P L P, LONDONO I, et al. Neonatal microglia: the cornerstone of brain fate[J]. Brain Behav Immun, 2017, 59: 333-345. |
| [5] |
HE X F, XU J H, LI G, et al. NLRP3-dependent microglial training impaired the clearance of amyloid-beta and aggravated the cognitive decline in Alzheimer's disease[J]. Cell Death Dis, 2020, 11(10): 849. |
| [6] |
LI J P, DAI X P, ZHOU L Y, et al. Edaravone plays protective effects on LPS-induced microglia by switching M1/M2 phenotypes and regulating NLRP3 inflammasome activation[J]. Front Pharmacol, 2021, 12: 691773. |
| [7] |
MILNER M T, MADDUGODA M, GÖTZ J, et al. The NLRP3 inflammasome triggers sterile neuroinflammation and Alzheimer's disease[J]. Curr Opin Immunol, 2021, 68: 116-124. |
| [8] |
MICHELUCCI A, HEURTAUX T, GRANDBARBE L, et al. Characterization of the microglial phenotype under specific pro-inflammatory and anti-inflammatory conditions: effects of oligomeric and fibrillar amyloid-beta[J]. J Neuroimmunol, 2009, 210(1/2): 3-12. |
| [9] |
CHERRY J D, OLSCHOWKA J A, O'BANION M K. Neuroinflammation and M2 microglia: the good, the bad, and the inflamed[J]. J Neuroinflammation, 2014, 11: 98. |
| [10] |
GUO Y, ZHANG H, YANG J, et al. Granulocyte colony-stimulating factor improves alternative activation of microglia under microenvironment of spinal cord injury[J]. Neuroscience, 2013, 238: 1-10. |
| [11] |
BUTOVSKY O, KORONYO-HAMAOUI M, KUNIS G, et al. Glatiramer acetate fights against Alzheimer's disease by inducing dendritic-like microglia expressing insulin-like growth factor 1[J]. Proc Natl Acad Sci U S A, 2006, 103(31): 11784-11789. |
| [12] |
RADDE R, BOLMONT T, KAESER S A, et al. Abeta42-driven cerebral amyloidosis in transgenic mice reveals early and robust pathology[J]. EMBO Rep, 2006, 7(9): 940-946. |
| [13] |
KANG J X, WANG J D, WU L, et al. Transgenic mice: fat-1 mice convert n-6 to n-3 fatty acids[J]. Nature, 2004, 427(6974): 504. |
| [14] |
SERNEELS L, VAN BIERVLIET J, CRAESSAERTS K, et al. Gamma-Secretase heterogeneity in the Aph1 subunit: relevance for Alzheimer's disease[J]. Science, 2009, 324(5927): 639-642. |
| [15] |
MO Z H, TANG C G, LI H Q, et al. Eicosapentaenoic acid prevents inflammation induced by acute cerebral infarction through inhibition of NLRP3 inflammasome activation[J]. Life Sci, 2020, 242: 117133. |
| [16] |
FOURRIER C, REMUS-BOREL J, GREENHALGH A D, et al. Docosahexaenoic acid-containing choline phospholipid modulates LPS-induced neuroinflammation in vivo and in microglia in vitro[J]. J Neuroinflammation, 2017, 14(1): 170. |
| [17] |
JERNERÉN F, CEDERHOLM T, REFSUM H, et al. Homocysteine status modifies the treatment effect of omega-3 fatty acids on cognition in a randomized clinical trial in mild to moderate Alzheimer's disease: the OmegAD study[J]. J Alzheimers Dis, 2019, 69(1): 189-197. |
| [18] |
NOLAN J M, POWER R, HOWARD A N, et al. Supplementation with carotenoids, omega-3 fatty acids, and vitamin E has a positive effect on the symptoms and progression of Alzheimer's disease[J]. J Alzheimers Dis, 2022, 90(1): 233-249. |
| [19] |
COLTON C A, MOTT R T, SHARPE H, et al. Expression profiles for macrophage alternative activation genes in AD and in mouse models of AD[J]. J Neuroinflammation, 2006, 3: 27. |
| [20] |
JIMENEZ S, BAGLIETTO-VARGAS D, CABALLERO C, et al. Inflammatory response in the hippocampus of PS1M146L/APP751SL mouse model of Alzheimer's disease: age-dependent switch in the microglial phenotype from alternative to classic[J]. J Neurosci, 2008, 28(45): 11650-11661. |
| [21] |
ITALIANI P, MAZZA E M C, LUCCHESI D, et al. Transcriptomic profiling of the development of the inflammatory response in human monocytes in vitro[J]. 2014, 9(2): e87680. DOI: 10.1371/journal.pone.0087680.
|
| [22] |
YANG X D, XU S Q, QIAN Y W, et al. Resveratrol regulates microglia M1/M2 polarization via PGC-1α in conditions of neuroinflammatory injury[J]. Brain Behav Immun, 2017, 64: 162-172. |
| [23] |
BAZINET R P, LAYÉ S. Polyunsaturated fatty acids and their metabolites in brain function and disease[J]. Nat Rev Neurosci, 2014, 15(12): 771-785. |
| [24] |
GRIMM M O W, MICHAELSON D M, HARTMANN T. Omega-3 fatty acids, lipids, and apoE lipidation in Alzheimer's disease: a rationale for multi-nutrient dementia prevention[J]. J Lipid Res, 2017, 58(11): 2083-2101. |
| [25] |
LUKIW W J, CUI J G, MARCHESELLI V L, et al. A role for docosahexaenoic acid-derived neuroprotectin D1 in neural cell survival and Alzheimer disease[J]. J Clin Invest, 2005, 115(10): 2774-2783. |
| [26] |
MINOGUE A M, LYNCH A M, LOANE D J, et al. Modulation of amyloid-beta-induced and age-associated changes in rat hippocampus by eicosapentaenoic acid[J]. J Neurochem, 2007, 103(3): 914-926. |
| [27] |
XIA J, YANG L E, HUANG C Y, et al. Omega-3 polyunsaturated fatty acid eicosapentaenoic acid or docosahexaenoic acid improved ageing-associated cognitive decline by regulating glial polarization[J]. Mar Drugs, 2023, 21(7): 398. |




