2. 100700 北京,解放军总医院第七医学中心妇产科医学部;
3. 100853 北京,解放军总医院第一医学中心妇产科
2. Department of Obstetrics and Gynecology, Seventh Medical Center of Chinese PLA General Hospital, Beijing, 100700;
3. Department of Obstetrics and Gynecology, First Medical Center of Chinese PLA General Hospital, Beijing, 100853, China
移植前早期胚胎发育停滞是造成反复移植失败的常见临床问题,约有40%的受精卵在到达囊胚期之前就发生停滞[1]。其中部分患者可能发生完全胚胎发育停滞,这种罕见的病例目前成因尚不清楚,并且没有可靠的治疗策略。已有研究者在遗传学方面进行了一些研究,认为胚胎发育停滞病因复杂,可能与胚胎的基因变异、线粒体DNA拷贝数、表观甲基化、染色体异常、代谢异常及形态异常等相关[2-3]。也可能与母体因素的基因变异、蛋白表达水平等相关。近年来随着遗传检测技术的发展,通过母体全外显子等检测方法已经证明多种基因与早期胚胎发育停滞的遗传学相关,主要包括:母源效应基因[4-6](如TUBB8、CDC20、PATL2、PLK4等)和编码皮层下母源复合体的基因[7-9](如NLRP2、NLRP5、PADI6、TLE6等)。此外,涉及细胞分裂、检查点、核糖体的基因变异、线粒体的基因变异和长链非编码RNA也与胚胎发育密切相关。然而,仍有许多早期胚胎发育停滞的病因尚未得到完全阐明,需要进一步深入的研究[10]。
线粒体是人体唯一具有自己遗传物质的细胞器。线粒体基因(mitochondrial DNA,mtDNA)是一种母系遗传的16.5 kb环状分子,能够编码其中37个基因,主要包括NADH脱氢酶、bc1复合体、细胞色素C氧化酶、合成tRNA、12S及16S核糖体RNA等。线粒体基因型的细微变化(包括mtDNA变异序列、变异总数及拷贝数变化等)都可能会影响线粒体活性氧的产生、氧化还原状态等功能,与肿瘤、糖尿病、高血压、代谢、气候性疾病紧密相关[11]。与生殖临床相关的线粒体突变是在女性生殖系中的母系遗传变异。这些变异是指以正常mtDNA为主的细胞内,产生有变异mtDNA的混合细胞质。其中,严重的mtDNA突变会引起显著的生理变化如tRNALys(MT-TK)m.8344A>G突变可导致肌阵挛性癫痫和不规则红纤维综合征[12], tRNALeu(MT-TL1)m.3243A>G突变,导致线粒体脑肌病、乳酸酸中毒和卒中样发作综合征[13]; MT-ATP6m.8993T>G(L156R)突变,导致神经源性肌肉无力、共济失调和视网膜色素变性(neuropathy, ataxia and retinitis pigmentosa, NARP)和Leigh综合征[14]。较轻微的mtDNA纯突变也会显著影响细胞功能,如mtDNAMT-ND4m.11778G>a(R340H)突变,导致Leber遗传性视神经病变[14]。然而与胚胎发育停滞相关的母体线粒体基因仍有待探明。
本研究旨在探索早期胚胎发育完全停滞的遗传因素。在排除染色体及全外显子基因异常后,对比了胚胎停滞患者与正常对照组母体的线粒体基因序列,旨在找到特异性突变位点及其定位基因,为进一步阐明不明原因早期胚胎发育停滞的发生机制,挖掘潜在治疗新靶点提供数据支撑。
1 资料与方法 1.1 研究对象及分组本研究为病例对照研究。收集2021年5月至2022年11月因不孕就诊解放军总医院生殖中心的不孕不育女性患者共46人作为研究对象,均进行外周血全外显子测序及线粒体基因突变检测。纳入标准:①年龄30~45岁;②行体外胚胎培养;③夫妻双方染色体检测未见异常;④女方外周血行全外显子检测未见致病基因,并进一步行线粒体基因检测。排除标准:①所取卵母细胞均受精失败,未形成胚胎;②女方激素水平异常,如卵巢功能不全、多囊卵巢综合征、高泌乳素血症、甲状腺功能亢进或甲状腺功能低下、糖尿病等;③既往行放、化疗,或免疫抑制疾病等影响胚胎质量者。本研究已通过解放军总医院第七医学中心伦理委员会审核批准(2023-97)。每位患者签署知情同意书。其中,研究组选取体外胚胎培养第3天所有胚胎发生胚胎发育停滞的患者。对照组选取体外胚胎培养第3天可移植胚胎数≥3的患者。经筛选,研究组12人中,2人因取得卵母细胞均未授精排除,最终纳入10人。对照组34人中,8人虽可以获得可移植胚胎,但因数量少(1~2个)被排除,因研究组人数较少,最终选取15人为对照组。所有入组病例夫妻双方未见染色体异常。统计2组患者临床基线数据、胚胎发育情况,分别比较2组患者线粒体基因突变位点及其定位基因情况,并对特异性突变位点/基因进行功能注释。
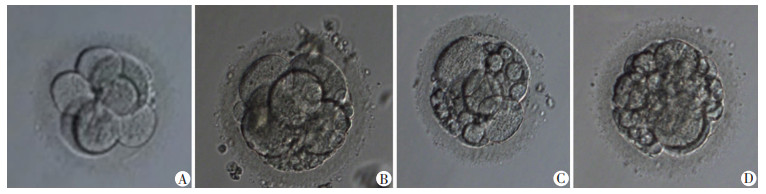
1.2 方法 1.2.1 临床资料收集通过病例采集获得女方临床特征及胚胎发育情况。一般临床信息包括:年龄、身高、体质量、体质量指数(body mass index, BMI)、不孕时间、抗米勒管激素(anti-Müllerian hormone,AMH)、雌二醇(estradiol,E2)、促卵泡激素(follicle-stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、基础卵泡数。胚胎发育情况包括:记录患者取卵后卵母细胞授精情况及人工授精后3 d内胚胎发育评估情况。根据胚胎发育情况将患者进行研究组和对照组分组。目前,在世界卫生组织国际辅助生殖技术监测委员会的不孕症术语表中并没有移植前早期胚胎发育停滞的定义[3],与移植前胚胎发育停滞相关文献的作者也没有提出一个明确的定义。因此,本研究参考意大利的一项专家共识[15],将胚胎停滞定义为:发育已经停滞至少24 h,或所有细胞已经退化或溶解的胚胎[16]。卵裂期胚胎的形态学评价方法是移植前胚胎质量评估的金标准。本研究根据2011年ESHRE胚胎学组和Alpha Executive的分级系统对卵裂期,即受精卵形成后的第1、2、3天的胚胎进行形态学最低标准评估。评估内容包括:授精后第1天是否有2PN,第2天是否发生卵裂(图 1)。第3天观察碎片比例、卵裂球数目及均一度、是否多核等,对胚胎进行分级,评估能否移植。评分标准如图 2,1级(优质胚胎): 卵裂球8~10个, 大小均匀, 碎片量≤10%, 没有多核、空泡;2级(优质胚胎): 卵裂球6~7个或>10个,不均≤1,碎片量≤15%,无多核、空泡;3级: 卵裂球4~5个,不均数≤2,碎片量≤20%,无多核、空泡无或较少;4级(废弃胚胎): 卵裂球2~3个,不均数≥3,碎片量≥20%,有多核、大量空泡。卵母细胞进行体外授精后第3天的胚胎评级1~3级,可定义为可移植胚胎。

|
| A:有2PN;B:发生卵裂;C:无2PN;D:未发生卵裂 图 1 受精后第1、2天胚胎发育情况 |
|
| A:1级胚胎;B:2级胚胎;C:3级胚胎;D:4级胚胎 图 2 受精后第3天胚胎分级 |
1.2.2 检测器材
DNA提取试剂盒:QIAamp DNA Blood Mini Kit、超声破碎器Covaris S220、DNA文库制备试剂盒:NEBNext Ultra Ⅱ DNA Library Prep Kit for Illumina、探针:DT探针(Integrated DNA Technologies)、测序平台:NovaSeq 6000。
1.2.3 检测方法使用EDTA抗凝管采集待检测患者外周血4 mL。外周血DNA使用DNA提取试剂盒进行DNA抽提;抽提的DNA同时使琼脂糖凝胶电泳及Qubit进行质检,检测DNA完整情况,要求总质量≥1 μg,样本浓度≥20 ng/μL,OD260/280在1.7~1.9质检,确保DNA无明显降解。抽提的基因组DNA使用Covaris S220进行超声随机打断,打断DNA片段大小250~300 bp,对打断后的DNA使用DNA文库制备试剂盒(NEBNext Ultra Ⅱ DNA Library Prep Kit for Illumina)进行文库构建及高通量测序,主要步骤为:DNA片段末端补平,3’端加A尾,链接测序接头,使用磁珠纯化去除多余接头,并对所建文库进行预扩增;对所扩增文库使用合适的探针进行用于实现基因组特定区域的捕获。对所捕获文库通过PCR进行扩增,完成目标区域文库捕获。并对文库进行定量,使用NovaSeq6000 S4 Reagent Kit v1.5试剂,在NovaSeq 6000平台进行测序,测序模式为150PE,获得测序原始线粒体序列数据。
1.3 数据分析经过质控筛选得到每个患者线粒体全基因测序数据与人线粒体参考序列(NC_012920)进行比对,找出突变点位、突变内容。统计2组患者临床基线数据、胚胎发育情况,比较2组患者线粒体基因突变位点及其定位基因情况,并通过Mitomap数据库找出突变点位所在基因及二级结构,对这些特异性突变位点/基因进行功能注释。
1.4 统计学分析采用SPSS 26.0统计学软件进行数据分析。计量资料符合正态分布的用x±s表示,不符合正态分布的用M(P25, P75)表示,计数资料以例(%)表示。多组定量数据的比较采用方差分析或Kruskal-Wallis检验,定性资料组间差异比较采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果 2.1 各组一般资料2组间一般临床信息如表 1所示,年龄、身高、体质量、BMI、不孕时间、AMH、E2、FSH、LH、基础卵泡数等项目的差异均无统计学意义。
| 项目 | 研究组(n=10) | 对照组(n=15) | P |
| 年龄/岁 | 37.80±3.36 | 36.33±2.79 | 0.248 |
| 身高/cm | 162.60±6.55 | 162.67±5.40 | 0.978 |
| 体质量/kg | 58.10±9.39 | 58.13±10.01 | 0.993 |
| BMI/(kg/m2) | 21.09(19.77,25.11) | 21.30(19.81,23.05) | 0.978 |
| AMH/(ng/mL) | 2.30(0.68,3.33) | 2.10(1.40,3.10) | 0.849 |
| E2/(pg/mL) | 31.98±12.86 | 34.96±13.52 | 0.576 |
| FSH/(miu/mL) | 11.31±5.67 | 7.99±3.73 | 0.090 |
| LH/(miu/mL) | 5.61(3.89,10.20) | 6.70(4.20,8.26) | 0.723 |
| 不孕时间/年 | 5.05±2.36 | 4.17±2.12 | 0.339 |
| 基础卵泡数/个 | 2.50(2.00,5.00) | 4.00(2.00,6.50) | 0.397 |
2.2 胚胎发育情况
2组均在体外人工授精后进行体外培养,并观察3 d胚胎发育情况。受精后第1天观察到所有患者有产生2PN的受精卵,第2天研究组中所有胚胎发育停滞的患者共4人,第3天有胚胎发育停滞的患者共6人。2组人工授精后3 d的胚胎发育情况如下所述:研究组10人在人工授精后第1天成功受精的受精卵数共31枚,其中18枚在第2天发生胚胎发育停滞,13枚在第3天发生胚胎发育停滞,最终没有可移植胚胎;对照组在人工受精后第1天成功受精的受精卵数共159枚,其中38枚在第2天发生胚胎发育停滞,40枚在第3天发生胚胎发育停滞,最终剩余81枚可移植胚胎。2组胚胎在受精后正常发育率如下所述:在成功受精的受精卵中,对照组在第2天卵裂率有76.1%,第3天获得可移植胚胎的比例有50.9%,而研究组在第2天的卵裂率只有29.0%,第3天没有可移植胚胎。
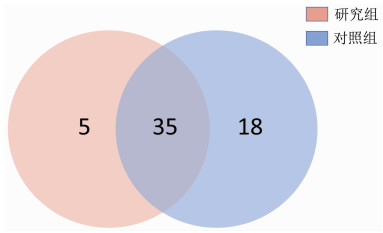
2.3 线粒体检测结移植前早期胚胎发育停滞患者发生突变的线粒体位点计数见表 2、图 3。结果显示,研究组线粒体基因突变点位次数大于3的位点共40个,对照组线粒体基因突变点位大于3的位点共53个。图 3显示,研究组特异性突变点位共5个,在移植前早期胚胎发育停滞患者中的突变频率为30%~40%。
| 组别 | 线粒体基因突变点位(人数) |
| 研究组 | MT-310(10)、MT-11719(10)、MT-1438(10)、MT-14766(10)、MT-15326(10)、MT-263(10)、MT-2706(10)、MT-4769(10)、MT-7028(10)、MT-73(10)、MT-750(10)、MT-8860(10)、MT-16183(8)、MT-513(7)、MT-247(6)、MT-3105(6)、MT-10310(5)、MT-13928(5)、MT-16189(5)、MT-16519(5)、MT-16304(5)、MT-3970(5)、MT-16223(4)、MT-6962(4)、MT-10873(3)、MT-15043(3)、MT-152(3)、MT-15301(3)、MT-489(3)、MT-8701(3)、MT-9540(3)、MT-15301(3)、MT-489(3)、MT-8701(3)、MT-9540(3)、MT-16172(3)、MT-12882(4)、MT-12406(4)、MT-10609(4)、MT-16129(4) |
| 对照组 | MT-10398(12)、MT-10400(8)、MT-14783(7)、MT-302(7)、MT-16362(6)、MT-709(6)、MT-4883(5)、MT-5178(5)、MT-8270(5)、MT-8584(5)、MT-16140(4)、MT-16266(4)MT-9950(4)、MT-14668(3)、MT-16092(3)、MT-16179(3)、MT-3010(3)、MT-8414(3) |
|
| 图 3 线粒体基因点突变分布 |
2.4 线粒体特异突变点位的分析
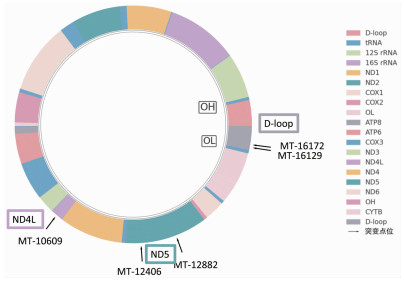
通过Mitomap线粒体数据库找出5个研究组特异性突变点位所在基因位置如图 4。其中3个突变点[MT-12882(C>T)、MT-12406(G>A)、MT-10609(T>C)]的发生在线粒体呼吸链复合物基因,另外2个突变点[MT-16172(T>C)、MT-16129(G>A)]发生在线粒体转录及复制的控制区。对以上5个特异性突变点位进行基因注释如表 3。MT-10609(T>C)在研究组发生的频率为40%,属于非同义突变,将编码线粒体呼吸链复合物中ND4L螺旋结构上的47位甲硫氨酸改变为苏氨酸。MT-12406(G>A)突变的频率为40%,同样属于非同义突变,将编码线粒体呼吸链复合物中ND5螺旋结构上的24位缬氨酸改变为异亮氨酸。MT-12882(C>T)的突变频率是40%,属于线粒体呼吸链复合物中ND5上的同义突变。MT-16172(T>C)、MT-16129(G>A)的发生频率分别为40%、30%,位于线粒体控制区。
|
| 图 4 特异突变点在线粒体基因的位置 |
| 突变点位 | 参考序列 | 变异序列 | 突变频率 | 突变同义性 | 密码子数 | 二级结构 | 氨基酸 | 突变位置 | 功能 | 相关疾病 |
| MT-10609 | T | C | 40% | 非同义 | 47 | 螺旋 | M-T | ND4L | 线粒体呼吸链复合物 | MELAS综合征、Leigh综合征、家族性震颤病 |
| MT-12406 | G | A | 40% | 非同义 | 24 | 螺旋 | V-I | ND5 | 线粒体呼吸链复合物 | Leigh综合征、家族性震颤病 |
| MT-12882 | C | T | 40% | 同义 | - | - | - | ND5 | ||
| MT-16129 | G | A | 40% | - | - | - | - | D-loop | 控制区 | 线粒体肌无力症、糖尿病 |
| MT-16172 | T | C | 30% | - | - | - | - | D-loop |
3 讨论
既往研究发现mtDNA中的MT-ND1、MT-ND2、MT-ND4、MT-ND4L、MT-ND5、MT-ND6、MT-CYB和MT-ATP6等功能区中的高异质性突变与癌症、代谢疾病等具有很强的相关性。少数癌症患者的线粒体突变表现出母系遗传,且突变频率高。然而,尽管线粒体在卵母细胞和胚胎发育中同样具有重要作用,但是对体外培养胚胎发育异常患者的线粒体异常的研究尚不全面,尤其是mtDNA与胚胎发育的相关研究仍需完善。
本研究揭示了5个可能与早期胚胎发育停滞相关的mtDNA突变点位,分别是:MT-10609(T>C)、MT-12406(G>A)、MT-12882(C>T)、MT-16129(G>A)和MT-16172(T>C)。MT-10609(T>C)、MT-12406(G>A)和MT-12882(C>T)这3个突变点位于ND4L、ND5这2个编码线粒体呼吸链复合物I(NADH脱氢酶)亚基的基因上,与细胞代谢,能量产生相关。而MT-16129(G>A)和MT-16172(T>C)位于D-loop调控区。该区域包含用于转录与D-loop结构紧密相邻的线粒体DNA的RNA启动子,与DNA复制的启动相关。
值得注意的是,MT-10609(T>C)突变和MT-12406(G>A)突变属于非同义突变,可能对基因表达产生影响。其中MT-10609(T>C)突变点位于ND4L基因上,它将47位密码子编码的甲硫氨酸转变为非极性的苏氨酸,而这一位点恰位于螺旋二级结构中,并通过氢键与周围结构相连。ND4L基因编码线粒体呼吸链复合物I(NADH脱氢酶)的亚基,这与细胞的代谢和能量产生密切相关。氨基酸的突变可能进一步影响蛋白质的折叠和稳定性,从而影响线粒体呼吸链复合物I的功能。已有研究表明,ND4基因的突变与MELAS综合征、Leigh综合征和家族性震颤病的发生有关。此外,2014年,我国蒋春华等发现mtDNA10609T的突变与高原红细胞增多症的发病风险显著相关,并在体外线粒体实验中得到了验证[17]。而MT-12406(G>A)突变点位于ND5基因上,它将24位密码子编码的缬氨酸转变为异亮氨酸,这一点位同样位于螺旋二级结构中,并且通过氢键与周围结构相连。可能影响蛋白质的结构与稳定性。已有研究证明人ND5的突变可能与线粒体脑病、乳酸酸中毒、MELAS综合征、Leigh综合征等相关。2018年李连等在我国胃癌人群的研究中发现MT-10609(T>C)、MT-12406(G>A)的异质性点突变[18]。2019年HASTURK等[19]在针对土耳其人群的研究中发现非酒精性脂肪性肝炎的发生及不同预后可能与D-Loop控制区变异有关,其中MT-16129点位突变与晚期纤维化表型相关。D-Loop控制区功能主要是控制线粒体基因的复制、修复及表达。本研究也发现在D-Loop上MT-16172(T>C)、MT-16129(G>A)这2个位点的突变可能与早期胚胎发育停滞相关。其中MT-16172(T>C)基因的突变是首次被提及与疾病相关。
本研究对不明原因的早期胚胎发育停滞进行了线粒体基因突变的相关研究,并首次发现在早期胚胎发育停滞患者的线粒体中存在多个变异位点,这些突变位点主要位于线粒体呼吸链复合物基因和线粒体调控基因的功能区域,提示线粒体基因突变可能与胚胎发育停滞相关。然而,对这些突变点位的与胚胎发育停滞相关的具体机制尚无明确的报道,这可能成为下一步的研究方向。
此次研究通过对患者的线粒体基因进行分析,理论上可以避免不必要的医疗资源浪费,减轻患者的经济和心理负担。此外,对那些不明原因早期胚胎发育停滞的患者,线粒体置换[20]或许是一种行之有效的治疗手段,主要包括:原核移植[21]、纺锤体移植(ST)[22]和极体移植[23]。上述方法的是通过将带有突变mtDNA的女性卵母细胞或受精卵的核DNA与健康供体的卵母细胞或受精卵的细胞质结合,将mtDNA的遗传与核基因组的遗传脱钩,从而获得重建胚胎异常核基因组和正常线粒体DNA。2016年4月,ZHANG等[24]在墨西哥通过ST手术帮助1名因线粒体携带导致Leigh综合征的突变的母亲生下1名健康的男婴。然而,这种方法涉及的伦理问题仍需深入探讨和妥善处理。
本研究尚有不足:样本量较小,并且纳入对象主要是在授精后第1天出现胚胎发育停滞的患者,因此需要扩大样本量。同时,还需要进一步行体外实验验证胚胎线粒体基因的作用机制,以便深入地阐明线粒体基因突变在早期胚胎发育停滞中的作用。
综上所述,本研究通过对移植前不明原因的早期胚胎发育完全停滞患者的线粒体基因进行分析,并发现了5个特异的突变点位。这些突变点位均位于线粒体呼吸链复合物基因和线粒体调控基因上,并且这些基因突变的具体意义尚无明确的报道。其中MT-16172(T>C)突变暂未见任何相关报道。通过分析母体特异性线粒体基因突变,可能成为早期胚胎质量评估的指标,并有助于临床医师判进行治疗方案的选择,有针对性的改善线粒体功能。在临床实践中,目前对于早期胚胎发育停滞患者尚无有效治疗手段。抗氧化剂锌离子[25],可能是一种有效的治疗方式,但尚需进一步研究。
| [1] |
Eshre Special Interest Group of Embryology and Alpha Scientists in Reproductive Medicine Electronic Address: Coticchio Biogenesi @ Grupposandonato It. The Vienna consensus: report of an expert meeting on the development of ART laboratory performance indicators[J]. Reprod Biomed Online, 2017, 35(5): 494-510. |
| [2] |
MCCOLLIN A, SWANN R L, SUMMERS M C, et al. Abnormal cleavage and developmental arrest of human preimplantation embryos in vitro[J]. Eur J Med Genet, 2020, 63(2): 103651. |
| [3] |
SFAKIANOUDIS K, MAZIOTIS E, KARANTZALI E, et al. Molecular drivers of developmental arrest in the human preimplantation embryo: a systematic review and critical analysis leading to mapping future research[J]. Int J Mol Sci, 2021, 22(15): 8353. |
| [4] |
ZHANG M, BI X, GE B, et al. Case report: human early embryonic arrest in a consanguineous Chinese family caused by a novel missense variant of PADI6[J]. QJM, 2023, 116(9): 784-786. |
| [5] |
SAHIN G N, YILDIRIM R M, SELI E. Embryonic arrest: causes and implications[J]. Curr Opin Obstet Gynecol, 2023, 35(3): 184-192. |
| [6] |
CAO T Q, GUO J, XU Y, et al. Two mutations in TUBB8 cause developmental arrest in human oocytes and early embryos[J]. Reprod Biomed Online, 2021, 43(5): 891-898. |
| [7] |
HAN J, ZHANG N N, CAO Q Q, et al. NLRP7 participates in the human subcortical maternal complex and its variants cause female infertility characterized by early embryo arrest[J]. J Mol Med, 2023, 101(6): 717-729. |
| [8] |
LIU J, TAN Z J, HE J, et al. Two novel mutations in PADI6 and TLE6 genes cause female infertility due to arrest in embryonic development[J]. J Assist Reprod Genet, 2021, 38(6): 1551-1559. |
| [9] |
XU Y, QIAN Y, LIU Y, et al. A novel homozygous variant in NLRP5 is associate with human early embryonic arrest in a consanguineous Chinese family[J]. Clin Genet, 2020, 98(1): 69-73. |
| [10] |
SOLOVOVA O A, CHERNYKH V B. Genetics of oocyte maturation defects and early embryo development arrest[J]. Genes, 2022, 13(11): 1920. |
| [11] |
KOPINSKI P K, SINGH L N, ZHANG S P, et al. Mitochondrial DNA variation and cancer[J]. Nat Rev Cancer, 2021, 21(7): 431-445. |
| [12] |
WALLACE D C, ZHENG X X, LOTT M T, et al. Familial mitochondrial encephalomyopathy (MERRF): genetic, pathophysiological, and biochemical characterization of a mitochondrial DNA disease[J]. Cell, 1988, 55(4): 601-610. |
| [13] |
TOMODA E, NAGAO A, SHIRAI Y, et al. Restoration of mitochondrial function through activation of hypomodified tRNAs with pathogenic mutations associated with mitochondrial diseases[J]. Nucleic Acids Res, 2023, 51(14): 7563-7579. |
| [14] |
HOLT I J, HARDING A E, PETTY R K, et al. A new mitochondrial disease associated with mitochondrial DNA heteroplasmy[J]. Am J Hum Genet, 1990, 46(3): 428-433. |
| [15] |
Scientists in Reproductive Medicine ALPHA and Special Interest Group of Embryology ESHRE. Istanbul consensus workshop on embryo assessment: proceedings of an expert meeting[J]. Reprod Biomed Online, 2011, 22(6): 632-646. |
| [16] |
CIMADOMO D, CAPALBO A, SCARICA C, et al. When embryology meets genetics: the definition of developmentally incompetent preimplantation embryos (DIPE)-the consensus of two Italian scientific societies[J]. J Assist Reprod Genet, 2021, 38(2): 319-331. |
| [17] |
JIANG C H, CUI J H, LIU F Y, et al. Mitochondrial DNA 10609T promotes hypoxia-induced increase of intracellular ROS and is a risk factor of high altitude polycythemia[J]. PLoS One, 2014, 9(1): e87775. |
| [18] |
LI L, XING R, CUI J T, et al. Investigation of frequent somatic mutations of MTND5 gene in gastric cancer cell lines and tissues[J]. Mitochondrial DNA B Resour, 2018, 3(2): 1002-1008. |
| [19] |
HASTURK B, YILMAZ Y, EREN F. Potential clinical variants detected in mitochondrial DNA D-loop hypervariable region I of patients with non-alcoholic steatohepatitis[J]. Hormones, 2019, 18(4): 463-475. |
| [20] |
QI S Y, WANG W, XUE X H, et al. Single-cell multiomics analyses of spindle-transferred human embryos suggest a mostly normal embryonic development[J]. PLoS Biol, 2022, 20(8): e3001741. |
| [21] |
SATO A, KONO T, NAKADA K, et al. Gene therapy for progeny of mito-mice carrying pathogenic mtDNA by nuclear transplantation[J]. Proc Natl Acad Sci USA, 2005, 102(46): 16765-16770. |
| [22] |
WANG T A, SHA H Y, JI D M, et al. Polar body genome transfer for preventing the transmission of inherited mitochondrial diseases[J]. Cell, 2014, 157(7): 1591-1604. |
| [23] |
MA H, VAN DYKEN C, DARBY H, et al. Germline transmission of donor, maternal and paternal mtDNA in Primates[J]. Hum Reprod, 2021, 36(2): 493-505. |
| [24] |
ZHANG J, LIU H, LUO S Y, et al. Live birth derived from oocyte spindle transfer to prevent mitochondrial disease[J]. Reprod Biomed Online, 2017, 34(4): 361-368. |
| [25] |
HUANG L, GAO W, HE X R, et al. Maternal zinc alleviates tert-butyl hydroperoxide-induced mitochondrial oxidative stress on embryonic development involving the activation of Nrf2/PGC-1α pathway[J]. J Anim Sci Biotechnol, 2023, 14(1): 45. |




