胰岛素抵抗是2型糖尿病(type 2 diabetes mellitus, T2DM)、代谢综合征、高血压、高脂血症、非酒精性脂肪肝等疾病共同的病理特征。《中国2型糖尿病防治指南(2020版)》指南提示,能量摄入过多引起的胰岛素抵抗及代谢紊乱是其发病的主要诱因。肠道L细胞产生的胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)是一种饮食依赖性的短肽激素,在改善胰岛素抵抗和维持血糖稳态中发挥关键调节作用[1]。CD26/DPP4是一种多功能的Ⅱ型跨膜丝氨酸肽酶,胞膜外结构具有二肽基肽酶活性。CD26/DPP4在自身免疫、糖尿病和肿瘤等方面发挥重要调节作用。作为一种广泛表达于淋巴细胞的胞外酶,CD26/DPP4参与营养物质的吸收和再循环,其对免疫系统尤其是T淋巴细胞的功能有重要影响。GLP-1主要被肠道组织中的CD26/DPP4分解[2],导致其生物半衰期短、生物利用度较低,现临床已使用其类似物防治胰岛素抵抗引起的T2DM,但仍存在药物副作用及依从性差的弊端。近年来,有研究表明,胃肠激素分泌减少、糖耐量异常及胰岛素抵抗可能与肠道的胆汁酸代谢异常有关[3-5]。前期本实验室研究发现,高脂饮食诱导的胰岛素抵抗小鼠肠道胆汁酸代谢异常,尤其是鹅去氧胆酸(chenodeoxycholic acid,CDCA)含量在高脂饮食喂养的小鼠肠道显著升高,提示CDCA可能在胰岛素抵抗的发生中起重要作用。有研究表明,CDCA是核内法尼醇X受体(farnesoid X receptor,FXR)的天然激动性配体,能够激活FXR受体参与代谢调节过程[6-7]。肠上皮间淋巴细胞(intestinal intraepithelial lymphocytes,IELs) 是肠道黏膜上皮的特殊T细胞群,其不同亚群比例和表型与多种疾病(包括胰岛素抵抗引起的T2DM)发生密切相关。有研究报道,某些IELs亚群能够影响肠道L细胞分泌GLP-1水平[8-9]。本研究通过建立高脂饮食喂养的胰岛素抵抗模型,研究CDCA对肠道GLP-1表达和分泌水平的影响,并揭示肠道FXR受体表达、L细胞和IELs介导的GLP-1产生和降解相关分子机制在高脂饮食诱导胰岛素抵抗中的作用,为胰岛素抵抗的防治提供新的依据。
1 材料与方法 1.1 实验试剂鹅去氧胆酸(CDCA)购自成都曼斯特生物有限公司(纯度>95%),FXR拮抗剂孕二烯二酮(Z-Guggulsterone,Z-Gug)购自广州市云天实验室科技有限公司(纯度98.43%)。葡萄糖(GLu)、总胆固醇(CHO)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)检测试剂盒购自南京建成生物工程研究所。
1.2 实验分组及干预方法C57BL/6小鼠40只,购自于重庆莱彼特生物科技有限公司,饲养于陆军军医大学SPF级动物实验中心。给予小鼠12 h/12 h昼夜明暗交替,自由饮食与饮水。实验分为5组,每组8只:①对照组(Control组):给予纯化饲料(XT19008);②高脂饮食组(HFD组):给予45%脂肪供能比高脂饲料(XTHF45);③HFD+CDCA组:高脂饮食干预8周,并按照100 mg/(kg·d)给予CDCA灌胃,连续干预8周;④HFD+Z-Gug组:高脂饮食干预8周,从第6周起按照100 mg/(kg·d)给予Z-Gug腹腔注射2周;⑤HFD+CDCA+Z-Gug组:高脂饮食干预8周并按照100 mg/(kg·d)给予CDCA灌胃连续干预8周,最后2周给予Z-Gug干预。各组干预至第8周末,检测相应指标。每周记录各组小鼠体质量和24 h摄食量。实验方案如图 1所示,该研究所有操作均符合陆军军医大学学术研究伦理审查委员会小鼠护理和使用指导原则并获得批准(AMUWEC20211008)。
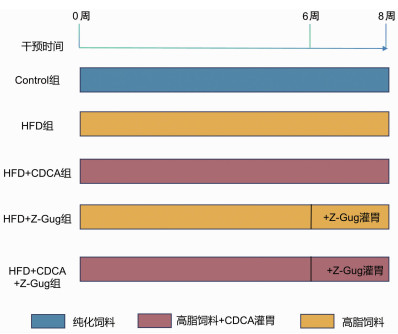
|
| 图 1 动物实验分组 |
1.3 口服葡萄糖耐量实验(oral glucose tolerance test,OGTT)及腹腔内葡萄糖耐量实验(intraperitoneal glucose tolerance test,IPGTT)
干预结束后,小鼠禁食12 h,尾静脉取血测量空腹血糖,然后按照2 g/kg灌胃或腹腔注射葡萄糖溶液,于灌胃或腹腔注射后15、30、60、90、120 min分别采集各组小鼠尾静脉血,检测血糖,计算OGTT及IPGTT糖耐量曲线下面积(AUC),并计算其与OGTT曲线下面积差值(△AUC)。
1.4 肠道组织免疫荧光检测取小肠组织,低温下PBS冲洗,取1 cm/只小肠组织浸泡于组织固定液内固定。经石蜡包埋、抗原修复、切片后,用山羊抗兔IgG抗体对FXR、GLP-1染色,细胞核用DAPI染色,荧光显微镜观察。
1.5 血清生化指标检测干预至第13周末,小鼠麻醉后取眼眶血,全血置于室温2 h后,4 ℃、3 000 r/min离心15 min,取上层血清,检测血清中CHO、TG、GLu、LDL-C、HDL-C含量,操作方法参照试剂盒说明书进行。
1.6 RT-qPCR检测使用Trizol以分离总RNA。使用Nanodrop分光光度计检测RNA浓度;逆转录以合成cDNA,按照逆转录试剂盒RevertAid firststrand cDNA synthesis Kit说明书进行RNA逆转录,获得cDNA,存于-20 ℃备用。使用SYBR RT-PCR试剂盒进行qPCR反应,并通过QTower 2.2系统(Anakytik Jena,Germany)分析结果。结果采用2-ΔΔCt计算分析目的基因的mRNA相对表达量,内参基因为β-actin。
| 基因 | 引物序列(5′→3′) |
| FXR | 上游:CCGGCTAAGGAAGTGCAAAG |
| 下游:AAACTTGGTTGTGGAGGTCA | |
| Gcg | 上游:GCTTATAATGCTGGTGCAAG |
| 下游:TTCATCTCATCAGGGTCCTC | |
| IL-6 | 上游:CCTCTGGTCTTCTGGAGTACC |
| 下游:TCTGTATCTCTCTGAAGGACTCT | |
| IL-1β | 上游:TCTGTATCTCTCTGAAGGACTCT |
| 下游:GCTTGGGAGTGAAGAGGTCA | |
| TNF-α | 上游:GCTTGGGAGTGAAGAGGTCA |
| 下游:GCTTGGGAGTGAAGAGGTCA | |
| β-actin | 上游:GTGCTATGTTCTAGACTTCG |
| 下游:ATGCCACAGGATTCCATACC |
1.7 酶联免疫吸附实验(ELISA)
干预结束后,处死小鼠,收集血液至1.5 mL EP管中,静置30 min,12 000 r/min离心15 min,将血清分离至新1.5 mL EP管中。通过ELISA法检测小鼠血清GLP-1含量,按照试剂盒说明书进行。
1.8 肠上皮间淋巴细胞(intraepithelial lymphocytes,IELs)分离及多色流式细胞术检测干预结束后,立即冰PBS中取出小鼠小肠。经剥离肠系膜及脂肪组织、清洗,将小肠剪成小块置于配好的消化液中,38 ℃摇床震荡20 min(210 r/min),涡旋20 s后,70 μm滤网过滤收集消化液,离心10 min(2 000 r/min),弃上清。加入9 mL 40% Percoll,重悬沉淀并转移至15 mL圆底离心管。向管底加入70% Percoll 5 mL,水平离心10 min(2 000 r/min),IELs聚集于中间层。用抗CD45、CD3、CD8β、CD8α、CD4、TCRγδ、TCRαβ IgG抗体在4 ℃避光染色30 min,PBS洗涤2次后,流式细胞仪(BD FCSverse)上机检测。
1.9 统计学分析数据以x±s表示,采用SPSS 26.0统计软件进行分析,用Graphpad 9.2.0软件作图。多组数据比较采用单因素方差分析,两组数据比较采用LSD法检验,以P < 0.05为差异具有统计学意义。
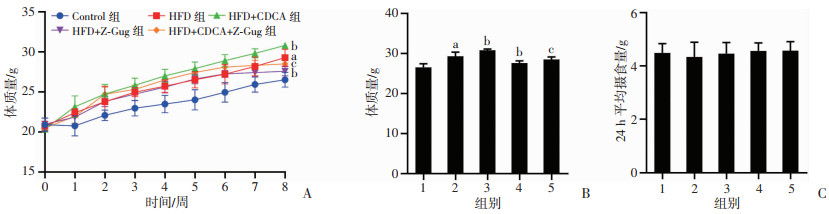
2 结果 2.1 CDCA对高脂饮食诱导小鼠体质量及摄食量的影响从第2周起至第8周末,HFD组小鼠体质量较Control组显著增加(P < 0.05),CDCA干预后小鼠体质量增加较HFD组更为明显(P < 0.05,图 2A)。Z-Gug干预后,与HFD、HFD+CDCA组分别相比,HFD+Z-Gug、HFD+CDCA+Z-Gug组小鼠体质量显著下降(P < 0.05,图 2B),提示抑制FXR可缓解HFD及CDCA干预导致的小鼠体质量增加。为了说明体质量变化与摄食量之间的关系,8周干预周期内对小鼠24 h平均摄食量进行统计,如图 2C所示,各组小鼠平均摄食量无明显差异。结果表明,CDCA处理后小鼠体质量显著增加,Z-Gug干预后能够抑制CDCA诱导的小鼠体质量增加,提示CDCA促进体质量增加的作用可能与FXR受体有关。
|
|
1:Control组;2:HFD组;3:HFD+CDCA组;4:HFD+Z-Gug组;5:HFD+CDCA+Z-Gug组;a:P < 0.01,与Control组比较;b:P < 0.01,与HFD组比较;c:P < 0.01,与HFD+CDCA组比较 A:各组小鼠体质量变化;B:各组小鼠第8周末体质量;C:各组小鼠24 h平均摄食量 图 2 CDCA对高脂饮食诱导小鼠体质量和摄食量的影响(n=8) |
2.2 CDCA对高脂饮食诱导小鼠血清糖脂代谢指标的影响
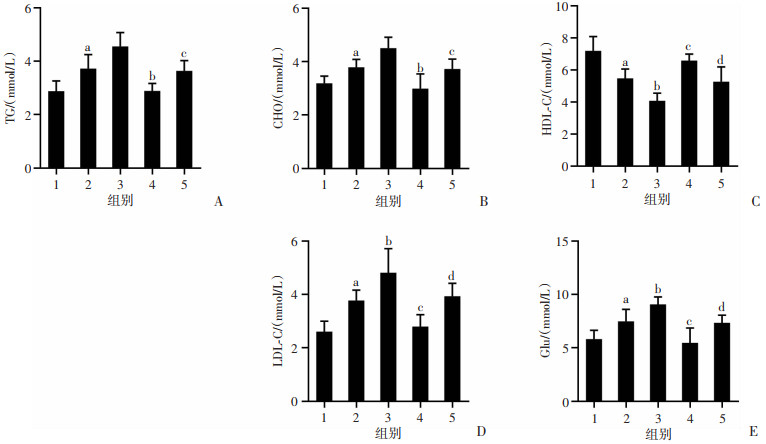
血清糖脂代谢指标检测发现,与Control组相比,HFD组小鼠血清TG、CHO、LDL-C、GLu均显著增加(P < 0.05,图 3B~E),而血清HDL-C显著下降(P < 0.05,图 3C);CDCA干预后,TG、CHO、LDL-C、Glu水平较HFD组显著升高(P < 0.05),HDL-C显著下降(P < 0.05);Z-Gug干预后,与HFD、HFD+CDCA组相比,HFD+Z-Gug、HFD+CDCA+Z-Gug组小鼠血清TG、CHO、LDL-C、GLu水平显著下降(P < 0.05),血清HDL-C水平明显升高(P < 0.05,图 3)。结果表明,CDCA处理后小鼠糖脂代谢指标异常,而Z-Gug干预后能够明显抑制CDCA导致的糖脂代谢异常,提示CDCA导致糖脂代谢异常的作用可能与FXR受体有关。
|
|
1:Control组;2:HFD组;3:HFD+CDCA组;4:HFD+Z-Gug组;5:HFD+CDCA+Z-Gug组 A:小鼠血清甘油三酯;a:P < 0.01,与Control组比较;b:P < 0.01,与HFD组比较;c:P < 0.01,与HFD+CDCA组比较;B:小鼠血清总胆固醇;a:P < 0.05,与Control组比较;b:P < 0.01,与HFD组比较;c:P < 0.01,与HFD+CDCA组比较;C:小鼠血清高密度脂蛋白;a:P < 0.01,与Control组比较;b:P < 0.01,c:P < 0.05,与HFD组比较;d:P < 0.05,与HFD+CDCA组比较;D:小鼠低密度脂蛋白;a:P < 0.01,与Control组比较;b:P < 0.01,c:P < 0.05,与HFD组比较;d:P < 0.05,与HFD+CDCA组比较;E:小鼠血清葡萄糖;a:P < 0.05,与Control组比较;b:P < 0.05,c:P < 0.01,与HFD组比较;d:P < 0.05,与HFD+CDCA组比较 图 3 CDCA对高脂饮食诱导小鼠血清糖脂代谢指标的影响(n=8) |
2.3 CDCA对高脂饮食诱导小鼠糖耐量的影响
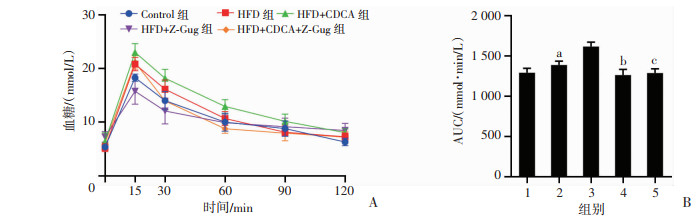
干预至第8周,糖耐量实验结果显示,与Control组相比,HFD组小鼠出现明显糖耐量异常(P < 0.05,图 4),CDCA干预后糖耐量异常较HFD组更为明显(P < 0.05),而Z-Gug干预后糖耐量异常得到显著改善(P < 0.05)。结果表明,CDCA能够加剧高脂饮食诱导的小鼠糖耐量异常,而Z-Gug干预能够显著改善CDCA干预引起的糖耐量异常,提示CDCA导致糖耐量异常的作用可能与FXR受体有关。
|
| A:小鼠OGTT实验;B:曲线下面积统计 1:Control组;2:HFD组;3:HFD+CDCA组;4:HFD+Z-Gug组;5:HFD+CDCA+Z-Gug组;a:P < 0.05,与Control组比较;b:P < 0.01,与HFD组比较;c:P < 0.01,与HFD+CDCA组比较 图 4 CDCA对高脂饮食诱导小鼠糖耐量的影响(n=8) |
2.4 CDCA对高脂饮食诱导小鼠胃肠激素分泌的影响
为了进一步探究胃肠激素GLP-1在CDCA加重HFD喂养小鼠胰岛素抵抗中的作用,本研究开展了腹腔葡萄糖糖耐量实验(IPGTT),利用IPGTT与OGTT曲线下面积之差进行比较评价胃肠激素分泌量,研究结果提示(图 5),与Control组相比,HFD组小鼠胃肠激素分泌量显著降低(P < 0.05),HFD+CDCA组小鼠胃肠激素分泌量显著低于HFD组(P < 0.05);而Z-Gug干预后,则能缓解CDCA引起的胃肠激素分泌下降(P < 0.05)。结果表明,CDCA能够显著抑制高脂饮食诱导的小鼠胃肠激素分泌,加重HFD诱导的胰岛素抵抗,该作用可能与FXR受体有关。
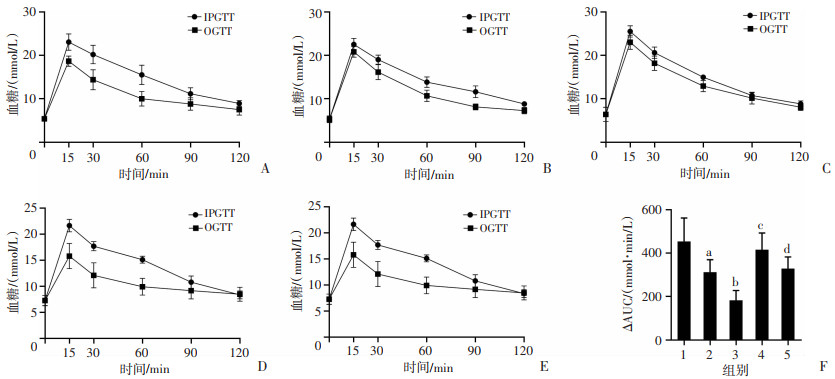
|
| A:Control组小鼠OGTT与IPGTT检测结果;B:HFD组小鼠OGTT与IPGTT检测结果;C:HFD+CDCA组小鼠OGTT与IPGTT检测结果;D:HFD+Z-Gug组小鼠OGTT与IPGTT检测结果;E:HFD+CDCA+Z-Gug组小鼠OGTT与IPGTT检测结果;F:各组间ΔAUC统计结果 1:Control组;2:HFD组;3:HFD+CDCA组;4:HFD+Z-Gug组;5:HFD+CDCA+Z-Gug组;a:P < 0.01,与Control组比较;b:P < 0.01,c:P < 0.05,与HFD组比较;d:P < 0.01,与HFD+CDCA组比较 图 5 CDCA对高脂饮食诱导小鼠胃肠激素分泌的影响 |
2.5 CDCA高脂饮食诱导小鼠肠道组织FXR和GLP-1表达的影响
通过免疫荧光、RT-qPCR及ELISA法分别对小鼠肠道FXR受体表达及GLP-1分泌水平进行检测,结果提示,与Control组相比,HFD组肠道FXR受体蛋白(P < 0.05,图 6A、B)和mRNA(P < 0.05,图 6D)表达水平明显增加,GLP-1表达和分泌水平(P < 0.05,图 6C、F)及Gcg mRNA(P < 0.05,图 6E)明显降低;CDCA干预后,肠道FXR受体mRNA及蛋白表达水平较HFD组升高更为明显(P < 0.05,图 6A、B、D),而Gcg mRNA与GLP-1表达和分泌水平较HFD组明显下降(P < 0.05,图 6C、E、F);Z-Gug干预后,与HFD、HFD+CDCA组相比,HFD+Z-Gug与HFD+CDCA+Z-Gug组小鼠肠道FXR受体表达显著下降(P < 0.05,图 6A、B),Gcg mRNA与GLP-1分泌水平显著增加(P < 0.05,图 6C、E、F)。结果表明,CDCA可能通过促进肠道FXR表达进而抑制GLP-1表达和分泌。
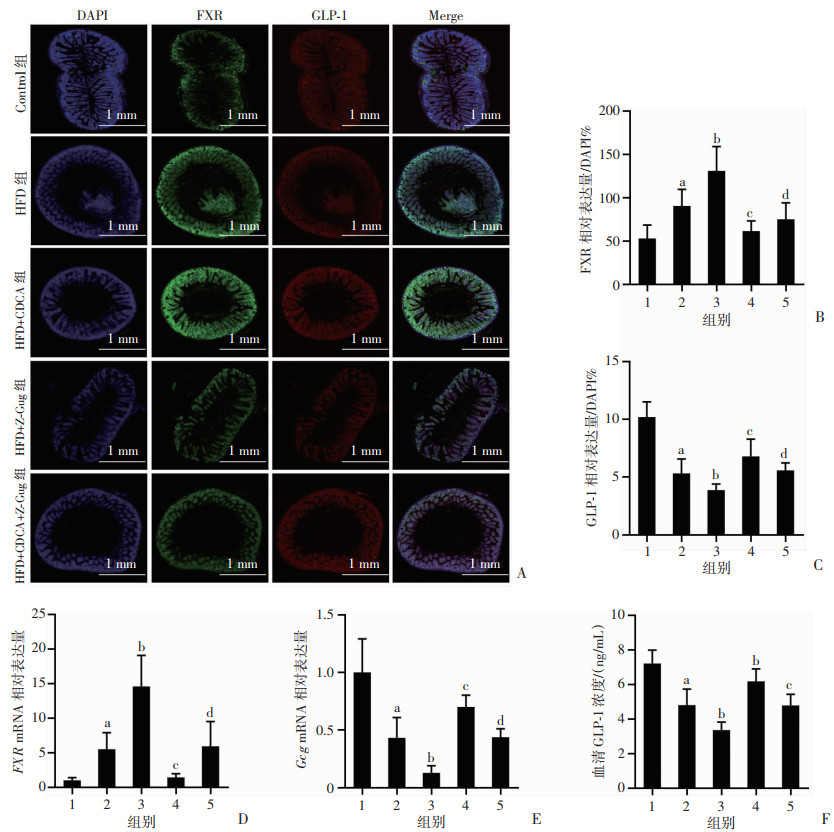
|
|
1:Control组;2:HFD组;3:HFD+CDCA组;4:HFD+Z-Gug组;5:HFD+CDCA+Z-Gug组 A:各组小鼠肠道组织免疫荧光检测;B:FXR相对表达量(n=8);a:P < 0.01,与Control组比较;b:P < 0.01,c:P < 0.05,与HFD组比较;d:P < 0.01,与HFD+CDCA组比较;C:GLP-1相对表达量(n=8);a:P < 0.01,与Control组比较;b:P < 0.05,与HFD组比较;c:P < 0.05,d:P < 0.01,与HFD+CDCA组比较;D:FXR mRNA相对表达量(n=8);a:P < 0.05,与Control组比较;b:P < 0.01,c:P < 0.05,与HFD组比较;d:P < 0.01,与HFD+CDCA组比较;E:Gcg mRNA相对表达量(n=8);a:P < 0.01,与Control组比较;b:P < 0.01,c:P < 0.05,与HFD组比较;d:P < 0.01,与HFD+CDCA组比较;F:血清GLP-1浓度(n=6);a:P < 0.01,与Control组比较;b:P < 0.05,与HFD组比较;c:P < 0.05,与HFD+CDCA组比较 图 6 CDCA对高脂饮食诱导小鼠GLP-1和FXR表达的影响 |
2.6 CDCA对高脂饮食诱导小鼠肠道炎性因子表达的影响
通过RT-qPCR法对小鼠肠道组织促炎因子TNF-α、IL-6、IL-1β mRNA表达水平进行检测,结果显示,HFD组小鼠肠道组织TNF-α、IL-6、IL-1β mRNA水平显著高于Control组,CDCA干预后表达下降,差异具有统计学意义(P < 0.05,图 7)。Z-Gug干预后,与HFD、HFD+CDCA组相比,HFD+Z-Gug、HFD+CDCA+Z-Gug组炎性因子TNF-α、IL-6、IL-1β mRNA表达增加。结果表明,CDCA能够有效缓解高脂饮食引起的肠道炎症反应,该作用可能与FXR受体有关。
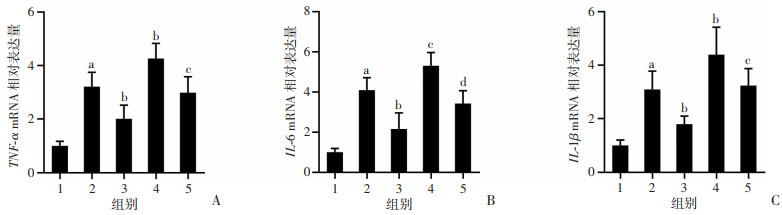
|
|
1:Control组;2:HFD组;3:HFD+CDCA组;4:HFD+Z-Gug组;5:HFD+CDCA+Z-Gug组 A:各组间TNF-α mRNA相对表达量(n=6);a:P < 0.01,与Control组比较;b:P < 0.01,与HFD组比较;c:P < 0.05,与HFD+CDCA组比较;B:各组间IL-6 mRNA相对表达量(n=6);a:P < 0.01,与Control组比较;b:P < 0.01,c:P < 0.05,与HFD组比较;d:P < 0.05,与HFD+CDCA组比较;C:各组间IL-1β mRNA相对表达量(n=6);a:P < 0.01,与Control组比较;b:P < 0.05,与HFD组比较;c:P < 0.01,与HFD+CDCA组比较 图 7 CDCA对高脂饮食诱导小鼠肠道炎性因子表达的影响 |
2.7 CDCA对高脂饮食诱导小鼠肠上皮间淋巴细胞(IELs) 不同亚群比例及CD26/DPP4表达的影响
通过流式细胞术检测小鼠肠道IELs数量及各亚群比例变化(图 8A),结果显示,各组间肠道IELs细胞数量无明显改变(图 8B)。进一步对IELs各亚群比例进行分析,HFD处理后,TCRαβ+IELs、TCRαβ+CD8αα+IELs与TCRαβ+CD8αβ+IELs在IELs中的比例显著升高(P < 0.05,图 8C、E、F),TCRγδ+IELs在IELs中比例显著下降(P < 0.05,图 8D),IELs总CD26/DPP4表达水平显著升高(P < 0.05,图 8G);CDCA干预后,TCRαβ+IELs、TCRαβ+CD8αα+IELs与TCRαβ+CD8αβ+IELs在IELs中的比例较HFD组显著下降(P < 0.05,图 8C、E、F),而TCRγδ+IELs在IELs中的比例及IELs总CD26/DPP4表达显著升高(P < 0.05,图 8D、G)。Z-Gug干预后,对IELs数量、亚群及CD26表达均无明显作用。结果表明,CDCA可能通过调节IELs亚群比例,上调CD26/DPP4表达水平,加速GLP-1降解,进而加重高脂饮食诱导的糖尿病进程。
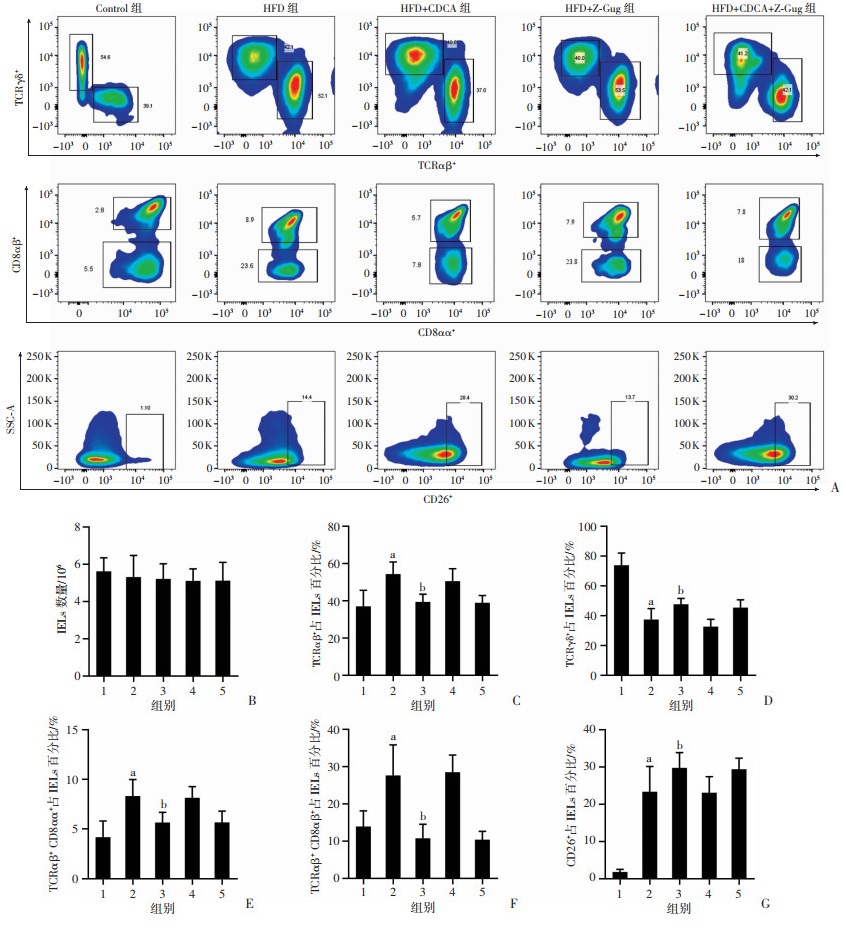
|
|
A:各组间IELs亚群比例及CD26表达变化(n=8);
1:Control组;2:HFD组;3:HFD+CDCA组;4:HFD+Z-Gug组;5:HFD+CDCA+Z-Gug组 B:各组间IELs数量变化;C:各组间TCRαβ+IELs比例变化;a:P < 0.01,与Control组比较;b:P < 0.01,与HFD组比较;D:各组间TCRγδ+IELs比例变化;a:P < 0.01,与Control组比较;b:P < 0.05,与HFD组比较;E:各组间TCRαβ+CD8αα+IELs比例变化;a:P < 0.01,与Control组比较;b:P < 0.01,与HFD组比较;F:各组间TCRαβ+CD8αβ+IELs比例变化;a:P < 0.01,与Control组比较;b:P < 0.01,与HFD组比较;G:各组间CD26表达情况;a:P < 0.01,与Control组比较;b:P < 0.05,与HFD组比较 图 8 CDCA对高脂饮食诱导小鼠肠上皮间淋巴细胞(IELs)不同亚群比例及CD26/DPP4表达的影响(n=8) |
3 讨论
世界卫生组织统计资料表明,我国胰岛素抵抗相关的慢病患者人数已占全球人数的30%,成为影响居民健康的重大公共卫生问题之一[10-11]。本研究发现,CDCA能激活FXR受体,抑制GLP-1分泌。GLP-1是由肠道L细胞分泌的短肽激素,具有能够刺激增强胰岛素分泌、抑制胰高血糖素分泌、维持糖耐量稳态等生物学作用[1]。GLP-1主要被肠道组织中的CD26/DPP4分解[2]。近年来,已有大量研究表明胆汁酸能够作为信号分子参与肠道内分泌、炎症及调节脂类、糖类代谢,参与机体能量代谢[12-13]。CDCA是肠道组织FXR受体的天然配体,研究发现CDCA具有参与调节肠道组织营养代谢的生理作用[14-16]。本研究利用CDCA及FXR受体拮抗剂Z-Gug对高脂喂养小鼠模型进行干预研究发现,CDCA能够通过激活FXR受体上调其表达,抑制Gcg基因表达降低肠道组织GLP-1分泌水平,引起胰岛素抵抗,对于深入认识CDCA对肠道组织营养代谢的调节作用提供了新的依据。
本研究发现,CDCA能通过调节TNF-α表达,促进IELs CD26/DPP4表达,促进GLP-1分解。有研究发现,胆汁酸以及次级胆汁酸具有抑制肠道炎症反应、调节肠道免疫等功能,对预防和治疗慢性疾病引起的炎症具有一定疗效[13]。本实验通过RT-qPCR技术检测肠道炎性因子,提示CDCA能缓解高脂饮食诱导的肠道炎症因子分泌,调节肠道炎症反应,这与WARD等[17]利用小鼠发现胆汁酸能够使肠道炎性因子TNF-α、IL-6、IL-1β分泌水平下降的结果一致。黏膜免疫系统包含了体内最大的免疫细胞储存库[18],其中肠上皮内的免疫淋巴细胞被称为肠上皮内淋巴细胞(IELs)[19]。小肠中肠上皮细胞与IELs细胞的比例约为10 ∶1,这个比例在结肠中较低[20-22]。肠道中IELs可分为TCR+和TCR-亚群[18]。TCR+IELs可分为诱导型(TCRαβ+CD8αβ+)和天然型(TCRαβ+CD8αα+、TCRγδ+CD8αα+/-)IELs。部分IELs亚型及其功能紊乱在T2DM等多种疾病发生中起重要作用[18]。本实验通过流式细胞术分析IELs发现,CDCA干预对小鼠IELs数量无影响,但能够调节高脂饮食诱导的IELs亚群比例,尤其使TCRαβ+CD8αα+与TCRαβ+CD8αβ+IELs比例下降,上调TCRγδ+IEls比例,同时使IELs总体CD26/DPP4表达水平增加。MAVROPOULOS等[23]在研究中发现抗TNF-α干预能够增加CD26/DPP4酶活性及表达,本研究结果与其研究结果一致。因此,CDCA可能通过调节高脂诱导的小鼠肠道TNF-α表达水平,改善IELs亚群比例失调,并上调CD26/DPP4表达水平,加速GLP-1分解,加重胰岛素抵抗。
综上,本研究通过建立高脂饮食喂养的小鼠胰岛素抵抗模型,发现CDCA可能通过激活FXR抑制肠道L细胞GLP-1分泌,同时调节肠道IELs细胞亚群比例及上调CD26/DPP4表达加速GLP-1分解,引起胰岛素抵抗。本研究为防治胰岛素抵抗提供了新的干预靶点和科学依据。
| [1] |
D'ALESSIO D. Is GLP-1 a hormone: whether and when?[J]. J Diabetes Investig, 2016, 7(Suppl 1): 50-55. |
| [2] |
VINCENZO F, MANFREDI T, CARMINE C, et al. CD26: a multi-purpose pharmacological target[J]. Curr Clin Pharmacol, 2014, 9(2): 157-164. |
| [3] |
LEFEBVRE P, CARIOU B, LIEN F, et al. Role of bile acids and bile acid receptors in metabolic regulation[J]. Physiol Rev, 2009, 89(1): 147-191. |
| [4] |
THOMAS C, GIOIELLO A, NORIEGA L, et al. TGR5-mediated bile acid sensing controls glucose homeostasis[J]. Cell Metab, 2009, 10(3): 167-177. |
| [5] |
SUN L L, PANG Y Y, WANG X M, et al. Ablation of gut microbiota alleviates obesity-induced hepatic steatosis and glucose intolerance by modulating bile acid metabolism in hamsters[J]. Acta Pharm Sin B, 2019, 9(4): 702-710. |
| [6] |
TU H, OKAMOTO A Y, SHAN B. FXR, a bile acid receptor and biological sensor[J]. Trends Cardiovasc Med, 2000, 10(1): 30-35. |
| [7] |
SUN L L, XIE C, WANG G, et al. Gut microbiota and intestinal FXR mediate the clinical benefits of metformin[J]. Nat Med, 2018, 24(12): 1919-1929. |
| [8] |
HE S, KAHLES F, RATTIK S, et al. Gut intraepithelial T cells calibrate metabolism and accelerate cardiovascular disease[J]. Nature, 2019, 566(7742): 115-119. |
| [9] |
WONG C K, YUSTA B, KOEHLER J A, et al. Divergent roles for the gut intraepithelial lymphocyte GLP-1R in control of metabolism, microbiota, and T cell-induced inflammation[J]. Cell Metabolism, 2022, 34(10): 1514-1531. |
| [10] |
WANG M, HU R Y, GONG W W, et al. Trends in prevalence of gestational diabetes mellitus in Zhejiang Province, China, 2016-2018[J]. Nutr Metab, 2021, 18(1): 12. |
| [11] |
WANG Z J, WU Y, WU J H, et al. Trends in prevalence and incidence of type 2 diabetes among adults in Beijing, China, from 2008 to 2017[J]. Diabet Med, 2021, 38(9): e14487. |
| [12] |
ARIFUZZAMAN M, WON T H, LI T T, et al. Inulin fibre promotes microbiota-derived bile acids and type 2 inflammation[J]. Nature, 2022, 611(7936): 578-584. |
| [13] |
VÍTEK L. Bile acid malabsorption in inflammatory bowel disease[J]. Inflamm Bowel Dis, 2015, 21(2): 476-483. |
| [14] |
WOLF P G, DEVENDRAN S, DODEN H L, et al. Berberine alters gut microbial function through modulation of bile acids[J]. BMC Microbiol, 2021, 21(1): 24. |
| [15] |
ISER J H, SALI A. Chenodeoxycholic acid: a review of its pharmacological properties and therapeutic use[J]. Drugs, 1981, 21(2): 90-119. |
| [16] |
TINT G S, SALEN G, SHEFER S. Effect of ursodeoxycholic acid and chenodeoxycholic acid on cholesterol and bile acid metabolism[J]. Gastroenterology, 1986, 91(4): 1007-1018. |
| [17] |
WARD J B J, LAJCZAK N K, KELLY O B, et al. Ursodeoxycholic acid and lithocholic acid exert anti-inflammatory actions in the colon[J]. Am J Physiol Gastrointest Liver Physiol, 2017, 312(6): G550-G558. |
| [18] |
OLIVARES-VILLAGÓMEZ D, VAN KAER L. Intestinal intraepithelial lymphocytes: sentinels of the mucosal barrier[J]. Trends Immunol, 2018, 39(4): 264-275. |
| [19] |
CHEROUTRE H, LAMBOLEZ F, MUCIDA D. The light and dark sides of intestinal intraepithelial lymphocytes[J]. Nat Rev Immunol, 2011, 11(7): 445-456. |
| [20] |
POUSSIER P, EDOUARD P, LEE C, et al. Thymus-independent development and negative selection of T cells expressing T cell receptor alpha/beta in the intestinal epithelium: evidence for distinct circulation patterns of gut- and thymus-derived T lymphocytes[J]. J Exp Med, 1992, 176(1): 187-199. |
| [21] |
SUZUKI S, SUGAHARA S, SHIMIZU T, et al. Low level of mixing of partner cells seen in extrathymic T cells in the liver and intestine of parabiotic mice: its biological implication[J]. Eur J Immunol, 1998, 28(11): 3719-3729. |
| [22] |
MASOPUST D, CHOO D, VEZYS V, et al. Dynamic T cell migration program provides resident memory within intestinal epithelium[J]. J Exp Med, 2010, 207(3): 553-564. |
| [23] |
MAVROPOULOS J C, CUCHACOVICH M, LLANOS C, et al. Anti-tumor necrosis factor-alpha therapy augments dipeptidyl peptidase Ⅳ activity and decreases autoantibodies to GRP78/BIP and phosphoglucose isomerase in patients with rheumatoid arthritis[J]. J Rheumatol, 2005, 32(11): 2116-2124. |




