2. 644000 四川 宜宾,重庆医科大学附属儿童医院宜宾医院新生儿科
2. Department of Neonatology, Yibin Hospital Affiliated to Children's Hospital of Chongqing Medical University, Yibin, Sichuan Province, 644000, China
新生儿坏死性小肠结肠炎(neonatal necrotizing enterocolitis,NEC)是新生儿期高发且严重的胃肠道急症。研究报道确贝尔分期>Ⅱa的NEC的新生儿病死率为23.5%[1]。存活的患儿可能会出现短肠综合征、肠衰竭[2]、神经发育异常[3]以及肺部损害[4]等并发症。因此,亟待探索NEC的发病机制以有效防治NEC。目前对于NEC发病机制的研究主要集中于肠道屏障功能障碍及肠道菌群失调等方面[5]。群体感应(quorum sensing,QS)是细菌间交流的一种机制,细菌通过QS系统感知周围细菌密度的变化,协调细菌的群体行为。这种通信过程由QS信号分子介导。自诱导分子-2(Autoinducer-2,AI-2)是QS系统中的一类重要的信号分子[6]。研究表明,AI-2与NEC疾病进展密切相关,急性期NEC患儿肠道AI-2水平降低,恢复期逐步升高[7]。
芳香烃受体(aryl hydrocarbon receptor,AHR)是一种配体依赖的转录因子,广泛表达于肠道多种细胞,经特定配体活化后转运至胞核,参与细胞增殖分化、免疫调节等病理生理过程[8]。研究发现AHR在维持肠道黏膜稳态中具有重要作用[9]。我们前期通过分析NEC患儿手术切除的肠组织,发现NEC患儿肠组织中的AHR较非NEC患儿表达减少,且与病变组织病理评分呈负相关,AHR表达越低,肠道损伤越重[10]。研究表明AHR不仅可以作为环境、饮食中某些化合物的传感器,还能够感知肠道微生物产生的QS信号分子,参与维持肠道屏障功能,实现肠道内稳态[11]。因此,我们推测AI-2可能通过激活AHR减轻NEC肠道组织损伤。本研究通过给NEC新生鼠外源性补充AI-2,以探索AHR在AI-2缓解新生鼠坏死性小肠结肠炎中的作用。
1 材料与方法 1.1 实验动物10只8~10周SPF级C57BL /6J小鼠,体质量18.0~20.0 g(购自重庆医科大学动物实验中心,饲养于重庆医科大学附属儿童医院动物实验中心)。按雌鼠6只、雄鼠4只合笼,合笼后21天小鼠正常分娩,取孕鼠自然分娩的7 d龄新生鼠进行实验,雌雄不拘,体质量约3.0~3.5 g。本研究通过重庆医科大学附属儿童医院动物实验中心伦理审查委员会批准(批准文号:CHCMU-IACUC20230529009)。
1.2 主要仪器、试剂本研究主要采用的仪器和试剂有:AI-2标准液(Omm公司,美国),脂多糖(Sigma公司,美国)。Trizol (湖南艾科瑞生物,中国),反转录和实时荧光定量PCR试剂(TaKaRa公司,日本),引物(北京擎科,中国)。全蛋白提取试剂盒、BCA蛋白含量检测试剂盒(江苏凯基,中国),SDS-PAGE电泳凝胶配制试剂盒(上海雅酶,中国),AHR Rabbit抗体(武汉三鹰,中国),CYP1A1 Rabbit抗体(杭州华安,中国),0.22 μm PVDF膜(Millipore公司,德国)。TNF-α检测试剂盒(北京四正柏,中国),IL-6 ELISA(深圳优品,中国),IL-22 ELISA检测试剂盒(深圳欣博盛,中国)。CFX-96荧光定量PCR仪、电泳仪(Bio-Rad,美国),BioTek Synergy H1酶标仪、低温高速离心机、NanoDrop 2000(Thermo,美国)。
1.3 实验方法 1.3.1 实验动物分组和处理根据随机数字表法将新生7 d的SPF级C57BL /6小鼠分为3组: Control组、坏死性小肠结肠炎组(NEC组),AI-2治疗组(NEC+AI-2组),每组12只。Control组小鼠由母鼠喂养,NEC组和NEC+AI-2组按照WANG[12]、ZOU[13]等的方法诱导NEC模型,幼鼠饲养于温度(36±1)℃、湿度45%~60%的恒温保育箱中,PICC管灌胃配方奶(30~50 μL/g),5次/d(08:00、12:00、16:00、20:00、24:00)。将新生鼠放入缺氧箱,以10 L/min流量向箱内充入100 %氮气,待箱内氧气浓度降至0时开始计时,90 s后将新生鼠取出立即放入4 ℃冰箱中刺激10 min,2次/d(10:00、22:00);LPS (5 mg /kg)灌胃,1次/d;连续3 d。AI-2治疗组NEC建模方法同NEC组,另在配方奶粉中加入AI-2溶液(AI-2终浓度为500 nmol/L)。
1.3.2 建模期间新生鼠一般情况观察观察新生鼠精神状态、活动度、毛色、皮下脂肪厚度、有无腹胀、腹泻、便血等。每日清晨建模前记录每只小鼠体质量、大便性状,每24 h统计各组小鼠生存情况。
1.3.3 新生鼠肠道内容物采集和AI-2活性测量用800μL 2216E液体培养基冲洗每只小鼠的回肠和结肠,并用无菌管收集内容物,涡旋并离心。将粪便沉积物及粪便上清冷冻在-80 ℃。使用哈维弧菌报告菌株BB170检测样品中的AI-2活性。将BB170菌株在2216E液体培养基中生长(30 ℃,18 h),并以1 ∶5 000梯度稀释到新鲜的2216E液体培养基中,作为工作液。然后,将180 μL BB170稀释剂加入96孔测定板中,之后分别将20 μL待测样本、1 μmol/L AI-2标准溶液(阳性对照),和2216E液体培养基(阴性对照) 以加入96孔板以产生200 μL的最终体积,并将板以30 ℃、120 r/min摇动。孵育30 min后,使用BioTek Synergy H1仪器每30 min测量一次生物发光强度,直到阴性对照组的值最小化。样本相对发光度为样本发光值与标准液发光值之比。
1.3.4 新生鼠回肠末端组织HE染色建模结束12 h后将各组小鼠断头处死,取出自十二指肠至直肠段肠管,分离系膜,观察肠道大体形态。取回肠远端约1 cm肠组织立即放入4%多聚甲醛中固定24 h,随后将样品脱水、包埋,并切成4 μm的石蜡切片,经HE染色后,在光学显微镜下观察回肠末端肠道组织病理形态学变化。根据SODHI等[14]所报道的双盲法行肠组织损伤评分:0分,肠道完整无损;1分,远端上皮脱落;2分,绒毛中段脱落;3分,绒毛完全坏死,隐窝保留;4分,肠道透壁性坏死。每例标本观察均3个视野,并取其平均值,评分≥2分确定为NEC。
1.3.5 荧光定量PCR法检测新生鼠回肠组织Ahr、Cyp1a1、Tnf-α、IL-6、IL-22 mRNA的表达量建模结束处死小鼠后,取回肠远端2~3 cm肠组织(约20 mg) 冻存于-80 ℃。Trizol法提取肠组织总RNA,用分光光度计测定每个样本RNA浓度,取1 μg总RNA反转录为cDNA,接着以cDNA为模板扩增Ahr、Cyp1a1、Tnf-α、IL-6、IL-22,Gapdh为内参。qPCR反应条件:95 ℃预变性30 s、95 ℃变性5 s、60 ℃退火30 s,共40个循环。采用2-ΔΔCt法进行目的基因相对表达量分析。引物序列见表 1。
| 基因 | 引物序列(5′→3′) | 长度(bp) |
| Ahr | 正义:ATGTCCATGTATCAGTGCCAG | 21 |
| 反义:CTGCTCAAGTCGGACGAATAG | 21 | |
| Cyp1a1 | 正义:TTTGTGAACCAGTGGCAGGT | 20 |
| 反义:TCTCCGATGCACTTTCGCTT | 20 | |
| Tnf-α | 正义:TTCCGAATTCACTGAGCCTCGAA | 23 |
| 反义:TGCACCTCAGGGAAGAATCTGGAA | 24 | |
| IL-6 | 正义:CCAATTTCCAATGCTCTCCT | 20 |
| 反义:ACCACAGTGAGGAATGTCCA | 20 | |
| IL-22 | 正义:CATACATCGTCAACCGCACCT | 21 |
| 反义:TCCCCGATGAGCCGGACA | 18 | |
| Gapdh | 正义:CTTCTCCTGCAGCCTCGT | 18 |
| 反义:TCATCCACCTCCCCACAGTA | 20 |
1.3.6 酶联免疫法检测新生鼠回肠组织细胞因子蛋白表达水平
从冰箱取出冻存的肠组织,按照1 g组织加入9 mL磷酸盐缓冲液(PBS)的比例加入相应体积的PBS,同时加入对应体积蛋白酶抑制剂(1 ∶1 000),匀浆后离心(4 ℃、14 000 ×g、10 min),取上清,向相应的抗体包被板中每孔加入待测样品100 μL(做好复孔及标准曲线),再向孔中加入100 μL生物素化抗体,微震荡混匀,37 ℃孵育2 h,洗板4次,甩尽孔中残余液体,每孔50 μL加入酶结合物,混匀,37 ℃孵育30 min,洗板4次,避光加入显色液及终止液,使用BioTek Synergy H1仪器测量450 nm吸光值,计算各自标准曲线公式并根据公式计算样本中TNF-α、IL-6、IL-22蛋白含量。
1.3.7 蛋白质印迹法检测新生鼠回肠组织AHR、CYP1A1的蛋白表达水平取20 mg新鲜肠组织置于200 μL组织裂解液(含200 μL Lysis buffer、2 μL PMSF、0.2 μL的蛋白酶抑制剂和2 μL磷酸酶抑制剂)中,匀浆后离心(4 ℃、14 000 ×g、10 min),取上清,BCA试剂盒测定蛋白浓度。将蛋白质溶液与十二烷基硫酸钠样品缓冲液以4 ∶1的比例混合,然后在金属浴中变性10 min。电泳分离变性蛋白并转移至PVDF膜,5%脱脂奶粉在室温下封闭1 h,TBST洗膜3次,在AHR、CYP1A1一抗中4 ℃孵育过夜,次日相应二抗常温孵育1 h,洗膜3次后使用Bio-Rad ChemiDocTM Touch成像系统进行成像。使用Image Lab软件测量目的蛋白与β-actin灰度值比值,相对定量分析目的蛋白表达。
1.4 统计学分析采用SPSS 25.0和GraphPad Prism 9.0软件分析和绘图。采用x±s表示正态分布且方差齐的定量资料;多组间比较采用单因素方差分析,采用LSD法进行组间两两比较;生存分析采用Kaplan-Meier检验。采用Spearman法进行相关性分析。检验水准α=0.05,P < 0.05表示差异有统计学意义。
2 结果 2.1 AI-2改善新生鼠NEC模型体质量及存活率图 1A显示3组新生小鼠肠内容物中的AI-2水平,NEC组新生鼠的肠道中AI-2相对生物发光度低于Control组和NEC+AI-2组(t=-2.723,P=0.047;t=-2.831,P=0.038)。在实验过程中,Control组新生鼠精神、活动度可,无腹胀、腹泻;NEC组新生鼠出现精神萎靡,活动量减少,毛发黯淡,皮下脂肪薄,有明显的腹胀、腹泻,部分出现血便;NEC+AI-2组新生鼠较NEC组小鼠活动量明显增加,毛发较干净,部分小鼠出现腹胀、腹泻。
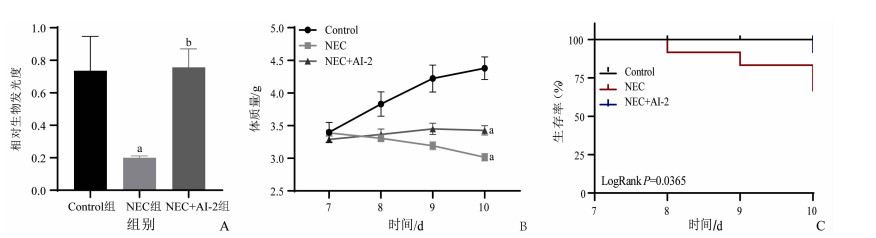
|
| A:肠道内容物中AI-2的相对生物发光度测定结果(n=6);B:小鼠生后第7、8、9、10天体质量变化(n=12);a:P < 0.05,与Control组比较, b: P < 0.05, 与NEC组比较;C:小鼠生后第7、8、9、10天的生存情况(n=12,LogRank P=0.036 5) 图 1 3组小鼠肠内容物中AI-2水平及建模期间一般情况(x±s) |
建模72 h后,NEC组新生鼠建模期间体质量下降明显高于Control组和NEC+AI-2组(t=-7.298,P < 0.001;t=-2.168,P=0.116),见图 1B。NEC组建模期间4只新生鼠死亡(4/12,33.3%),NEC+AI-2组1只小鼠死亡(1/12,8.3%),3组间小鼠生存率具有统计学意义(P=0.036 5),见图 1C。
2.2 AI-2缓解新生鼠NEC模型的肠道损伤肉眼观察可见:Control组新生鼠肠组织外观基本正常,淡黄色,肠腔无扩张,肠壁无水肿、出血、坏死;NEC组新生鼠肠道明显扩张,肠壁水肿、积气呈串珠样改变;NEC+AI-2组有少量积气和水肿,无出血(图 2A)。光镜下观察显示:Control组新生鼠肠上皮细胞排列整齐,绒毛完整,黏膜下层、肌层无水肿、分离;NEC组肠组织结构紊乱,部分绒毛脱落、坏死,固有层及黏膜下层分离,肌层变薄,部分肠段出现透壁坏死;NEC+AI-2组肠组织病理损伤较NEC组明显减轻,结构形态基本正常,绒毛肿胀,无脱落、坏死,固有层、肌层轻度肿胀(图 2B)。病理损伤评分显示,NEC组病理损伤评分明显高于Control组(t=8.281,P < 0.001),AI-2干预后病理损伤评分明显降低(t=-4.140,P=0.003,图 2C)。
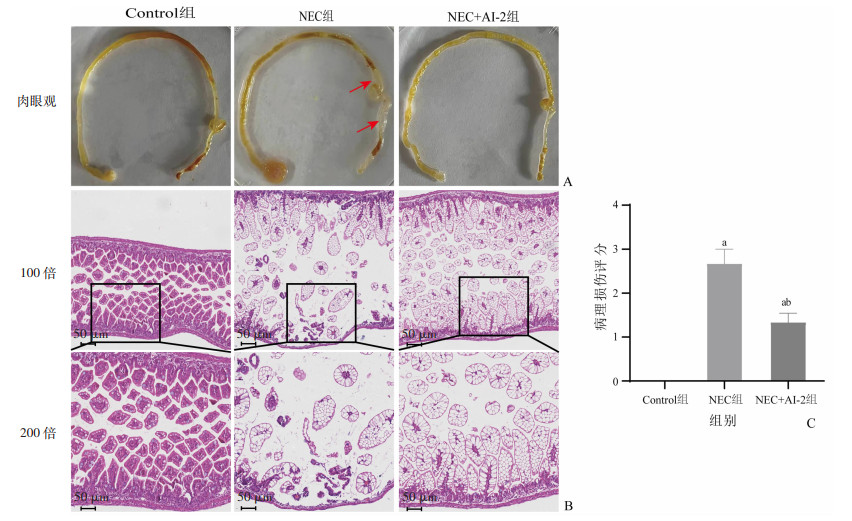
|
| A:小鼠肠组织的大体形态↘:示肠壁积气处肠段;B:光学显微镜观察各组小鼠肠组织的病理改变;C:各组小鼠肠组织病理损伤评分 a:P < 0.05,与Control组比较;b: P < 0.05,与NEC组比较 图 2 3组小鼠肠组织的大体形态和病理学改变(n=6,x±s) |
2.3 AI-2干预后新生鼠NEC模型肠组织中AHR、CYP1A1的表达水平增加
RT-qPCR检测到NEC组Ahr及其下游靶基因Cyp1a1 mRNA的表达水平较Control组明显降低(t=-9.016,P < 0.001;t=-5.411,P < 0.001),NEC+AI-2组中Ahr和Cyp1a1 mRNA的表达水平较NEC组明显升高(t=8.941,P < 0.001;t=5.813,P < 0.001),见图 3A、B。同时,Western blot检测到NEC组AHR和CYP1A1蛋白表达水平较Control组明显降低(t=-3.336,P=0.005;t=-4.532,P < 0.001);NEC+AI-2组AHR和CYP1A1蛋白表达水平较NEC组明显升高(t=3.573,P=0.003;t=6.031,P < 0.001),见图 3C~E。
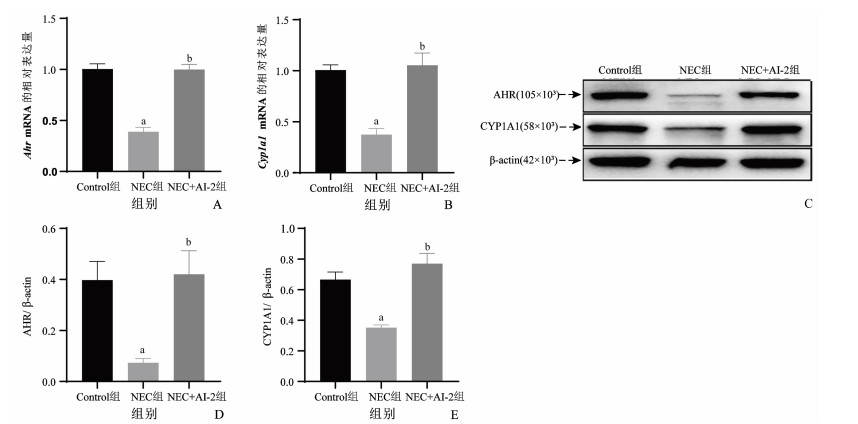
|
| A:各组小鼠肠组织中Ahr基因的表达水平(n=4);B:各组小鼠肠组织中Cyp1a1基因的表达水平(n=6);C:各组小鼠肠组织AHR、CYP1A1、β-actin电泳图;D:各组小鼠肠组织AHR定量分析(n=6);E:各组小鼠肠组织CYP1A1定量分析(n=6) a:P < 0.05,与Control组比较;b:P < 0.05,与NEC组比较 图 3 RT-qPCR和Western blot检测各组小鼠肠组织AHR和CYP1A1的表达水平(x±s) |
2.4 新生鼠肠组织中AHR、CYP1A1表达水平与肠道病理损伤呈负相关
Spearman相关性分析结果显示:AHR和CYP1A1的蛋白表达水平与新生鼠肠组织病理损伤评分呈现显著的负相关关系(P < 0.001,图 4A,4B)。
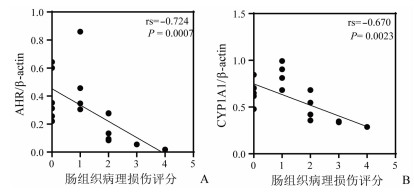
|
| A:各组小鼠肠组织AHR蛋白相对表达量与病理损伤评分的相关性分析(n=18);B:各组小鼠肠组织CYP1A1蛋白相对表达量与病理损伤评分的相关性分析(n=18) 图 4 小鼠肠组织中AHR、CYP1A1表达量与病理损伤评分的相关性分析 |
2.5 AI-2干预调节新生鼠NEC模型肠组织中炎症因子水平
RT-qPCR显示NEC组新生鼠肠组织中炎症因子Tnf-α和IL-6 mRNA水平较Control组明显升高(t=8.149,P < 0.001;t=4.369,P < 0.01),且抑炎因子IL-22 mRNA水平明显下降(t=-4.237,P < 0.01);而NEC+AI-2组新生鼠回肠组织中Tnf-α和IL-6 mRNA水平较NEC组明显降低(t=-8.244,P < 0.001;t=-3.676,P < 0.01),IL-22 mRNA水平上调(t=5.061,P < 0.01),见图 5A~C。ELISA检测新生鼠回肠组织中TNF-α和IL-6蛋白表达水平显示NEC组明显高于Control组(t=7.740,P < 0.01;t=7.373,P < 0.01),IL-22蛋白表达水平下调(t=-6.663,P < 0.001);NEC+AI-2组新生鼠回肠组织中TNF-α和IL-6蛋白表达量较NEC组明显降低(t=-7.922,P < 0.001;t=-7.798,P < 0.001),IL-22蛋白水平上调(t=4.646,P < 0.01),见图 5D~F。
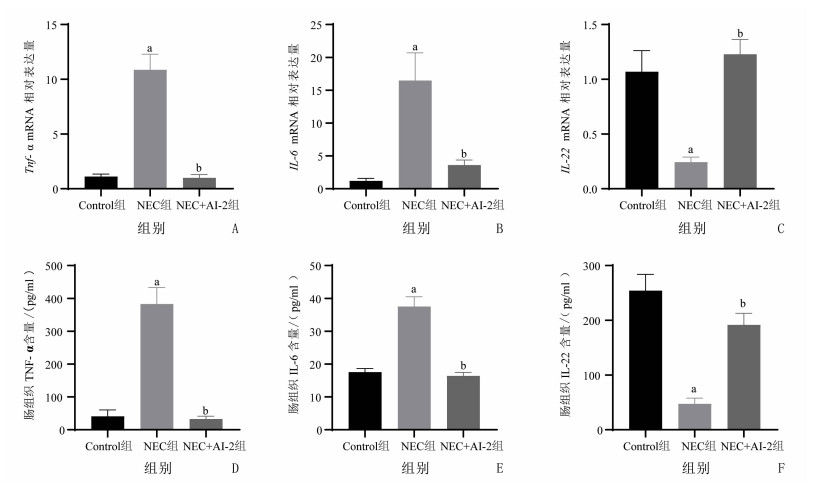
|
| A:各组小鼠肠组织Tnf-α mRNA表达水平(n=5);B:各组小鼠肠组织IL-6 mRNA表达水平(n=5);C:各组小鼠肠组织IL-22 mRNA表达水平(n=5);D:各组小鼠肠组织TNF-α蛋白表达水平(n=4);E:各组小鼠肠组织IL-6蛋白表达水平(n=5);F:各组小鼠肠组织IL-22蛋白表达水平(n=5);a:P < 0.05,与Control组比较;b:P < 0.05,与NEC组比较 图 5 3组小鼠肠组织细胞因子表达水平(x±s) |
3 讨论 3.1 NEC的研究现状
NEC是新生儿中最常见和最严重的胃肠道疾病之一。目前主要的治疗手段包括禁食、胃肠减压、抗生素治疗[15]。然而,约20%~50%的患儿对保守治疗无效,需要进行手术治疗。不幸的是,手术会导致患儿的死亡率显著增加,并且术后可能出现严重的并发症[16]。目前NEC的发病机制尚不完全清楚,也缺乏针对病因的有效治疗手段。现普遍认为肠道屏障功能障碍与NEC发病密切相关[5]。
3.2 AHR参与维护肠道黏膜稳态的机制探讨AHR是维护肠道黏膜稳态的关键调节因子。研究发现,AHR通过调节肠道免疫应答来维持肠道黏膜稳态。例如,LIU等[17]发现黄芩素通过激活AHR调节小鼠肠道Th17/Treg细胞分化,恢复促炎细胞因子和抗炎细胞因子的平衡,从而缓解右旋糖酐硫酸钠(DSS)诱导的结肠炎。LI等[18]也发现通过激活AHR/IL-22途径可以减轻溃疡性结肠炎小鼠的肠道损伤。此外,AHR还参与调控肠道上皮细胞的增殖和修复。SHAH等[19]人研究发现AHR可直接调控结肠上皮细胞分化过程中的关键转录因子,终止再生反应,促进细胞再生后高效、及时的分化,从而控制结肠上皮细胞再生并防止恶性转化。METIDJI等[20]研究也表明肠上皮细胞中Ahr的缺失会促进炎症和结肠肿瘤的发生。综上所述,研究揭示了AHR与肠道健康的密切关系。因此,肠道细胞中的AHR可能是NEC的潜在治疗靶点。
3.3 AI-2在肠道健康中的作用研究研究表明,肠道共生菌释放的一些QS信号分子可以与宿主肠上皮细胞上的受体相互作用,有助于维持肠黏膜的屏障功能,并调节免疫反应[11],揭示了宿主-微生物界面的群体感应信号传递的可能性,对于维持正常的宿主-微生物关系具有重要的影响。AI-2作为细菌间的“公共语言”,有助于促进不同种类细菌之间的信号交流,同时也参与宿主-细菌共生[6]。研究发现,哺乳动物肠道上皮细胞在受损后会产生AI-2类似物刺激细菌的群体感应,在肠上皮修复过程中发挥保护作用[21],ZARGAR等[22]将体外合成的AI-2与肠道上皮细胞共培养,结果显示,在AI-2不同浓度和作用时间下细胞炎症因子的表达发生了动态变化,这些研究结果表明AI-2也可能是一种肠上皮信号分子。近期研究发现,给孕鼠提供富含QS信号分子的饮食,可以激活胎儿肠道中的AHR信号预防新生小鼠发生NEC[23]。综上所述,AI-2具有激活肠道细胞中AHR并参与维持肠道稳态的可能性。
3.4 AI-2可能通过激活AHR减轻新生鼠NEC模型的肠道炎症我们的研究发现,与正常新生鼠相比,NEC组新生鼠模型中AHR、CYP1A1的表达水平均显著降低。同时,AHR的表达水平与活性与小鼠肠道病理损伤程度呈负相关,这一结果与我们课题组前期在NEC患儿手术标本中的发现一致。CYP1A1是体内重要的Ⅰ相解毒酶,也是AHR调控的直接靶基因之一,通过检测CYP1A1的表达水平,可以评估AHR的活性[24]。AI-2干预后,新生鼠NEC模型的一般情况、体质量下降明显好转,存活率增加;且肠组织中AHR和CYP1A1在基因和蛋白水平的表达量都明显增加;促炎因子TNF-α、IL-6的表达降低,抑炎因子IL-22的表达增加。综上所述,本研究表明AI-2可以通过激活肠组织中的AHR来下调促炎因子表达、上调抑炎因子表达,从而减轻新生鼠NEC模型的肠道损伤。在本研究中,关于AI-2激活AHR的机制尚未进行深入研究,AI-2是通过配体的方式直接活化AHR还是通过操纵肠道菌群的行为间接激活AHR,仍需进一步探索。在未来的研究中,可通过运用Ahr-/-动物模型抑制Ahr基因表达或使用AHR抑制剂阻断AHR功能,来进一步验证AHR在AI-2缓解NEC肠道损伤中的重要作用。同时,可以分析各组小鼠的粪便微生物组成和代谢物组成进行分析,以深入挖掘潜在的分子机制。
| [1] |
JONES I H, HALL N J. Contemporary outcomes for infants with necrotizing enterocolitis—a systematic review[J]. J Pediatr, 2020, 220: 86-92. |
| [2] |
OU J, COURTNEY C M, STEINBERGER A E, et al. Nutrition in necrotizing enterocolitis and following intestinal resection[J]. Nutrients, 2020, 12(2): 520. |
| [3] |
MATEI A, MONTALVA L, GOODBAUM A, et al. Neurodevelopmental impairment in necrotising enterocolitis survivors: systematic review and meta-analysis[J]. Arch Dis Child Fetal Neonatal Ed, 2020, 105(4): 432-439. |
| [4] |
HOSFIELD B D, HUNTER C E, LI H G, et al. A hydrogen-sulfide derivative of mesalamine reduces the severity of intestinal and lung injury in necrotizing enterocolitis through endothelial nitric oxide synthase[J]. Am J Physiol Regul Integr Comp Physiol, 2022, 323(4): R422-R431. |
| [5] |
HACKAM D J, SODHI C P. Bench to bedside—new insights into the pathogenesis of necrotizing enterocolitis[J]. Nat Rev Gastroenterol Hepatol, 2022, 19: 468-479. |
| [6] |
WU S B, LIU J H, LIU C J, et al. Quorum sensing for population-level control of bacteria and potential therapeutic applications[J]. Cell Mol Life Sci, 2020, 77(7): 1319-1343. |
| [7] |
FU C Y, LI L Q, YANG T, et al. Autoinducer-2 may be a new biomarker for monitoring neonatal necrotizing enterocolitis[J]. Front Cell Infect Microbiol, 2020, 10: 140. |
| [8] |
PERNOMIAN L, DUARTE-SILVA M, DE BARROS CARDOSO C R. The aryl hydrocarbon receptor (AHR) as a potential target for the control of intestinal inflammation: insights from an immune and bacteria sensor receptor[J]. Clin Rev Allergy Immunol, 2020, 59(3): 382-390. |
| [9] |
GONG S Y, ZHENG J C, ZHANG J J, et al. Arabinogalactan ameliorates benzo[a]pyrene-induced intestinal epithelial barrier dysfunction via AhR/MAPK signaling pathway[J]. Int J Biol Macromol, 2023, 242(Pt 4): 124866. |
| [10] |
ZHANG Y H, YANG L, LU Q. Expression of aryl hydrocarbon receptor in the intestinal tissue of preterm infants with necrotizing enterocolitis[J]. Indian J Pharm Sci, 2023, 85(S5): Spl Issue "22-28". |
| [11] |
KRASULOVA K, ILLES P. Intestinal interplay of quorum sensing molecules and human receptors[J]. Biochimie, 2021, 189: 108-119. |
| [12] |
王雪, 邹谋, 张绍卿, 等. 坏死性小肠结肠炎对新生小鼠脑损伤及其程度的影响[J]. 第三军医大学学报, 2021, 43(17): 1634-1641. WANG X, ZOU M, ZHANG S Q, et al. Effects of necrotizing enterocolitis on brain injury and its severity in neonatal mice[J]. J Third Mil Med Univ, 2021, 43(17): 1634-1641. |
| [13] |
邹谋, 王雪, 余玉娟, 等. 缺氧诱导因子-1α对坏死性小肠结肠炎小鼠脑损伤的保护作用[J]. 陆军军医大学学报, 2022, 44(10): 1001-1008. ZOU M, WANG X, YU Y J, et al. Protective effect of hypoxia-inducible factor-1α on brain injury in mice with necrotizing enterocolitis[J]. J Army Med Univ, 2022, 44(10): 1001-1008. |
| [14] |
SODHI C P, WIPF P, YAMAGUCHI Y, et al. The human milk oligosaccharides 2'-fucosyllactose and 6'-sialyllactose protect against the development of necrotizing enterocolitis by inhibiting toll-like receptor 4 signaling[J]. Pediatr Res, 2021, 89(1): 91-101. |
| [15] |
黄兰, 熊涛, 唐军, 等. 新生儿坏死性小肠结肠炎临床诊疗指南(2020)[J]. 中国当代儿科杂志, 2021, 23(1): 1-11. HUANG L, XIONG T, TANG J, et al. Clinical guidelines for the diagnosis and treatment of neonatal necrotizing enterocolitis (2020)[J]. Chin J Contemp Pediatr, 2021, 23(1): 1-11. |
| [16] |
MOSCHINO L, DUCI M, FASCETTI LEON F, et al. Optimizing nutritional strategies to prevent necrotizing enterocolitis and growth failure after bowel resection[J]. Nutrients, 2021, 13(2): 340. |
| [17] |
LIU C, LI Y Y, CHEN Y P, et al. Baicalein restores the balance of Th17/treg cells via aryl hydrocarbon receptor to attenuate colitis[J]. Mediators Inflamm, 2020, 2020: 5918587. |
| [18] |
LI Y Y, WANG X J, SU Y L, et al. Baicalein ameliorates ulcerative colitis by improving intestinal epithelial barrier via AhR/IL-22 pathway in ILC3s[J]. Acta Pharmacol Sin, 2022, 43(6): 1495-1507. |
| [19] |
SHAH K, MARADANA M R, JOAQUINA DELAS M, et al. Cell-intrinsic aryl hydrocarbon receptor signalling is required for the resolution of injury-induced colonic stem cells[J]. Nat Commun, 2022, 13(1): 1827. |
| [20] |
METIDJI A, OMENETTI S, CROTTA S, et al. The environmental sensor AHR protects from inflammatory damage by maintaining intestinal stem cell homeostasis and barrier integrity[J]. Immunity, 2019, 50(6): 1542. |
| [21] |
ISMAIL A S, VALASTYAN J S, BASSLER B L. A host-produced autoinducer-2 mimic activates bacterial quorum sensing[J]. Cell Host Microbe, 2016, 19(4): 470-480. |
| [22] |
ZARGAR A, QUAN D N, CARTER K K, et al. Bacterial secretions of nonpathogenic Escherichia coli elicit inflammatory pathways: a closer investigation of interKingdom signaling[J]. mBio, 2015, 6(2): e00025. |
| [23] |
LU P, YAMAGUCHI Y, FULTON W B, et al. Maternal aryl hydrocarbon receptor activation protects newborns against necrotizing enterocolitis[J]. Nat Commun, 2021, 12(1): 1042. |
| [24] |
RANNUG A. How the AHRbecame important in intestinal homeostasis-a diurnal FICZ/AHR/CYP1A1 feedback controls both immunity and immunopathology[J]. Int J Mol Sci, 2020, 21(16): 5681. |




