2. 400038 重庆,陆军军医大学(第三军医大学)军事预防医学系复合伤研究所,创伤与化学中毒全国重点实验室;
3. 400038 重庆,陆军军医大学(第三军医大学)基础医学院实验动物学教研室
2. State Key Laboratory of Trauma and Chemical Poisoning, Institute of Combined Injury, Faculty of Military Preventive Medicine, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038, China;
3. Department of Laboratory Animal Sciences, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038, China
天然产物及其衍生物已成为针对多种疾病预防和治疗药物开发的重要来源[1]。柑橘类植物中富含生物活性类黄酮的化合物已引起广泛关注[2]。川陈皮素(nobiletin, NOB)是一种多甲氧基黄酮(polymethoxylated flavonoids, PMFs),主要存在于柑橘、陈皮、橙子和一些杂交橙子的外皮中[2]。研究证实,在多种人类疾病模型中,NOB在调节昼夜节律[3]、调节代谢[4-5]、抗氧化[2, 6]、抗炎[4, 6]等方面发挥积极作用。
另一方面NOB可以调节参与细胞死亡和增殖的信号通路[7-11]。多项研究证实NOB对脑、乳腺、肺、胃、结肠、肝等多种组织来源的癌细胞具有生长抑制和细胞毒性作用[7-8]。影响细胞周期和增殖的药物通常对肠道等更新速度快的正常组织产生副作用。大部分研究结果证实NOB对结直肠癌细胞的IC50在50 μmol/L以上[8],在这个浓度下的NOB是否对快速增殖的正常组织细胞如肠上皮细胞有影响还没有得到确切证实[9]。
肠上皮的更新是由隐窝中肠干细胞(intestinal stem cell, ISC) 池的自我更新和分化来支持的[12]。在体外模型中依靠细胞因子和细胞基质的支持,可实现肠干细胞的培养,最终长成肠道类器官[13-14]。在体肠干细胞的特性可以在肠道类器官中得到较好的保存和模拟,因此它逐渐成为毒理学评价的重要模型[15-16]。本研究采用小鼠小肠类器官给药处理和在体给药处理两种模型,系统观察NOB对肠道干细胞增殖的影响,并初步探讨其相关机制。
1 材料与方法 1.1 材料 1.1.1 小鼠C57/ B6J野生型雄性小鼠,8~10周龄,体质量23~26 g,购自重庆恩斯维尔生物科技有限公司,饲养于SPF房间内,自由饲喂食物和水,生活环境为12 h黑夜和12 h白天,室温22~25 ℃。动物实验均经陆军军医大学动物伦理学评审通过。
1.1.2 试剂DMEM高糖培养基、胎牛血清FBS、DPBS购自Biological Industries公司(美国),青霉素-链霉素、PBS、MTT、EDTA、EGTA、BSA、Penicillin streptomycin solution(100×)购自碧云天公司(中国),胰蛋白酶-EDTA购自Cytiva公司(美国),Zinc Formalin Fixative、BrdU(5-Bromo-2’-deoxyuridine)购自Sigma公司(美国),D-山梨醇购自BBI公司(中国),蔗糖购自科密欧公司(中国),恩诺沙星购自华畜公司(中国),川陈皮素(NOB)购自MCE公司(美国),DMSO、TRIZOL reagent购自Thermo公司(美国),Y-27632 dihydrochloride(ROCK inhibitor)购自Sigma公司(美国),IntestiCultTM Organoid Growth Medium(Mouse)、Chir99021购自STEMCELL公司(加拿大),Advanced D-MEM/F-12(1×)、GlutaMAXTM Supplement(100×)、B-27 Serum-Free Supplement(50×)、N-2 Supplement(100×)购自Gilbco公司(美国)。无水乙醇购自重庆化工公司(中国),柠檬酸盐组织抗原修复液、内源性过氧化物酶阻断剂、酶标免疫组化山羊抗小鼠IgG二抗、酶标免疫组化山羊抗小鼠IgG二抗、PBS缓冲粉末(pH=7.3)、中性树脂、DAB显色剂试剂盒(20×)购自中国北京中杉金桥公司(中国),曲拉通TritonX-100购自索莱宝公司(中国),BrdU购自BD Pharmingen公司,Olfm4XP® Rabbit mAb购自CST公司(美国),羧甲基纤维素钠购自海天生物科技公司(中国),Recombinant Human R-spondin1购自PeproTech公司(美国),MATRIGEL MATRIX High购自Corning公司(美国)。
1.2 方法 1.2.1 药物配制离体实验:使用DMSO溶解NOB成100 mmol/L的母液后冰箱保存备用,使用时使用培养基分别稀释至特定的工作浓度10、25、50、100、200 μmol/L;在体实验:根据小鼠体质量计算每组小鼠的药物使用剂量,给药剂量按100、200、400 mg/kg分别计算,混悬于羧甲基纤维素钠(0.5%)中,灌胃,300 μL/只。
1.2.2 小鼠结肠癌MC38细胞系3D培养MC38小鼠结肠癌细胞系由上海交通大学刘福实验室馈赠。培养板准备:将4 ℃预冷的Matrigel加入96孔培养板中至铺满孔板底部后,37 ℃放置30 min。细胞准备:将可以使用的MC38细胞消化后计数,按每孔10 000细胞、50 μL培养基稀释后,接种于96孔板中,37 ℃、5%CO2,30 min。剩余50 μL培养基,冰浴至0 ℃,按培养基∶Matrigel=19 ∶1加入Matrigel,混匀加入每孔中。37 ℃、5%CO2,培养4 d左右。镜下观察所有细胞成球后开始给药处理,分别给予50、100 μmol/L NOB,同时设置对照组和2‰DMSO溶剂对照组,处理4 d后倒置显微镜拍照,进行四甲基偶氮唑盐(MTT)活性检测、染色和成像处理,统计分析3D球体的成球率及MTT染色后的球体IOD值。
1.2.3 小鼠小肠隐窝类器官培养参考文献[16],在无菌环境下C57BL/B6J野生型小鼠安乐死后,75%乙醇浸泡1 min,取出小肠使用无菌冰DPBS冲出肠道内容物;剖开小肠,进一步涮洗小肠至无明显可见肠内容物。剪成0.5 cm肠段,于放有预冷EDTA螯合液的50 mL离心管中,摇床4 ℃孵育30 min后更换DPBS,冰上静止15 min。利用上下震摇的剪切力使肠隐窝和绒毛分离,70 μm的滤器过滤后离心收集隐窝悬浊液。用0.1%BSA-PBS洗涤离心和计数后用Matrigel重悬,按10 μL的Matrigel含30~50个隐窝接种于96孔板中,37 ℃、5%CO2的培养箱中孵育17~22 min,按100 μL/孔添加含有B-27(Glibco,Cat:17504-044)和N-2(Gilbco,Cat:17502-048)的IntescultTM类器官完全培养基(Stem cell Technologies,Cat:06005)。间隔1 d更换培养基。
1.2.4 NOB体外实验小鼠小肠隐窝在96孔板中培养24 h,然后加入不同浓度的NOB处理72 h;NOB的浓度为10、25、50、100、200 μmol/L。在NOB撤药实验中,在96孔板中培养48 h后,分别给予50、100 μmol/L的NOB处理,24 h或48 h后,更换新的不含NOB的培养基,培养至结束观察。撤药后类器官增长率按公式计算。
在NOB效应挽救实验中,肠道类器官在96孔板中培养48 h,给予50 μmol/L的NOB持续处理,分别联合添加1、2 μg/mL的R-spondin1或2、4 nmol/L的CHIR99021两种药物浓度进行培养,联合处理72 h后进行MTT染色检测;所有处理设置空白对照组及2‰DMSO处理组(Veh)。各组均在药物处理后间隔24 h使用倒置显微镜拍照,并分别统计类器官出芽数及面积。
1.2.5 类器官成像使用EVOS M5000成像系统(ThermoFisher)拍摄类器官。根据以前的报道[16],基于面积和积分光密度(IOD)对经MTT染色的类器官进行成像和分析。
1.2.6 NOB体内实验小鼠习服1~2周后,随机分组,设置对照组及100、200、400 mg/kg的NOB处理组(n=4)。根据小鼠体质量,使用0.5%羧甲基纤维素钠(CMC-Na)混悬NOB,60 Hz、37℃超声水浴30 min,灌胃,每天记录小鼠状态和体质量变化,连续处理4 d,小鼠取材前2 h给予腹腔注射BrdU(100 mg/kg),收集肠道及脏器等后甲醛固定,并制成蜡块保存。
1.2.7 组织病理HE染色将小鼠组织固定、脱水、石蜡包埋后得到3 μm切片。切片在染色前烘干,然后脱蜡并在自来水中漂洗。苏木精染色,分化2~3 min,用酒精伊红复染,梯度乙醇脱水。切片烘干后在二甲苯中透明,通风橱风干、封片;最后用奥林巴斯显微镜拍摄,并统计每组小肠隐窝绒毛比和隐窝底部凋亡小体情况。
1.2.8 免疫组化染色小鼠小肠切片在染色前干燥处理,然后脱蜡并在自来水中漂洗。用柠檬酸缓冲液修复抗原,然后用3%的双氧水阻断。一抗4 ℃孵育过夜,洗涤后加入相应二抗,孵育1 h后进行DAB染色。染色后脱水封片,用奥林巴斯显微镜成像,统计隐窝底部+4位以下Olfm4+和BrdU+的细胞数,并对每组进行统计分析。
1.3 统计学分析生物实验每组至少重复3次,数据以x±s表示,组间差异比较采用非配对t检验及单因素方差分析,使用GraphPad 9.0进行分析。单因素方差分析使用Tukey’s多重检验分析。P<0.05表示差异有统计学意义。用Image-Pro Plus(6.0版)测量器官的面积和累积光密度IOD。
2 结果 2.1 NOB可以抑制3D培养的肠道肿瘤细胞选取小鼠肿瘤细胞MC38模型,进行3D培养成细胞球,采用川陈皮素50、100 μmol/L处理。4 d后,与对照组相比,NOB 50 μmol/L处理组M38球体开始变得松散,细胞球体开始解离,NOB 100 μmol/L处理组出现明显的细胞死亡碎片(图 1A)。统计分析结果显示,NOB处理组MC38细胞系的成球率较对照组显著降低(P < 0.001,图 1B)。在Z轴不同层面上可以更加清晰观察到NOB 50 μmol/L处理后的球体解离(图 1C)。NOB 50 μmol/L处理组MTT染色后克隆平均IOD值也显著低于对照组(P < 0.001,图 1D、E)。
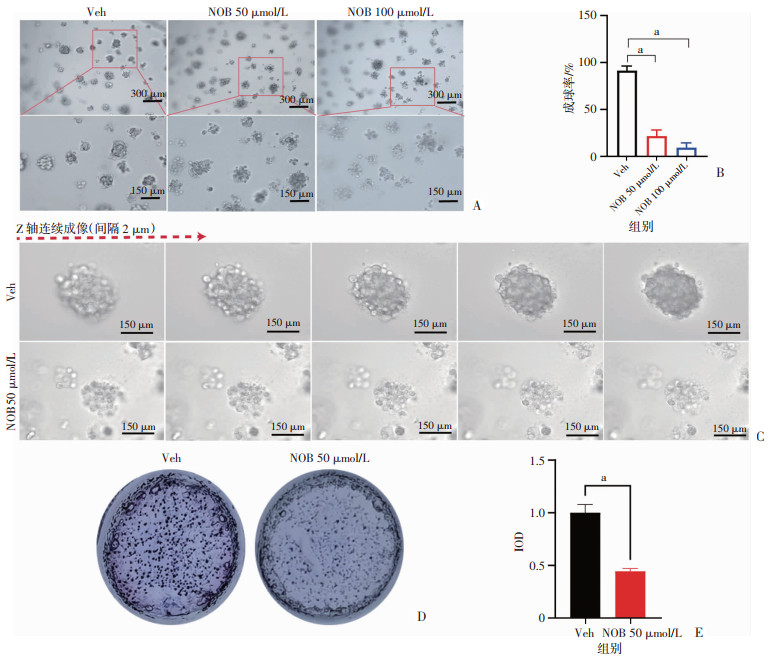
|
|
a:P < 0.001 A:NOB对MC38细胞3D培养系统的影响;B:各组成球率对比统计;C:两组球体Z-轴图像对比(间隔2 μm/图);D:两组对3D培养系统中瘤体MTT活性染色图像;E:D图中两组IOD统计分析 图 1 NOB对3D培养的MC38肿瘤细胞的影响(n=3) |
2.2 抑制肿瘤细胞常规剂量的NOB可以抑制小肠类器官的生长
为检测NOB对小鼠小肠隐窝细胞生长的抑制作用,将小鼠小肠隐窝接种于Matrigel中,24 h后分别加入不同浓度的NOB。进一步孵育24 h后,不同组的类器官呈现不同的表型(图 2A)。对照组中类器官典型的形态是中心圆形绒毛状结构,周围有多个萌芽的隐窝状结构。NOB 50 μmol/L或更高剂量抑制了类器官新芽形成(图 2A),甚至可以是使这些新芽逆转,导致类器官形成囊状结构(图 2A),并降低了出芽率(P < 0.01,图 2B)。经10 μmol/L或25 μmol/L NOB处理的器官仍然是经典的类器官结构(图 2A)。培养48 h后,经200 μmol/L处理的类器官细胞中出现了明显的细胞死亡和崩解(图 2C)。计数克隆数并测定面积后发现,与对照组相比,NOB处理组的类器官平均面积显著减少(P < 0.01,图 2D)。表明常规抑制肿瘤细胞浓度的NOB在体外可以明显抑制肠道干细胞ISC和前体细胞的生长。
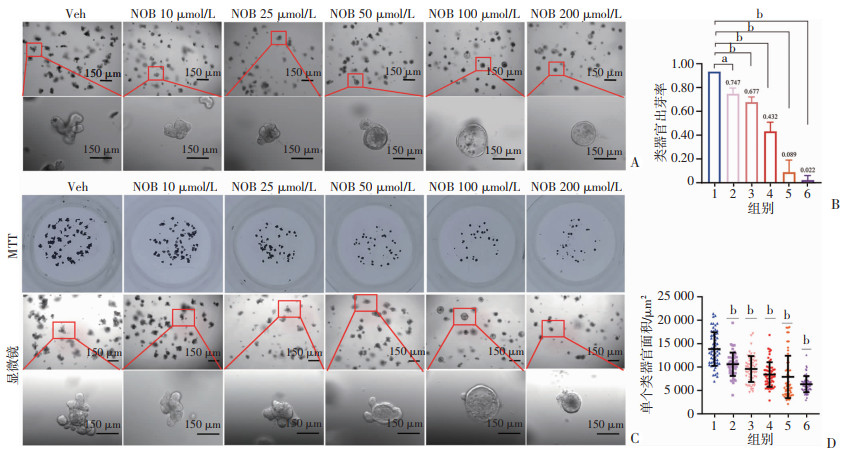
|
|
1:Veh;2:NOB 10 μmol/L;3:NOB 25 μmol/L;4:NOB 50 μmol/L;5:NOB 100 μmol/L;6:NOB 200 μmol/L;a:P < 0.05, b:P < 0.01 A:不同浓度NOB处理肠类器官24 h后出芽情况;B:不同浓度下类器官出芽率的统计(n=3);C:不同浓度NOB处理类器官48 h后类器官图像及MTT染色后类器官克隆情况;D:不同浓度下单个类器官面积分析(n=45) 图 2 NOB对小鼠小肠类器官生长抑制的观察 |
2.3 特定浓度NOB抑制肠道类器官的效应具有时效性
为了进一步探究NOB对肠道干细胞的抑制作用,连续观察NOB 50 μmol/L处理后不同时间点类器官的形态,并追踪单个类器官面积变化。与对照组相比,NOB处理组类器官的形态发生了明显变化(图 3A),并且这种变化伴随着NOB处理而持续存在(图 3A),在类器官增长率上可以看出NOB作用时间越长对类器官的生长抑制影响越明显(图 3B)。在撤药效应观察实验中,在可以明显抑制类器官的浓度50、100 μmol/L下,NOB作用48 h后撤药与持续给药组类器官大小差异不明显,同时NOB处理24 h后撤药组类器官的恢复较48 h撤药组恢复更快(P < 0.05,图 3C~E),但是这种恢复并不能完全逆转NOB的抑制效应(图 3C、E)。这说明NOB对类器官的抑制作用具有时间依赖性,短时间内的抑制作用还可以被纠正,但是随着NOB作用时间延长,其对类器官的抑制作用则难以再被纠正。
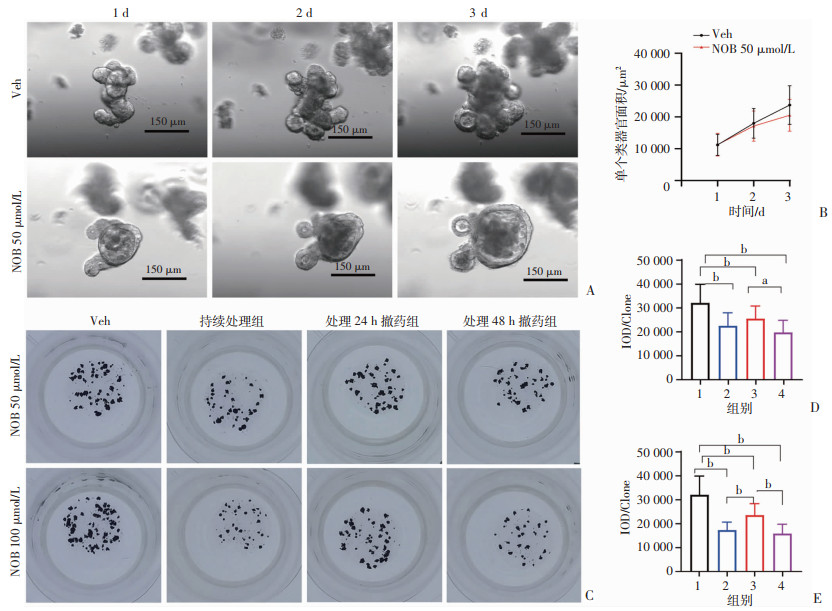
|
|
1:Veh组;2:持续处理组;3:处理24 h撤药组;4:处理48 h撤药组;a:P < 0.05, b:P < 0.01 A:NOB处理后不同时间类器官图像;B:NOB处理后不同时间单个类器官面积变化(n=30);C:MTT活性检测NOB 50、100 μmol/L处理后各组类器官克隆图像;D:NOB 50 μmol/L处理后各组类器官IOD统计分析(n=45);E:NOB 100 μmol/L处理后各组类器官IOD统计分析(n=45) 图 3 NOB对小鼠小肠类器官生长抑制的时效性 |
2.4 特定浓度NOB对肠道干细胞的抑制具有可逆性
不同浓度NOB对类器官的抑制程度不一致,通过撤药实验观察发现,与持续处理组相比,NOB 50 μmol/L处理24 h后撤药组类器官的增长率明显可以得到恢复(P < 0.01,图 4A、B),但是处理48 h后撤药组类器官增长率与持续处理组相比差异无统计学意义(图 4A、B);当NOB浓度升到100 μmol/L时(出芽已经明显抑制),与持续处理组相比,撤药组重新出芽率和单个类器官的出芽数目差异具有统计学意义(P < 0.01,图 4C~E)。这些结果提示在特定浓度NOB处理下,对肠道干细胞抑制是可逆的,即部分活跃的ISC可以变得静止,等NOB祛除后可以快速恢复活跃状态;而高浓度和长时间NOB处理会导致部分ISC的过度静止、分化和衰老等,形成不可逆的抑制。
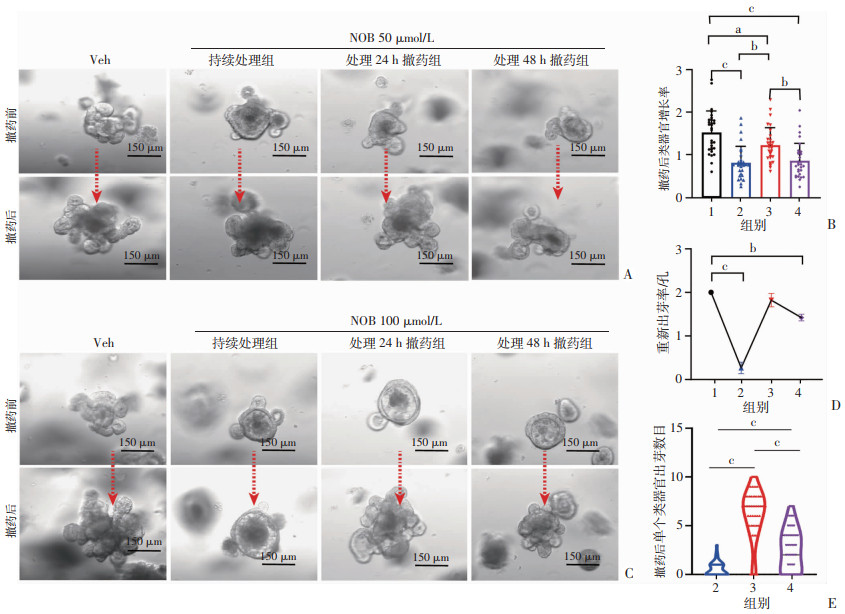
|
|
1:Veh组;2:持续处理组;3:处理24 h撤药组;4:处理48 h撤药组;a:P < 0.05, b:P < 0.01, c:P < 0.001 A:NOB 50 μmol/L处理后各组类器官撤药前后生长情况;B:各组撤药后类器官增长率对比(n=30);C:NOB 100 μmol/L处理后各组类器官撤药前后生长情况;D:各组类器官重新出芽率对比(n=3);E:各组撤药后单个类器官出芽数目统计(n=45) 图 4 NOB对小鼠小肠类器官生长抑制的可逆性 |
2.5 提高Wnt通路可以部分挽救NOB对小肠类器官的抑制效应
为了确定Wnt通路在NOB处理表型中的潜在作用,在类器官培养系统中分别加入R-spondin1和GSK抑制剂(CHIR99021)进行挽救性实验。类器官培养体系中额外加入不同剂量的NOB和R-spondin1(图 5A),与单独NOB处理组相比,R-spondin1(2 μg/mL)会增加类器官的大小,并且差异具有统计学意义(P < 0.01,图 5B);与单独NOB处理组相比,CHIR99021处理也增加了类器官的大小,但是差异无统计学意义(P>0.05,图 5C、D)。然而,在NOB处理组中,Wnt激活剂影响下的类器官大小仍然小于溶剂对照组(P < 0.001,图 5B、D)。表明激活Wnt通路可以部分恢复NOB对类器官中ISC的抑制作用,NOB可以调控多条信号通路抑制ISC。
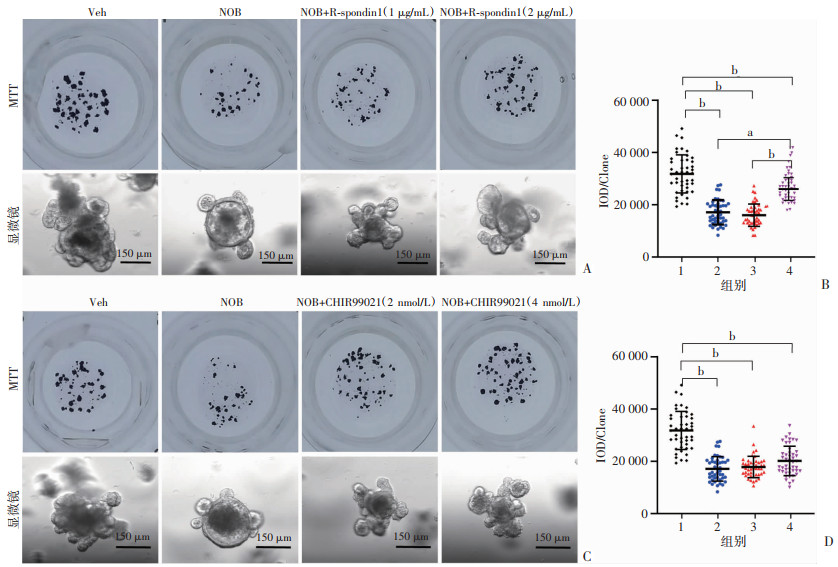
|
|
a:P < 0.01, b:P < 0.001 A:Veh组及NOB联合R-spondin1处理后类器官图像及MTT染色类器官克隆图像;B:单个克隆IOD统计分析 1:Veh;2:NOB;3:NOB+R-spondin1(1 μg/mL);4:NOB+R-spondin1(2 μg/mL);C:Veh组及NOB联合CHIR99021处理后类器官图像及MTT染色类器官克隆图像;D:单个克隆IOD统计分析 1:Veh;2:NOB;3:NOB+CHIR99021(2 nmol/L);4:NOB+CHIR99021(4 nmol/L) 图 5 在类器官培养中提高Wnt通路对NOB抑制效应的挽救作用(n=15) |
2.6 NOB在体模型应用不影响肠道干/祖细胞的增殖
在体内研究中NOB剂量一般为100~200 mg/kg[7-8]。为了进一步测试NOB在体内应用对肠隐窝干、祖细胞动态平衡的影响,采用不同剂量NOB连续给药灌胃小鼠的模型。如HE染色结果所示(图 6A),即使400 mg/kg也不影响隐窝/绒毛长度比(图 6B)。与对照组相比,NOB处理组未见明显的细胞凋亡增加(图 6C、D)。这些结果提示:较高浓度的NOB也不会诱导快速增殖的肠道隐窝干细胞和祖细胞的死亡而降低组织更新能力。BrdU掺入实验显示,不同剂量组NOB处理的隐窝细胞增殖未见明显下降(图 6G、H)。为了进一步评估ISC的数量,进行了ISC标记分子Olfm4的组化染色。各个剂量的NOB处理并不能减少隐窝中低于+4位置的Olfm4+细胞的数量(图 6E、F)。另外,本研究尝试用了最大剂量800 mg/kg,虽然可以促使小鼠体质量下降和死亡,但是对肠隐窝细胞的凋亡和增殖仍无显著影响(数据未显示)。这些结果提示,既往研究中使用的NOB剂量在离体模型中不能有效发挥调控干细胞关键信号的作用来抑制体内肠干/祖细胞的增殖。
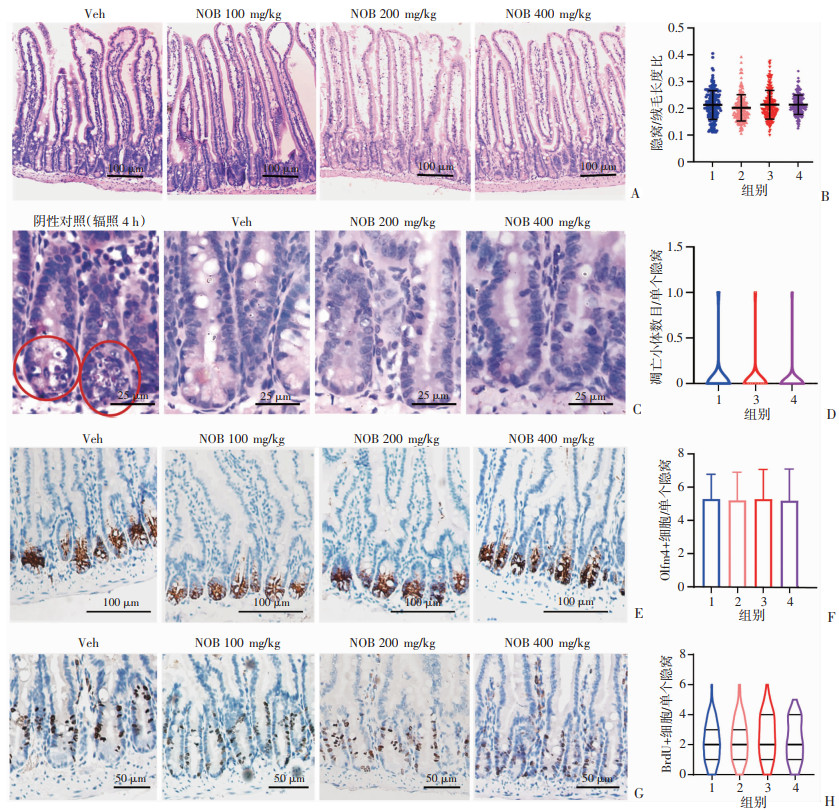
|
|
1:Veh;2:NOB 100 mg/kg;3:NOB 200 mg/kg;4:NOB 400 mg/kg A: HE染色观察各组对肠隐窝干、祖细胞形态;B:各组隐窝/绒毛长度比统计(n=200);C:各组小肠隐窝细胞凋亡小体;D:各组凋亡小体统计(n=100);E:各组Olfm4染色图像;F:各组隐窝底部+4位以下Olfm4+细胞数(n=150);G:各组BrdU染色图像;H:各组隐窝底部+4位以下BrdU+细胞数(n=150) 图 6 NOB在体应用对肠道干、祖细胞存活和增殖的影响 |
3 讨论
NOB生物学活性的多样性使其成为对多种疾病具预防和/或治疗有前景的候选药物,包括炎症、代谢和衰老相关的疾病[17-19]。作为一种食品来源的多甲氧基黄酮类小分子,NOB被认为具有较高的安全性。但是同时,NOB在体外对多种癌细胞系具有抑制作用,主要是诱导细胞凋亡,抑制细胞周期等[7-8, 20-22]。肿瘤细胞的特点之一是不受控的快速增殖,很多抑制肿瘤的药物对正常快速增殖的细胞有影响;在临床中,一些细胞毒性的药物往往对胃肠道有较强的副作用。在评估药物对肿瘤细胞的作用同时,需要同时检测其对正常组织细胞的影响。迄今为止,还没有对NOB正常小肠上皮干细胞的作用进行系统的研究。
人的小肠上皮1周左右更新1次,小鼠的肠上皮更新周期是3~5 d。上皮细胞由隐窝新生然后大部分向上迁徙到绒毛区脱落[23]。位于隐窝底部被潘氏细胞包夹的Lgr5干细胞大部分处于活跃的细胞周期,不断产生前体细胞,供给隐窝-绒毛单位。Lgr5干细胞表达Olfm4、Ascl2等一系列特征性的基因,受到Wnt、Notch、EGF、BMP等信号通路的精确调控[12]。在Matrigel中添加相关的调控因子,可以促使肠干细胞在离体环境中增殖和分化成长为肠道类器官。类器官早期呈囊球状,随着Paneth细胞的分化和Lgr5的扩增会出芽形成新的隐窝结构并不断长大;后续死亡的上皮细胞会在囊状(绒毛区)进行脱落。隐窝出芽和新生的数量代表了Lgr5干细胞的扩增。在本研究模型中NOB处理早期未观察到明显的细胞死亡,晚期观察到的类器官周围的细胞碎片通常与衰老诱导的分化细胞死亡有关,而不是促使ISC或祖细胞的死亡。这让人联想到用100 μmol/L的NOB处理的白血病细胞系模型,NOB没有诱导明显的凋亡,但能有效地抑制细胞生长[24]。值得注意的是,这一剂量范围下,MC38等多种肿瘤细胞也受到了明显的抑制。在诸多体外实验报道中,NOB对肿瘤细胞的抑制剂量集中在50~200 μmol/L[7-8, 20]。本研究结果说明,在这种剂量下,NOB虽然有广泛的肿瘤抑制效果但同时也会影响正常肠上皮干细胞的增殖。
本研究结果显示,NOB在体外模型对ISC有明显抑制作用,进一步在体内测试NOB对ISC的作用。出乎意料的是,即使采用比以往研究[8]大得多的剂量(200~400 mg/kg)也没有对ISC自我更新和隐窝细胞增殖产生明显的抑制作用。另外,剂量如果提高到800 mg/kg会引起小鼠的体质量下降和死亡,但是依然没有引起明显的隐窝细胞凋亡和干细胞数目的减少(数据未显示)。体内模型和体外模型不一致的原因可能有几个。首先,NOB作为一种类黄酮化合物溶解度低,具有亲脂性,在肠道的吸收率较低[25],导致NOB肠道生物利用度较低[26];体内NOB剂量可能达不到体外使用的50 μmol/L浓度[27],使用纳米乳剂可能会增加其吸收[25]。其次,类黄酮化合物多会在回肠吸收后与肠道菌群相互作用最终改变其生物学特性[25]。NOB在体内的代谢可能会改变其有效性。第三,尽管类器官的ISC特征保持良好,但考虑到来自微环境的不同信号,体内仍有一些不同的通路被激活,影响NOB的相关作用。
体外实验结果提示,如果增强Wnt信号强度,对NOB抑制类器官的效应可以部分挽救,这证实NOB确实具有调控ISC维持的关键信号通路的能力,包括下调WNT通路而促进肠干细胞的静止和分化。而这些信号通路同时也是调控肿瘤甚至是肿瘤干细胞的关键通路,NOB对这些通路的调控具有一定的剂量依赖性。而小鼠连续给药的实验结果表明这种剂量效应在在体是很难实现的;这提示如果将来要开发NOB的抑制肿瘤的效应,需要对NOB分子进行进一步改造,降低其对正常干细胞的影响,保留其对肿瘤细胞的抑制和杀伤效能。而目前在肿瘤模型中尤其是在体模型中解释NOB对肿瘤细胞的抑制作用需要非常谨慎,重视离体模型和在体模型的不一致性。另一方面,目前广泛开展的应用NOB进行抗氧化、调控代谢和生物节律、抗衰老等研究是相对安全的,因为在体模型中的极大剂量亦不会对肠上皮干细胞稳态造成影响。但是NOB是否可以通过影响在体小肠隐窝细胞的基因,如抗菌肽分泌、消化吸收等对在体模型的多种表型产生贡献,还需要进一步的研究。
| [1] |
ATANASOV A G, ZOTCHEV S B, DIRSCH V M, et al. Natural products in drug discovery: advances and opportunities[J]. Nat Rev Drug Discov, 2021, 20(3): 200-216. |
| [2] |
WANG Y, LIU X J, CHEN J B, et al. Citrus flavonoids and their antioxidant evaluation[J]. Crit Rev Food Sci Nutr, 2022, 62(14): 3833-3854. |
| [3] |
HE B K, NOHARA K, PARK N, et al. The small molecule nobiletin targets the molecular oscillator to enhance circadian rhythms and protect against metabolic syndrome[J]. Cell Metab, 2016, 23(4): 610-621. |
| [4] |
NGUYEN-NGO C, SALOMON C, QUAK S, et al. Nobiletin exerts anti-diabetic and anti-inflammatory effects in an in vitro human model and in vivo murine model of gestational diabetes[J]. Clin Sci (Lond), 2020, 134(6): 571-592. |
| [5] |
LEE Y S, CHA B Y, CHOI S S, et al. Nobiletin improves obesity and insulin resistance in high-fat diet-induced obese mice[J]. J Nutr Biochem, 2013, 24(1): 156-162. |
| [6] |
ZHANG L, ZHANG X J, ZHANG C, et al. Nobiletin promotes antioxidant and anti-inflammatory responses and elicits protection against ischemic stroke in vivo[J]. Brain Res, 2016, 1636: 130-141. |
| [7] |
HUANG J, CHANG Z S, LU Q Z, et al. Nobiletin as an inducer of programmed cell death in cancer: a review[J]. Apoptosis, 2022, 27(5/6): 297-310. |
| [8] |
CHEN Y Y, LIANG J J, WANG D L, et al. Nobiletin as a chemopreventive natural product against cancer, a comprehensive review[J]. Crit Rev Food Sci Nutr, 2023, 63(23): 6309-6329. |
| [9] |
WALLE T. Methoxylated flavones, a superior cancer chemopreventive flavonoid subclass?[J]. Semin Cancer Biol, 2007, 17(5): 354-362. |
| [10] |
SUN Y, HAN Y H, SONG M Y, et al. Inhibitory effects of nobiletin and its major metabolites on lung tumorigenesis[J]. Food Funct, 2019, 10(11): 7444-7452. |
| [11] |
CHEN J C, CREED A, CHEN A Y, et al. Nobiletin suppresses cell viability through AKT pathways in PC-3 and DU-145 prostate cancer cells[J]. BMC Pharmacol Toxicol, 2014, 15: 59. |
| [12] |
MCCARTHY N, KRAICZY J, SHIVDASANI R A. Cellular and molecular architecture of the intestinal stem cell niche[J]. Nat Cell Biol, 2020, 22(9): 1033-1041. |
| [13] |
SATO T, VAN ES J H, SNIPPERT H J, et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts[J]. Nature, 2011, 469(7330): 415-418. |
| [14] |
WANG F C, SCOVILLE D, HE X C, et al. Isolation and characterization of intestinal stem cells based on surface marker combinations and colony-formation assay[J]. Gastroenterology, 2013, 145(2): 383-395.e1-21. |
| [15] |
MATSUI T, SHINOZAWA T. Human organoids for predictive toxicology research and drug development[J]. Front Genet, 2021, 12: 767621. |
| [16] |
REN J, NIU Z B, LI X Q, et al. A novel morphometry system automatically assessing the growth and regeneration of intestinal organoids[J]. Biochem Biophys Res Commun, 2018, 506(4): 1052-1058. |
| [17] |
YANG X Y, WANG H, LI T, et al. Nobiletin delays aging and enhances stress resistance of Caenorhabditis elegans[J]. Int J Mol Sci, 2020, 21(1): 341. |
| [18] |
MORROW N M, TRZASKALSKI N A, HANSON A A, et al. Nobiletin prevents high-fat diet-induced dysregulation of intestinal lipid metabolism and attenuates postprandial lipemia[J]. Arterioscler Thromb Vasc Biol, 2022, 42(2): 127-144. |
| [19] |
MARTCHENKO A, BIANCOLIN A D, MARTCHENKO S E, et al. Nobiletin ameliorates high fat-induced disruptions in rhythmic glucagon-like peptide-1 secretion[J]. Sci Rep, 2022, 12(1): 7271. |
| [20] |
ASHRAFIZADEH M, ZARRABI A, SABERIFAR S, et al. Nobiletin in cancer therapy: how this plant derived-natural compound targets various oncogene and onco-suppressor pathways[J]. Biomedicines, 2020, 8(5): 110. |
| [21] |
LIU J L, WANG S, TIAN S Q, et al. Nobiletin inhibits breast cancer via p38 mitogen-activated protein kinase, nuclear transcription factor-κB, and nuclear factor erythroid 2-related factor 2 pathways in MCF-7 cells[J]. Food Nutr Res, 2018, 62. |
| [22] |
MORLEY K L, FERGUSON P J, KOROPATNICK J. Tangeretin and nobiletin induce G1 cell cycle arrest but not apoptosis in human breast and colon cancer cells[J]. Cancer Lett, 2007, 251(1): 168-178. |
| [23] |
BARKER N, VAN OUDENAARDEN A, CLEVERS H. Identifying the stem cell of the intestinal crypt: strategies and pitfalls[J]. Cell Stem Cell, 2012, 11(4): 452-460. |
| [24] |
ISHⅡ K, TANAKA S, KAGAMI K, et al. Effects of naturally occurring polymethyoxyflavonoids on cell growth, p-glycoprotein function, cell cycle, and apoptosis of daunorubicin-resistant T lymphoblastoid leukemia cells[J]. Cancer Invest, 2010, 28(3): 220-229. |
| [25] |
JU S N, SHI H H, YANG J Y, et al. Characterization, stability, digestion and absorption of a nobiletin nanoemulsion using DHA-enriched phosphatidylcholine as an emulsifier in vivo and in vitro[J]. Food Chem, 2022, 397: 133787. |
| [26] |
KESHARWANI S S, MALLYA P, KUMAR V A, et al. Nobiletin as a molecule for formulation development: an overview of advanced formulation and nanotechnology-based strategies of nobiletin[J]. AAPS Pharm Sci Tech, 2020, 21(6): 226. |
| [27] |
WU X, SONG M Y, WANG M Q, et al. Chemopreventive effects of nobiletin and its colonic metabolites on colon carcinogenesis[J]. Mol Nutr Food Res, 2015, 59(12): 2383-2394. |





