2. 563000 贵州 遵义,遵义医科大学附属医院消化内科
2. Department of Gastroenterology, Affiliated Hospital of Zunyi Medical University, Zunyi, Guizhou Province, 563000, China
幽门螺杆菌(Helicobacter pylori,H.pylori)是一种螺旋状、微需氧革兰阴性杆菌,主要定植于胃黏膜[1],全球有超过50%的人口感染[2],可导致慢性胃炎和消化性溃疡,甚至胃癌[3-5]。在2021年美国卫生及公共服务部发布的第15版致癌物报告中,H.pylori已被列为明确致癌物,并且H.pylori对临床一线使用的抗生素耐药性仍在逐年增加,使其越来越难被根除[6]。细胞毒素相关基因A (cytotoxin-associated gene A,CagA)是H.pylori最主要的毒力因子之一,与H.pylori感染相关胃炎的发生密切相关[7]。当CagA被注入细胞,其特征性序列谷氨酸-脯氨酸-异亮氨酸-酪氨酸-丙氨酸(Glu-Pro-Ile-Tyr-Ala,EPIYA)基序中的酪氨酸位点会被各种细胞激酶磷酸化,从而引发细胞信号通路活化和细胞病变过程[8]。H.pylori感染诱发的慢性炎症在胃黏膜相关疾病中的发展演变机制尚不十分清楚,但我们认为H.pylori感染引起的胃黏膜免疫反应是一个关键因素。胃上皮细胞是H.pylori感染胃黏膜后菌体最先接触的细胞类型[7],是宿主防御的第一道防线,它还可以通过产生某些炎症性的分子进一步激发免疫反应。本研究中的血管生成素样蛋白4(angiopoietin-like 4, ANGPTL4)就属于这类分子,其在慢性炎症中的免疫病理性功能也受到越来越多的关注。
ANGPTL4也被称为空腹诱导脂肪因子(fasting-induced adipose factor, FIAF)、过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ),是ANGPTL家族(ANGPTL1-8)的成员之一。ANGPTL4主要通过自分泌/旁分泌和内分泌过程发挥其生物学作用[9]。天然全长ANGPTL4 (flANGPTL4) 包含一个分泌信号肽(SP),一个N端卷曲螺旋结构域(CCD)和一个COOH端纤维蛋白原样结构域(FLD)。从细胞分泌后,ANGPTL4在连接区通过前蛋白转换酶(proprotein convertases,PCs)进行蛋白水解,从而释放N端区域(nANGPTL4)和C端部分(cANGPTL4)。cANGPTL4以单体形式存在,可以触发细胞内通路,帮助伤口愈合并支持肿瘤生长和转移。nANGPTL4组装成寡聚结构,这对其作为脂蛋白脂肪酶抑制剂的功能很重要[10-11]。
ANGPTL4蛋白片段的多样性决定了其功能的多样性,研究发现ANGPTL4在心血管疾病[12]、癌症转移[13]、肥胖[14]、糖尿病[15]、伤口修复[16]、炎症[17]等多种疾病中都发挥着作用。本研究旨在明确ANGPTL4在H.pylori感染中的表达情况,阐明H.pylori调控ANGPTL4表达的分子机制,探讨ANGPTL4在H.pylori感染中的潜在功能,为临床探索免疫学调控手段,缓解H.pylori感染引起的胃部病症提供新思路和新靶点。
1 材料与方法 1.1 临床胃镜标本及人体胃组织标本来源H.pylori阳性临床胃镜标本取自陆军军医大学第二附属医院消化内科胃镜室进行胃镜检查的患者。人胃组织标本来自陆军军医大学第一附属医院普外科胃癌患者胃大部切除术取出的距离肿瘤部位至少5 cm处的正常胃组织。所有志愿者为成年,且在标本收集前均已知情同意。人体组织标本实验已经陆军军医大学第一附属医院伦理委员会批准[批件号:(A)KY202220]。
1.2 小鼠来源C57BL/6野生型小鼠购买于陆军军医大学实验动物中心,无病原体条件下饲养。所有动物实验符合陆军军医大学动物使用规范。
1.3 细胞、细菌来源及培养细胞来源及培养:人胃腺癌细胞系(AGS)购自美国ATCC,并于液氮中长期保存,细胞在含有10%胎牛血清的完全DMEM/F12 1∶1培养基中培养。培养条件为37 ℃、5% CO2。
细菌来源及培养:野生型cagA阳性幽门螺杆菌NCTC 11637(WT H.pylori)购自美国ATCC, cagA敲除突变株幽门螺杆菌(△cagA H.pylori)菌种由Chihiro Sasakawa教授(日本东京大学)惠赠。菌种于-80 ℃超低温冰箱中长期保存,培养使用Skirrow血平板(含1.75% 琼脂粉、0.5%葡萄糖、5%兔血),液体培养使用Skirrow液体培养基(含0.5%葡萄糖、10%胎牛血清)。培养条件均为37 ℃、85% N2、10% CO2、5% O2。
1.4 胃类器官培养取人胃组织标本或者小鼠胃体部,用预冷的DPBS清洗后剪碎,将组织碎片用预冷的DPBS吹打重悬,再使其自然沉降于管底,弃掉大部分上清,如此反复清洗5~10次至上清液清亮。加入组织消化液室温消化60 min。清洗后将细胞悬液过滤,调整细胞悬液浓度约为1.6×105/mL。吸取适量细胞悬液与等体积的基质胶混匀,接种到24孔板中心,待基质胶完全凝固向培养孔中加入500 μL培养基[培养基中含50% Wnt3a、Noggin、R-spindin(1 μg/mL)、表皮生长因子(50 ng/mL)、成纤维细胞生长因子-10(100 ng/mL)、胃泌素Ⅰ (10 nmol/L)、1×N2添加剂、10% GlutaMAX添加剂、10 μmol/L Y-27632二盐酸盐],培养条件为37 ℃、5% CO2。
1.5 主要试剂重组人flANGPTL4蛋白(Cat: 4487-AN)和cANGPTL4蛋白(Cat: 3485-AN)均购自R&D Systems公司;兔抗人/小鼠ANGPTL4抗体(Cat: 40-9800)、兔抗人CLDN1抗体(Cat: 37-4900)、山羊抗兔IgG (H+L)高度交叉吸附二抗AF Plus 555(Cat: A32732)、山羊抗兔IgG (H+L)高度交叉吸附二抗AF Plus 488(Cat: A32731)均购自Thermo Fisher Scientific公司;兔抗人/小鼠ANGPTL4抗体(Cat: ab196746)、兔抗人/小鼠胃蛋白酶原Ⅱ/PGC抗体(Cat: ab255826)均购自Abcam公司;兔抗人NF-κB p65/RelA抗体(Cat: 8242)、兔抗人p-NF-κB p65(Ser536)抗体(Cat: 3033)、兔抗人/小鼠GAPDH抗体(Cat: 5174)、兔抗人Lamin B1抗体(Cat: 12586)、兔抗人p-ERK1/2抗体(Cat: 4370)、兔抗人ERK1/2抗体(Cat: 4695)均购自Cell Signaling Technology公司;辣根酶标记山羊抗兔IgG(H+L)二抗(Cat: ZB-2301)、辣根酶标记山羊抗小鼠IgG(H+L)二抗(Cat: ZB-2305)均购自北京中杉金桥公司;细胞因子Wnt3a、Noggin、R-Spindin-1、表皮生长因子、成纤维细胞生长因子-10、胃泌素Ⅰ均购自PeproTech公司;N2添加剂、高级DMEM/F12均购自Thermo Fisher Scientific公司;GlutaMAX添加剂购自GIBCO公司;Y-27632二盐酸盐购自Sigma-Aldrich公司;Matrigel基底膜基质购自Corning公司;荧光定量PCR试剂盒、逆转录试剂盒、总RNA提取试剂购自TaKaRa公司;ECL显色液购自重庆葆光公司;蛋白提取液购自Thermo Scientific公司;BAY 11-7082、U0126、SB203580、JNK inhibitor Ⅱ、Wartmannin、AG490、FLLL32、GSK-3β inhibitor Ⅵ均购自Merck Millipore公司。
1.6 方法 1.6.1 H.pylori感染AGS细胞细菌感染前1 d将AGS细胞按预设好的量铺于无菌细胞培养板中,待细胞充分贴壁(16~18 h)后将培养基更换为完全无抗培养基,待用。将培养在Skirrow血平板上的H.pylori用完全无抗培养基刮洗下来,调整细菌浓度,使用紫外分光光度计测定600 nm处光密度值(OD)。按照1OD≈109 CFU/mL,计算细菌菌液的浓度。根据实验预设的感染复数(MOI=细菌数量:细胞数,如0、10、20、50、100;不同感染复数代表不同细菌浓度)计算出每孔需要的菌液体积,并加入到对应孔内,混匀,置于37 ℃、5% CO2的培养箱中与细胞共同培养至预设的时长(如3、6、12、24 h)。
1.6.2 H.pylori感染胃类器官根据1.3培养出胃类器官,在预冷PBS中收获类器官,并清洗以去除基质胶。用注射器大力吸取类器官以进行机械破坏。随后使用高级DMEM/F12洗涤,在37 ℃条件下与H.pylori在1 mL培养基中共同孵育2 h后,用培养基洗涤1次,以去除未结合的细菌。然后将类器官细胞重新包埋在24孔组织培养板中的基质胶中,并在37 ℃、5% CO2、500 mL培养基中孵育24h。共培养结束后,将基质胶融化并清洗,离心去上清后,用总RNA提取试剂或蛋白提取液提取胃类器官的总mRNA及总蛋白。
1.6.3 H.pylori感染小鼠用WT H.pylori菌液对雌性C57BL/6 WT小鼠连续灌胃5次,每半天1次,共2.5 d。
1.6.4 重组ANGPTL4刺激AGS细胞实验前1 d将AGS细胞铺至24孔细胞培养板中,实验时使用PBS清洗后,更换为新鲜完全无抗DMEM/F12 1∶1培养基,加入人重组flANGPTL4和cANGPTL4蛋白(终浓度均为1 μg/mL),混匀后继续培养24 h,收集总RNA和总蛋白。
1.6.5 信号通路阻断实验实验前16~18 h将AGS细胞铺至细胞培养板中,实验时使用PBS清洗细胞3遍,更换为新鲜无血清无抗生素的基础DMEM/F12 1∶1培养基,按实验预设加入对应信号通路阻断剂BAY 11-7082、U0126、SB203580、JNK inhibitor Ⅱ、Wartmannin、AG490、FLLL32、GSK-3β inhibitor Ⅵ (10 nmol/L) 以及等体积DMSO(对照)处理2 h(37 ℃,5% CO2)。PBS清洗3遍后更换为完全无抗培养基,加入WT H.pylori(MOI=100)或人重组ANGPTL4蛋白(1 μg/mL)与细胞共培养24 h,收集总RNA和总蛋白。
1.6.6 实时荧光定量PCR(Real-Time PCR)实验用TRIzol法提取出H.pylori感染或未感染的AGS细胞以及小鼠胃组织的总RNA,用SYBR Green嵌合荧光法进行实时荧光定量PCR检测对应细胞或组织中ANGPTL4 mRNA的表达情况,引物序列见表 1。通过电泳检验抽提出的总RNA无降解后,使用Nanodrop one微量紫外可见分光光度计测定样本总RNA浓度。将总质量为500 ng的RNA按照逆转录试剂盒操作方法逆转录为cDNA,逆转录体系为10 μL。将获得的cDNA按照SYBR Green嵌合荧光法Real-Time PCR试剂说明进行定量PCR反应。每个样本设复孔取平均值,实验重复3次。使用Bio-Rad CFX Manager、Excel和GraphPad Prism等软件分析实验数据,得出实验结果。
| 基因 | 引物序列(5′→ 3′) |
| 人GAPDH | 上游ACCCAGAAGACTGTGGATGG 下游CAGTGAGCTTCCCGTTCAG |
| 人ANGPTL4 | 上游TGGTTTGGCACCTGCAGCCATTC 下游TGCTGCCATGGGCTGGATCAAC |
| 人CLDN1 | 上游CCGTGCCTTGATGGTGGTTGG 下游CATCTTCTGCACCTCATCGTCTTCC |
| 小鼠Angptl4 | 上游AAAAGATGCACCCTTCAAAGAC 下游CTTGAGCTGAGTCTGCAAACTC |
| 小鼠β-actin | 上游AGTGTGACGTTGACATCCGT 下游GCAGCTCAGTAACAGTCCGC |
1.6.7 蛋白质免疫印迹(Western blot)实验
分别使用RIPA缓冲液和T-PER组织蛋白提取液提取细胞和组织总蛋白,BCA法测定总蛋白浓度,调整样品总浓度一致,每条泳道取10 μL蛋白上样。将样品进行十二烷基磺酸钠-聚丙烯酰(SDS-PAGE) 凝胶电泳,随后利用湿法电转将蛋白转印至PVDF膜上。转膜结束后使用PBST缓冲液充分洗膜,脱脂奶粉溶液室温封闭1 h,加入一抗(兔抗人/小鼠GAPDH抗体、兔抗人/小鼠ANGPTL4抗体均为1∶1 000稀释,兔抗人CLDN1抗体稀释浓度1 μg/mL) 4 ℃过夜。一抗孵育结束充分洗膜后加入辣根过氧化物酶标记的二抗室温孵育1 h。充分洗膜后在Bio-Rad ChemiDoc Touch型化学发光成像系统检测蛋白表达情况,并用ImageLab软件记录和分析成像结果。
1.6.8 免疫荧光(IF)染色实验将石蜡切片60 ℃烘烤脱蜡后恢复至室温,二甲苯中脱蜡。将切片放入浓度由高到低的乙醇溶液中水化,充分清洗后泡入柠檬酸盐缓冲液中加热进行抗原修复。在标本上滴加H2O2溶液封闭内源性过氧化物酶;滴加0.5% Triton X-100-PBS溶液进行固定通透;滴加山羊血清封闭后滴加一抗,切片放入孵育盒中4 ℃过夜;滴加二抗37 ℃孵育1 h;滴加第2种一抗37 ℃孵育2 h后,滴加第2种二抗37 ℃孵育1 h;滴加DAPI溶液进行细胞核染色后用封片液封片。随后置于TCS SP8共聚焦显微镜下观察、采图。
1.7 统计学分析采用SPSS 22.0进行统计分析,数据用x±s表示,组间差异用t检验比较,当方差不同时使用Mann-Whitney U检验进行分析,对于多组比较,采用单因素方差分析。数据分析使用GraphPad Prism(version 5.0)软件,当P < 0.05时认为差异具有统计学意义。
2 结果 2.1 H.pylori依赖毒力因子CagA诱导胃上皮细胞表达ANGPTL4,并且具有细菌浓度和感染时间依赖性通过免疫荧光染色实验发现在H.pylori感染的患者和小鼠胃黏膜中,ANGPTL4主要在胃蛋白酶原Ⅱ阳性的胃上皮细胞中表达(图 1A)。表明在H.pylori感染的胃组织中,胃上皮细胞是ANGPTL4表达的来源细胞。随后用不同感染复数的WT H.pylori (MOI=10, 20, 50, 100)感染胃上皮细胞系AGS,结果显示随着细菌浓度增加,AGS细胞内ANGPTL4在转录和翻译水平的表达量均逐渐增加(P<0.05,图 1B),具有细菌浓度依赖性。H.pylori诱导AGS细胞表达的ANGPTL4也随感染时间(3、6、12、24 h)的增加而逐渐升高(P<0.05,图 1C),具有感染时间依赖性。用WT H.pylori菌株和△cagA H.pylori菌株分别感染AGS细胞(MOI=100,24 h),与未感染组和△cagA H.pylori感染组相比,WT H.pylori感染的AGS细胞在转录和翻译水平的表达显著增加(P<0.05,图 1D)。结果表明,H.pylori依赖毒力因子CagA诱导胃上皮细胞表达ANGPTL4,并且诱导程度与细菌浓度和感染时间相关。
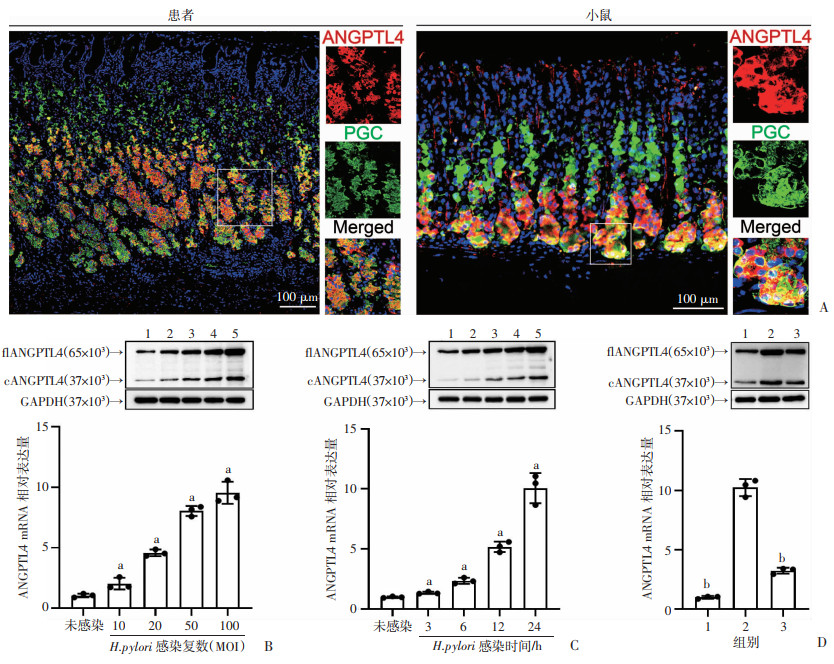
|
|
a:P<0.05,与未感染组比较;b:P<0.05,与WT H.pylori感染组比较 A:免疫荧光染色图像显示H.pylori感染患者或H.pylori感染小鼠胃黏膜中表达ANGPTL4(红色)的胃蛋白酶原Ⅱ阳性胃上皮细胞(绿色);B:WT H.pylori感染AGS细胞在不同感染复数下(24 h)ANGPTL4蛋白及mRNA表达水平(n=3);1:未感染;2~5:分别为MOI 10、20、50、100;C:WT H.pylori感染AGS细胞在不同时间点(MOI=100)时ANGPTL4蛋白及mRNA表达水平(n=3);1:未感染;2~5:分别为感染后3、6、12、24 h;D:不同H.pylori菌株感染AGS细胞(MOI=100,24 h)的ANGPTL4蛋白及mRNA表达水平(n=3);1:未感染;2:WT H.pylori感染;3:△cagA H.pylori感染 图 1 H.pylori感染AGS细胞中ANGPTL4的表达水平 |
2.2 ANGPTL4在H.pylori感染的胃类器官中表达增加
从人和小鼠胃黏膜组织中分离胃腺培养出胃类器官(图 2A、B),并用H.pylori(包括WT H.pylori和△cagA H.pylori)对小鼠和人胃类器官进行感染(24 h)。结果显示,相比于未感染组,WT H.pylori感染组的人或小鼠胃类器官中ANGPTL4 mRNA和蛋白表达显著升高(P<0.05),而△cagA H.pylori感染组ANGPTL4 mRNA和蛋白表达仅略有增加(图 2C、D)。以上结果从3D维度证明,H.pylori依赖毒力因子CagA诱导胃类器官表达ANGPTL4。
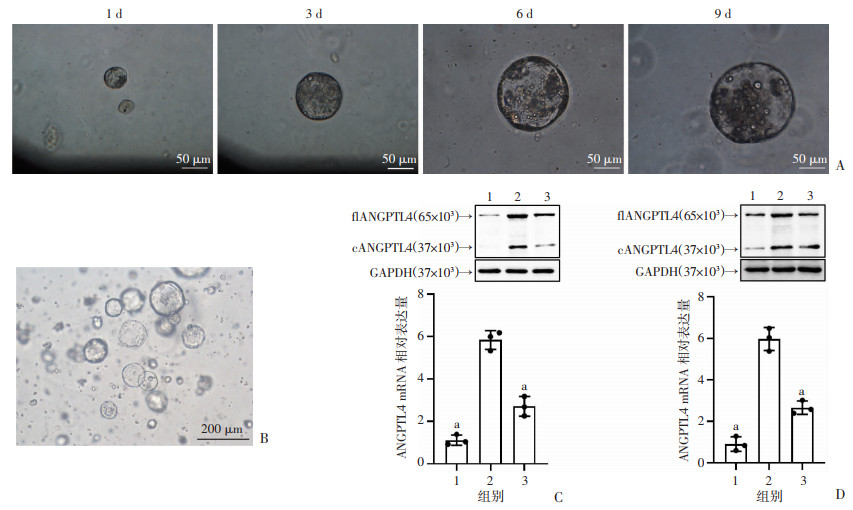
|
|
1:未感染;2:WT H.pylori感染;3:△cagA H.pylori感染;a:P < 0.05,与WT H.pylori感染组比较 A:小鼠胃类器官在培养第1、3、6、9天时的镜下形态;B:人胃类器官在培养第7天时的镜下形态;C、D:不同H.pylori菌株感染人和小鼠胃类器官(24 h)的ANGPTL4蛋白及mRNA表达水平(n=3) 图 2 ANGPTL4在H.pylori感染的人和小鼠胃类器官中表达水平 |
2.3 H.pylori通过磷酸化CagA激活胃上皮细胞中NF-κB通路诱导ANGPTL4表达增加
为了探讨H.pylori诱导胃上皮细胞表达ANGPTL4的潜在调控机制,本研究进行了信号通路阻断实验。结果显示,只有抑制剂BAY 11-7082阻断NF-κB通路的信号传递能有效降低WT H.pylori感染的AGS细胞中ANGPTL4表达(P<0.05,图 3A)。进一步检测CagA作用缺失或者阻断NF-κB通路情况下细胞中ANGPTL4以及相关蛋白的表达情况。结果显示,WT H.pylori感染的AGS细胞中,ANGPTL4表达量和NF-κB通路直接下游底物p65的磷酸化显著增加,且细胞核内磷酸化p65水平也相应增高。但在NF-κB通路抑制剂BAY 11-7082或CagA EPIYA基序磷酸化抑制剂PP2预处理的WT H.pylori感染,以及△cagA H.pylori感染的AGS细胞中ANGPTL4表达、p65的磷酸化以及核内p65的磷酸化均被显著抑制(P<0.05,图 3B、C)。
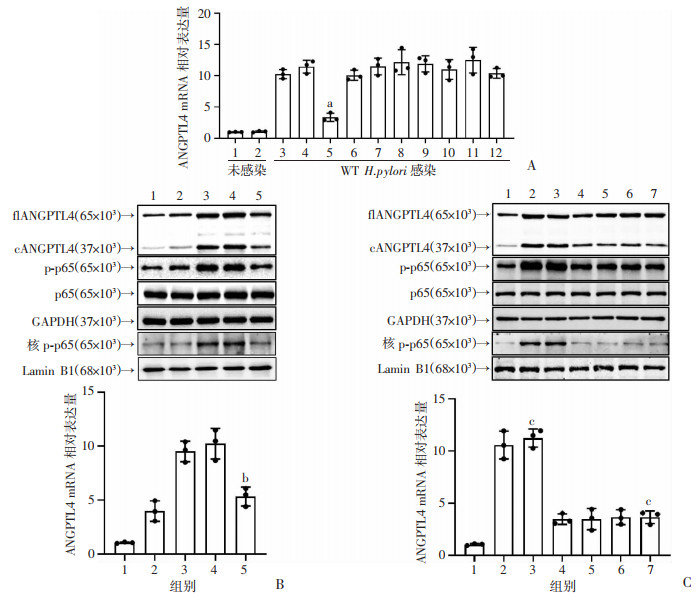
|
| A:WT H.pylori刺激的AGS细胞(预处理或未预处理)中ANGPTL4 mRNA表达水平(24 h,MOI=100,n=3);1:未处理;2:DMSO处理;3:未处理;4:DMSO处理;5:BAY 11-7082处理;6:U0126处理;7:SB203580处理;8:JNK inhibitor Ⅱ处理;9:Wartmannin处理;10:GSK-3β inhibitor Ⅵ处理;11:AG490处理;12:Full32处理;a:P<0.05,与4组比较;B:WT H.pylori或△cagA H.pylori刺激的AGS细胞(BAY 11-7082预处理或未预处理)中ANGPTL4 mRNA表达水平(24 h,MOI=100,n=3)以及相关蛋白表达水平;1:未感染;2:△cagA H.pylori感染;3:WT H.pylori感染;4:WT H.pylori+DMSO;5:WT H.pylori+BAY 11-7082;b:P<0.05,与4组比较;C:WT H.pylori或△cagA H.pylori刺激的AGS细胞(PP2预处理或未预处理)中ANGPTL4 mRNA表达水平(24 h,MOI=100,n=3)以及相关蛋白表达水平;1:未感染;2:WT H.pylori感染;3:WT H.pylori+DMSO;4:WT H.pylori+PP2;5:△cagA H.pylori感染;6:△cagA H.pylori+DMSO;7:△cagA H.pylori+PP2;c:P<0.05,与4组比较 图 3 H.pylori诱导胃上皮细胞表达ANGPTL4的机制 |
2.4 ANGPTL4下调胃上皮细胞密封蛋白CLDN1表达
用重组人flANGPTL4蛋白和cANGPTL4蛋白(1 μg/mL终浓度)处理AGS细胞24 h后,检测胃上皮细胞中CLDN1表达情况。结果显示,相比于对照组,flANGPTL4和cANGPTL4组CLDN1在转录和翻译水平表达减少(P < 0.05,图 4A)。检测WT H.pylori感染、△cagA H.pylori感染或使用BAY 11-7082预处理的AGS细胞中CLDN1蛋白的表达情况。相比于未感染组,WT H.pylori感染能抑制CLDN1蛋白的表达,并且在毒力因子CagA缺失或阻断NF-κB信号通路的情况下,这种抑制作用明显减弱(图 4B)。用信号通路抑制剂实验研究ANGPTL4导致胃上皮细胞CLDN1表达下调的潜在机制,结果显示,只有ERK信号通路抑制剂U0126能抑制flANGPTL4蛋白对CLDN1的这种下调作用(P < 0.05,图 4C),且flANGPTL4和cANGPTL4均能通过ERK磷酸化下调CLDN1 mRNA和蛋白的表达,并在使用U0126预处理AGS细胞后,这种作用被抑制(P < 0.05,图 4D、E)。以上结果均提示,在H.pylori感染期间,表达上调的ANGPTL4是通过激活ERK通路来抑制胃上皮细胞中CLDN1的表达。
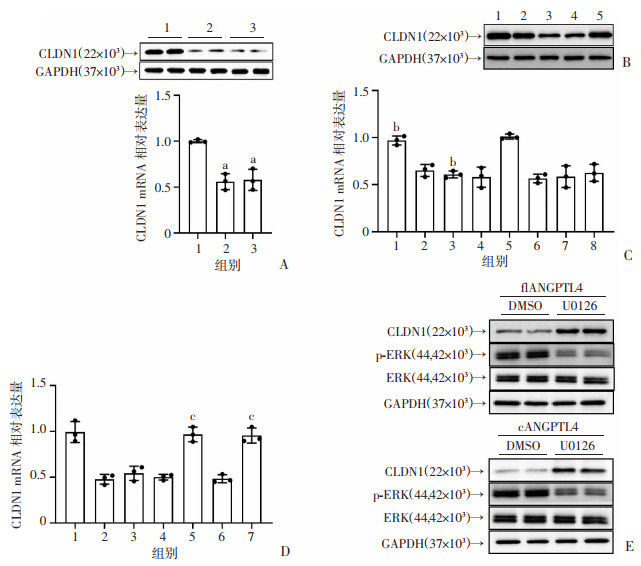
|
| A:人重组ANGPTL4蛋白刺激后AGS细胞中CLDN1 mRNA和蛋白表达水平(n=3);1:未刺激;2:flANGPTL4刺激;3:cANGPTL4刺激;a:P<0.05,与1组比较;B:WT H.pylori或△cagA H.pylori刺激的AGS细胞(预处理或未预处理)中CLDN1蛋白表达水平;1:未感染;2:△cagA H.pylori感染;3:WT H.pylori感染;4:WT H.pylori+DMSO;5:WT H.pylori+BAY-11-7082;C:重组flANGPTL4蛋白刺激的AGS细胞(预处理或未预处理)中CLDN1 mRNA表达水平(24 h,n=3);1:未刺激;2:flANGPTL4刺激;3:DMSO处理+flANGPTL4刺激;4:SB203580处理+flANGPTL4刺激;5:U0126处理+flANGPTL4刺激;6:BAY-11-7082处理+flANGPTL4刺激;7:GSK-3β inhibitor Ⅵ处理+flANGPTL4刺激;8:JNK inhibitor Ⅱ处理+flANGPTL4刺激;b:P<0.05,与5组比较;D:重组flANGPTL4或cANGPTL4蛋白刺激的AGS细胞(预处理或未预处理)中CLDN1 mRNA表达水平(24 h,n=3);1:未刺激;2:flANGPTL4刺激;3:cANGPTL4刺激;4:DMSO处理+flANGPTL4刺激;5:U0126处理+flANGPTL4刺激;6:DMSO处理+cANGPTL4刺激;7:U0126处理+cANGPTL4刺激;c:P<0.05,与1组和4组比较;E:用U0126对AGS细胞预处理,再用重组flANGPTL4或者cANGPTL4蛋白刺激24h后AGS细胞中CLDN1、p-ERK蛋白表达水平 图 4 重组ANGPTL4对AGS细胞中CLDN1表达水平的影响 |
3 讨论
H.pylori感染胃部后,通过粘附素/受体相互作用附着于宿主胃黏膜上皮细胞,并释放多种毒力因子,诱导胃上皮细胞表达炎症性分子,如基质金属蛋白酶MMP10[18]、基质细胞蛋白TINAGL1[19]、核细胞因子ETS1[20]等。这些分子参与调控宿主胃黏膜微环境的免疫反应和慢性胃炎的发生发展,介导宿主防御“失能”及H.pylori感染慢性化。本研究发现H.pylori感染能显著诱导一种新的分泌性蛋白ANGPTL4在胃上皮细胞中表达增高。胃上皮细胞属于细胞单一的二维(2D)细胞模型,而哺乳动物的胃排列着有序的上皮,由内陷的胃单位组成,容纳各种类型的细胞(粘液细胞、泌酸壁细胞、产酶主细胞、增殖细胞和中间细胞群)。类器官是干细胞起源的、自组织的器官特异性细胞的3D集群,能够维持原始器官的功能、分子和细胞异质性[21]。在H.pylori感染机制和炎症的研究中,源自原代细胞的胃类器官在细胞种类和细胞自我组织方面更加贴近人的体内过程[22]。本研究中使用H.pylori感染胃类器官模型在3D层面进一步验证了ANGPTL4在H.pylori感染中的表达情况。以上结果均提示ANGPTL4在H.pylori感染相关胃部病中发挥着重要作用。
毒力因子CagA的细胞内易位是与细胞内各种蛋白相互作用的第一步,可能依赖于磷酸化,也可能独立于磷酸化。磷酸化的CagA可与多种细胞内蛋白相互结合,如Shp-2、AbI激酶等,从而改变宿主细胞内信号[23]。用△cagA H.pylori感染胃上皮细胞时, 其ANGPTL4的表达水平显著低于WT H.pylori菌株感染组,这提示H.pylori主要是通过毒力因子CagA来诱导胃上皮细胞表达ANGPTL4。进一步的抑制剂实验明确了H.pylori是依赖磷酸化的CagA激活NF-κB通路上调胃上皮细胞中ANGPTL4的表达。
H.pylori可以通过破坏上皮细胞之间的紧密连接组分来破坏胃黏膜屏障的完整性,从而使更多菌体得以在宿主胃中停留,促进炎症慢性化[18]。CLDN1是一种紧密连接蛋白,在合并H.pylori感染的胃癌中表达降低[24]。本研究发现H.pylori诱导产生的ANGPTL4能抑制胃上皮细胞中CLDN1的表达。以上研究结果提示,ANGPTL4能通过抑制紧密连接蛋白CLDN1的表达,破坏胃上皮细胞间紧密连接的结构和功能,有助于细菌定植和炎症慢性化。ANGPTL4可与整合素αVβ3结合减轻缺氧导致的血管通透性增加[25]。在HUANG等[26]的一项研究中证明肿瘤组织产生的ANGPTL4与内皮中粘附蛋白和紧密连接蛋白的主要成分整合素α5β1、VE-钙粘蛋白和CLDN5结合,导致内皮细胞的破坏。可见ANGPTL4对细胞间紧密连接的作用不同学者存在不同意见,这可能与ANGPTL4的片段多样性及其表达的组织差异性有关。
H.pylori感染初期胃黏膜淋巴细胞和单核细胞浸润增多,相应的炎症因子IL-1、IL-8和IL-6的表达也显著升高,CD4+和CD8+ T细胞等T淋巴细胞亚群的数量也有所增加。进入持续感染阶段,胃黏膜活检显示各种类型白细胞的浸润都有所增加[27],可见H.pylori感染是一个细胞免疫反应和免疫分子活化的持续刺激的综合作用过程。ANGPTL4起初被视为一种脂肪因子参与脂质代谢和影响葡萄糖稳态[28-30],近年越来越多研究表明ANGPTL4能作为炎症因子参与炎症信号通路的调控[31]。本研究阐明了H.pylori诱导胃上皮细胞表达ANGPTL4的表达调控机制以及ANGPTL4对紧密连接蛋白CLDN1的调控作用,而ANGPTL4在介导胃黏膜免疫反应中的调控机制和效应功能还需要进一步探究。
| [1] |
MARSHALL B J, WARREN J R. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration[J]. Lancet, 1984, 1(8390): 1311-1315. |
| [2] |
SALAMA N R, HARTUNG M L, MVLLER A. Life in the human stomach: persistence strategies of the bacterial pathogen Helicobacter pylori[J]. Nat Rev Microbiol, 2013, 11(6): 385-399. |
| [3] |
DOOLEY C P, COHEN H, FITZGIBBONS P L, et al. Prevalence of Helicobacter pylori infection and histologic gastritis in asymptomatic persons[J]. N Engl J Med, 1989, 321(23): 1562-1566. |
| [4] |
GOODWIN C S, ARMSTRONG J A, MARSHALL B J. Campylobacter pyloridis, gastritis, and peptic ulceration[J]. J Clin Pathol, 1986, 39(4): 353-365. |
| [5] |
PLUMMER M, FRANCESCHI S, VIGNAT J, et al. Global burden of gastric cancer attributable to Helicobacter pylori[J]. Int J Cancer, 2015, 136(2): 487-490. |
| [6] |
BOYANOVA L, HADZHIYSKI P, GERGOVA R, et al. Evolution of Helicobacter pylori resistance to antibiotics: a topic of increasing concern[J]. Antibiotics, 2023, 12(2): 332. |
| [7] |
AMIEVA M, JR PEEK R M. Pathobiology of Helicobacter pylori-induced gastric cancer[J]. Gastroenterology, 2016, 150(1): 64-78. |
| [8] |
ANSARI S, YAMAOKA Y. Helicobacter pylori virulence factor cytotoxin-associated gene A (CagA)-mediated gastric pathogenicity[J]. Int J Mol Sci, 2020, 21(19): 7430. |
| [9] |
SANTULLI G. Angiopoietin-like proteins: a comprehensive look[J]. Front Endocrinol, 2014, 5: 4. |
| [10] |
YIN W, ROMEO S, CHANG S R, et al. Genetic variation in ANGPTL4 provides insights into protein processing and function[J]. J Biol Chem, 2009, 284(19): 13213-13222. |
| [11] |
LEI X, SHI F J, BASU D, et al. Proteolytic processing of angiopoietin-like protein 4 by proprotein convertases modulates its inhibitory effects on lipoprotein lipase activity[J]. J Biol Chem, 2011, 286(18): 15747-15756. |
| [12] |
FOLSOM A R, PEACOCK J M, DEMERATH E, et al. Variation in ANGPTL4 and risk of coronary heart disease: the atherosclerosis risk in communities study[J]. Metabolism, 2008, 57(11): 1591-1596. |
| [13] |
PADUA D, ZHANG X H F, WANG Q Q, et al. TGFβ primes breast tumors for lung metastasis seeding through angiopoietin-like 4[J]. Cell, 2008, 133(1): 66-77. |
| [14] |
KOREK E, KRAUSS H. Novel adipokines: their potential role in the pathogenesis of obesity and metabolic disorders[J]. Postepy Hig Med Dosw, 2015, 69: 799-810. |
| [15] |
SODHI A, MA T, MENON D, et al. Angiopoietin-like 4 binds neuropilins and cooperates with VEGF to induce diabetic macular edema[J]. J Clin Invest, 2019, 129(11): 4593-4608. |
| [16] |
GOH Y Y, PAL M, CHONG H C, et al. Angiopoietin-like 4 interacts with matrix proteins to modulate wound healing[J]. J Biol Chem, 2010, 285(43): 32999-33009. |
| [17] |
GUO L, LI S Y, JI F Y, et al. Role of Angptl4 in vascular permeability and inflammation[J]. Inflamm Res, 2014, 63(1): 13-22. |
| [18] |
LV Y P, CHENG P, ZHANG J Y, et al. Helicobacter pylori-induced matrix metallopeptidase-10 promotes gastric bacterial colonization and gastritis[J]. Sci Adv, 2019, 5(4): eaau6547. |
| [19] |
TENG Y S, XIE R, XU J Y, et al. Tubulointerstitial nephritis antigen-like 1 is a novel matricellular protein that promotes gastric bacterial colonization and gastritis in the setting of Helicobacter pylori infection[J]. Cell Mol Immunol, 2023, 20(8): 924-940. |
| [20] |
TENG Y S, CANG B C, MAO F Y, et al. Expression of ETS1 in gastric epithelial cells positively regulate inflammatory response in Helicobacter pylori-associated gastritis[J]. Cell Death Dis, 2020, 11(7): 498. |
| [21] |
IDOWU S, BERTRAND P P, WALDUCK A K. Gastric organoids: advancing the study of H. pylori pathogenesis and inflammation[J]. Helicobacter, 2022, 27(3): e12891. |
| [22] |
LANCASTER M A, KNOBLICH J A. Organogenesis in a dish: modeling development and disease using organoid technologies[J]. Science, 2014, 345(6194): 1247125. |
| [23] |
TOHIDPOUR A. CagA-mediated pathogenesis of Helicobacter pylori[J]. Microb Pathog, 2016, 93: 44-55. |
| [24] |
CHOI S, KIM N, PARK J H, et al. Effect of Helicobacter pylori infection and its eradication on the expression of tight junction proteins in the gastric epithelium in relation to gastric carcinogenesis[J]. Helicobacter, 2022, 27(6): e12929. |
| [25] |
GOMEZ PERDIGUERO E, LIABOTIS-FONTUGNE A, DURAND M, et al. ANGPTL4-αvβ3 interaction counteracts hypoxia-induced vascular permeability by modulating Src signalling downstream of vascular endothelial growth factor receptor 2[J]. J Pathol, 2016, 240(4): 461-471. |
| [26] |
HUANG R L, TEO Z, CHONG H C, et al. ANGPTL4 modulates vascular junction integrity by integrin signaling and disruption of intercellular VE-cadherin and claudin-5 clusters[J]. Blood, 2011, 118(14): 3990-4002. |
| [27] |
ALGOOD H M, COVER T L. Helicobacter pylori persistence: an overview of interactions between H. pylori and host immune defenses[J]. Clin Microbiol Rev, 2006, 19(4): 597-613. |
| [28] |
KERSTEN S, MANDARD S, TAN N S, et al. Characterization of the fasting-induced adipose factor FIAF, a novel peroxisome proliferator-activated receptor target gene[J]. J Biol Chem, 2000, 275(37): 28488-28493. |
| [29] |
LIU D J, PELOSO G M, YU H J, et al. Exome-wide association study of plasma lipids in >300000 individuals[J]. Nat Genet, 2017, 49: 1758-1766. |
| [30] |
GUSAROVA V, O'DUSHLAINE C, TESLOVICH T M, et al. Genetic inactivation of ANGPTL4 improves glucose homeostasis and is associated with reduced risk of diabetes[J]. Nat Commun, 2018, 9(1): 2252. |
| [31] |
ZUO Y, HE Z, CHEN Y, et al. Dual role of ANGPTL4 in inflammation[J]. Inflammation Res, 2023, 72(6): 1303-1313. |




