2. 400038 重庆,陆军军医大学(第三军医大学)基础医学院细胞生物学教研室
2. Department of Cell Biology, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038, China
慢性肾病(chronic kidney disease,CKD)作为一种不可逆的结构性或功能性肾脏损害,已成为全球范围内危害健康的常见病。终末期肾病是慢性肾病发展的终末阶段,终末期肾病患者开通血透通路的首选方式为动静脉瘘(arteriovenous fistulas,AVF)。然而随着使用时间增长,AVF瘘口静脉端可能因血管新生内膜增生及血栓形成逐渐狭窄。近年来的报告显示,AVF的1年通畅率为60%,2年降到51%[1]。血管内皮细胞损伤引起的新生内膜增生和血栓形成,是导致血管狭窄的主要原因之一[2]。因此,预防新生内膜增生以提高AVF通畅率对患者至关重要。
舒洛地特(sulodexide,SDX)是从猪肠黏膜中提取的高度纯化的糖胺聚糖混合物,由80%的硫酸肝素和20%的硫酸皮肤素组成,具有抗血栓、抗炎、抑制细胞增殖等作用[3-6]。舒洛地特对血管具有保护作用,在临床上已被应用于糖尿病肾病、慢性动静脉疾病[5-6]的辅助治疗。然而,舒洛地特是否可用于阻止慢性肾病患者AVF新生内膜增生过程并不清楚。
YAP是Hippo信号通路的转录因子,Hippo通路通过调节细胞增殖、分化和迁移,在发育过程中控制器官大小和形态发生[7-8]。在动脉损伤模型中,YAP的异常调控能引起血管新生内膜增生和血管狭窄[9]。舒洛地特是否可通过调控YAP发挥作用也不清楚。作为安全有效的治疗药物,本研究希望了解舒洛地特是否可对CKD患者新生内膜增生发挥作用并探究其作用机制,为临床防治动静脉瘘术后血管狭窄提供新的治疗方案。
1 材料与方法 1.1 材料与试剂本实验采用的材料与试剂有:舒洛地特(意大利Alfasigma公司);胎牛血清(FBS,美国Hyclone公司);青-链霉素(中国碧云天);苏木精-伊红染液(C0105S,中国碧云天);CCK-8(BG0025,中国葆光公司);一抗:YAP(BS9920m,美国Bioworld公司);phosphor-YAP(BS94007,美国Bioworld公司);间充质细胞标志分子(connective tissue growth factor,CTGF,BS7445,美国Bioworld公司);CD31(BS7445,美国Bioworld公司)。辣根过氧化物酶标记山羊抗兔IgG(A0208,中国碧云天);辣根过氧化物酶标记山羊抗鼠IgG(A0216,中国碧云天);Cy3标记的山羊抗兔IgG(A0516,中国碧云天)。
1.2 实验动物与分组成年雄性SD大鼠18只,体质量(300±50)g(陆军军医大学动物实验中心提供)。依据随机数字法将大鼠分为3组,每组6只。① AVF组,正常大鼠(Ctl)进行AVF手术;②慢性肾病组(CKD+AVF组):大鼠经诱导慢性肾病后进行AVF手术+与3组等体积生理盐水灌胃2月;③舒洛地特组(CKD+AVF+SDX组):大鼠经诱导慢性肾病后进行AVF手术+8 mg/(kg·d)SDX灌胃2月。CKD模型和AVF手术建立参考已有文献进行[10],通过对大鼠进行尾尖静脉采血检测血清尿素氮(blood urea nitrogen,BUN)和血清肌酐(serum creatinine,Cr)确认CKD模型建立成功后进行AVF手术。
1.3 样本的收集与固定于AVF术后8周进行标本采集,整个过程在异氟醚麻醉下进行,麻醉成功后将大鼠以仰卧位固定,暴露颈部动静脉瘘并在两端结扎,取血管组织,完成采集。采集的血管用生理盐水冲洗管腔后置于4%多聚甲醛固定液中4 ℃过夜固定,经各级浓度的乙醇逐步脱水后放入二甲苯透明,再进行浸蜡、包埋和切片等操作。用于电镜观察的标本,在生理盐水冲洗后用2.5%戊二醛进行固定。
1.4 HE染色石蜡切片经烤片、脱蜡、水合后用苏木精染色5 min,蒸馏水洗涤3次后用伊红染色2 min,再经脱水、透明,最后用中性树脂封片,在光学显微镜下观察。
1.5 免疫荧光切片脱蜡、复水,在抗原修复液中100 ℃抗原修复10 min,经1.5%H2O2和50%甲醇淬灭内源性过氧化物酶活性15 min,0.3%Triton X-100/PBS通透20 min,免疫染色封闭液封闭1 h,4 ℃下滴加一抗孵育过夜,室温下孵育相应的二抗1 h,然后滴加DAPI孵育5 min,在荧光显微镜下观察拍照。
1.6 细胞培养和处理内皮细胞株EAHy926(人脐静脉细胞融合细胞)购自美国细胞培养物收藏中心(American type culture collection,ATCC),用含10%胎牛血清、100 U/mL青霉素和0.1 mg/mL链霉素抗生素的DMEM培养基在37 ℃、5%CO2培养箱中传代培养,每48 h更换一次培养液。EAHy926接种且细胞融合70%左右,无血清处理后,按不同分组进行处理。细胞分组如下:①对照组(Ctl)、②CKD大鼠血清处理组(CKD serum)、③ CKD大鼠血清+舒洛地特处理组(CKD serum+SDX)、④CKD大鼠血清+维替泊芬处理组(CKD serum+VP)。对照组培养基中加入正常大鼠血清含量为10%,CKD大鼠血清处理组为培养基中加入CKD大鼠血清含量为10%,共处理组均先加入CKD大鼠血清1 h后再加入舒洛地特(2.5 μg/mL)或VP(0.25 μmol/L)[11],继续培养24 h。
1.7 细胞增殖检测细胞以2 000/孔的密度接种于96孔板,分别给予不同浓度(0、2.5、5、10、20、40 μg/mL)舒洛地特处理24 h,再以2.5 μg/mL浓度分别处理24、48和72 h,每组设置3个复孔,同时设空白对照组。处理后加入10 μL细胞计数试剂盒-8(Cell Counting Kit-8,CCK-8)试剂孵育2 h,在酶标仪450 nm波长下测定各孔吸光度。细胞存活率=(实验组-空白组)/(对照组-空白对照组)×100%。
1.8 蛋白印迹检测处理后的细胞用RIPA裂解液冰上裂解5 min,刮取细胞裂解液于EP管中,4 ℃下以5 000× g离心5 min,收集上清进行蛋白质浓度测定,然后加入上样缓冲液,100 ℃加热5 min后变性。在10% SDS-PAGE电泳凝胶的上样孔中加入20 μg样品,以70 V的恒压条件浓缩40 min,120 V的恒压条件分离80 min后,转移到硝酸纤维素膜上,室温封闭1 h。进一步在4 ℃分别进行GAPDH(1 ∶3 000)、YAP(1 ∶1 000)、pYAP(1 ∶1 000)、CD31(1 ∶1 000)和CTGF(1 ∶1 000)一抗孵育过夜,用TBSTw(Tris-Buffered Saline Tween-20)洗膜5 min×3次,与辣根过氧化物酶(HRP)偶联的二抗(1 ∶3 000),室温孵育2 h,TBSTw洗膜5 min×3次。按ECL显影液说明书显影,放入化学发光仪中成像。
1.9 统计学分析实验均重复至少3次,数据均以x±s表示。采用GraphPad Prism 8进行统计分析并制图,两组之间比较采用t检验,多组间比较采用单因素方差分析,以P < 0.05为差异有统计学意义。
2 结果 2.1 CKD大鼠模型构建为探讨SDX在CKD大鼠血管内膜增生中的作用,本研究首先对大鼠进行CKD造模。与未进行AVF手术前的正常对照(Ctl)组大鼠相比,CKD大鼠血清尿素氮和血清肌酐显著升高(P < 0.05,图 1),表明CKD大鼠建模成功。
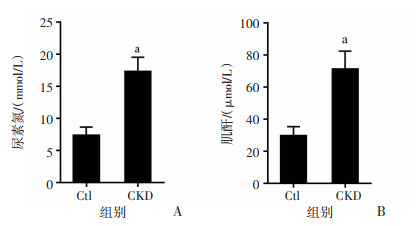
|
| a:P < 0.05,与Ctl组比较 图 1 5/6肾切除术诱导慢性肾病后大鼠尿素氮(A)及肌酐(B)检测结果(x±s,n=6) |
2.2 舒洛地特抑制CKD大鼠AVF术后血管内膜增生
CKD建模成功后,对各组大鼠进行AVF手术,术后进行SDX灌胃,2个月后检测血管新生内膜厚度。HE染色结果显示CKD+AVF组血管新生内膜较AVF组明显增厚,管腔与内膜面积比降低(P < 0.05);在SDX灌胃处理后,与CKD+AVF组相比,CKD+AVF+SDX组血管新生内膜增厚程度减轻,管腔与内膜面积比有明显提升(图 2)。
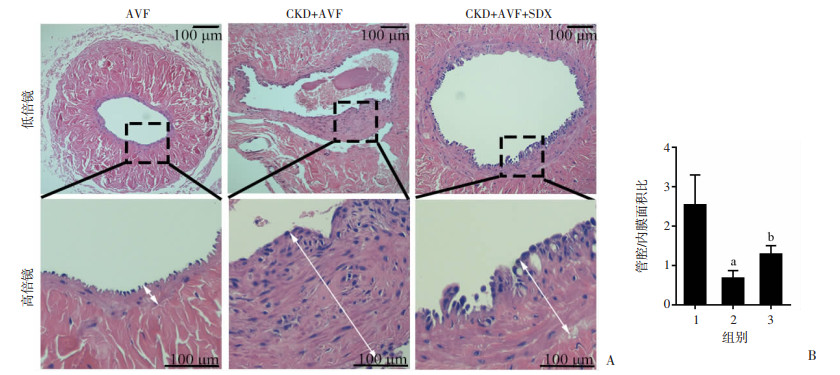
|
| A:大鼠AVF组织切片HE染色←→:示内膜厚度;B:血管管腔与内膜面积用ImageJ软件测量后的比值(x±s,n=6) 1: AVF; 2:CKD+AVF; 3: CKD+AVF+SDX; a:P < 0.05,与AVF组比较;b:P < 0.05,与CKD+AVF组比较 图 2 CKD大鼠AVF术后新生内膜增生检测 |
2.3 舒洛地特抑制CKD诱导的YAP信号激活
为探讨SDX抑制新生内膜增殖是否与YAP有关,采用免疫荧光检测了CKD大鼠AVF术后静脉YAP及其下游靶分子CTGF的表达(图 3)。与AVF组相比,CKD+AVF组大鼠AVF瘘口内膜和内皮细胞均表达YAP和CTGF,且内皮细胞中YAP和CTGF的荧光强度显著增强,而YAP磷酸化水平下调,即pYAP荧光强度降低。舒洛地特灌胃后,与CKD+AVF组相比,CKD+AVF+SDX处理组AVF瘘口YAP和CTGF的表达降低,YAP磷酸化水平明显升高。表明CKD通过降低YAP磷酸化水平激活YAP信号,引起了CTGF表达;而舒洛地特对YAP信号的激活起到阻止作用。
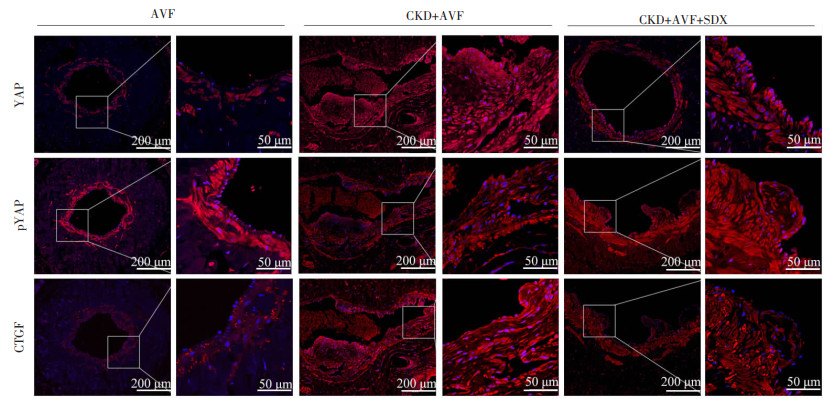
|
| AVF:正常大鼠进行AVF手术;CKD+AVF:大鼠经诱导慢性肾病后进行AVF手术+生理盐水灌胃2月;CKD+AVF+SDX:大鼠经诱导慢性肾病后进行AVF手术+8 mg/(kg·d)SDX灌胃2月。 图 3 免疫荧光检测大鼠AVF瘘口YAP和CTGF的表达 |
2.4 舒洛地特影响EAHy926细胞存活率
为了进一步探讨舒洛地特的作用机制,本研究培养了人内皮细胞株EAHy926细胞,首先以不同浓度的SDX(0、2.5、5、10、20、40 μg/mL)处理细胞,检测细胞存活率。CCK-8检测结果显示,在SDX处理24 h后,随着SDX浓度的增加,细胞存活率逐渐降低。与0 μg/mL相比,舒洛地特浓度为2.5 μg/mL时,细胞存活率降到80%(P < 0.05,图 4A),在2.5~20 μg/mL浓度之间,细胞存活率无明显变化,直到40 μg/mL的浓度才出现明显抑制。进一步检测2.5 μg/mL SDX处理后24、48、72 h的细胞存活率,结果发现随SDX处理时间增加,EAHy926细胞存活率也随之降低。与0 h处理组相比,72 h组EAHy926细胞存活率受到显著抑制(P < 0.05,图 4B)。因此,为保证SDX处理效果,后续实验选择细胞存活率为80%时2.5 μg/mL舒洛地特处理24 h。
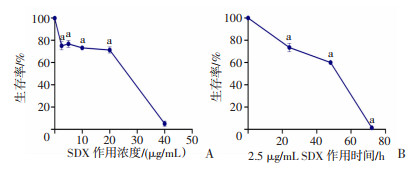
|
| A:不同浓度舒洛地特处理24 h后EAHy926的存活率 a:P < 0.05,与0 μg/mL比较;B:2.5 μg/mL的舒洛地特处理不同时间后EAHy926的存活率 a:P < 0.05,与0 h比较 图 4 舒洛地特对EAHy926的存活率的影响(x±s,n=3) |
2.5 舒洛地特抑制CKD诱导的EAHy926细胞YAP信号激活
在体外细胞实验过程中,利用CKD大鼠血清处理内皮细胞。蛋白印迹结果表明,与用正常大鼠血清处理细胞(Ctl组)相比,CKD大鼠血清诱导了内皮细胞YAP和CTGF的表达,降低了YAP磷酸化水平(P < 0.05,图 5)。与CKD serum组相比,加入SDX处理后,CKD serum+SDX组内皮细胞YAP和CTGF的表达降低,YAP磷酸化水平明显升高(P < 0.05,图 5),与免疫荧光实验结果一致。本研究进一步在CKD大鼠血清处理基础上加入YAP信号阻断剂VP,与CKD serum组相比,VP处理后(CKD serum+VP组)中YAP表达显著降低,YAP磷酸化水平明显升高,CKD血清诱导的CTGF表达几乎被阻断。CDK大鼠血清处理后的YAP、pYAP和CTGF表达在加入SDX或VP后呈现一致的趋势。
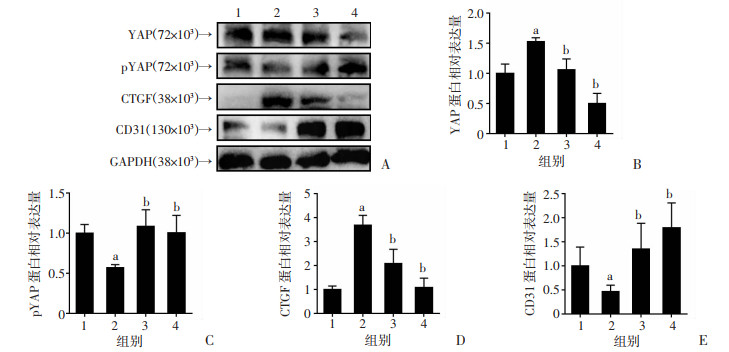
|
|
1:Ctl,培养基中加入正常大鼠血清含量为10%;2:CKD serum,培养基中加入CKD大鼠血清含量为10%;3:CKD serum+SDX,培养基中加入CKD大鼠血清1 h后再加入SDX(2.5 μg/mL);4:CKD serum+VP,培养基中加入CKD大鼠血清1 h后再加入VP(0.25 μmol/L) A:蛋白印迹检测EAHy926细胞内皮间质化相关分子表达;B:YAP蛋白表达的量化分析;C:pYAP蛋白表达的量化分析;D:CTGF蛋白表达的量化分析;E:CD31蛋白表达的量化分析 a:P < 0.05,与Ctl组比较;b:P < 0.05,与CKD serum组比较 图 5 舒洛地特阻止CKD大鼠血清诱导EAHy926细胞EndMT相关分子表达(x±s,n=3) |
由于CTGF不仅是YAP的靶效应分子,还是成纤维细胞标志蛋白,提示CKD诱导的YAP信号激活可能参与了内皮间质化进程。在内皮细胞中CTGF已经表达增强的情况下,本研究进一步检测了内皮细胞标志分子CD31表达情况。蛋白印迹结果显示,与正常大鼠血清处理组(Ctl组)相比,CKD大鼠血清处理(CKD serum组)细胞中,CD31水平降低(P < 0.05,图 5)。VP阻断YAP信号后CD31表达显著提升(P < 0.05,图 5A、E),舒洛地特处理后CD31表达水平与VP组一致(P < 0.05,图 5A、E)。结果表明,CKD大鼠血清诱导了内皮细胞表型转换,舒洛地特通过失活YAP抑制了内皮细胞间质化进程。
3 讨论 3.1 内膜增生导致AVF功能障碍具有功能且高流量的AVF是CKD患者必需的血透通路,而AVF失功会阻碍血液透析进程,严重影响患者的生命延续。过度的新生内膜增生是导致AVF功能障碍的重要原因之一。在我们以往研究中还发现在CKD患者及CKD小鼠AVF瘘口新生内膜增生会加重[12-13]。阻止新生内膜增生探讨改善AVF功能障碍的有效策略一直是重要的临床课题。本研究报道了舒洛地特可通过抑制CKD引起的YAP激活,阻止内皮间质化进程,从而减轻了AVF血管内膜增生。
3.2 舒洛地特对AVF的保护作用舒洛地特是一种长效性、安全的内皮保护药物,具有抗凝血活性,能被血管内皮广泛吸收,其肠外和口服给药对血管疾病的作用已被充分证实,在许多国家已广泛使用[3]。此外,舒洛地特对其他疾病的作用也有不少报道。SHEN等[14]发现舒洛地特可减少心肌凋亡,保护心肌缺血/再灌注损伤。LIU等[15]发现舒洛地特可抑制糖尿病大鼠肾脏肾小管间质损伤,发挥抗衰老和抗氧化作用,防止糖尿病肾病的进展。SDX对AVF是否具有保护作用也引起了越来越多的关注。
最近的研究表明,舒洛地特在球囊损伤大鼠颈动脉模型中,减轻了新生内膜增生,舒洛地特通过重建糖萼维持内皮完整性,起到了保护内皮的作用[16]。因球囊对血管的损伤仅限于内皮层,另有学者利用大鼠股动脉与股静脉进行端侧缝合,建立大鼠AVF模型,在这种全横断面血管严重损伤情况下,舒洛地特也表现出阻止新生内膜增生的作用[17]。然而,研究中使用的AVF模型仅来自正常大鼠。为了更好地模拟CKD患者端端缝合的AVF,本研究对CKD大鼠右颈动脉和颈内静脉之间进行了AVF端端缝合,建立了CKD大鼠AVF模型,并利用SDX灌胃。结果证实,舒洛地特对CKD大鼠的新生内膜增生表现出有益的阻止作用(图 2)。
3.3 舒洛地特通过失活YAP减轻新生内膜增生新生内膜增生由血流动力学改变、内皮屏障损伤、尿毒症、缺氧、炎症等多种因素诱发,Hippo信号可作为血流动力学引起机械刺激的传感器。已有报道表明单向血流剪切力可抑制Hippo信号途径的转录共激活因子YAP,使其磷酸化,从而降低炎症因子表达,减轻动脉粥样硬化[18]。CKD大鼠AVF瘘口持续处于血流动力学改变及尿毒症的影响下,我们希望了解YAP在其中所起的作用。激活的YAP处于未磷酸化状态,可由胞质转位入核,与转录因子TEAD结合,启动CTGF等靶基因表达。当Hippo通路激活时,通过上游激酶MST1/2磷酸化YAP,磷酸化的YAP在胞质中被降解,YAP信号被阻止[8]。因此,靶基因CTGF表达水平反映了YAP激活程度。本研究对CKD大鼠AVF检测结果表明,CKD大鼠动静脉瘘口处YAP和CTGF表达升高,磷酸化YAP处于低水平,表明CKD促进的新生内膜增生与YAP信号激活密切相关;舒洛地特的加入可阻止YAP的激活,减轻了CKD大鼠的新生内膜增生程度。
3.4 YAP激活促进内皮间质化新生内膜增生显著特征为血管平滑肌细胞过度生长,内皮细胞间质化(endothelial-mesenchymal transition, EndMT)也是血管损伤后新生内膜增生过程中平滑肌细胞来源之一[19]。在EndMT的过程中,内皮细胞失去其特异性标志物,表达α平滑肌肌动蛋白(α-SMA)、纤连蛋白(fibronectin)和I型胶原等间充质细胞标志物。既往也有研究报道TGF-β诱导的EndMT的过程中,需要YAP的激活[20]。REN等人还揭示了敲除血管内皮YAP基因可以抑制EndMT[21]。这些结果表明YAP可能是抑制EndMT的潜在靶点。CTGF不仅是Hippo信号转录因子YAP的下游靶效应分子,也是间质细胞标记物。在CKD大鼠AVF瘘口或CKD大鼠血清处理的内皮细胞中,YAP表达水平升高,CTGF表达上调(图 4和5);本研究进一步检测了内皮细胞标志物CD31的表达,结果发现,伴随着YAP信号激活,CD31表达降低,而通过VP阻断YAP信号,可恢复CD31表达。舒洛地特具有与VP相似的作用,它可以通过促进YAP磷酸化使YAP失活,对EndMT进程起到抑制作用。
综上所述,本研究的数据表明,YAP激活是引起大鼠AVF失功的重要因素之一,CKD促进了EC中YAP去磷酸化和激活,引起内皮细胞间质化,加重新生内膜增生;舒洛地特可以通过阻止YAP激活,抑制CKD诱导的EndMT,从而减轻新生内膜增生,提升AVF的长期通畅率。
| [1] |
BYLSMA L C, GAGE S M, REICHERT H, et al. Arteriovenous fistulae for haemodialysis: a systematic review and meta-analysis of efficacy and safety outcomes[J]. Eur J Vasc Endovasc Surg, 2017, 54(4): 513-522. |
| [2] |
ROY-CHAUDHURY P, SUKHATME V P, CHEUNG A K. Hemodialysis vascular access dysfunction: a cellular and molecular viewpoint[J]. J Am Soc Nephrol, 2006, 17(4): 1112-1127. |
| [3] |
COCCHERI S, MANNELLO F. Development and use of sulodexide in vascular diseases: implications for treatment[J]. Drug Des Devel Ther, 2013, 8: 49-65. |
| [4] |
MANNELLO F, LIGI D, CANALE M, et al. Sulodexide down-regulates the release of cytokines, chemokines, and leukocyte colony stimulating factors from human macrophages: role of glycosaminoglycans in inflammatory pathways of chronic venous disease[J]. Curr Vasc Pharmacol, 2014, 12(1): 173-185. |
| [5] |
LI R, XING J, MU X, et al. Sulodexide therapy for the treatment of diabetic nephropathy, a meta-analysis and literature review[J]. Drug Des Devel Ther, 2015, 9: 6275-6283. |
| [6] |
CARROLL B J, PIAZZA G, GOLDHABER S Z. Sulodexide in venous disease[J]. J Thromb Haemost, 2019, 17(1): 31-38. |
| [7] |
DEY A, VARELAS X, GUAN K L. Targeting the Hippo pathway in cancer, fibrosis, wound healing and regenerative medicine[J]. Nat Rev Drug Discov, 2020, 19(7): 480-494. |
| [8] |
PICCOLO S, DUPONT S, CORDENONSI M. The biology of YAP/TAZ: hippo signaling and beyond[J]. Physiol Rev, 2014, 94(4): 1287-1312. |
| [9] |
WANG X B, HU G Q, GAO X W, et al. The induction of Yes-associated protein expression after arterial injury is crucial for smooth muscle phenotypic modulation and neointima formation[J]. Arterioscler Thromb Vasc Biol, 2012, 32(11): 2662-2669. |
| [10] |
LIANG A L, WANG Y, HAN G F, et al. Chronic kidney disease accelerates endothelial barrier dysfunction in a mouse model of an arteriovenous fistula[J]. Am J Physiol Renal Physiol, 2013, 304(12): F1413-F1420. |
| [11] |
HASEGAWA T, SUGIHARA T, HOSHINO Y, et al. Photosensitizer verteporfin inhibits the growth of YAP- and TAZ-dominant gastric cancer cells by suppressing the anti-apoptotic protein survivin in a light-independent manner[J]. Oncol Lett, 2021, 22(4): 703. |
| [12] |
WANG Y, LIANG A L, LUO J L, et al. Blocking Notch in endothelial cells prevents arteriovenous fistula failure despite CKD[J]. J Am Soc Nephrol, 2014, 25(4): 773-783. |
| [13] |
WANG W S, WANG Z, TIAN D Y, et al. Integrin β3 mediates the endothelial-to-mesenchymal transition via the Notch pathway[J]. Cell Physiol Biochem, 2018, 49(3): 985. |
| [14] |
SHEN D P, CHEN R Y, ZHANG L J, et al. Sulodexide attenuates endoplasmic reticulum stress induced by myocardial ischaemia/reperfusion by activating the PI3K/Akt pathway[J]. J Cell Mol Med, 2019, 23(8): 5063-5075. |
| [15] |
LIU Y N, ZHOU J W, LI T T, et al. Sulodexide protects renal tubular epithelial cells from oxidative stress-induced injury via upregulating klotho expression at an early stage of diabetic kidney disease[J]. J Diabetes Res, 2017, 2017: 4989847. |
| [16] |
LI T J, LIU X N, ZHAO Z W, et al. Sulodexide recovers endothelial function through reconstructing glycocalyx in the balloon-injury rat carotid artery model[J]. Oncotarget, 2017, 8(53): 91350-91361. |
| [17] |
PARK H Y, KANG S, KIM G Y, et al. Inhibition of neointimal proliferation of rat carotid artery by sulodexide[J]. J Korean Med Sci, 1997, 12(3): 210-214. |
| [18] |
WANG L, LUO J-Y, LI B, et al. Integrin-YAP/TAZ-JNK cascade mediates atheroprotective effect of unidirectional shear flow[J]. Nature, 2016, 540(7634): 579-582. |
| [19] |
TIAN D Y, JIN X R, ZENG X, et al. Notch signaling in endothelial cells: is it the therapeutic target for vascular neointimal hyperplasia?[J]. Int J Mol Sci, 2017, 18(8): 1615. |
| [20] |
SAVORANI C, MALINVERNO M, SECCIA R, et al. A dual role of YAP in driving TGFβ-mediated endothelial-to-mesenchymal transition[J]. J Cell Sci, 2021, 134(15): jcs251371. |
| [21] |
REN Y F, ZHANG Y W, WANG L, et al. Selective targeting of vascular endothelial YAP activity blocks EndMT and ameliorates unilateral ureteral obstruction-induced kidney fibrosis[J]. ACS Pharmacol Transl Sci, 2021, 4(3): 1066-1074. |




