代谢相关脂肪性肝病(metabolic dysfunction-associated fatty liver disease,MAFLD)是以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征[1],其全球患病率已上升至32.4%,成为全球重大公共卫生问题[2]。我国2023年6月最新发布的一项近600万的人群研究发现肝脏脂肪变性患病率已达44.39%[3]。目前生活方式改善及膳食营养干预仍是其主要防治措施,因此从膳食营养的角度探索MAFLD的防治措施至关重要。
近年来研究强调机体“代谢紊乱”诱导的肝内和肝外综合因素在肝脏脂质沉积中的核心作用。哺乳动物中,脂肪组织主要包括白色脂肪组织(white adipose tissue,WAT)和棕色脂肪组织(brown adipose tissue,BAT)。WAT是专门储存和代谢甘油三酯的组织,其脂肪细胞大小和代谢功能对维持全身能量平衡和脂代谢至关重要,尤其是内脏脂肪(visceral adipose tissue,VAT)活跃的高脂肪酸输出可通过门静脉流入肝脏组织,从而对肝脏脂代谢产生直接影响[4]。BAT内含有丰富的线粒体,是机体以非颤抖产热的形式将脂质代谢为热量耗散的组织,其促进脂肪代谢和产热功能对缓解肝脏脂质的蓄积有重要意义[5]。研究表明,高脂肪、高热量饮食会诱导脂肪组织功能障碍,主要表现在脂肪细胞增生与肥大、炎症细胞浸润和脂肪因子的分泌,从而促进脂质在肝脏的异位沉积,诱导MAFLD的发生[6-7]。因此WAT与BAT功能稳态维持对MAFLD发生至关重要。
近年来,“肝病肠治”理念在MAFLD防治中被逐渐推广,肠道内分泌蛋白,菌群代谢产物如次级胆汁酸、短链脂肪酸等在改善机体糖脂代谢紊乱和MAFLD的发生中尤为重要。吲哚-3-丙酸(indole-3-propionic acid,IPA)是一种来源于膳食色氨酸经肠道菌群代谢的重要内源性代谢产物[8]。研究发现IPA可以通过增加紧密连接蛋白的表达来维持肠屏障功能稳态,减少内毒素血症,缓解大鼠脂肪性肝炎的发生[9]。然而,IPA对高脂饮食诱导的肝脏脂代谢紊乱和MAFLD发生的代谢机制尚不明确。本研究通过高脂饮食诱导C57BL/6J小鼠建立MAFLD模型,在观察IPA对高脂饮食诱导MAFLD发生发展的作用基础上,深入研究内脏脂肪和棕色脂肪组织脂代谢功能在其中的作用及相关机制。
1 材料与方法 1.1 主要试剂IPA(纯度≥99%,220027)购自Sigma-Aldrich;对照饲料(XTCON50)、高脂饲料(XTHF60)购自江苏省协同医药生物工程有限责任公司;甘油三酯(triglyceride,TG) (BC0625)、总胆固醇(total cholesterol,TC)(BC1985)、游离脂肪酸(free fatty acids,FFA)(BC0595)检测试剂盒购自北京索莱宝科技有限公司;谷丙转氨酶(alanine aminotransferase,ALT)(ALT01X)、谷草转氨酶(aspartate aminotransferase,AST)(AST01X)检测试剂购自重庆捷伦科技贸易发展有限公司;逆转录试剂盒(RK20429)和SYBR RT-PCR试剂盒(RK21203) 购自武汉爱博泰克生物科技有限公司;qRT-PCR引物由生工生物工程上海股份有限公司合成。
1.2 实验动物分组与干预6~7周龄SPF级雄性C57BL/6J小鼠21只,体质量19~21 g,购自重庆莱彼特生物科技有限公司[SCXK(湘)2019-0004],于陆军军医大学SPF级实验动物中心饲养在恒温(22~25 ℃)、恒湿(50±5)%环境下,采用12 h/12 h昼夜明暗交替,自由饮水摄食。小鼠适应性饲养1周后按随机数字表法分为3组:正常对照组(CON)、高脂组(HFD)、高脂+IPA干预组(HFD+IPA),每组7只。CON组以对照饲料喂养,HFD组和HFD+IPA组均以高脂饲料喂养,实验周期为12周,根据文献[9]从第7周开始HFD+IPA组以20 mg/(kg·d)IPA灌胃6周。每周记录各组小鼠体质量和摄食量,观察小鼠活动状态,干预至第12周末进行相应指标检测。本研究所有操作符合陆军军医大学实验动物福利和伦理的相关要求和规定(AMUWEC20211120)。
1.3 小鼠体成分检测小鼠干预至12周末,按照小动物体成分分析仪(QMR06-090H-PRO,苏州纽迈分析仪器股份有限公司,中国)操作说明检测小鼠体成分。
1.4 组织病理学检测取部分肝脏、内脏脂肪(附睾旁脂肪组织)、棕色脂肪组织(肩胛间棕色脂肪组织)固定在4%的多聚甲醛组织固定液中,制成石蜡或冰冻切片,分别进行HE或油红O染色,利用全玻片扫描仪(VS120,Olympus,日本)采集图像。
1.5 血清生化指标检测小鼠干预至12周末,麻醉后取眼眶血,置于室温2 h后,4 ℃、3 000 r/min离心15 min,取上层血清,参照试剂盒说明书检测血清中TG、TC、ALT、AST含量。
1.6 qRT-PCR检测按照TRIzol reagent试剂说明书提取肝脏、内脏脂肪和棕色脂肪组织总RNA,利用微量核酸蛋白浓度测定仪(NANODROP2000,Thermo scientific,美国)检测提取的RNA浓度和D(260)/D(280)比值,利用逆转录试剂盒逆转录为cDNA,随后按照SYBR Green Master Mix试剂盒说明书配置qRT-PCR反应体系,采用实时荧光定量PCR仪(qTOWER2.2,成都立德赛科技有限公司,中国)进行扩增和检测,结果采用2-ΔΔCt计算分析目的基因的mRNA相对表达量。引物序列如表 1所示。
| 基因 | 引物序列(5′→3′) |
| 18s | 上游: ACGGACCAGAGCGAAAGCAT |
| 下游: TGTCAATCCTGTCCGTGTCC | |
| Cpt1a | 上游: CACAACAACGGCAGAGCAGAG |
| 下游: ACACCACATAGAGGCAGAAGAGG | |
| CD36 | 上游: GCGACATGATTAATGGCACAGAC |
| 下游: GATCCGAACACAGCGTAGATAGAC | |
| TNF-α | 上游: ATCAGTTCTATGGCCCAGACC |
| 下游: ACTTGGTGGTTTGCTACGAC | |
| IL-1β | 上游: AAAAAAGCCTCGTGCTGTCG |
| 下游: GTCGTTGCTTGGTTCTCCTTG | |
| CXCL1 | 上游: ACCCGCTCGCTTCTCTGTG |
| 下游: ATTCTTGAGTGTGGCTATGACTTCG | |
| CCL2 | 上游: CTCACCTGCTGCTACTCATTCAC |
| 下游: GTATGTCTGGACCCATTCCTTCTTG | |
| ATGL | 上游: CAGAGATGGACTTCGATTCCTT |
| 下游: CAGGTGCTCTAGAATTCGATCT | |
| HSL | 上游: AGAGACACCAGCCAACGGATAC |
| 下游: TTGCGGTTAGAAGCCACATAGC | |
| CGI58 | 上游: TTTCTAGTAAGACGCCACTTGT |
| 下游: CATCACTGTCAAACCTAGGTCT | |
| UCP1 | 上游: GGAGGTGTGGCAGTGTTCATTG |
| 下游: GCTTTCTGTGGTGGCTATAACTCTG | |
| ND5 | 上游: CTGGCAGACGAACAAGACATCC |
| 下游: AGGGCGAGGCTTCCGATTAC | |
| prdm16 | 上游: GCCGTTCAAGTGCCATCTGTG |
| 下游: CCTCGTGTTCGTGCTTCTTCAG | |
| Cidea | 上游: CCGTGTTAAGGAATCTGCTGAGG |
| 下游: GGATGGCTGCTCTTCTGTATCG | |
| PPARα | 上游: AGTCCATCGGTGAGGAGAGC |
| 下游: TGGAAGCTGGAGAGAGGGTG |
1.7 统计学分析
实验数据利用SPSS25.0软件进行统计分析,用GraphPad Prism 9.0软件作图。多组数据比较采用单因素方差分析,其中两两比较采用LSD法检验,当P < 0.05时差异具有统计学意义。
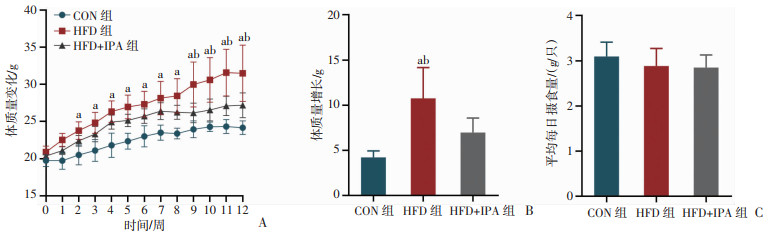
2 结果 2.1 IPA改善高脂饮食诱导的小鼠体质量增加和体成分变化如图 1A、B所示,3组小鼠初始体质量差异无统计学意义,至实验结果时,HFD组体质量显著增加,而IPA干预显著减缓体质量增加(P < 0.05)。图 1C显示,各组小鼠摄食量无显著差异。干预结束后小鼠体成分检测发现(表 2),HFD饮食显著增加体脂肪质量和比例并降低肌肉比例;而IPA可改善HFD饮食导致的脂肪和肌肉的比例变化(P < 0.05)。结果表明,IPA能够改善HFD诱导的体质量增加和体成分变化,其机制与调节脂肪功能密切相关。
|
|
a:P < 0.05,与CON组比较;b:P < 0.05,与HFD+IPA组比较 A:小鼠体质量变化;B:小鼠12周体质量的增长;C:小鼠平均每日摄食量 图 1 各组小鼠基础指标 |
| 组别 | 体质量/g | 肌肉质量/g | 肌肉比例/% | 体脂肪质量/g | 体脂肪比例/% | 自由水质量/g | 自由水比例/% |
| CON组 | 23.90±1.02 | 17.51±0.83 | 73.25±1.39 | 0.34±0.32 | 1.40±1.32 | 0.98±0.06 | 4.10±0.25 |
| HFD组 | 31.58±4.07a | 18.94±1.17 | 60.83±8.88a | 5.65±3.84a | 16.98±9.23a | 1.33±0.35 | 4.26±1.26 |
| HFD+IPA组 | 25.87±1.54b | 18.26±1.68 | 70.50±4.77b | 2.63±1.06 | 10.22±4.36b | 1.40±0.30 | 5.41±1.07 |
| a:P < 0.05,与CON组比较;b:P < 0.05,与HFD组比较 | |||||||
2.2 IPA改善高脂饮食诱导的小鼠肝脏结构和功能异常
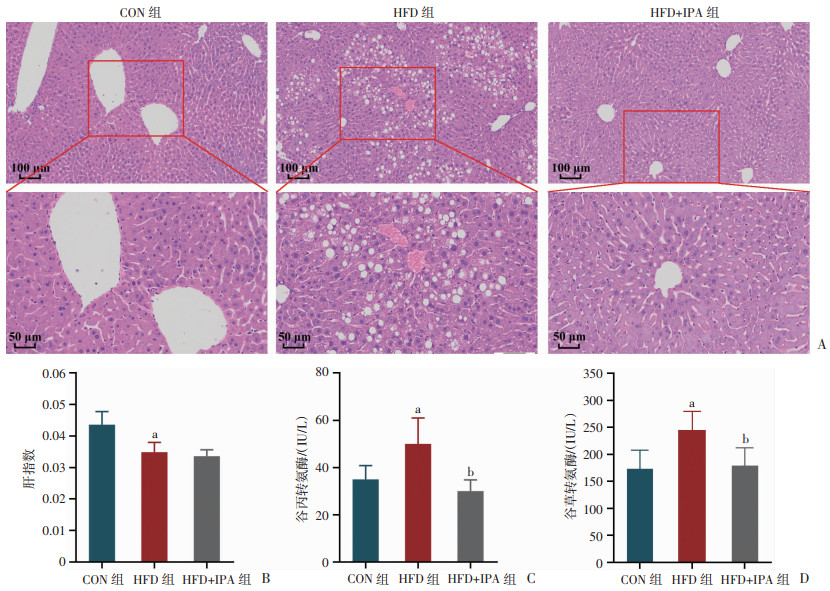
小鼠肝脏HE染色结果显示(图 2A),与CON组相比,HFD组小鼠大泡性肝细胞脂肪变性增多,而IPA干预改善了HFD诱导的肝脏病理变化特征,但其肝指数未见显著变化(图 2B)。如图 2C、D显示,与CON组相比,HFD组小鼠血清中ALT和AST水平均升高,IPA干预降低了ALT和AST水平(P < 0.05)。结果表明,IPA能够改善高脂饮食诱导的肝脏结构和功能异常。
|
|
a:P < 0.05,与CON组比较;b:P < 0.05,与HFD组比较 A:小鼠肝脏HE染色结果;B:小鼠肝指数;C:血清中谷丙转氨酶水平;D:血清中谷草转氨酶水平 图 2 各组小鼠肝脏病理及肝功能相关指标 |
2.3 IPA改善高脂饮食诱导的小鼠肝脏脂质沉积
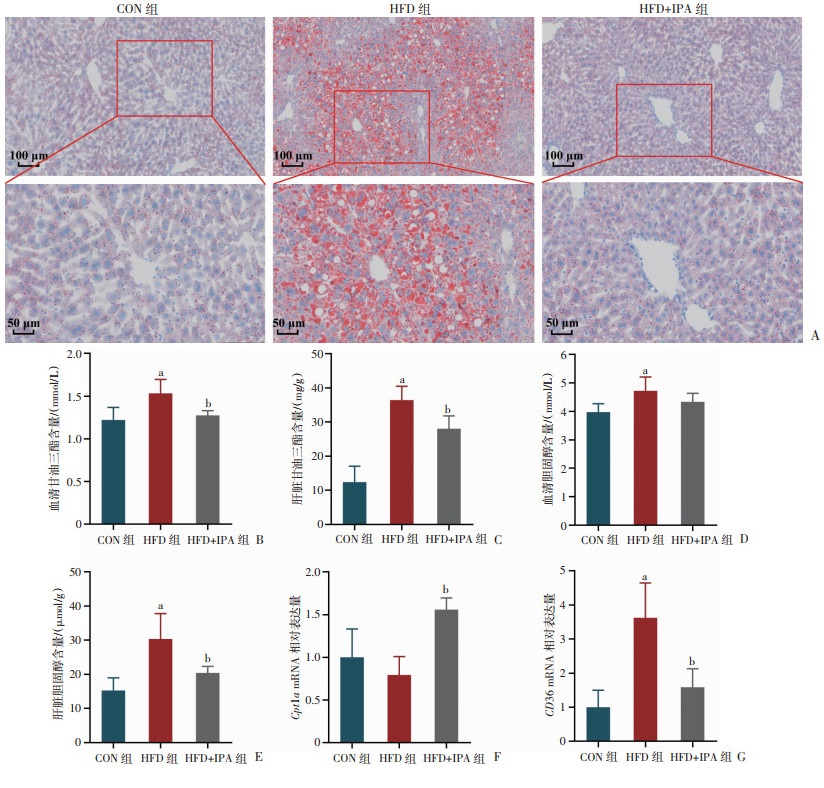
肝脏组织油红O染色结果显示(图 3A),IPA干预显著改善HFD组小鼠肝脏组织的脂质沉积。如图 3B~E所示,HFD组小鼠血清和肝脏组织中TG和TC含量均升高,IPA干预降低TG和TC含量(P < 0.05)。qRT-PCR检测相关基因表达水平发现(图 3F、G),IPA干预组Cpt1a mRNA升高,CD36 mRNA的表达水平降低(P < 0.05)。结果表明,IPA能够改善高脂饮食诱导的小鼠肝脏脂质沉积,其机制可能与减少脂肪酸转运分子CD36的mRNA表达水平,增加脂肪酸β氧化分子Cpt1a的mRNA表达水平有关。
|
|
a:P < 0.05,与CON组比较;b:P < 0.05,与HFD组比较 A:小鼠肝脏油红O染色;B:小鼠血清甘油三酯含量;C:小鼠肝脏组织甘油三酯含量;D:小鼠血清总胆固醇含量;E:小鼠肝脏组织总胆固醇含量;F:Cpt1a mRNA相对表达量;G:CD36 mRNA相对表达量 图 3 各组小鼠肝脏脂质沉积与脂代谢相关基因mRNA的表达 |
2.4 IPA改善高脂饮食诱导的小鼠内脏脂肪组织结构异常
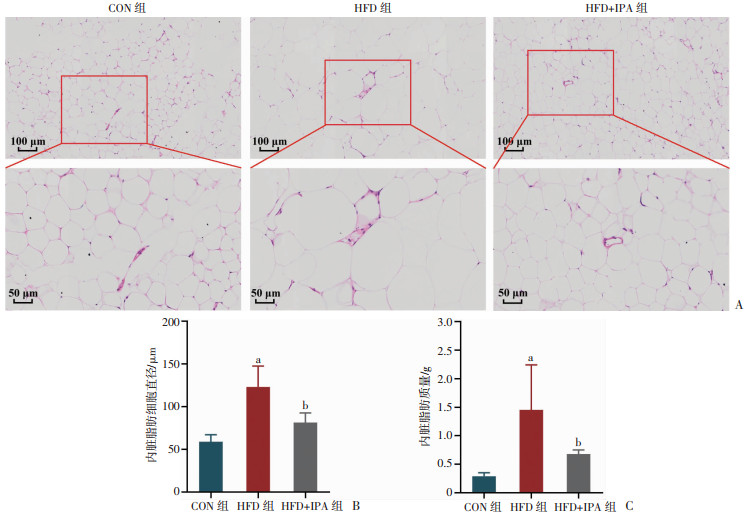
进一步研究IPA对内脏脂肪组织和棕色脂肪组织的作用,如图 4A、B显示,与CON组相比,HFD组内脏脂肪细胞增大,IPA干预后减小(P < 0.05)。同时,IPA干预降低了HFD引起的内脏脂肪组织质量的升高(P < 0.05,图 4C)。结果表明,IPA干预能够改善高脂饮食诱导的内脏脂肪组织结构异常。
|
|
a:P < 0.05,与CON组比较;b:P < 0.05,与HFD组比较 A:小鼠内脏脂肪HE染色;B:小鼠内脏脂肪细胞直径;C:小鼠内脏脂肪质量 图 4 各组小鼠内脏脂肪组织形态与质量变化 |
2.5 IPA改善高脂饮食诱导的小鼠内脏脂肪组织炎症与脂代谢异常
检测血清和内脏脂肪组织中游离脂肪酸含量显示(图 5A、B),IPA干预显著改善HFD诱导的血清和内脏脂肪组织中游离脂肪酸升高(P < 0.05)。此外,脂肪组织过度炎症与脂肪组织功能障碍密切相关,结果发现(图 5C),IPA干预抑制了HFD诱导的TNF-α表达升高(P < 0.05)。进一步检测脂质分解和棕色化相关基因发现(图 5D、E),与HFD组相比,IPA干预增加了HSL、CGI58脂解基因(P < 0.05)以及棕色化相关基因Cidea、ND5、UCP1、Prdm16的表达(P < 0.05)。结果提示IPA可能通过调节内脏脂肪细胞炎症反应、脂代谢与棕色化相关基因的表达进而改善内脏脂肪功能异常。
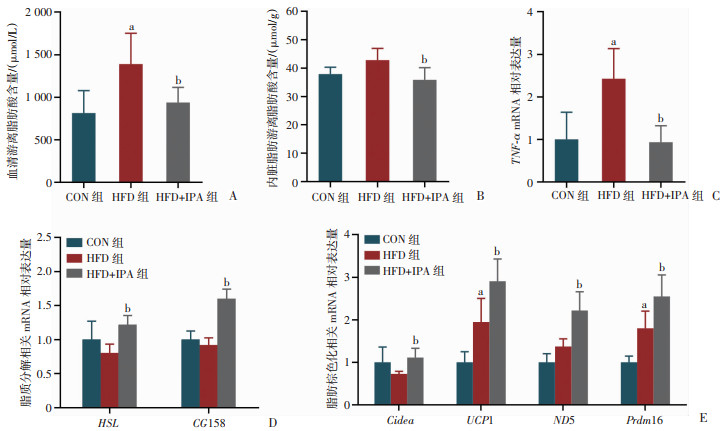
|
|
a:P < 0.05,与CON组比较;b:P < 0.05,与HFD组比较
A:小鼠血清中游离脂肪酸含量;B:小鼠内脏脂肪中游离脂肪酸含量;C:TNF-α mRNA相对表达量;D:脂质分解相关mRNA相对表达量;E:脂肪棕色化相关mRNA相对表达量 图 5 各组小鼠内脏脂肪代谢与炎性相关基因mRNA的表达 |
2.6 IPA改善高脂饮食诱导的小鼠棕色脂肪组织结构异常
如图 6A显示,与CON组相比,HFD组棕色脂肪细胞显著增大,IPA干预后减小(P < 0.05)。对棕色脂肪细胞直径统计分析结果也表明(图 6B),IPA干预减小了HFD引起的棕色脂肪细胞直径增大(P < 0.05)。但是IPA干预对棕色脂肪组织质量无显著影响(图 6C)。结果表明,IPA干预能够改善高脂饮食诱导的棕色脂肪组织结构异常。
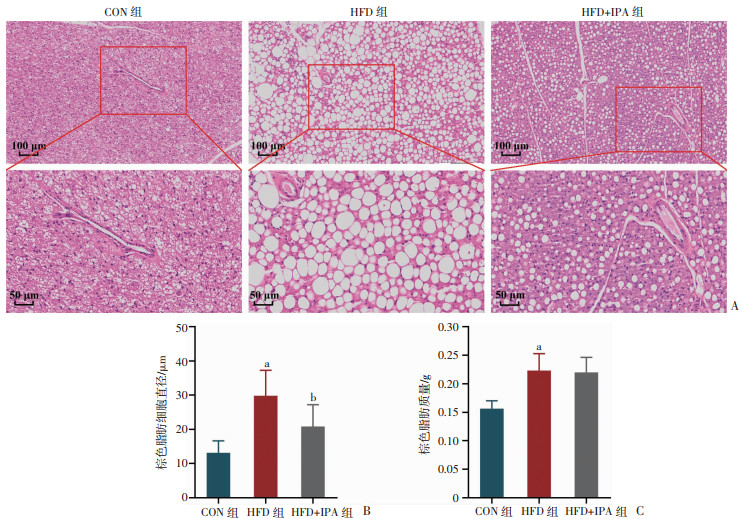
|
|
a:P < 0.05,与CON组比较;b:P < 0.05,与HFD组比较 A:小鼠棕色脂肪HE染色;B:小鼠棕色脂肪细胞直径;C:小鼠棕色脂肪质量 图 6 各组小鼠棕色脂肪组织形态与质量变化 |
2.7 IPA改善高脂饮食诱导的小鼠棕色脂肪组织炎症与脂代谢异常
检测棕色脂肪组织脂质分解相关基因发现(图 7A),HFD+IPA组与HFD组相比增加了ATGL、HSL的表达(P < 0.05)。检测脂肪酸β-氧化相关基因发现(图 7B),与HFD组相比,IPA干预增加了Cpt1a、PPARα的表达(P < 0.05)。进一步检测炎症和趋化因子相关基因的表达发现(图 7C、D),与HFD组相比,IPA干预后TNF-α、IL-1β、CXCL1、CCL2表达均降低(P < 0.05)。结果提示IPA可能通过影响棕色脂肪组织中脂代谢、促炎因子与趋化因子相关基因的表达进而改善棕色脂肪组织炎症与代谢异常。
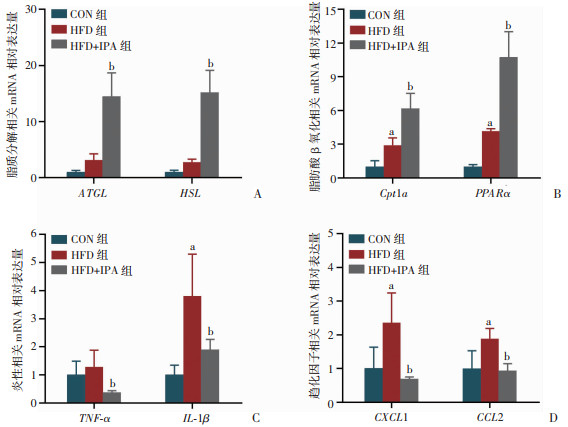
|
|
a:P < 0.05,与CON组比较;b:P < 0.05,与HFD组比较 A:脂质分解相关mRNA相对表达量;B:脂肪酸β氧化相关mRNA相对表达量;C:炎性相关mRNA相对表达量;D:趋化因子相关mRNA相对表达量 图 7 各组小鼠棕色脂肪代谢和炎性相关基因mRNA的表达 |
3 讨论
随着社会发展,高热量饮食引起的代谢紊乱和代谢异常日益严重,进而诱导脂肪肝等代谢性疾病的发病率逐年递增,目前尚无有效的防治措施。许多研究表明,膳食中必需氨基酸之一的色氨酸代谢失调在多种代谢性疾病发病机制中起着重要作用,吲哚-3-丙酸(IPA)作为肠道菌群产生的一种内源性色氨酸代谢物,其在代谢相关疾病的防治中逐渐受到关注。本研究发现IPA可以显著改善高脂饮食诱导的体质量以及肝脏脂质沉积和肝损伤,其机制与调节脂肪组织功能密切相关,为MAFLD提供了新的防治策略和实验依据。IPA主要通过厚壁菌门中的乳酸杆菌、生孢梭菌、肉毒梭状芽胞杆菌等代谢膳食色氨酸产生[10-11],其与多个代谢性疾病的发生密切相关。我国的一个前瞻性队列研究表明,血浆色氨酸和IPA水平与冠心病患者的死亡风险降低显著相关[12]。同时多项临床研究表明血浆IPA水平与2型糖尿病、胰岛素抵抗、肥胖、肝纤维化之间存在负相关关系[13-14]。本研究证实了IPA能够显著降低高脂诱导小鼠体质量和脂肪比例的升高,同时增加肌肉含量,有效改善高脂诱导小鼠出现的肝脏脂质沉积,降低肝脏中ALT、AST、TG、TC的水平,并且发现IPA干预可以显著降低肝脏组织脂肪酸转运分子CD36的表达,表明IPA改善MAFLD发生的机制可能与调节肝脏游离脂肪酸的摄取密切相关。
脂肪组织作为人体脂肪储存和能量代谢的重要器官,其脂解作用诱导的游离脂肪酸通过门静脉系统被转运到肝脏是导致MAFLD发生发展的关键机制[15]。本研究进一步发现IPA能够显著改善高脂饮食引起的内脏和棕色脂肪细胞的增大,降低VAT和血清中FFA的含量,而分子生物学结果同样也提示IPA增加了VAT脂解基因(HSL,CGI58)和棕色化相关基因(Cidea、ND5、UCP1、Prdm16)的mRNA表达。因此,IPA可能通过增强VAT白色脂肪棕色化进而增加脂肪酸的利用,从而降低血清中游离脂肪酸的水平。与此同时,IPA干预增加了BAT脂解基因(HSL、CGI58)和脂肪酸氧化相关基因(Cpt1a、PPARα)的mRNA表达。因此,IPA可能通过增加BAT中脂质代谢和产热功能来促进脂质的利用,改善肝脏的脂质异位沉积。另外有研究表明,肥大的脂肪细胞表现出脂肪分解增加,释放大量的FFA,可以激活巨噬细胞表面Toll样受体4(Toll-like receptor 4,TLR4),并通过NF-κB信号增加促炎细胞因子包括TNF-α、IL-1β、IL-6等的释放,从而促进机体糖脂代谢紊乱[16]。本研究发现IPA显著降低了VAT炎性因子TNF-α以及BAT中TNF-α、IL-1β、CXCL1、CCL2的表达,缓解了脂肪组织炎症反应,改善了脂肪组织功能,然而进一步的分子机制和作用靶点需要深入研究阐明。
综上所述,IPA可以改善高脂饮食诱导的肝脏脂质沉积和肝脏结构与功能异常,对MAFLD的发生发展有保护作用,其机制可能与调节内脏白色脂肪组织和肩胛间棕色脂肪组织结构、代谢功能及炎性相关基因的表达有关,为MAFLD的防治提供科学依据和膳食营养干预策略。
| [1] |
ESLAM M, SANYAL A J, GEORGE J, et al. MAFLD: a consensus-driven proposed nomenclature for metabolic associated fatty liver disease[J]. Gastroenterology, 2020, 158(7): 1999-2014.e1. |
| [2] |
RIAZI K, AZHARI H, CHARETTE J H, et al. The prevalence and incidence of NAFLD worldwide: a systematic review and meta-analysis[J]. Lancet Gastroenterol Hepatol, 2022, 7(9): 851-861. |
| [3] |
MAN S, DENG Y H, MA Y, et al. Prevalence of liver steatosis and fibrosis in the general population and various high-risk populations: a nationwide study with 5.7 million adults in China[J]. Gastroenterology, 2013, 165(4): 1025-1040. |
| [4] |
FANG H J, BERG E, CHENG X G, et al. How to best assess abdominal obesity[J]. Curr Opin Clin Nutr Metab Care, 2018, 21(5): 360-365. |
| [5] |
ZHOU X Y, LI Z L, QI M H, et al. Brown adipose tissue-derived exosomes mitigate the metabolic syndrome in high fat diet mice[J]. Theranostics, 2020, 10(18): 8197-8210. |
| [6] |
KAHN C R, WANG G X, LEE K Y. Altered adipose tissue and adipocyte function in the pathogenesis of metabolic syndrome[J]. J Clin Investig, 2019, 129(10): 3990-4000. |
| [7] |
CIFARELLI V, BEEMAN S C, SMITH G I, et al. Decreased adipose tissue oxygenation associates with insulin resistance in individuals with obesity[J]. J Clin Invest, 2020, 130(12): 6688-6699. |
| [8] |
ROSE D. Aspects of tryptophan metabolism in health and disease: a review[J]. J Clin Pathol, 1972, 25: 17-25. |
| [9] |
ZHAO Z H, XIN F Z, XUE Y Q, et al. Indole-3-propionic acid inhibits gut dysbiosis and endotoxin leakage to attenuate steatohepatitis in rats[J]. Exp Mol Med, 2019, 51(9): 1-14. |
| [10] |
DODD D, SPITZER M H, VAN TREUREN W, et al. A gut bacterial pathway metabolizes aromatic amino acids into nine circulating metabolites[J]. Nature, 2017, 551(7682): 648-652. |
| [11] |
WLODARSKA M, LUO C W, KOLDE R, et al. Indoleacrylic acid produced by commensal Peptostreptococcus species suppresses inflammation[J]. Cell Host Microbe, 2017, 22(1): 25-37.e6. |
| [12] |
LI Q, YOU Y R, ZENG Y P, et al. Associations between plasma tryptophan and indole-3-propionic acid levels and mortality in patients with coronary artery disease[J]. Am J Clin Nutr, 2022, 116(4): 1070-1077. |
| [13] |
DE MELLO V D, PAANANEN J, LINDSTRÖM J, et al. Indolepropionic acid and novel lipid metabolites are associated with a lower risk of type 2 diabetes in the Finnish Diabetes Prevention Study[J]. Sci Rep, 2017, 7: 46337. |
| [14] |
SEHGAL R, ILHA M, VAITTINEN M, et al. Indole-3-propionic acid, a gut-derived tryptophan metabolite, associates with hepatic fibrosis[J]. Nutrients, 2021, 13(10): 3509. |
| [15] |
AZZU V, VACCA M, VIRTUE S, et al. Adipose tissue-liver cross talk in the control of whole-body metabolism: implications in nonalcoholic fatty liver disease[J]. Gastroenterology, 2020, 158(7): 1899-1912. |
| [16] |
PEISELER M, SCHWABE R, HAMPE J, et al. Immune mechanisms linking metabolic injury to inflammation and fibrosis in fatty liver disease- novel insights into cellular communication circuits[J]. J Hepatol, 2022, 77(4): 1136-1160. |




