阴茎硬结症是由法国外科医师Peyronie于1743年首次发现并报告的一种少见的慢性疾病,又称为Peyronie病(佩罗尼病)[1]。其临床表现是在阴茎白膜,尤其是在阴茎背侧白膜上形成局限性条索状不规则纤维斑块为主要特征,从而导致患者出现勃起时阴茎弯曲、畸形、勃起疼痛,弯曲严重者可导致插入困难,甚至勃起功能障碍[2]。流行病学调查显示该类疾病的患病率为0.5%~11.0% [3],多见于中年男性,其患病率随年龄增长而增加。
目前对于阴茎硬结症存在多种非手术治疗方法,包括口服药物如非甾体抗炎药、他莫昔芬、秋水仙碱、维生素E、左卡尼汀、己酮可可碱以及对氨基苯甲酸钾等,硬结内局部注射药物如溶组织梭菌胶原酶、干扰素α-2b、维拉帕以及类固醇等,及其他治疗方法如低能量体外冲击波、离子电渗疗法、机械牵引以及放射治疗等[4-7]。口服药物治疗目前仍然基于临床治疗经验,缺乏高质量的循证医学证据[4]。近年来硬结内注射溶组织梭菌胶原酶联合阴茎牵引装置取得一定的进展。一项对比手术与硬结内注射溶组织梭菌胶原酶联合阴茎牵引的随机对照研究共纳入38名不同严重程度的阴茎硬结症患者,随访3个月,结果表明硬结内注射溶组织梭菌胶原酶可取得与手术治疗相当的效果(非常满意率:50.0% vs 21.1%;满意率:43.8% vs 63.2%),同时有更低的术后不良事件发生率(50.0% vs 89.5%)[8]。但需要指出该研究随访时间过短,得出更加严谨的结果尚需更长的随访。尽管该病具有多种非手术治疗方法,但总体效果并不满意,故手术治疗就成为具有严重阴茎弯曲畸形患者的最终选择。
现有手术治疗包括3大类:阴茎缩短(折叠)术、阴茎白膜斑块切除或切开+移植物修补术和阴茎假体置入术[9-12]。具体手术方案的选择取决于阴茎勃起后形态、患者喜好等因素。针对现有手术治疗存在术后勃起功能障碍、阴茎缩短、感觉减退等缺点,本院男科团队自2021年1月至2023年5月,在显微镜下联合应用电动磨钻进行白膜斑块磨削及应用睾丸鞘膜或牛心包进行白膜修补术治疗伴有严重弯曲畸形的阴茎硬结症,取得满意效果,现总结报告如下。
1 资料与方法 1.1 病例资料本研究为回顾性队列研究,获得陆军特色医学中心伦理委员会审批[医研伦审(2023)第168号]。本研究纳入自2021年1月至2023年5月因阴茎硬结症于本院行显微镜下白膜斑块电动磨削及移植物修补术患者。本研究收集了21例患有阴茎硬结症的患者的基线特征。参与者的年龄为(51.5±9.4)岁。吸烟时长为(20±10)年。病程为15(12,84)个月,其中病程1~3年17例, 超过3年的4例。8例患者(42.9%)合并有糖尿病。16例患者(76.2%)白膜斑块主要位于阴茎背侧正中,呈单一长条索状或2处及以上条索状,使阴茎呈现显著的单纯背侧弯曲,弯曲角度60°~90°; 另外5例患者(23.8%)除背侧正中存在斑块外,斑块还呈不规则扩展至阴茎一侧或双侧,使阴茎呈现复杂的既有背弯又有侧弯的复合畸形,或伴有缩窄样、沙漏样畸形,弯曲角度为45°~60°。患者均有多年性生活史。
1.2 诊断标准和手术指征诊断标准:阴茎硬结一般通过临床表现即可做出诊断。所有患者有大小、数目不等的阴茎硬结致阴茎弯曲、畸形、疼痛。硬结常位于阴茎背面及侧面,多数表现为条索状、片状,甚至环绕阴茎[4, 12]。
手术指征:所有患者病程在12个月以上且稳定期超过3个月,表现为阴茎弯曲畸形,勃起疼痛不明显,不能或难以完成性生活但勃起功能良好[4, 12]。
排除标准:术前存在勃起功能障碍。
1.3 手术方法采用连续硬膜外麻醉、腰麻或全麻。首先应用橡皮筋阻断阴茎根部,通过阴茎头向阴茎海绵体内注入生理盐水诱发人工勃起,观察阴茎弯曲的角度、程度及畸形状态,触摸阴茎硬结大小、范围及方位并记录。常规取冠状沟下1 cm处环形切口,在肉膜与Buck’s筋膜之间进行阴茎皮肤脱套至根部。然后在显微镜下分别于阴茎海绵体两侧,接近与尿道海绵体交界处做纵行切口,切开Buck’s筋膜,远端近阴茎头,近端近根部。应用显微手术剪刀小心锐性分离Buck’s筋膜与白膜之间的间隙,保护Buck’s筋膜层面的阴茎背动脉,背深静脉及背神经,进出白膜的穿支血管进行精细电凝止血,直至分离阴茎背侧大部分区域的Buck’s筋膜,并将阴茎背侧的Buck’s筋膜及神经血管束完整掀起,从而充分暴露阴茎背侧白膜斑块区。术中可见斑块区域组织同正常的富有弹性的纵行白膜纤维相比,呈紊乱的坚硬致密的疤痕状纤维组织。应用记号笔或美兰对斑块范围进行标记,测量硬结的长度和宽度。然后使用电动磨钻对斑块进行磨削,直至使斑块区域白膜呈“网格状”缺损,牵拉阴茎显示海绵体完全恢复其良好延展性;如斑块向白膜两侧蔓延至尿道海绵体区域,则需要将阴茎海绵体与尿道海绵体之间进行游离,充分显露并磨削切除该区域硬结, 同时避免损伤尿道。
白膜的缺损修补,选择修剪成合适大小和形状的牛心包或自体睾丸鞘膜作为移植物。自体睾丸鞘膜切取:取阴囊中缝纵行切口,约4 cm,切开皮肤、皮下及肉膜,暴露睾丸鞘膜,完整切取一侧或双侧整个睾丸鞘膜。根据阴茎白膜缺损大小,对鞘膜进行适当修剪后,将鞘膜内面光滑面向下,覆盖于白膜缺损处,取5-0可吸收薇乔线进行间断或连续性严密吻合,修补白膜缺损。牛心包为商品可供的高值耗材(广东冠昊生物科技股份有限公司,胸普外科修补膜TB-S6080、TB-S3050)。修补缝合过程中,牵拉阴茎头,使整个阴茎处于拉伸状态,保证睾丸鞘膜松弛覆盖缝合于缺损处,最后将Buck’s筋膜完整复位缝合。橡皮筋阻断阴茎根部,通过阴茎头向阴茎海绵体内进行注水诱发人工勃起,观察阴茎弯曲的纠正程度,如仍有弯曲,再进行适度的对侧白膜的折叠缝合,直至弯曲和畸形完全消失,阴茎可呈笔直状态。逐层关闭切口,结束手术。详细手术过程见图 1。
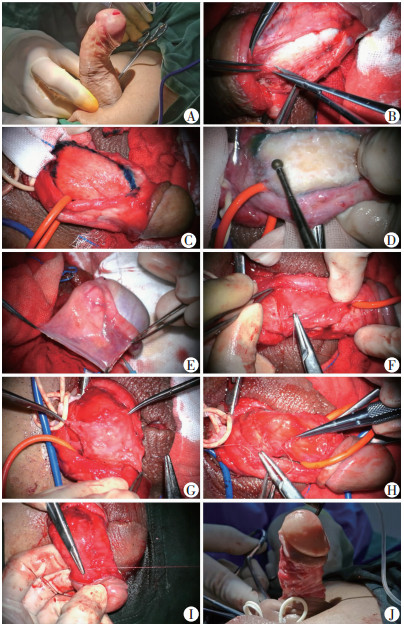
|
| A:橡皮筋阻断阴茎根部,诱发人工勃起;B:两侧分别向背侧中线区域分离Buck’s筋膜;C:美兰标记斑块区域;D:电动磨钻磨削斑块;E:完整切取睾丸鞘膜;F:睾丸鞘膜覆盖白膜缺损区;G:睾丸鞘膜缝合修补白膜缺损区;H:完全修复白膜缺损区;I:复位缝合Buck’s筋膜;J:评估术中效果 图 1 阴茎硬结症患者手术主要步骤 |
1.4 术后处理
术毕阴茎适度加压包扎, 并保持于直立位,维持包扎状态2周以上,以防早期包皮及阴茎炎性肿胀。进行常规抗感染等治疗。为减少术后性功能障碍发病率,避免阴茎缩短,促进勃起功能早期恢复,嘱患者术后4周起间断性应用真空负压助勃装置辅助阴茎海绵体的功能康复,口服他达拉非5 mg,每日1次,维持2~3个月。术后8周起可积极尝试恢复性生活。
1.5 统计学分析计量资料满足正态分布采用x±s、非正态分布用M(P25,P75)表示。计数资料采用n(%)表示。术后满意度评价选择评分制(1~5)分,分别代表极不满意、不满意、一般、满意、非常满意。使用STATA 18.0软件进行统计分析。
2 结果本研究纳入了21例患有阴茎硬结症的患者,并记录了他们的术中信息及术后随访结局。手术时长为170~385(272±69) min。硬结表面积为2.0~12.0(4.3±2.6) cm2。术中使用的补片类型包括自体单侧鞘膜(12例,57.1%)、自体双侧鞘膜(3例,14.3%)以及牛心包(6例,28.6%)。其中,5例(23.8%)患者术中进行了追加白膜折叠。
术后1~3月内随访观察,患者阴茎背侧原斑块区域触及略呈僵硬肿胀状,但原硬结消失,阴茎形态正常。术后3~6月随访,患者阴茎背侧原斑块区域软组织逐渐变得柔软而富有弹性,牵拉阴茎示背侧延展性良好。最终随访时间为12.1(3,24)个月。有9例患者(42.9%) 出现阴茎头麻木,持续时间为(3.2±1.9)个月。13例患者(61.9%)自我报告出现阴茎缩短,缩短长度为(1.1±0.7) cm。测量客观阴茎长度变化为[+(1.1±0.5)] cm。17例患者(81.0%)自述勃起时阴茎完全伸直,无弯曲,无缩窄畸形,4例(19.0%)述略有背侧弯曲,但弯曲度<10°,与正常人群中阴茎勃起时上翘的状态类似,患者均对其阴茎勃起时形态满意。术后勃起硬度评分为(3.8±0.4)分。恢复性生活时间为(2.9±1.4)个月。患者的满意度评分为(4.4±0.7)。综合满意率为90.5%,其中满意5例(23.8%),非常满意14例(66.7%)。
3 讨论 3.1 阴茎硬结症疾病特点阴茎硬结症是一种以阴茎白膜形成纤维样、无顺应性硬结为特征的常见阴茎疾病。白膜纤维斑块的形成导致阴茎的形态和功能异常,包括弯曲、缩窄、变短、疼痛等,严重者可引起勃起功能障碍[2]。目前该病的准确病因及具体发病机制尚未完全清楚。有研究显示与外伤关系密切,同时尚存在某些明显的相关危险因素:如尿道内操作、尿道感染、糖尿病、痛风、性伴侣生殖道疾病、高血压、缺血性心脏病、高脂血症、吸烟、应用β-受体阻滞剂和自身免疫因素等[12]。近年来,阴茎硬结症的总体患病率有增加趋势,但由于该病患者总体就诊率较低,故临床存在该病患病率明显低估现象[13-14]。
大部分阴茎硬结症患者的自然病程存在两个明显的发展阶段,即活动期和稳定期。活动期常持续12~18个月,表现为白膜斑块沿阴茎长轴的逐渐增大,甚至横向扩展,阴茎弯曲加重并伴有痛性勃起。根据白膜斑块的大小、形状及所处位置的不同,阴茎外观可呈背弯、侧弯、扭曲甚至呈沙漏样或纺锤样缩窄畸形等多种畸形。该阶段患者一般主张以保守治疗或观察为主,不宜进行手术。在阴茎硬结症的非手术治疗选择中包括口服药物,硬结内局部注射药物如溶组织梭菌胶原酶、干扰素α-2b、维拉帕、类固醇等,以及其他治疗方法如低能量体外冲击波、离子电渗疗法、机械牵引、放射治疗等[4, 6-7, 15], 但总体疗效均不太理想。
进入稳定期后,阴茎以不可逆畸形为特点,表现为阴茎疼痛缓解或减轻、阴茎畸形逐渐稳定。对于进入稳定期内、阴茎表现显著弯曲畸形、严重影响性生活者,手术治疗是矫正阴茎弯曲畸形的金标准[6, 12]。手术方式主要有3种,包括缩短(折叠)术、阴茎白膜斑块切除或切开+移植物修补术和阴茎假体置入术[9-11]。国内最新的阴茎硬结症诊断治疗指南及相关文献均提出:该病的手术时机及指征为:病程>12个月且稳定期>3~6个月,无疼痛症状、阴茎严重弯曲、影响正常性活动且保守治疗无效者[4, 16]。本组患者病史均大于12个月,且均处于稳定期3个月以上,患者有强烈的进一步治疗意愿。在具体的手术方式选择方面,尽管国内相关指南认为弯曲角度<60°~70°、无不稳定的纺锤样畸形或铰链效应、预计术后阴茎勃起长度缩短<20%者,推荐行白膜缩短(折叠)术。弯曲角度>60°~70°、存在不稳定铰链效应者,推荐行硬结切开/切除+移植物修补术。但阴茎硬结症患者常常对单纯白膜折叠后的阴茎显著缩短具有强烈的抗拒态度,要求进行避免阴茎缩短的矫正手术,为此,本组尽管少数患者弯曲角度<60°,但因为存在复合畸形,根据患者意愿,均选择了阴茎白膜斑块电动磨削+移植物修补术。
3.2 阴茎白膜硬结处理方式针对白膜斑块的处理方式,理论上讲,“彻底切除病变”似乎是最理想的处理方法,但因为斑块常常蔓延范围较大,而且斑块的病理改变范围常常超越可触及的斑块,过多的白膜切除可能造成阴茎白膜缺损过大,增加术后发生ED的风险[17-18],因此,目前彻底切除斑块方法并不为国内外专家所认可,已经极少使用[19]。一般认为仅需切除导致阴茎畸形的最严重区域的斑块组织,而无需切除整个斑块,或者仅仅进行斑块区域白膜的松解,纠正弯曲即可。国内外学者所采用的处理斑块的具体方式包括:采用长方形切口切除部分斑块组织[20];采用沿阴茎长轴的“H”形切口,切开但不切除斑块[21];采用椭圆形切口(0.5 cm×2.0 cm) 切除部分斑块,并可根据需要向两侧横向延长切口[22];采用“I”形松解切口,不切除斑块[23];采用多个横行切口,不切除斑块[24]等多种方式。在切开或切除斑块的基础上,需要对缺损的白膜进行移植物的修补术,在修补材料的选择上,也有多种类型的材料如自体材料(皮肤、静脉补片、睾丸鞘膜、腹直肌腱膜、口腔颊黏膜、舌黏膜),异体材料(心包、阔筋膜、冰冻脑膜)、异种材料(牛心包、猪小肠黏膜下层、猪真皮,Tachosil)及合成材料(聚酯纤维)等[25-26],采用不同白膜斑块处理方式,不同材料修补白膜缺损的技术均获得不同程度的恢复效果,但目前尚没有一种理想和标准的手术模式能够为大家所广泛接受。因而,对于该类患者的手术治疗方法,仍然值得不断改进和创新,从而达到更加理想的治疗效果。
基于阴茎硬结症导致严重阴茎弯曲以及复杂畸形的患者,通常白膜斑块较大且不规则,以往白膜斑块单纯切开的手术方式,必然会使患者继续局部遗留明显的不规则斑块硬结,患者自我感受满意度不佳,而采用长方形切口或椭圆形切口,切除部分斑块组织的方法,切除过程中深浅及范围较难把握,易导致海绵体的过度损伤。为此,我们借鉴其他专业及术者经验,在白膜斑块的处理上,尝试采用了电动磨钻技术。电动磨钻为神经外科及骨科常用的进行骨骼塑形工具,对于坚硬的骨头磨削效率高,软组织相反损伤小。这一特性使得其在硬结的处理上具有得天独厚的优势。手术过程中先用记号笔或美兰标记白膜斑块的范围,接着通过电动磨削的方法,对坚硬的斑块区域进行大面积“移动式”磨削,磨薄,直至触摸硬结消失,然后为使斑块区域海绵体充分松解,将已经磨薄的区域进一步行“散点状”磨削,直至斑点状暴露海绵体,最终使斑块区域白膜呈现“网格状”缺损,牵拉阴茎显示该区域海绵体可充分伸展。这样,采用该方法的主要优势是既可以避免传统切除方式导致的白膜大面积缺损,又可使坚硬的斑块尽可能减少,提高患者局部触感的满意度。
3.3 修补材料选择在修补材料的选择上,理想白膜补片应该具备下列特点:①取材简便,对机体损伤性小;②有良好血供或再生能力;③与白膜组织相容性好,无免疫排斥反应;④具有良好的延展性及组织弹性;⑤易于缝合,价格低廉等。但至今尚没有哪种补片能够满足理想补片的所有标准[25, 27],也尚没有证明某一种补片与其他补片相比具有突出的优势[28-29]。本组研究大多选择了睾丸鞘膜进行白膜的修补,发现其在下列多方面优势突出:①对于泌尿外科医生而言,切取睾丸鞘膜简单方便,并发症极少;②自体睾丸鞘膜材料充分,对于斑块较大且不规则的患者,可切取单侧睾丸鞘膜或双侧鞘膜,双侧鞘膜足以修补任何大小斑块磨削后留下的白膜缺损;③鞘膜组织较薄,游离的鞘膜贴附于海绵体缺损处,依赖于局部血供提供营养,易于存活,中远期观察,没有因为补片组织挛缩导致的弯曲复发的现象;④组织延展性和弹性极好,松弛缝合于缺损区后,即可人工注水诱发勃起,可见纠正弯曲效果理想,没有因鞘膜弹性不足所导致的弯曲纠正不理想的现象;⑤由于鞘膜组织较薄,在修补缺损时,无需严格按照既往文献方法,将修补材料严格依据缺损大小进行修剪,并将补片“对缘”缝合于切口的边缘,而是可以将宽裕的鞘膜重叠覆盖于白膜表面,进行缝合。牛心包为成品商品,可常规用作人体组织缺损的修补材料,如血管、膈肌等,组织坚固不具备弹性,但对比自体睾丸鞘膜取材更加方便。手术中修补材料的选择取决于缺损大小及材料可及性。
3.4 本技术的创新与既往同类手术技术相比,本项临床研究在临床技术诸多方面进行了技术优化和改进,主要包括:①利用显微技术,在手术的整个过程中贯穿精细的显微操作;②对于Buck筋膜,强调在尽可能远离背侧神经血管束的两侧区域开始掀起并进行全程锐性分离,避免损伤神经血管,并避免过度牵拉Buck筋膜及其神经血管束;③利用电动磨钻,采用“移动式”联合“散点式”磨削手法,将整个白膜斑块区域磨削成网格状缺损,使海绵体充分松解;④完整切取睾丸鞘膜,重叠覆盖于白膜网格状缺损区表面,进行缝合;⑤Buck筋膜的完整复位和缝合,以抗击睾丸鞘膜修补区域可能在勃起时的过度膨出;⑥Buck筋膜完整复位缝合后,需再次海绵体注水诱发人工勃起,观察阴茎伸直的恢复情况,并根据情况,必要时,加用有限的白膜折叠技术,做到使阴茎笔直;⑦为促进阴茎勃起功能的恢复及减少手术区域瘢痕愈合导致阴茎缩短的可能性,在手术4周起常规应用他达拉非5 mg,每日1次口服,并采用真空负压助勃装置进行康复训练,每日1次,每次15~20 min,维持治疗2~3个月。
总之,本研究初步结果表明,在显微镜下应用电动磨钻进行白膜斑块的精细磨削松解,联合游离睾丸鞘膜或牛心包进行白膜修补,是矫正阴茎硬结症所致阴茎严重畸形的较理想方法。利用显微技术对Buck筋膜具有更可靠神经血管保护作用,利用电动磨钻进行白膜斑块磨削可更精确而充分松解瘢痕硬结,利用睾丸鞘膜或牛心包可充分修补各类大小的白膜缺损且术后未见补片缺血、坏死、挛缩等并发症,综合应用上述技术治疗阴茎硬结症所导致的严重弯曲畸形,术后中远期随访患者综合满意度可达到90%以上,效果良好。本组患者例数尚较少,随访时间也较为有限,尚需要继续扩大应用的例数和随访的时间,以进一步确定本治疗方案的中远期疗效。
| [1] |
HAUCK E W, WEIDNER W. François de la Peyronie and the disease named after him[J]. Lancet, 2001, 357(9273): 2049-2051. |
| [2] |
CHUNG E, RALPH D, KAGIOGLU A, et al. Evidence-based management guidelines on Peyronie's disease[J]. J Sex Med, 2016, 13(6): 905-923. |
| [3] |
STUNTZ M, PERLAKY A, DES VIGNES F, et al. The prevalence of Peyronie's disease in the United States: a population-based study[J]. PLoS One, 2016, 11(2). |
| [4] |
邓春华. 男科疾病诊断治疗指南[M]. 2022版. 北京: 中华医学电子音像出版社, 2022. DENG C H. The giudeline for andrology disease diagnosis and treatments[M]. version 2022. Beijing: Chinese Medical Multimidia Press, 2022. |
| [5] |
ALMEIDA J, FELÍCIO J, MARTINS F. Surgical planning and strategies for Peyronie's disease[J]. Sex Med Rev, 2021, 9(3): 478-487. |
| [6] |
SHERER B A, LEVINE L A. Contemporary review of treatment options for Peyronie's disease[J]. Urology, 2016, 95: 16-24. |
| [7] |
CHUNG P H, HAN T M, RUDNIK B, et al. Peyronie's disease: what do we know and how do we treat it?[J]. Can J Urol, 2020, 27(S3): 11-19. |
| [8] |
GREEN B, FLORES A, WARNER J, et al. Comparison of collagenase Clostridium histolyticum to surgery for the management of Peyronie's disease: a randomized trial[J]. J Urol, 2023, 210(5): 791-802. |
| [9] |
WAYNE G F, CORDON B H. Contemporary surgical and non-surgical management of Peyronie's disease[J]. Transl Androl Urol, 2018, 7(4): 603-617. |
| [10] |
KADIOGLU A, KÜÇÜKDURMAZ F, SANLI O. Current status of the surgical management of Peyronie's disease[J]. Nat Rev Urol, 2011, 8(2): 95-106. |
| [11] |
RALPH D, GONZALEZ-CADAVID N, MIRONE V, et al. The management of Peyronie's disease: evidence-based 2010 guidelines[J]. J Sex Med, 2010, 7(7): 2359-2374. |
| [12] |
NEHRA A, ALTEROWITZ R, CULKIN D J, et al. Peyronie's disease: AUA guideline[J]. J Urol, 2015, 194(3): 745-753. |
| [13] |
BOLE R, ZIEGELMANN M, AVANT R, et al. Patient's choice of health information and treatment modality for Peyronie's disease: a long-term assessment[J]. Int J Impot Res, 2018, 30(5): 243-248. |
| [14] |
GARAFFA G, TROST L W, SEREFOGLU E C, et al. Understanding the course of Peyronie's disease[J]. Int J Clin Pract, 2013, 67(8): 781-788. |
| [15] |
BILGUTAY A N, PASTUSZAK A W. Peyronie's disease: a review of etiology, diagnosis, and management[J]. Curr Sex Health Rep, 2015, 7(2): 117-131. |
| [16] |
LENTZ A C, CARSON C C 3rd. Peyronie's surgery: graft choices and outcomes[J]. Curr Urol Rep, 2009, 10(6): 460. |
| [17] |
KENDIRCI M, HELLSTROM W J G. Critical analysis of surgery for Peyronie's disease[J]. Curr Opin Urol, 2004, 14(6): 381-388. |
| [18] |
KADIOGLU A, AKMAN T, SANLI O, et al. Surgical treatment of Peyronie's disease: a critical analysis[J]. Eur Urol, 2006, 50(2): 235-248. |
| [19] |
DALKIN B L, CARTER M F. Venogenic impotence following dermal graft repair for Peyronie's disease[J]. J Urol, 1991, 146(3): 849-851. |
| [20] |
LEVINE L A. Partial plaque excision and grafting (PEG) for Peyronie's disease[J]. J Sex Med, 2011, 8(7): 1842-1845. |
| [21] |
LUE T F, EL-SAKKA A I. Venous patch graft for Peyronie's disease. Part Ⅰ: technique[J]. J Urol, 1998, 2047-2049. |
| [22] |
HATZICHRISTODOULOU G, GSCHWEND J E, LAHME S. Surgical therapy of Peyronie's disease by partial plaque excision and grafting with collagen fleece: feasibility study of a new technique[J]. Int J Impot Res, 2013, 25(5): 183-187. |
| [23] |
SAMPAIO J S, PASSARINHO A. Surgical correction of severe Peyronie's disease without plaque excision. A new approach[J]. Eur Urol, 1989, 16(6): 460-462. |
| [24] |
CASTRO A, SIMOES D O, DIAS J, et al. V04-06 multiple transverse dorsal incisions patched with TachoSilⓇ in the surgical treatment of Peyronie's disease: preliminary results[J]. J Urol, 2019, 201(Supplement 4): e493-e. |
| [25] |
GARCÍA-GÓMEZ B, RALPH D, LEVINE L, et al. Grafts for Peyronie's disease: a comprehensive review[J]. Andrology, 2018, 6(1): 117-126. |
| [26] |
HATZICHRISTODOULOU G. Grafting techniques for Peyronie's disease[J]. Transl Androl Urol, 2016, 5(3): 334-341. |
| [27] |
RICE P G, SOMANI B K, REES R W. Twenty years of plaque incision and grafting for Peyronie's disease: a review of literature[J]. Sex Med, 2019, 7(2): 115-128. |
| [28] |
SALONIA A, BETTOCCHI C, BOERI L, et al. European Association of Urology guidelines on sexual and reproductive health-2021 update: male sexual dysfunction[J]. Eur Urol, 2021, 80(3): 333-357. |
| [29] |
HATZICHRISTODOULOU G. Evolution of the surgical sealing patch TachoSilⓇ in Peyronie's disease reconstructive surgery: technique and contemporary literature review[J]. World J Urol, 2020, 38(2): 315-321. |




