2. 550025 贵阳,贵州医科大学基础医学院:分子医学工程研究中心;
3. 生物教研室
2. Department of Biology, Basic Medical School, Guizhou Medical University, Guiyang, Guizhou Province, 550025, China;
3. Research Center of Molecular Medical Engineering
癫痫是一种常见的慢性神经系统疾病[1]。全球约有6 500万人患有癫痫[2]。有研究表明基因突变是癫痫发病的重要因素之一[3]。目前已经确定了多个与癫痫发生相关的基因突变,其中一些基因编码的蛋白与神经元兴奋性调节、离子通道的功能、突触可塑性等神经生物学机制密切相关。
Na+/H+交换体(Na+/H+ exchangers, NHEs)是一类膜转运蛋白家族,通过排出H+来交换Na+内流,积极参与调节细胞内和细胞器pH值,NHE1功能的改变显著影响神经元兴奋性,并在癫痫发病中发挥作用[4]。有研究表明NHE1突变的小鼠具有运动性共济失调和癫痫发作的表型,同时生长和繁殖能力也会下降[5]。一项全外显子组测序显示Lichtenstein-Knorr综合征是由于人类NHE1基因(Slc9a1)突变引起的,可导致耳聋、发育受损、共济失调和癫痫[6]。然而NHE1突变或者敲除后造成众多表型潜在的机制仍旧不清楚。
Ppp3cb是一种钙调蛋白磷酸酶,具有丝氨酸/苏氨酸活性位点,可以结合钙、铁和锌等多种离子发挥作用,Ppp3cb和神经退行性疾病[7]、神经元星形胶质细胞[8]、精神疾病[9]高度相关。Ppm1g也同属于磷酸酶家族,且Ppm1g和精神[10]、行为表型[11]以及运动神经元[12]高度相关,因此探究Ppp3cb和Ppm1g在NHE1基因敲除模型鼠海马组织中的表达水平至关重要。
蛋白质组学技术可以揭示不同个体在生理或病理的状态下,其蛋白质表达的异同,从而帮助我们更加全面地了解疾病的病理生理过程,为确定新的药物治疗靶点,以及改善新的疗法提供信息[13-14]。因此,本研究拟采用蛋白质组学技术,结合课题组前期研究结果[15-17],分析NHE1基因敲除小鼠和正常小鼠海马组织的蛋白质表达差异,并从分子水平探索差异蛋白Ppp3cb和Ppm1g的表达变化,试图为探索癫痫发病机制提供新的线索。
1 材料与方法 1.1 构建NHE1基因敲除模型使用CRISPR/Cas9技术对Slc9a1基因外显子2进行敲除,将CRISPR/Cas9系统微注射到C57BL/ 6JGpt小鼠受精卵中,移植受精卵获得F0代阳性小鼠,经PCR和测序鉴定其基因型,接着将F0代阳性小鼠与C57BL/6JGpt小鼠交配,获得稳定的F1代小鼠模型。
1.2 动物及分组采用的实验动物有:3~4周龄SPF级C57BL/6J Gpt-Slc9a1雄鼠1只及雌鼠3只,购自江苏集萃药康生物科技股份有限公司,体质量10~14 g;6周龄C57BL/6J雄鼠2只及雌鼠3只,来自贵州医科大学动物实验中心。小鼠均饲养于SPF级环境,室内的温度保持在22~28 ℃,相对湿度维持在40%~60%,昼夜明暗交替时间为12 h/12 h。基因型鉴定后选取2周龄野生型雄鼠6只作为对照(Control)组,纯合型雄鼠6只作为模型(Model)组。所有实验经过贵州医科大学伦理委员会批准(No.2303414),通过戊巴比妥钠腹腔麻醉处理后取材,符合动物实验相关的伦理和福利原则。
1.3 基因型鉴定提取鼠尾DNA后经PCR扩增鉴定。PCR反应体系包括2×Taq Master Mix (Dye Plus)(南京诺唯赞生物科技股份有限公司)12.5 μL,ddH2O 9.5 μL,P1和P2引物各1 μL。PCR方案按如下进行:95 ℃启动5 min,98 ℃扩增30 s,65 ℃进行30 s,72 ℃进行45 s,20个循环后继续在98 ℃下扩增30 s,55 ℃进行30 s,在72 ℃进行45 s,重复20个循环,接着在72 ℃下扩增5 min,10 ℃保持。最后通过琼脂糖凝胶电泳,在凝胶成像仪中观察拍照(图 1A)。琼脂糖凝胶电泳基因分型引物序列信息为:P1正向5′-GGACAGTTGGCG-AATACTCTGTG-3′和反向5′-GCCTCCTCAGAGATTA-AATGGGC-3,P2正向5′-AACCTTCTGTTCTTCTGGCT- CCC-3′和反向5′-GCAGAGATGATGCTGCCAAAGAG-3′。
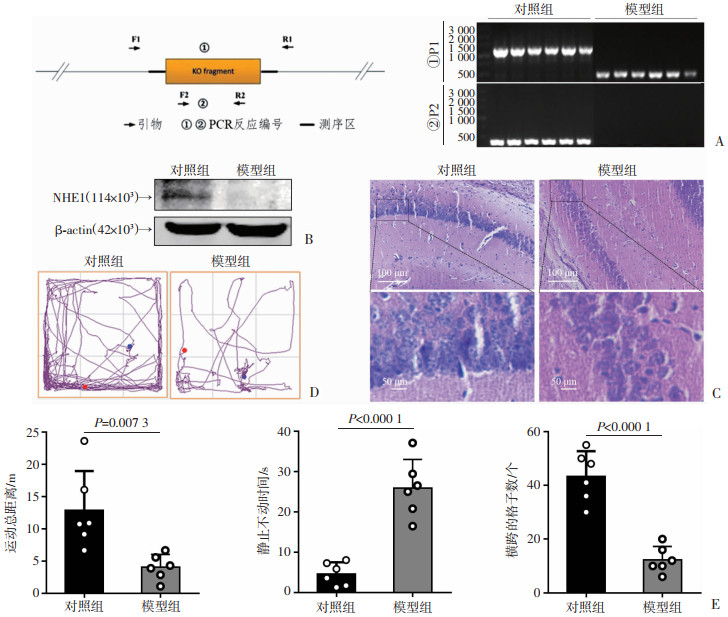
|
| A:基因型鉴定和琼脂糖凝胶电泳;B:Western blot检测NHE1的蛋白表达;C:小鼠海马区域HE染色;D:旷场实验代表性轨迹图;E:分别为2组运动总路程、强迫游泳不动时间和跨越的格子数(n=6, x ± s) 图 1 小鼠基因型鉴定、行为学和HE染色 |
1.4 癫痫发作分级
采用Racine标准对小鼠的发作进行分级:0级无抽搐发作,Ⅰ级面部阵挛(眼、鼻、嘴唇),Ⅱ级面部阵挛+咀嚼、节律性点头,Ⅲ级单只前肢阵挛伴节律性点头,Ⅳ级双侧前肢持续性痉挛伴站立,Ⅴ级全身强直阵挛发作或跌倒。
1.5 蛋白质组学 1.5.1 蛋白提取、酶解与肽段标记通过研磨、裂解、超声、离心相结合的方法对样品蛋白进行高效提取,接着用TCA/丙酮沉淀蛋白,经丙酮清洗后溶解蛋白沉淀,进行蛋白质控。质控合格后,各组取等量(通常100 μg)蛋白进行酶解消化。为提高酶解效率,通常在酶解前进行还原、烷基化处理,并进行二次酶解。酶解产生的肽段经脱盐处理即可进行iTRAQ/TMT标记反应。标记反应目的在于通过在不同样品肽段的末端分别加上异质同位素标记的报告基团,来对各组样品的肽段进行精确定量。
1.5.2 组分分离与质谱上机为了减低单次上机的肽段复杂度,提高整体蛋白鉴定的通量,需要对标记肽段进一步组分分离。这里通过高pH反向C18色谱柱对混合后的标记肽段进行HPLC组分分离,根据样品蛋白的复杂程度,通常分为8~20个组分。接着每一个肽段组分分别进行LC-MS/MS鉴定,使用nanoLC1000对肽段梯度洗脱,然后进入Orbitrap Elite组合式质谱仪/Q Exactive组合式质谱仪质谱鉴定,挑选20个高强度母离子进行二级质谱鉴定与定量。
1.5.3 生物信息学分析质谱数据下机后使用Mascot、Request等数据库进行检索并对蛋白进行鉴定和定量分析,最后对鉴定到的差异蛋白做基因本体论(Gene Ontology Analysis, GO)分析。使用蛋白网络数据库(search tool for the retrieval of interesting genes, STRING) 对所有差异蛋白进行蛋白相互作用(protein-protein interaction, PPI)分析。
1.6 行为学评估旷场实验(open field test, OFT)在透明箱(长36 cm×宽36 cm ×高40 cm)内进行,观察小鼠10 min内运动总距离和跨越的格子数,使用视频分析系统(美国Stoelting公司)记录。结束时用75%乙醇清除老鼠的排泄物。强迫游泳(forced swimming test, FST)实验在一长30 cm×宽20 cm×高10 cm桶内进行,水温23~25 ℃,观察并记录1 min内小鼠在水面漂浮不动的时间。对小鼠不动状态的评估是指主动放弃挣扎,躯体呈漂浮状态,无扭动、重心稳定的时间。
1.7 HE染色4%多聚甲醛(PFA)固定海马组织,常规石蜡切片脱蜡至水。接着按照试剂盒标准步骤进行染色。HE染色试剂盒购自于北京索莱宝科技有限公司。最后使用光学显微镜(日本Nikon公司)观察并捕捉图像。
1.8 Western blot检测用RIPA裂解缓冲液裂解海马组织。使用BCA蛋白分析试剂盒(北京索莱宝科技有限公司)测定总蛋白浓度。使用SDS-PAGE来分离蛋白的提取物,然后转移到PVDF膜上。接着使用高效封闭液(上海积福生命科学有限公司)30 min,一抗在4 ℃下孵育过夜[NHE1(1 ∶200,Abcam,AB216573), Ppp3cb(1 ∶1 000,Proteintech,13340-1-AP),Ppm1g(1 ∶100,Proteintech,15532-1-AP),β-actin(1 ∶1 000,Affinity,BS6007M)]。PBS洗涤后二抗在37 ℃下孵育2 h。通过增强化学发光试剂盒(杭州弗德生物科技有限公司)蛋白质条带可视化。使用化学曝光仪(上海天能科技有限公司)观察和拍照。最后使用Image J软件对结果进行量化。
1.9 实时荧光定量PCR所有试剂由北京宝日医生物技术有限公司提供。使用TRIzol试剂从速冻的海马组织或收集的细胞中分离总RNA,最终获得的cDNA是从使用随机引物逆转录的1 μg总RNA中获得的。使用由cDNA、特异性引物和TB Green® Premix Ex Taq Ⅱ(Tli RNaseH Plus)组成的混合物进行qPCR。简而言之,PCR方案在95 ℃下启动30 s,然后使用预扩增系统在95 ℃下进行40个循环的扩增阶段5 s,在60 ℃下进行30 s。为了鉴定扩增特异性,使用熔解曲线分析Ppp3cb和Ppm1g基因的PCR产物,同时使用β-actin作为内参。mRNA水平的相对定量通过2-ΔΔCt测量。使用到的引物从5′到3′如下所示: Ppp3cb正向5′-GTAAAAGAA-GGGCGGGTGGA-3′和反向5′-TGGATGTCACCACACA-CTGTA-3, Ppm1g正向5′- FAGAATGCTGGTGGCAAG-GTC-3′和反向5′-GTAGAAGTGGTCTCCAATGGC-3′。
1.10 免疫组化检测4%多聚甲醛(PFA)固定海马组织,常规石蜡切片脱蜡至水。使用3%H2O2灭活内源性过氧化物酶10 min,用Tris-EDTA缓冲液修复抗原,5%BSA缓冲液阻断30 min,一抗在4 ℃下孵育过夜。使用的一抗分别为:Ppp3cb(1 ∶1 000,Proteintech,13340-1-AP),Ppm1g(1 ∶100,Proteintech,15532-1-AP)。接着使用免疫组织化学检测试剂盒(美国Boster公司)孵育1 h,苏木精重新复染,最后使用DAB染色液显色后在光学显微镜(日本Nikon公司)下观察并捕捉图像。
1.11 统计学分析使用Graphpad Prism(6.0)进行统计分析并作图,数据以x ± s表示,2组间比较采用t检验,多组间比较采用单因素方差分析,2组间差异比较采用Tukey多重比较检验。P < 0.05被认为差异具有统计学意义。
2 结果 2.1 小鼠基因型鉴定通过琼脂糖凝胶电泳的方法鉴定小鼠的基因型,在第1个PCR反应(P1)中,1 260 bp条带是对照组,489 bp条带是模型组。而在第2个PCR反应(P2)中,418 bp条带是对照组,0 bp条带是模型组。如图 1A所示,从左到右分别为对照组、模型组。另外,模型组V级发作后会立即死亡,并且使用Western blot证实了NHE1的敲除(图 1B)。
2.2 小鼠行为学和病理学的表现为了进一步确定NHE1敲除对小鼠的影响,通过旷场实验和强迫游泳实验对2组小鼠进行行为学评估。结果显示,模型鼠的运动总距离相比较对照组减少(P=0.007 3),跨越的格子数比对照组显著减少(P<0.000 1),模型鼠不动的时间明显延长(P<0.000 1,图 1D、E)。另外,HE染色发现,对照组细胞核正常,色均一,胞质淡染,而模型组海马区细胞胞质融合,轮廓模糊,细胞核固缩变圆,染色加深(图 1C)。
2.3 蛋白质组学分析 2.3.1 海马组织中的差异蛋白以表达倍数(FC)≥1.2倍且P < 0.05为筛选标准,检测到海马组织中845个差异表达的蛋白质点,其中有9个蛋白表达上调,7个蛋白表达下调。其中Ppp3cb下调,Ppm1g上调(表 1)。
| 蛋白质编号 | 蛋白名称 | 基因名 | 调节 | 模型/对照 | P值 |
| Q3UID0 | SWI/SNF complex subunit SMARCC2 | Smarcc2 | 下调 | 1.734365 | 0.019 |
| G3X8U7 | Serine/threonine-protein phosphatase | Ppp3cb | 下调 | 1.220018 | 0.034 |
| Q99PT1 | Rho GDP-dissociation inhibitor 1 | Arhgdia | 下调 | 1.377619 | 0.031 |
| P62996 | Transformer-2 protein homolog beta | Tra2b | 下调 | 2.909768 | 0.033 |
| Q03517 | Secretogranin-2 | Scg2 | 下调 | 2.063898 | 0.018 |
| P09528 | Ferritin heavy chain | Fth1 | 下调 | 2.201237 | 0.013 |
| Q6PAJ1 | Breakpoint cluster region protein | Bcr | 下调 | 1.857252 | 0.016 |
| G5E8R4 | SAPS domain family, member 3 | Ppp6r3 | 上调 | 0.594700 | 0.029 |
| Q9CT10 | Ran-binding protein 3 | Ranbp3 | 上调 | 0.664929 | 0.017 |
| A2ARP8 | Microtubule-associated protein 1A | Map1a | 上调 | 0.724632 | 0.029 |
| Q9WV92 | Band 4.1-like protein 3 | Epb41l3 | 上调 | 0.802555 | 0.014 |
| P17182 | Alpha-enolase | Eno1 | 上调 | 0.811451 | 0.037 |
| A0A3B2W7J8 | Plectin | Plec | 上调 | 0.470013 | 0.028 |
| Q8BHE3 | Caytaxin | Atcay | 上调 | 0.821322 | 0.032 |
| E9PWP6 | Regulating synaptic membrane exocytosis protein 1 | Rims1 | 上调 | 0.514933 | 0.047 |
| Q61074 | Protein phosphatase 1G | Ppm1g | 上调 | 0.649490 | 0.011 |
2.3.2 差异蛋白GO、PPI分析
GO功能注释结果表明,NHE1敲除后,在分子功能(MF)富集中(图 2A),对照组和模型组显著富集在蛋白丝氨酸/苏氨酸磷酸酶活性、GTP酶结合、蛋白磷酸酶结合、磷酸酶活性以及磷酸酶结合等,其中富集在蛋白丝氨酸/苏氨酸磷酸酶活性的差异最显著。在细胞成分(CC)富集中(图 2B),对照组和模型组显著富集在质膜部分、细胞外空间、肌纤维膜以及收缩纤维等,其中富集在质膜部分的差异蛋白数量最多。在生物过程(BP)富集中(图 2C),对照组和模型组显著富集在负向调节生物过程、免疫系统过程、对其他生物的反应、对外界生物刺激的反应、对生物刺激的反应、免疫效应过程的调控、调节胞外分泌、蛋白去磷酸化、免疫反应、免疫效应过程、去磷酸化、调节分泌途径、白细胞介导的免疫调节、白细胞介导的免疫负调控、免疫系统过程的负调节、免疫应答负向调节、免疫效应过程的负向调控、白细胞介导的免疫、钙离子调节、胞吐作用等,其中富集在白细胞介导的免疫负调控、免疫应答负向调节、免疫效应过程的负向调控的差异最显著,而富集在负向调节生物过程、免疫系统过程的差异蛋白数量最多。
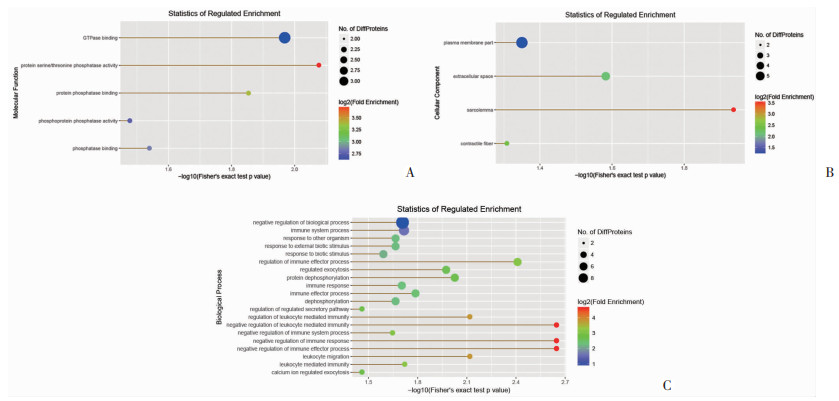
|
| A:分子功能(MF);B:细胞成分(CC);C:生物过程(BP) 图 2 差异表达蛋白质GO分析 |
另外,通过STRING数据库,分析了全部差异蛋白之间的蛋白质相互作用关系(图 3A),其中Ppp3cb和Slc9a1有直接作用关系(图 3B),另外,Ppm1g通过Ppp3cb和Slc9a1有间接作用关系,Ppp3cb和Ppm1g之间相互作用(图 3C)。
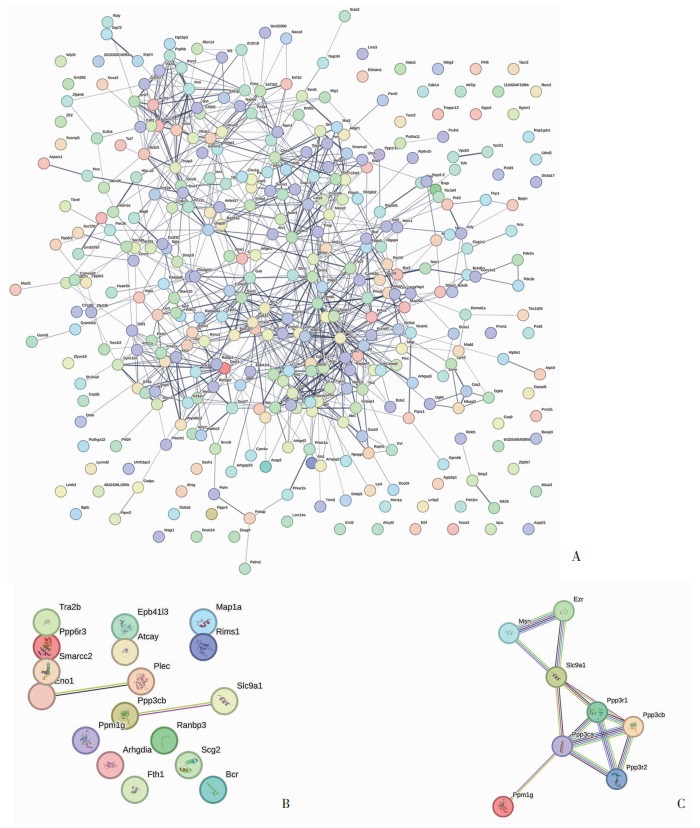
|
| A:全部差异蛋白的蛋白互作关系; B、C:Ppp3cb、Ppm1g和Slc9a1的蛋白互作关系 图 3 蛋白互作关系分析 |
2.3.3 差异蛋白Ppp3cb和Ppm1g在NHE1基因敲除小鼠模型中的表达
为了进一步确定Ppp3cb和Ppm1g的表达是否异常,采用qPCR和Western blot检测海马组织中差异蛋白Ppp3cb和Ppm1g的mRNA和蛋白的表达。与对照组相比,模型组Ppp3cb的mRNA和蛋白的表达量下降(P<0.05),而Ppm1g的表达相反(P<0.01,图 4A)。此外,免疫组织化学显示Ppp3cb在NHE1基因敲除模型鼠海马组织中的CA1、CA3、DG区表达减少(P<0.05,图 4B),而Ppm1g在NHE1基因敲除模型鼠海马组织中的CA1、CA3、DG区的表达量上升(P<0.05,图 4C)。这些结果表明Ppp3cb和Ppm1g可能参与了NHE1基因敲除模型小鼠癫痫发病的机制。

|
| A: Ppp3cb和Ppm1g的蛋白和mRNA水平及分析(n=3, x ± s); B: 免疫组化检测小鼠CA1、CA3、DG区的Ppp3cb的表达量及分析; C免疫组化检测小鼠CA1、CA3、DG区的Ppm1g的表达量及分析 图 4 2组小鼠海马组织中差异蛋白Ppp3cb和Ppm1g mRNA和蛋白的表达 |
3 讨论
Na+/H+交换体1是一类膜转运蛋白家族之一。其活性受到钙离子的调控,细胞内的钙离子通过与钙调蛋白形成复合物来调节细胞的功能[18]。然而NHE1突变或者敲除后造成众多表型潜在的机制仍旧不清楚。本研究基于海马蛋白质组学的研究发现,Ppp3cb表达下调和Ppm1g表达上调。
Ppp3cb具有4个结构域: 催化结构域、螺旋钙调蛋白b结合段、钙调蛋白结合段和自身抑制肽段。Ppp3cb被激活后与靶蛋白结合,使底物蛋白去磷酸化,进而促进信号转导[19]。Ppp3cb在人类胚胎早期的多个组织中都有表达,该基因与神经发育密切相关,与Ppp3cb相关的疾病有精神分裂症[20]。一项回顾性队列研究显示[21],入院的精神分裂症患者癫痫发作的风险增加,癫痫患者合并精神分裂症的风险也增加。除此之外,严重的难治性癫痫患者合并精神分裂症的风险更高。越来越多的研究表明,Ppp3cb在癫痫和精神分裂症中都起着关键作用,它们之间存在双向关系和共享机制[22]。本研究发现,NHE1基因敲除小鼠海马CA1、CA3、DG区Ppp3cb的表达量下降,其在转录和翻译水平也如此。这些结果表明,Ppp3cb很可能参与了NHE1基因敲除鼠癫痫的发病机制。
Ppm1g也同属于磷酸酶家族。Ppm1g和镁、锰等离子结合形成蛋白磷酸酶全酶复合体,参与mRNA剪接、染色质重塑、DNA损伤应答、蛋白质翻译以及细胞凋亡等过程[12, 23]。本研究蛋白质组学结果显示,蛋白磷酸酶Ppm1g上调。PPI分析表明Ppm1g通过Ppp3cb和Slc9a1有间接作用关系,Ppp3cb和Ppm1g之间相互作用。进一步验证结果提示Ppm1g的蛋白和mRNA表达量增加,在NHE1基因敲除小鼠海马CA1、CA3、DG区表达量也增加。研究表明,Ppm1g可以通过磷酸化、乙酰化和泛素化等许多种方式进行调节,Ppm1g的表达量和基因突变、激酶的调控以及启动子的甲基化相关,与Ppm1g相关的疾病包括肿瘤[24]与品行障碍[11]。一项遗传分析证实,一名男性中年癫痫患者,因基因突变导致脊髓肿瘤发生[25],并且较高水平的Ppm1g与不良预后密切相关[26]。Ppm1g甲基化的改变是品行障碍患者冒险倾向、冲动增加的原因之一,而品行障碍病史是一种和癫痫高度相关的危险因素[27]。Ppm1g与神经元细胞凋亡增加以及应激信号升高有关,其具有显著的胚胎致死性,Ppm1g在调节细胞的周期进程和应激反应中都在发挥着至关重要的作用[10]。Ppm1g的过表达促进去磷酸化,从而改变细胞周期、转录和调控[28]。因此,Ppm1g可能在参与癫痫发病机制中起着非常关键的作用。
蛋白质的磷酸化是一种普遍存在的可逆翻译后修饰,参与各种各样的生物活动过程。在人类中,98%的磷酸化存在于丝氨酸/苏氨酸,且受到蛋白激酶和蛋白磷酸酶的调节[29]。此外,丝氨酸/苏氨酸的去磷酸化由3种不同的磷酸酶调节,分别是钙调蛋白磷酸酶、磷酸蛋白磷酸酶,以及基于天冬氨酸的RNA聚合酶,其中钙调蛋白磷酸酶的作用最重要[30]。
有研究表明,缺乏钙调蛋白磷酸酶的小鼠,表现为运动能力减弱,其骨骼肌的过度磷酸化与线粒体结构异常有关[31]。本研究结果显示,NHE1基因敲除小鼠运动能力明显下降,其海马神经元细胞胞质融合,轮廓模糊,核固缩变圆,染色加深。一项基于生物本体的分析表明,钙调蛋白磷酸酶在对环境变化的适应性代谢反应中起着高度保守的枢纽作用,介导和细胞过程相关的基因表达[32],因此,钙调蛋白磷酸酶也间接反映了神经毒性。钙调蛋白磷酸酶在控制全身能量和体重稳态中起关键作用,因此,和钙调蛋白磷酸酶相关的信号是许多生理过程的核心[33]。
本研究中GO-MF显著富集在蛋白丝氨酸/苏氨酸磷酸酶活性、GTP酶结合、蛋白磷酸酶结合、磷酸酶活性以及磷酸酶结合等,并且蛋白质组学结果显示钙调蛋白磷酸酶家族成员Ppp3cb下调,PPI结果表明,Ppp3cb和Slc9a1有直接作用关系。另外,GO-CC显著富集在质膜部分、细胞外空间、肌纤维膜以及收缩纤维等,其中质膜部分数量最多,提示缺失NHE1,胞外区域最先受到影响,导致胞内和胞外失去联系,胞内会启动其他的结构和连接进行代偿,从而维持细胞稳态。GO-BP富集在负向调节生物过程、蛋白质的去磷酸化、免疫应答、钙离子调节以及胞吐作用等过程,说明NHE1会影响蛋白质的磷酸化水平,这一机制可能和钙离子相关的调控有关。
综上所述,本研究确定了NHE1基因敲除小鼠海马组织中差异蛋白Ppp3cb和Ppm1g的表达变化,为进一步研究Ppp3cb和Ppm1g参与癫痫发病机制提供了依据,但具体的机制还需要深入研究。
| [1] |
DUKO B, AYALEW M, TOMA A. The epidemiology of headaches among patients with epilepsy: a systematic review and meta-analysis[J]. J Headache Pain, 2020, 21(1): 3. |
| [2] |
MESRAOUA B, TOMSON T, BRODIE M, et al. Sudden unexpected death in epilepsy (SUDEP): definition, epidemiology, and significance of education[J]. Epilepsy Behav, 2022, 132: 108742. |
| [3] |
SYMONDS J D, ZUBERI S M, JOHNSON M R. Advances in epilepsy gene discovery and implications for epilepsy diagnosis and treatment[J]. Curr Opin Neurol, 2017, 30(2): 193-199. |
| [4] |
吴旭玲, 冯占辉, 叶兰. NHE1在神经系统疾病中的研究进展[J]. 癫痫与神经电生理学杂志, 2021, 30(6): 363-367. WU X L, FENG Z H, YE L. Research progress of NHE1 in nervous system diseases[J]. J Epileptol Electroneuro-physiol China, 2021, 30(6): 363-367. |
| [5] |
ZHAO H S, CARNEY K E, FALGOUST L, et al. Emerging roles of Na+/H+ exchangers in epilepsy and developmental brain disorders[J]. Prog Neurobiol, 2016, 138/139/140: 19-35. |
| [6] |
GUISSART C, LI X J, LEHEUP B, et al. Mutation of SLC9A1, encoding the major Na+/H+ exchanger, causes ataxia-deafness Lichtenstein-Knorr syndrome[J]. Hum Mol Genet, 2015, 24(2): 463-470. |
| [7] |
RUSMINI P, CORTESE K, CRIPPA V, et al. Trehalose induces autophagy via lysosomal-mediated TFEB activation in models of motoneuron degeneration[J]. Autophagy, 2019, 15(4): 631-651. |
| [8] |
PFUHLMANN K, SCHRIEVER S C, LEGUTKO B, et al. Calcineurin A beta deficiency ameliorates HFD-induced hypothalamic astrocytosis in mice[J]. J Neuroinflammation, 2018, 15(1): 35. |
| [9] |
FORERO D A, HERTELEER L, DE ZUTTER S, et al. A network of synaptic genes associated with schizophrenia and bipolar disorder[J]. Schizophr Res, 2016, 172(1/2/3): 68-74. |
| [10] |
FOSTER W H, LANGENBACHER A, GAO C, et al. Nuclear phosphatase PPM1G in cellular survival and neural development[J]. Dev Dyn, 2013, 242(9): 1101-1109. |
| [11] |
PARK C I, KIM H W, HWANG S S, et al. Association of PPM1G methylation with risk-taking in alcohol use disorder[J]. Sci Rep, 2020, 10(1): 5490. |
| [12] |
SUN C, WANG G H, WRIGHTON K H, et al. Regulation of p27Kip1 phosphorylation and G1 cell cycle progression by protein phosphatase PPM1G[J]. Am J Cancer Res, 2016, 6(10): 2207-2220. |
| [13] |
BINDILA L, EID T, MILLS J D, et al. A companion to the preclinical common data elements for proteomics, lipidomics, and metabolomics data in rodent epilepsy models. A report of the TASK3-WG4 omics working group of the ILAE/AES joint translational TASK force[J]. Epilepsia Open, 2022. |
| [14] |
ZHENG Y Q, JIN M F, SUO G H, et al. Proteomics for studying the effects of ketogenic diet against lithium chloride/pilocarpine induced epilepsy in rats[J]. Front Neurosci, 2020, 14: 562853. |
| [15] |
谢懂君, 郑乾, 彭爽, 等. 癫痫模型大鼠心肌组织钠氢交换体1的表达及与凋亡的关系[J]. 癫痫与神经电生理学杂志, 2022, 31(1): 7-11. XIE D J, ZHENG Q, PENG S, et al. The relationship of the expression of sodium hydrogen exchanger 1 and apoptosis in myo-cardial tissue of epileptic rats[J]. J Epileptol Electroneurophysiol China, 2022, 31(1): 7-11. |
| [16] |
马鹏飞, 彭爽, 谢懂君, 等. Cariporide对癫痫模型大鼠心肌细胞凋亡的影响[J]. 癫痫与神经电生理学杂志, 2022, 31(4): 193-196, 202. MA P F, PENG S, XIE D J, et al. Effect of cariporide on cardiomyocyte apoptosis in epileptic rats[J]. J Epileptol Electroneurophysiol China, 2022, 31(4): 193-196, 202. |
| [17] |
彭爽, 吴旭玲, 于云莉, 等. 钠氢交换体1在氯化锂-匹罗卡品点燃癫痫大鼠模型海马组织内的表达[J]. 贵州医科大学学报, 2021, 46(1): 16-21. PENG S, WU X L, YU Y L, et al. Expression of NHE1 in hippocampus of epileptic rat model kindled by lithium pilocarpine[J]. J Guizhou Med Univ, 2021, 46(1): 16-21. |
| [18] |
CHEN H L, SONG L J, LI G X, et al. Human rotavirus strain Wa downregulates NHE1 and NHE6 expressions in rotavirus-infected Caco-2 cells[J]. Virus Genes, 2017, 53(3): 367-376. |
| [19] |
CHEN L, HE Q L, LIU Y M, et al. PPP3CB inhibits migration of G401 cells via regulating epithelial-to-mesenchymal transition and promotes G401 cells growth[J]. Int J Mol Sci, 2019, 20(2): 275. |
| [20] |
LIU C M, FANN C S, CHEN C Y, et al. ANXA7, PPP3CB, DNAJC9, and ZMYND17 genes at chromosome 10q22 associated with the subgroup of schizophrenia with deficits in attention and executive function[J]. Biol Psychiatry, 2011, 70(1): 51-8. |
| [21] |
ANDERSEN K M, PETERSEN L V, VESTERGAARD M, et al. Premature mortality in persons with epilepsy and schizophrenia: a population-based nationwide cohort study[J]. Epilepsia, 2019, 60(6): 1200-1208. |
| [22] |
TAO H, ZHOU X, CHEN J, et al. Genetic effects of the schizophrenia-related gene DTNBP1 in temporal lobe epilepsy[J]. Front Genet, 2021, 12: 553974. |
| [23] |
XIONG D L, LI Q, WANG H, et al. High expression of PPM1G is associated with the progression and poor prognosis of hepatocellular carcinoma[J]. Cancer Biomark, 2022, 34(1): 13-22. |
| [24] |
LIN Y R, YANG W J, YANG G W. Prognostic and immunological potential of PPM1G in hepatocellular carcinoma[J]. Aging, 2021, 13(9): 12929-12954. |
| [25] |
DE SOUZA P V S, DE REZENDE PINTO W B V, SANTOS A J. Metastatic breast cancer in a man with nonprogressive ataxia and epilepsy[J]. Neurology, 2015, 85(13): 1183-1184. |
| [26] |
CHEN J Y, LI J Z, SUN H, et al. PPM1G promotes the progression of lung adenocarcinoma by inhibiting p38 activation via dephosphorylation of MEK6[J]. Carcinogenesis, 2023, 44(1): 93-104. |
| [27] |
HERZOG A G. Association between family history of alcohol use disorder and catamenial epilepsy[J]. Epilepsia, 2022, 63(6): e63-e67. |
| [28] |
CHEN D W, ZHAO Z G, CHEN L, et al. PPM1G promotes the progression of hepatocellular carcinoma via phosphorylation regulation of alternative splicing protein SRSF3[J]. Cell Death Dis, 2021, 12(8): 722. |
| [29] |
ZHANG W, LI J, ZHAO N, et al. Ratiometric fluorescence biosensor for imaging of protein phosphorylation levels in atherosclerosis mice[J]. Anal Chim Acta, 2022, 1208: 339825. |
| [30] |
KUMAR P, TATHE P, CHAUDHARY N, et al. PPM1G forms a PPP-type phosphatase holoenzyme with B56δ that maintains adherens junction integrity[J]. EMBO Rep, 2019, 20(10): e46965. |
| [31] |
PFLUGER P T, KABRA D G, AICHLER M, et al. Calcineurin links mitochondrial elongation with energy metabolism[J]. Cell Metab, 2015, 22(5): 838-850. |
| [32] |
LEE B H, KIM J H, KIM J M, et al. The early molecular processes underlying the neurological manifestations of an animal model of Wilson's disease[J]. Metallomics, 2013, 5(5): 532-540. |
| [33] |
NOLZE A, KÖHLER C, RUHS S, et al. Calcineurin (PPP3CB) regulates angiotensin Ⅱ-dependent vascular remodelling by potentiating EGFR signalling in mice[J]. Acta Physiol (Oxf), 2021, 233(3): e13715. |




