胆汁淤积是指各种原因引起的胆汁生成和排泌障碍导致胆汁不能正常流入十二指肠进行肠肝循环的一种病理状态。持续的胆汁淤积可能导致肝损伤、肝纤维化甚至发展为肝硬化[1]。胆汁酸是胆汁的重要成分,在胆汁淤积的病理状态下,过量的胆汁酸积聚导致肝细胞损伤,1%胆酸(cholic acid,CA)饮食喂养是经典的构建胆汁淤积小鼠模型的方法[2-3]。肝脏是胆汁酸合成的主要器官,胆汁酸的合成和排泌与胆汁淤积病理状态密切相关,其中大部分胆汁酸由经典途径合成,其重要限速酶有胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,Cyp7a1)等[4-5]。肝细胞内产生的未结合胆汁酸,主要由肝脏解毒酶如Cyp2b10、Cyp3a4、尿苷二磷酸葡萄糖醛基酶1A1(udp-glucuronosyltransferase, Ugt1a1)、胆盐磺基转移酶(sulfotransferase family 2A member 1, Sult2a1/2)等代谢后变为毒性较低的结合胆汁酸[6]。因此,胆汁酸代谢在胆汁淤积疾病机制的探索中至关重要。
褪黑素(melatonin, Mel)在生物体内广泛表达,褪黑素由松果体和外周器官(如胃肠道和胆道)分泌,有强大的神经内分泌免疫调节活性和清除自由基抗氧化能力[7-10]。WU等[11]指出褪黑素在哺乳动物中至少有2种不同的受体,分别为褪黑素受体1A和1B(MT1和MT2),MT1信号下调可改善胆道损伤和肝脏表型。目前对于褪黑素改善胆汁淤积肝病的研究主要集中在抗氧化应激、抗纤维化、抗炎和抗细胞凋亡等作用机制,但褪黑素对胆汁酸代谢的影响仍不清楚,本研究通过胆汁酸合成和肝脏解毒酶的变化对胆酸诱导的胆汁淤积病理状态的研究,来探索褪黑素改善胆汁淤积性肝病的可行性。
1 材料与方法 1.1 材料与试剂褪黑素(M5250)和1%胆酸购自Sigma Aldrich公司,α-SMA购自Abcam公司,TRIzol试剂购自Invitrogen公司,逆转录试剂盒和TB Green Premix Ex Taq Ⅱ购自TaKaRa公司,磷酸酶抑制剂和蛋白酶抑制剂购自Roche公司。
1.2 动物模型8周龄雄性C57BL/6J小鼠,体质量(20±2) g,购自陆军军医大学实验动物中心。小鼠按随机数字表法分为3组,每组5只,分别为对照组、1%CA组和1%CA+Mel组,对照组喂养正常饮食,1%CA组和1%CA+Mel组喂养1%CA饮食,1%CA+Mel组同时腹腔注射褪黑素100 mg/kg溶于无菌生理盐水中,对照组和1%CA组腹腔注射等量无菌生理盐水,每天1次,连续2周[12]。小鼠取材前禁食12 h,留取肝组织保存于液氮或多聚甲醛固定。小鼠肝脏总胆汁酸于陆军军医大学第一附属医院检验科进行检测。所有动物实验和方案已经通过陆军军医大学实验动物福利伦理审查委员会批准(AMUWEC20211902)。
1.3 总RNA提取、逆转录及RT-qPCR使用TRIzol法提取小鼠肝脏总RNA,然后使用反转录试剂盒得到cDNA,检测ColⅠa1、ColⅡa1、Tgfβ1、α-SMA、Cyp7a1、Cyp8b1、Cyp2b10和Ugt1a1的mRNA的水平。
1.4 Western blot检测提取肝脏总蛋白使用含有磷酸酶抑制剂和蛋白酶抑制剂的RIPA裂解液,采用SDS-PAGE技术分离蛋白。一抗:Cyp7a1(1∶1 000)、Cyp2b10(1∶1 000)、Ugt1a1(1∶1 000)和Sult2a1/2(1∶1 000)和Gapdh(1∶5 000)。数据采用Image J软件进行统计分析。
1.5 小鼠肝组织免疫组化染色肝组织在多聚甲醛固定后,脱水石蜡包埋,对小鼠肝脏标本进行切片并常规脱蜡,进行α-SMA(1∶1 000)免疫组化染色,中性树胶封片后镜下观察。
1.6 肝组织总胆汁酸(total bile acids, TBA)测定从液氮中取出小鼠肝组织,加入75%酒精中研磨,其混悬液匀速混匀过夜后置于65 ℃水浴中2 h,离心后取上清检测TBA指标。
1.7 液相色谱- 串联质谱(LC-MS/MS)取小鼠血清100 μL,使用ACQUITY BEH C18色谱柱分离萃取混合物中的胆汁酸,检测胆酸、牛磺胆酸、牛磺鹅去氧胆酸、牛磺鼠胆酸、牛磺石胆酸、甘氨胆酸、甘氨鹅去氧胆酸、鹅去氧胆酸、3-去氢胆酸等的含量。随后,胆汁酸的含量通过ACQUITY液相色谱与带有ESI源的XEVO TQ-S质谱仪联用测定。胆汁酸的LC-MS/MS分析由上海中科新生命生物科技有限公司提供技术支持。
1.8 统计学分析所有数据采用SPSS 26.0软件进行统计学分析。首先验证每组数据的正态性,符合正态分布数据以x±s表示,各组之间比较采用单因素方差分析;不满足正态分布时,数据以M(P25,P75)表示,各组之间用非参数K-W检验。P<0.05表示差异具有统计学意义。
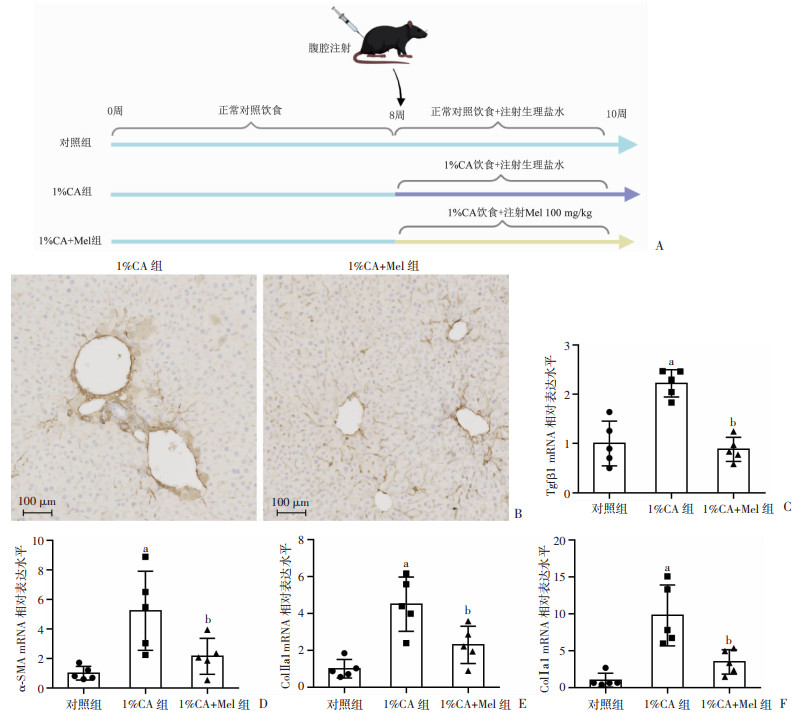
2 结果 2.1 褪黑素减少胆酸诱导的胆汁淤积的肝星状细胞活化通过构建1%CA饲料喂养的小鼠模型来研究褪黑素对胆汁淤积造成的肝纤维化作用(图 1A)。在1%CA喂养的小鼠胆汁淤积模型中,α-SMA免疫组化观察褪黑素处理前后胆汁淤积小鼠肝星状细胞活化的变化。结果显示,与1%CA组比较,1%CA+Mel组小鼠肝脏内肝星状细胞活化明显减少(图 1B)。通过RT-qPCR检测褪黑素对胆汁淤积病理状态下肝纤维化相关指标mRNA水平的影响,结果显示,与对照组相比,1%CA组的ColⅠa1、ColⅡa1、Tgfβ1和α-SMA的mRNA水平均显著升高(图 1C~F);与1%CA组相比,1%CA+Mel组纤维化指标ColⅠa1、ColⅡa1、Tgfβ1和α-SMA的mRNA水平明显下降,且差异具有统计学意义(P<0.05)。上述结果说明褪黑素能够抑制胆汁淤积小鼠肝脏肝星状细胞激活减少细胞外基质沉积。
|
|
a:P<0.05,与对照组比较;b:P<0.05,与1%CA组比较 A:小鼠1%CA胆汁淤积模型的建立;B:通过免疫化学组织染色检测1%CA组和1%CA+Mel组小鼠肝组织α-SMA的表达情况;C~F:各组小鼠肝脏内Tgfβ1、α-SMA、ColⅡa1和ColⅠa1的mRNA表达水平(n=5,x±s) 图 1 褪黑素对1%CA喂养小鼠肝星状细胞活化及肝纤维化指标mRNA表达水平的影响 |
2.2 褪黑素减少胆酸诱导的胆汁淤积肝病小鼠肝内外胆汁酸水平
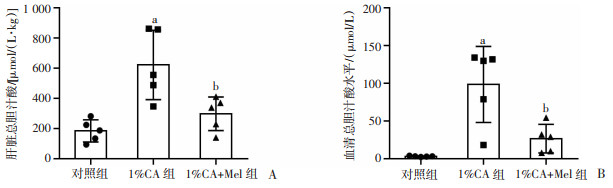
检测各组小鼠血清和肝组织中的TBA水平,结果发现,与1%CA组比较,1%CA+Mel组的小鼠TBA水平显著降低(P<0.05,图 2)。LC-MS/MS分析1%CA组和1%CA+Mel组小鼠血清中的各种胆汁酸成分,发现胆汁酸成分主要以TCA为主,与1%CA组相比,1%CA+Mel组中TCA含量明显降低(P<0.05,表 1)。
|
|
a:P<0.05,与对照组比较;b:P<0.05,与1%CA组比较 A:各组小鼠肝组织内总胆汁酸的含量;B:各组小鼠血清总胆汁酸的水平 图 2 褪黑素对1%CA喂养小鼠的肝内外胆汁酸水平的改变(n=5,x±s) |
| 指标 | 1%CA组 | 1%CA+Mel组 |
| TCA | 136 280.74±40 404.89 | 23 977.29±18 979.15a |
| TCDCA | 125.44±40.89 | 25.86±16.37a |
| TMCA | 896.88±439.44 | 183.87±102.01a |
| TLCA | 6.12±2.86 | 3.97±2.53 |
| GCA | 1 225.29±915.41 | 300.43±221.24 |
| GCDCA | 24.26±8.02 | 18.13±6.13 |
| CDCA | 291.29±78.02 | 150.84±134.23 |
| 3-DHCA | 13.25±6.22 | 7.21±3.47 |
| TCA:牛磺胆酸;TCDCA:牛磺鹅去氧胆酸;TMCA:牛磺鼠胆酸;TLCA:牛磺石胆酸;GCA:甘氨胆酸;GCDCA:甘氨鹅去氧胆酸;CDCA:鹅去氧胆酸;3-DHCA:3-去氢胆酸;a:P<0.05,与1%CA组比较 | ||
2.3 褪黑素通过减少胆汁酸合成改善胆汁淤积肝病
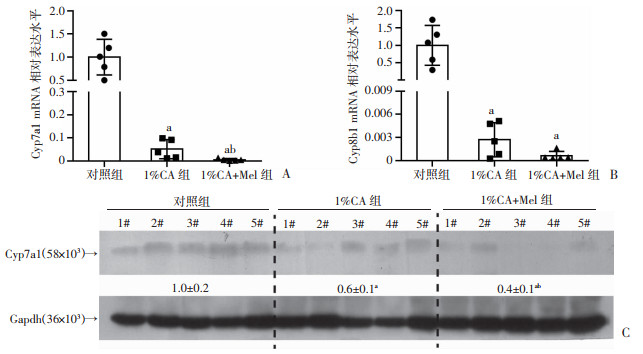
为了进一步证实褪黑素能够显著降低胆汁淤积小鼠的胆汁酸水平,胆汁酸合成主要为经典途径,其中重要的限速酶有Cyp7a1和Cyp8b1。利用RT-qPCR检测胆汁酸合成相关指标的mRNA水平,与对照组相比,1%CA组的Cyp7a1和Cyp8b1的mRNA水平均显著降低;与1%CA组相比,1%CA+Mel组上述胆汁酸合成相关指标mRNA明显下降(P<0.05,图 3A、B)。接下来进一步检测各组小鼠肝脏内Cyp7a1的蛋白水平表达(P<0.05,图 3C),结果显示褪黑素可抑制Cyp7a1的蛋白水平表达。
|
|
a:P<0.05,与对照组比较;b:P<0.05,与1%CA组比较 A、B:各组小鼠肝脏内Cyp7a1和Cyp8b1的mRNA表达水平(n=5,x±s);C:各组小鼠肝脏内Cyp7a1的蛋白水平表达 图 3 褪黑素对1%CA喂养小鼠的肝脏内胆汁酸合成酶表达水平的影响 |
2.4 褪黑素可明显增强胆汁淤积小鼠的胆汁酸代谢能力
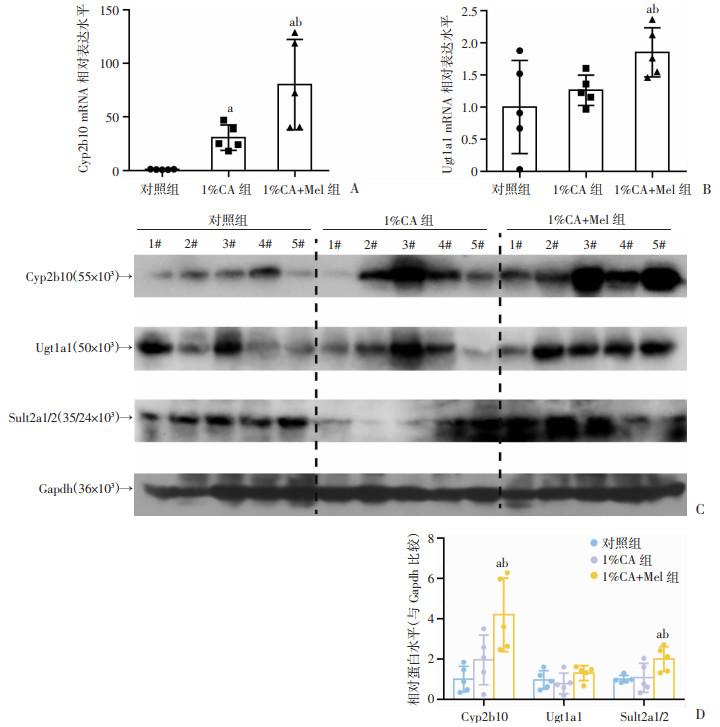
前面的研究发现经过褪黑素处理后,胆汁酸合成相关指标的表达水平明显降低,胆汁酸水平显著降低,胆汁淤积明显改善。因为肝脏解毒酶与胆汁酸代谢有着密切关系,人体内肝脏解毒酶中主要包括了Ugt1a1和Sult2a1/2, Ugt1a1和Sult2a1/2通过增加胆汁酸的水溶性将胆汁酸通过尿液和粪便排出体外。进一步检测Cyp2b10和Ugt1a1的mRNA水平的变化,结果显示1%CA+Mel组明显增加(P<0.05,图 4A、B)。同时检测上述肝脏解毒酶Cyp2b10、Ugt1a1和Sult2a1/2的蛋白水平表达,显示1%CA+Mel组Cyp2b10和Sult2a1/2表达增加,且差异具有统计学意义(P<0.05,图 4C、D)。结果显示通过褪黑素处理后小鼠肝组织中的肝脏解毒酶表达有所增加,褪黑素通过增加肝脏解毒酶来调节胆汁酸代谢,从而导致胆汁酸水平显著降低,改善了胆汁淤积。
|
|
a:P<0.05,与对照组比较;b:P<0.05,与1%CA组比较 A、B:各组小鼠肝脏内Cyp2b10和Ugt1a1的mRNA的表达水平;C、D:各组小鼠Cyp2b10、Ugt1a1和Sult2a1/2的蛋白水平表达及定量分析统计 图 4 褪黑素对1%CA喂养小鼠的肝脏解毒酶表达水平的影响(n=5,x±s) |
3 讨论
本研究发现1%CA饲料喂养小鼠会发生肝损伤,胆汁酸水平明显升高,而给予褪黑素治疗后可以减轻这些改变。体内实验显示褪黑素通过抑制胆汁酸的合成和增加肝脏解毒酶,来减轻胆酸诱导的小鼠胆汁淤积状态,以此发挥其护肝作用。
持续的胆汁淤积病理状态下,过量的毒性胆汁酸在肝内累积可导致肝细胞损伤,从而导致肝纤维化,因此抑制胆汁酸合成是防止肝脏胆汁酸过度积累和细胞毒性的保护机制,法尼醇X受体(farnesoid X receptor,FXR)通过小异源二聚体伴侣(small heterodimer partner,SHP)减少Cyp7a1和Cyp8b1的表达从而减少胆汁酸的合成[13]。之前有研究证实增加肝脏解毒酶Cyp2b10的表达可以减轻胆酸饮食诱导的胆汁淤积肝损伤[14]。
褪黑素除了调节中枢昼夜节律活动外,还通过与MT1和MT2相互作用调节肝脏表型。MT1可以与G蛋白偶联受体50 (G protein-coupled receptor 50,GPR50)受体结合后形成二聚体(MT1/GPR50)抑制褪黑素与MT1的结合,褪黑素与MT1相互作用机制可以改善原发性硬化性胆管炎(primary sclerosing cholangitis, PSC)的表型;另外MT1基因敲除可导致小鼠胆汁淤积病理状态下的肝脏总胆汁酸中牛磺胆酸(taurocholic acid, TCA)含量显著下降[11]。之前的研究中也提到褪黑素可以通过细胞外信号调节的激酶/早期生长反应蛋白1(extracellular signal-regulated kinase/early growth response 1, ERK/Egr1)信号通路抑制胆汁淤积的肝细胞炎症反应,从而改善胆汁淤积肝损伤[15]。褪黑素依赖的自分泌信号通过增加胆道芳香烷基胺N乙酰转移酶(Arylalkylamine N Acetyltransferase, AANAT)表达和褪黑素分泌,来减轻胆汁淤积引起的胆道增生和肝纤维化[2, 16-17]。脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)对神经元存活和突触可塑性至关重要, 与原肌球蛋白受体激酶B (tropomyosin-related kinase B, TrkB)结合可以促进MAPK/ERK通路细胞内信号级联激活。转录因子环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)的磷酸化是pERK通过pCREB与BDNF启动子区结合,从而实现BDNF转录;BDNF-ERK-CREB通路对于维持神经元存活、突触和突触可塑性至关重要,Mel通过作用于MT1激活BDNF-ERK-CREB信号通路与改善海马神经发生、减少突触损失以及更好地完成最复杂的海马依赖性认知任务相关[18-22]。
为了探索褪黑素对胆汁淤积的作用,本研究构建了用于诱导胆汁酸稳态失衡和胆汁淤积的常规疾病模型,即1%CA喂养小鼠模型。检测了各组小鼠肝脏胆汁酸及血清胆汁酸的水平,发现与1%CA组相比,予以褪黑素治疗后的胆汁淤积小鼠的肝内外胆汁酸水平均显著下降。同时通过检测其胆汁酸合成相关指标(Cyp7a1、Cyp8b1)和肝脏解毒酶的相关指标(Cyp2b10、Ugt1a1和Sult2a1/2)的表达量,发现褪黑素可显著减少1%CA喂养小鼠模型肝内胆汁酸合成经典途径重要限速酶Cyp7a1的表达,同时可显著增加肝脏解毒酶的表达量。本研究证明褪黑素可能通过胆汁酸代谢来改善胆汁淤积。
综上所述,本研究发现褪黑素能够治疗1%CA喂养小鼠的胆汁淤积、减少其肝内胆汁酸合成以及增强肝脏解毒酶功能。目前,褪黑素改善胆汁酸代谢的作用及其潜在的分子机制尚未阐明。而胆汁淤积的特征在于胆汁形成过多、胆汁酸毒性作用及其由肝细胞和胆管细胞损伤引起的转运障碍。因此,我们提出褪黑素可能通过改善胆汁酸代谢来改善胆汁淤积。
| [1] |
GHONEM N S, ASSIS D N, BOYER J L. Fibrates and cholestasis[J]. Hepatology, 2015, 62(2): 635-643. |
| [2] |
CHEN L X, ZHOU T H, WU N, et al. Pinealectomy or light exposure exacerbates biliary damage and liver fibrosis in cholestatic rats through decreased melatonin synthesis[J]. Biochim Biophys Acta Mol Basis Dis, 2019, 1865(6): 1525-1539. |
| [3] |
LI J, ZHU X Y, ZHANG M H, et al. Limb expression 1-like (LIX1L) protein promotes cholestatic liver injury by regulating bile acid metabolism[J]. J Hepatol, 2021, 75(2): 400-413. |
| [4] |
ALNOUTI Y, KLAASSEN C D. Tissue distribution and ontogeny of sulfotransferase enzymes in mice[J]. Toxicol Sci, 2006, 93(2): 242-255. |
| [5] |
RIZZOLO D, KONG B, TAYLOR R E, et al. Bile acid homeostasis in female mice deficient in Cyp7a1 and Cyp27a1[J]. Acta Pharm Sin B, 2021, 11(12): 3847-3856. |
| [6] |
WAGNER M, HALILBASIC E, MARSCHALL H U, et al. CAR and PXR agonists stimulate hepatic bile acid and bilirubin detoxification and elimination pathways in mice[J]. Hepatology, 2005, 42(2): 420-430. |
| [7] |
FLORIDO J, MARTINEZ-RUIZ L, RODRIGUEZ-SANTANA C, et al. Melatonin drives apoptosis in head and neck cancer by increasing mitochondrial ROS generated via reverse electron transport[J]. J Pineal Res, 2022, 73(3): e12824. |
| [8] |
LUO J H, ZHANG Z G, SUN H Q, et al. Effect of melatonin on T/B cell activation and immune regulation in pinealectomy mice[J]. Life Sci, 2020, 242: 117191. |
| [9] |
LEE J S, CUA D J. Melatonin lulling Th17 cells to sleep[J]. Cell, 2015, 162(6): 1212-1214. |
| [10] |
GALANO A, TAN D X, REITER R J. On the free radical scavenging activities of melatonin's metabolites, AFMK and AMK[J]. J Pineal Res, 2013, 54(3): 245-257. |
| [11] |
WU N, CARPINO G, CECI L, et al. Melatonin receptor 1A, but not 1B, knockout decreases biliary damage and liver fibrosis during cholestatic liver injury[J]. Hepatology, 2022, 75(4): 797-813. |
| [12] |
谭雅, 唐菀, 徐子芊, 等. 褪黑素通过JNK/c-Jun信号通路抑制胆汁酸诱导Cxcl2表达的机制研究[J]. 陆军军医大学学报, 2022, 44(8): 782-788. TAN Y, TANG W, XU Z Q, et al. Melatonin inhibits bile acids-initiated Cxcl2 expression through JNK/c-Jun signalling pathway[J]. J Army Med Univ, 2022, 44(8): 782-788. |
| [13] |
LIU Y H, CHEN K F, LI F Y, et al. Probiotic Lactobacillus rhamnosus GG prevents liver fibrosis through inhibiting hepatic bile acid synthesis and enhancing bile acid excretion in mice[J]. Hepatology, 2020, 71(6): 2050-2066. |
| [14] |
XU J L, KAUSALYA P J, VAN HUL N, et al. Protective functions of ZO-2/Tjp2 expressed in hepatocytes and cholangiocytes against liver injury and cholestasis[J]. Gastroenterology, 2021, 160(6): 2103-2118. |
| [15] |
TAN Y, ZHAO N, XIE Q L, et al. Melatonin attenuates cholestatic liver injury via inhibition of the inflammatory response[J]. Mol Cell Biochem, 2023, 478(11): 2527-2537. |
| [16] |
RENZI A, DEMORROW S, ONORI P, et al. Modulation of the biliary expression of arylalkylamine N-acetyltransferase alters the autocrine proliferative responses of cholangiocytes in rats[J]. Hepatology, 2013, 57(3): 1130-1141. |
| [17] |
GLASER S, GAUDIO E, RENZI A, et al. Knockout of the neurokinin-1 receptor reduces cholangiocyte proliferation in bile duct-ligated mice[J]. Am J Physiol Gastrointest Liver Physiol, 2011, 301(2): G297-G305. |
| [18] |
MADHU L N, KODALI M, ATTALURI S, et al. Melatonin improves brain function in a model of chronic Gulf War Illness with modulation of oxidative stress, NLRP3 inflammasomes, and BDNF-ERK-CREB pathway in the hippocampus[J]. Redox Biol, 2021, 43: 101973. |
| [19] |
KOWIANSKI P, LIETZAU G, CZUBA E, et al. BDNF: a key factor with multipotent impact on brain signaling and synaptic plasticity[J]. Cell Mol Neurobiol, 2018, 38(3): 579-593. |
| [20] |
MINICHIELLO L. TrkB signalling pathways in LTP and learning[J]. Nat Rev Neurosci, 2009, 10(12): 850-860. |
| [21] |
REICHARDT L F. Neurotrophin-regulated signalling pathways[J]. Philos Trans R Soc Lond B Biol Sci, 2006, 361(1473): 1545-1564. |
| [22] |
FINKBEINER S, TAVAZOIE S F, MALORATSKY A, et al. CREB: a major mediator of neuronal neurotrophin responses[J]. Neuron, 1997, 19(5): 1031-1047. |




