大负荷运动是指持续时间较长的高强度运动。《“健康中国2030”规划纲要》指出[1],要广泛开展全民健身运动。随着人民健康意识增强,运动健身人群规模不断增大,特别是马拉松、长距离自行车、长距离游泳、滑雪等大负荷运动人群明显增加。为提升运动效果,减少运动损伤,营养保障非常重要,其中运动营养食品是该类运动健身人群的必然选择[2]。运动营养食品种类繁多,主要包含补充能量类、控制能量类、补充蛋白质类、速度力量类、耐力类、运动后恢复类。研究显示,导致大负荷运动耐力下降的主要原因包括骨骼肌氧化应激、代谢紊乱及运动损伤等[3]。国内外研究发现,一些特殊营养素、营养因子或植物活性成分可能发挥抗氧化、抗疲劳、损伤修复等作用,进而增强骨骼肌耐力。同时,单一营养物质对于提升运动耐力的作用具有局限性,而将多种营养物质按照一定科学配比进行联合干预,通过协同作用可能发挥更优效果。本课题组基于前期研究,参照《食品安全国家标准运动营养食品通则》(GB 24154-2015)[4],试制了一种新型复方营养制剂,拟根据《保健食品功能检验与评价方法》(2023年版)进行提升运动耐力效果的综合评价[5],并阐明相关作用机制,为开展大负荷运动营养保障提供科学依据。
1 材料与方法 1.1 主要试剂牡蛎肽购自中食都庆生物技术有限公司,牛磺酸购自碧云天生物技术公司,左旋肉碱购自上海麦克林生化科技股份有限公司,肌酸、辅酶Q10购自上海旭硕生物科技有限公司,吡啶甲酸铬购自上海迈瑞尔生化科技有限公司,L-精氨酸及SOD、MDA、PC、GSH、LA检测试剂盒均购自北京索莱宝科技有限公司。
1.2 复方营养剂组成及制备根据前期研究,该复方营养制剂包含牡蛎肽、牛磺酸、肌酸、L-精氨酸、左旋肉碱、辅酶Q10、吡啶甲酸铬。以60 kg定义一名自然人的体质量,将人群实验每人每日所需单一营养素换算成每人每日每千克体质量所需剂量,以其10倍剂量作为动物实验的低剂量(1 675 mg/kg),20倍剂量作为动物实验的中剂量(3 350 mg/kg),30倍作为动物实验的高剂量(5 025 mg/kg)。根据动物实验每天所需剂量对营养素进行称取,并将7种营养素进行混合配制于蒸馏水中,超声震荡混匀制成悬浊液,现用现配。
1.3 实验动物6~8周龄雄性C57BL/6J小鼠60只,体质量(19.40±0.65)g,购于莱比特实验动物中心(合格证号:SCX-2019-0004),并于陆军军医大学SPF级实验动物中心饲养,12 h/12 h昼夜明暗交替,室内环境温度(22±1)℃,室内环境湿度为(55±5)%。各组小鼠自由进食和饮水,保持小鼠笼内清洁卫生。实验程序遵循陆军军医大学学术研究伦理审查委员会小鼠护理和使用指导原则并获得批准(AMUWEC20228026)。
1.4 实验分组与干预C57雄性小鼠60只,按随机数字表法分成4组(n=15),即对照组(CON组)、低剂量复方营养制剂组(low-dose nutritional formula,LDF组)、中剂量复方营养制剂组(medium-dose nutritional formula,MDF组)、高剂量复方营养制剂组(high-dose nutritional formula,HDF组)。实验周期为2周,实验方法见图 1。第1周,LDF组、MDF组和HDF组分别给予相应的复方营养制剂干预(表 1),CON组给予同等体积生理盐水,各组分别于每日早上8:00灌胃,1 h后进行适应性训练。跑台训练参数为:坡度10°,运动速度15 m/min,每次运动时间10 min。第2周,各组营养干预同第1周(表 1),灌胃1 h后进行大负荷运动,相当于70%~80%的VO2Max。跑台训练参数为:坡度10°,以15 m/min的速度开始运动10 min,随后以1 m/min2加速到25 m/min后保持不变,每次运动时间1 h。干预至最后1 d(即大负荷运动的第7天),各组按随机数字表法选取10只小鼠在运动至第3小时处死取材,各组其余小鼠继续运动至力竭,记录力竭运动时间[6-9]。动物跑步采用动物跑步机(SA101B,江苏赛昂斯公司)。力竭判断标准为:维持运动负荷直至动物无法坚持,腹卧位贴于跑道上并滞留于跑道后1/3处3次及以上,表现为呼吸急深、幅度大、垂头,刺激无反应。每2天记录各组小鼠的体质量和摄食量,观察小鼠的活动状态。
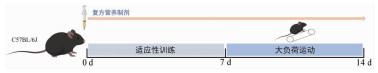
|
| 图 1 动物运动和复方营养制剂干预的实验方法 |
1.5 提升运动耐力的评价方法
参照《保健食品功能检验与评价方法》(2023年版)中的“抗氧化能力”和“抗疲劳能力”检测指标和判断标准,对该复方营养制剂是否具有提升运动耐力作用进行功效评价(表 1)。
1.6 动物样本收集大负荷运动3 h后,将小鼠麻醉,摘取眼球取血。收集血液后,室温静置2 h,于4 ℃以6 000×g的转速离心5 min,得到血清,保存于-80 ℃。接着颈椎脱位法处死小鼠,分离得到双侧比目鱼肌和腓肠肌。同时,迅速将骨骼肌组织顺肌丝方向剪取适当大小,置于4%多聚甲醛溶液中,以备后续实验使用。
1.7 血清生化指标检测采用全自动生化分析仪(日立3110,上海日立诊断产品有限公司)检测血清中的生化指标,包括谷丙转氨酶(ALT)、谷草转氨酶(AST)、尿素氮(UREA)、肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、乳酸脱氢酶(LDH)。
1.8 骨骼肌糖原过碘酸雪夫氏染色(Schiff periodic acid shiff,PAS)小鼠处死后,将右侧腓肠肌修剪成1 mm×1 mm×1 mm组织块,放置于4%多聚甲醛溶液中,脱水透明处理后进行包埋。然后将包埋过的蜡块切成3 μm薄片后烘干。最后将切片依次置于高碘酸、雪弗、苏木精中染色,再冲洗脱水透明后,使用中性树胶封片。使用光学显微镜观察组织切片,保存图像。用Image J软件测量各组图像累计光密度(IOD),IOD值除以目标分布区域的面积,得到平均光密度(AOD),用AOD值进行统计分析。
1.9 骨骼肌抗氧化与血清疲劳相关指标检测采用试剂盒检测小鼠骨骼肌的抗氧化指标,包括超氧化物歧化酶(SOD)、丙二醛(MDA)、蛋白质羰基(protein carbonyl,PC)、还原性谷胱甘肽(GSH)及血清疲劳指标乳酸(lactic acid,LA)。
1.10 统计学分析通过SPSS 26.0软件对数据进行统计分析,计量资料以x±s表示,各组间比较采用单因素方差分析,两组间比较采用LSD法检验,P<0.05为差异有统计学意义。
2 结果 2.1 复方营养制剂干预对大负荷运动小鼠摄食量和体质量的影响首先观察不同剂量复方营养制剂干预对小鼠摄食量和体质量的影响。如图 2所示,实验周期内不同剂量复方营养制剂干预组小鼠摄食量与CON组相比无明显改变,不同剂量复方营养制剂干预组间也无显著差异。不同剂量复方营养制剂干预组小鼠体质量与CON组相比无明显改变,不同剂量复方营养制剂干预组间也无显著差异。结果提示,不同剂量的复方营养制剂对小鼠的摄食量和体质量均无明显影响。
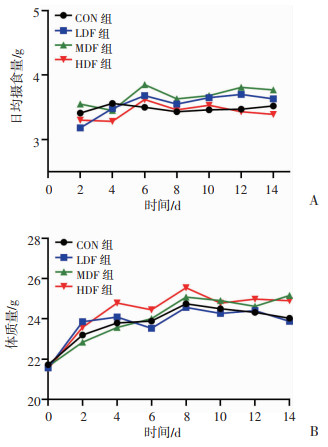
|
| A:小鼠摄食量;B:小鼠体质量 图 2 复方营养制剂干预对小鼠摄食量和体质量的影响 |
2.2 复方营养制剂干预对大负荷运动小鼠力竭时间的影响
为评估各组小鼠运动耐力,于实验最后1 d进行力竭运动,比较各组小鼠的跑步力竭时间。如图 3所示,LDF组小鼠跑步力竭时间较CON组延长19.26%(P < 0.05);MDF组小鼠跑步力竭时间较CON组延长34.96%(P < 0.05);HDF组小鼠跑步力竭时间较CON组延长41.34%(P < 0.05)。不同剂量复方营养制剂组间进行比较发现,HDF组小鼠跑步力竭时间较LDF组延长18.51%(P < 0.05),MDF组小鼠跑步力竭时间与LDF、HDF组无统计学差异。上述结果提示,复方营养制剂干预可明显提升小鼠运动耐力,且高剂量组效果最明显。
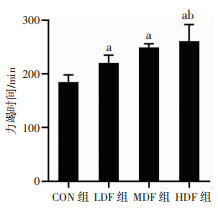
|
| a:P < 0.05,与CON组比较;b:P < 0.05,与LDF组比较 图 3 复方营养制剂干预对大负荷运动小鼠力竭时间的影响 |
2.3 复方营养制剂干预对大负荷运动小鼠骨骼肌氧化应激的影响
大负荷运动后,对各组小鼠腓肠肌的SOD、MDA、PC、GSH氧化应激指标进行检测。结果显示,LDF组、MDF组、HDF组小鼠骨骼肌SOD活性较CON组相比均显著增加(P < 0.05),但不同剂量复方营养制剂干预组间无显著差异(图 4A)。LDF组、MDF组、HDF组小鼠骨骼肌MDA含量较CON组相比均显著降低(P < 0.05),但不同剂量复方营养制剂干预组间无显著差异(图 4B)。LDF组、MDF组、HDF组小鼠骨骼肌PC含量较CON组相比均显著降低(P < 0.05,图 4C),不同剂量复方营养制剂组间进行比较发现,HDF组小鼠骨骼肌PC含量低于LDF组(P < 0.05),LDF组和MDF组、MDF组和HDF组间无显著差异(图 4C)。LDF组、MDF组、HDF组小鼠骨骼肌GSH含量较CON组相比均显著增加(P < 0.05,图 4D),不同剂量复方营养制剂组间进行比较发现,HDF组小鼠骨骼肌GSH含量高于MDF组、LDF组(P < 0.05),MDF组和LDF组间无显著差异(图 4D)。综上,根据《保健食品功能检验与评价方法》关于有助于抗氧化的动物实验评价方法和判断标准,该复方营养制剂干预可明显提升小鼠大负荷运动下骨骼肌的抗氧化能力,且高剂量组效果最明显。
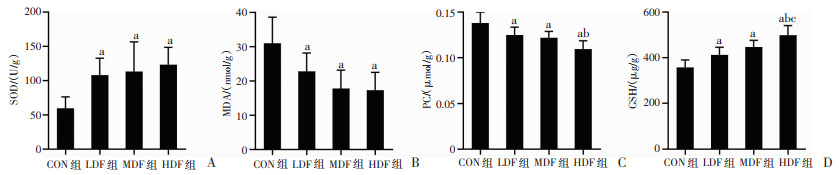
|
|
a:P < 0.05,与CON组比较;b:P < 0.05,与LDF组比较;c:P < 0.05,与MDF组比较 A:骨骼肌SOD活性;B:骨骼肌MDA水平;C:骨骼肌PC水平;D:骨骼肌GSH水平 图 4 复方营养制剂干预对大负荷运动小鼠骨骼肌氧化应激的影响 |
2.4 复方营养制剂干预对大负荷运动小鼠疲劳状况的影响 2.4.1 复方营养制剂干预对大负荷运动小鼠血清疲劳相关指标的影响
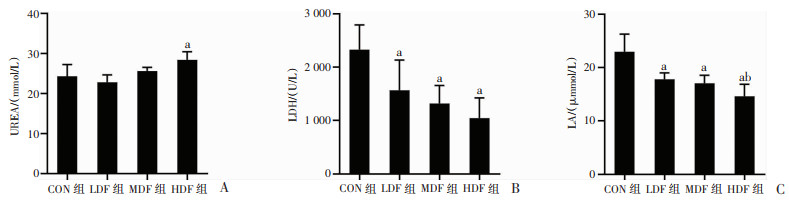
通过检测血清疲劳相关指标,评估各组小鼠疲劳状态和复方营养制剂的抗疲劳能力。结果显示,大负荷运动后,通过检测血清疲劳指标水平,评估各组小鼠疲劳状态和抗疲劳能力。HDF组小鼠血清UREA含量较CON组显著增加(P < 0.05),而LDF组、MDF组与CON组比较均无显著差异(图 5A),可能与高剂量复方营养制剂组的牡蛎肽摄入量过高有关。LDF组、MDF组、HDF组小鼠血清LDH水平较CON组相比均显著降低(P < 0.05),但不同剂量的复方营养制剂组间无显著差异(图 5B)。LDF组、MDF组、HDF组小鼠血清LA水平较CON组相比均显著降低(P < 0.05,图 5C),不同剂量复方营养制剂组间进行比较发现,HDF组小鼠血清LA含量低于LDF组(P < 0.05),LDF组和MDF组、MDF组和HDF组间无显著差异(图 5C)。
|
|
a:P < 0.05,与CON组比较;b:P < 0.05,与LDF组比较 A:血清UREA水平;B:血清LDH水平;C:血清LA水平 图 5 复方营养制剂干预对大负荷运动小鼠血清疲劳相关指标的影响 |
2.4.2 复方营养制剂干预对大负荷运动小鼠骨骼肌糖原含量的影响
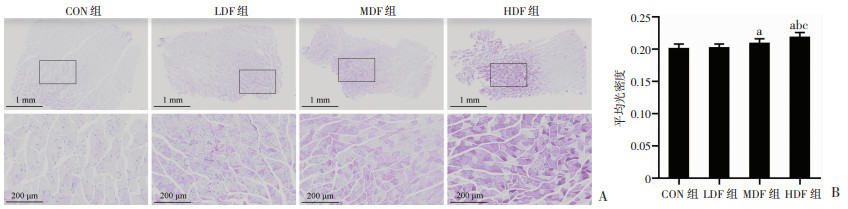
通过检测小鼠腓肠肌糖原含量水平,评估各组小鼠疲劳状态和抗疲劳能力。如图 6所示,MDF组、HDF组小鼠肌糖原AOD与CON组相比均显著增高(P < 0.05)。不同剂量复方营养制剂组间进行比较发现,HDF组小鼠肌糖原含量高于MDF组、LDF组(P < 0.05)。
|
|
a:P < 0.05,与CON组比较;b:P < 0.05,与LDF组比较;c:P < 0.05,与MDF组比较 A:PAS染色观察各组小鼠骨骼肌糖原含量;B:PAS染色平均光密度分析 图 6 复方营养制剂干预对大负荷运动小鼠骨骼肌糖原含量的影响 |
根据小鼠血清UREA、LDH、LA和骨骼肌PAS检测结果和《保健食品功能检验与评价方法》关于有助于缓解体力疲劳的动物实验评价方法和判断标准,该复方营养制剂干预可明显缓解小鼠大负荷运动下的疲劳水平,且高剂量组效果最明显。
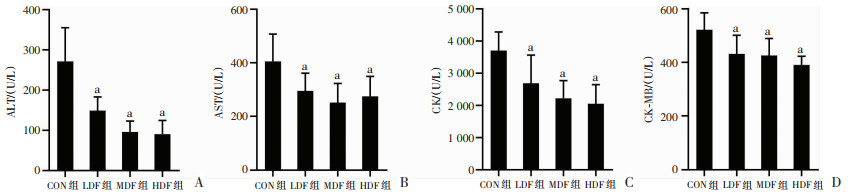
2.5 复方营养制剂对大负荷小鼠运动损伤的影响通过检测血清中运动损伤相关指标,评估复方营养制剂的运动损伤保护作用。如图 7所示,LDF组、MDF组、HDF组小鼠大负荷运动后血清ALT、AST、CK、CK-MB的含量较CON组均显著降低(P < 0.05),但不同剂量的复方营养制剂组间无显著差异。结果提示,复方营养制剂干预可降低大负荷运动小鼠的运动损伤。
|
|
a:P < 0.05,与CON组比较 A:血清ALT水平;B:血清AST水平;C:血清CK水平;D:血清CK-MB水平 图 7 复方营养制剂对大负荷运动小鼠运动损伤相关指标的影响 |
3 讨论
人体在大负荷运动过程中,出现能量和营养物质耗竭、水盐代谢紊乱、氧化应激等,这是导致疲劳、作业能力降低和诱发训练伤害的重要原因[10]。体能包括耐力、力量、速度、爆发力、柔韧、平衡、灵敏等诸多构成要素,其中耐力素质(包括心肺耐力、骨骼肌耐力等)是体能的重要基础,在大负荷运动中具有重要作用[11]。本课题组前期通过文献调研并结合实验室研究,遴选出多种能够增强体能的营养成分,如牡蛎肽、牛磺酸、L-精氨酸等。研究表明,牡蛎肽作为一种食源性生物活性肽,来源广泛、食用安全、易消化吸收,具有抗氧化、缓解疲劳等多种功能。牛磺酸、左旋肉碱可以发挥抗疲劳、增强运动功能的作用[12-13];肌酸可以提升肌肉力量,增强爆发力[14];L-精氨酸可以扩张血管,增加血流量[15];辅酶Q10可以增强线粒体呼吸,保护心脏[16];铬剂可以降血糖,调节糖代谢[17]。根据《食品安全国家标准运动营养食品通则》(GB 24154)营养成分的推荐使用剂量[4],确定了各营养成分的配比,研发出一款可能提升体能的复方营养制剂,结合《保健食品功能检验与评价方法》(2023年版)中规定的动物实验分组及干预剂量标准[5],确定动物实验干预剂量按人体推荐剂量的10、20、30倍作为低、中、高复方营养制剂组,国家或国际相关标准中对大负荷运动耐力提升干预物没有统一的“金标准”,选择合适的阳性对照比较困难,本研究只是对不同剂量复方营养制剂组进行比较,重在评价该营养配方的效能和适宜用量。运动模型及干预时间参考本课题组前期的研究内容。
为评估该营养组方对体能提升的作用,根据相关国家标准,开展功效评估。力竭实验研究结果表明,复方营养制剂干预可明显提升小鼠在大负荷运动下的耐力,LDF组、MDF组、HDF组小鼠跑步力竭时间较CON组分别延长19.26%、34.96%、41.34%。为评估该复方营养制剂的抗氧化活性,我们对大负荷运动小鼠腓肠肌的抗氧化指标进行了检测[18-21]。研究结果表明,该营养复方制剂干预组小鼠大负荷运动后骨骼肌中GSH、SOD的水平均明显升高,MDA、PC的水平均明显下降,其中高剂量组的作用效果最明显。根据《保健食品功能检验与评价方法》(2023年版)中关于有助于抗氧化的评价方法[5],抗氧化酶、脂质氧化产物、蛋白质氧化产物、抗氧化物质四项指标中三项阳性,可判定该受试样品具有抗氧化作用,可以明确本复方营养制剂具有抗氧化活性。为评估该营养组方抗疲劳活性,本研究对大负荷运动后小鼠血清和腓肠肌的抗疲劳指标进行了检测[22-24]。研究结果表明,复方营养制剂干预组小鼠大负荷运动后血清中LDH、LA的水平明显降低,肌糖原的含量明显提升,其中高剂量组的作用最明显,此外HDF组小鼠血清UREA水平高于CON组,可能与高剂量组的牡蛎肽摄入量过高有关。参考《保健食品功能检验与评价方法》(2023年版)关于有助于缓解体力疲劳的评价方法[5],负重游泳实验结果阳性,血乳酸、血清尿素、肝糖原或肌糖原三项指标中任二项指标阳性,可判定该受试样品具有缓解体力疲劳作用,可以明确该复方营养制剂具有抗疲劳活性。此外,本研究观察了复方营养制剂对大负荷小鼠血清生化指标的影响[25-28],结果显示,复方营养制剂干预组小鼠大负荷运动后血清ALT、AST、CK、CK-MB的含量均明显降低,明确复方营养制剂干预可以减少大负荷小鼠的运动损伤及改善肝脏、骨骼肌、心肌等重要组织器官功能。
综上,本研究通过动物实验并结合相关国家标准,研究推出了一种提升人体大负荷运动耐力的复方营养制剂,此复方营养剂可能通过抗氧化、抗疲劳以及损伤防护途径提升小鼠大负荷运动耐力,预期能够提升大负荷运动训练效果,增强损伤防护,为开展大负荷运动营养保障提供科学依据。
| [1] |
中共中央国务院印发《"健康中国2030"规划纲要》[EB/OL]. [2016-10-25]. https://www.gov.cn/gongbao/content/2016/content_5133024.htm. The Central Committee of the Communist Party of China and the State Council have issued the outline of the "Healthy China 2030" Plan[EB/OL]. [2016-10-25]. https://www.gov.cn/gongbao/content/2016/content_5133024.htm. |
| [2] |
CUI P B, LI M Y, YU M X, et al. Advances in sports food: sports nutrition, food manufacture, opportunities and challenges[J]. Food Res Int, 2022, 157: 111258. |
| [3] |
CHENG A J, JUDE B, LANNER J T. Intramuscular mechanisms of overtraining[J]. Redox Biol, 2020, 35: 101480. |
| [4] |
中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准运动营养食品通则: GB 24154-2015[S]. 北京: 中国标准出版社, 2016. The National Health and Family Planning Commission of the People's Republic of China. National standard for food safety—General rules for sports nutrition food: GB 24154-2015[S]. Beijing: Standards Press of China, 2016. |
| [5] |
总局正式发布《保健食品功能检验与评价方法(2023年版)》[EB/OL]. [2023-08-31]. https://baijiahao.baidu.com/s?id=1775737365621044231&wfr=spider&for=pc. The General Administration of China has officially released the "methods for functional inspection and evaluation of health food (2023 edition)" [EB/OL]. [2023-08-31]. https://baijiahao.baidu.com/s?id=1775737365621044231&wfr=spider&for=pc. |
| [6] |
HOU P F, WANG D W, LANG H D, et al. Dihydromyricetin attenuates high-intensity exercise-induced intestinal barrier dysfunction associated with the modulation of the phenotype of intestinal intraepithelial lymphocytes[J]. Int J Mol Sci, 2022, 24(1): 221. |
| [7] |
LI T Y, WANG L, WU L T, et al. Integrated metabolomics and network pharmacology investigation of cardioprotective effects of myricetin after 1-week high-intensity exercise[J]. Nutrients, 2023, 15(6): 1336. |
| [8] |
刘洋, 郎和东, 惠锁成, 等. 紫檀芪改善睡眠限制小鼠运动耐力的作用及其机制[J]. 第三军医大学学报, 2020, 42(3): 259-266. LIU Y, LANG H D, HUI S C, et al. Pterostilbene improves exercise intolerance induced by sleep restriction in mice by activating AMPK/SIRT1 signaling and promoting mitochondrial biosynthesis[J]. J Third Mil Med Univ, 2020, 42(3): 259-266. |
| [9] |
李方, 曹建民, 翟鹏飞, 等. 白藜芦醇调节NLRP3炎性小体改善力竭运动大鼠肾组织炎症损伤[J]. 陆军军医大学学报, 2022, 44(12): 1229-1236. LI F, CAO J M, ZHAI P F, et al. Resveratrol improves renal inflammatory injury in exhaustive exercise rats by regulating NOD-like receptor protein 3 inflammasome[J]. J Army Med Univ, 2022, 44(12): 1229-1236. |
| [10] |
RAVINDRA P V, JANHAVI P, DIVYASHREE S, et al. Nutritional interventions for improving the endurance performance in athletes[J]. Arch Physiol Biochem, 2022, 128(4): 851-858. |
| [11] |
ROTHSCHILD J A, KILDING A E, PLEWS D J. What should I eat before exercise? pre-exercise nutrition and the response to endurance exercise: current prospective and future directions[J]. Nutrients, 2020, 12(11): 3473. |
| [12] |
GNONI A, LONGO S, GNONI G V, et al. Carnitine in human muscle bioenergetics: can carnitine supplementation improve physical exercise?[J]. Molecules, 2020, 25(1): 182. |
| [13] |
BALIOU S, ADAMAKI M, IOANNOU P, et al. Protective role of taurine against oxidative stress (Review)[J]. Mol Med Rep, 2021, 24(2): 605. |
| [14] |
WAX B, KERKSICK C M, JAGIM A R, et al. Creatine for exercise and sports performance, with recovery considerations for healthy populations[J]. Nutrients, 2021, 13(6): 1915. |
| [15] |
SZLAS A, KUREK J M, KREJPCIO Z. The potential of L-arginine in prevention and treatment of disturbed carbohydrate and lipid metabolism—a review[J]. Nutrients, 2022, 14(5): 961. |
| [16] |
DROBNIC F, LIZARRAGA M A, CABALLERO-GARCÍA A, et al. Coenzyme Q10 supplementation and its impact on exercise and sport performance in humans: a recovery or a performance-enhancing molecule?[J]. Nutrients, 2022, 14(9): 1811. |
| [17] |
ALVAREZ C C, BRAVO GÓMEZ M E, HERNÁNDEZ ZAVALA A. Hexavalent chromium: regulation and health effects[J]. J Trace Elem Med Biol, 2021, 65: 126729. |
| [18] |
TRIST B G, HILTON J B, HARE D J, et al. Superoxide dismutase 1 in health and disease: How a Frontline antioxidant becomes neurotoxic[J]. Angew Chem Int Ed, 2021, 60(17): 9215-9246. |
| [19] |
TSIKAS D. GC-MS and GC-MS/MS measurement of malondialdehyde (MDA) in clinical studies: pre-analytical and clinical considerations[J]. J Mass Spectrom Adv Clin Lab, 2023, 30: 10-24. |
| [20] |
GEORGIOU-SIAFIS S K, TSIFTSOGLOU A S. The key role of GSH in keeping the redox balance in mammalian cells: mechanisms and significance of GSH in detoxification via formation of conjugates[J]. Antioxidants, 2023, 12(11): 1953. |
| [21] |
AKAGAWA M. Protein carbonylation: molecular mechanisms, biological implications, and analytical approaches[J]. Free Radic Res, 2021, 55(4): 307-320. |
| [22] |
PUNDIR C S, JAKHAR S, NARWAL V. Determination of urea with special emphasis on biosensors: a review[J]. Biosens Bioelectron, 2019, 123: 36-50. |
| [23] |
RABINOWITZ J D, ENERBÄCK S. Lactate: the ugly duckling of energy metabolism[J]. Nat Metab, 2020, 2(7): 566-571. |
| [24] |
VIGH-LARSEN J F, ØRTENBLAD N, SPRIET L L, et al. Muscle glycogen metabolism and high-intensity exercise performance: a narrative review[J]. Sports Med, 2021, 51(9): 1855-1874. |
| [25] |
GIANNINI E G. Liver enzyme alteration: a guide for clinicians[J]. Can Med Assoc J, 2005, 172(3): 367-379. |
| [26] |
MOHAMED M F, WADHAVKAR N, ELFANAGELY Y, et al. Etiologies and outcomes of transaminase Elevation>1000 IU/L: a systematic review and meta-analysis[J]. Dig Dis Sci, 2023, 68(7): 2843-2852. |
| [27] |
TAMBER S S, BANSAL P, SHARMA S, et al. Biomarkers of liver diseases[J]. Mol Biol Rep, 2023, 50(9): 7815-7823. |
| [28] |
KIM E J, WIERZBICKI A S. Investigating raised creatine kinase[J]. BMJ, 2021, 373: n1486. |




