适度运动可以预防和治疗各种代谢疾病,增强免疫力[1]。然而,持续进行超过最大摄氧量(VO2 max)的60%或最大可达心率的70%的大强度运动(如50 km的急行军、马拉松或铁人三项),可能反而会对健康造成较多危害[2]。大强度运动使骨骼肌氧化应激,代谢紊乱,并导致肌肉、结缔组织、骨结构的重复性组织微损伤和慢性炎症[3],慢性炎症的发生伴随着IL-1β、IL-6和TNF-α等细胞因子的激活[4],这些细胞因子水平增加将导致疲劳和运动能力下降[5]。
疲劳是一种动物和人体中常见的生理状态,是指机体的生理过程不能维持其机能在某一特定水平,或不能维持预定的运动强度的生理生化过程[6]。人体在进行剧烈或长时间大强度运动时,容易引发疲劳,而长期疲劳状态不仅影响人体正常活动运作,导致运动能力降低,还会引起机体的免疫力下降,甚至引发相关疾病。已有研究表明,疲劳伴随机体长期处于氧化应激状态,活性氧、自由基、乳酸等氧化应激产物会对组织和细胞造成急性或长期的损害[7]。
n-3多不饱和脂肪酸(n-3 polyunsaturated fatty acids,n-3 PUFAs)指多不饱和脂肪酸中第1个不饱和键出现在碳链甲基端的第3位。n-3 PUFAs主要包括α-亚麻酸(α-linolenicaicd,ALA),二十碳五烯酸(eicosapentaenoicacid,EPA),二十二碳六烯酸(docosahexaenoicacid,DHA)等,其中ALA是人体中的一种必需脂肪酸,可从部分植物油,如亚麻籽油、核桃油和紫苏籽油等中获取。体内由ALA代谢合成EPA和DHA的比率最多不超过4%,因此需要额外摄入EPA和DHA才能满足人体需求。EPA和DHA主要来源于海洋鱼类,如鳕鱼、大比目鱼等瘦白鱼的肝脏,以及鲭鱼、鲱鱼、鲑鱼等油性鱼类的鱼肉中。n-3 PUFAs已被证明可以减少炎症性二十烷类化合物、炎症细胞因子和活性氧的产生,具有免疫调节和抗氧化作用,可减轻炎症性疾病[8];还可缓解肌肉疲劳,减轻肌肉损伤[9-10],n-3 PUFAs的抗炎特性被认为可以改善肌肉酸痛感和肌肉功能损伤,但其作用机制目前尚不清楚。
大量研究证明,大强度运动诱导炎症和氧化应激,导致IL-1β、IL-6和TNF-α等促炎细胞因子增多[11-12];此外有研究发现,NLRP3炎症小体在急性大强度运动后表达增加[13]。n-3 PUFAs是否可通过介导NLRP3炎症小体通路发挥抗炎抗疲劳作用尚需更深入的研究。因此,本研究利用7 d力竭跑台运动小鼠模型,探讨补充n-3 PUFAs对力竭运动小鼠骨骼肌炎症及运动性疲劳的作用及其可能机制。
1 材料与方法 1.1 实验动物7周龄健康雄性SPF级C57BL/6J小鼠40只,体质量(22.85±1.05)g,购自重庆腾鑫比尔实验动物销售有限公司[生产许可证号: SCXK(京)2019-0010;动物合格证号:110324220106477115]。7周龄健康雄性SPF级Fat-1小鼠20只,体质量(22.43±1.14)g,饲养在陆军军医大学实验动物中心。动物饲养于SPF级动物房,室温(23±1)℃,明暗周期12 h,自由进食和饮水。实验遵守陆军军医大学实验动物伦理相关规定。适应性饲养1周后,进行适应性训练。
1.2 小鼠分组处理与适应性训练40只C57BL/6J小鼠按简单随机抽样法分为4组(每组10只):空白静息组(CON组)、空白运动组(EX组)、鱼油静息组(FO组)、鱼油运动组(FO+EX组)。20只Fat-1小鼠按简单随机抽样法分为2组(每组10只):Fat-1静息组(FA组)、Fat-1运动组(FA+EX组)。FO组和FO+EX组按照每日300 mg/kg的n-3PUFAs的剂量定时灌胃鱼油,CON组、EX组、FA组和FA+EX组小鼠每日等体积灌胃生理盐水,6组小鼠连续灌胃14 d。采用动物跑步机,并参照本科室研究团队统一的训练方法设计训练计划,坡度为0°,速度为15 m/min,运动训练时间为10 min,每天同一时间(9:00)训练1次[14-15],训练持续5 d。
1.3 小鼠力竭跑台模型的建立经过适应性训练的小鼠参照BEDFORD方法[16-17],第一阶段小鼠在坡度为0°,速度为15 m/min的条件下跑步10 min;第二阶段小鼠在坡度0°,速度25 m/min的条件下跑步至力竭,构建小鼠运动性疲劳及骨骼肌炎症损伤模型。主要观测运动时后肢蹬地力量、鼠尾与跑道的接触程度、维持运动强度能力、对刺激的应答反应能力和力竭状态的出现。力竭判断标准为用毛刷驱赶无法坚持运动,小鼠翻身反射迟缓且30 min内不主动站起。
1.4 主要仪器与试剂鱼油购自美国Sigma公司;反转录试剂盒及qPCR试剂盒购自日本TaKaRa公司;PCR引物购自上海生工生物工程股份有限公司;丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性检测试剂盒和糖原含量检测试剂盒购自北京索莱宝科技有限公司;NLRP3鼠单克隆抗体购自武汉三鹰生物技术有限公司;ASC兔单克隆抗体购自美国Cell Signaling Technology公司;Mouse IL-1β ELISA KIT购自北京索莱宝科技有限公司;Mouse IL-18 ELISA KIT购自北京索莱宝科技有限公司;全自动生化分析仪购自日本HITACHI公司;数字切片工作站VS120购自德国SIMATIC公司;多功能酶标仪购自美国Molecular Devices公司;低温组织研磨仪购自中国塞维尔公司;低温高速离心机购自美国Beckman公司;实时荧光定量PCR仪购自美国Thermo Fisher公司。
1.5 小鼠血清和组织取材第7天小鼠跑台运动力竭后,立即将小鼠异氟烷麻醉,后眼球采血并颈椎脱臼处死,将血样收集到离心管中,并在4 ℃、3 000 r/min条件下离心15 min,获得上清液,-80 ℃保存备用。迅速取小鼠左右两侧腿部的腓肠肌、比目鱼肌,记录质量后,分别放置于冻存管中,-80 ℃保存备用。部分腓肠肌采取横切的方式,保存于4%多聚甲醛,用于制作石蜡切片。收集肝脏,分左、右2块,分别装于冻存管中,-80 ℃保存备用。
1.6 血清生化指标测定全自动生化分析仪检测血清中尿素(urea, UREA)、葡萄糖(glucose,GLU)、肌酸激酶(creatine kinase,CK)、乳酸脱氢酶(lactate dehydrogenase,LDH)的水平。
1.7 血清IL-1β和IL-18酶联免疫吸附测定ELISA法检测小鼠血清中IL-1β和IL-18含量,按照试剂盒说明书进行。
1.8 RT-qPCR检测按照RNA提取试剂盒说明书(日本TaKaRa公司),分离提取各组腓肠肌组织中总RNA后,用TaKaRa反转录酶试剂盒逆转录获得cDNA产物,-20 ℃保存备用。按照SYBR Green Master Mix说明书配制反应溶液,PCR反应体系为20 μL,采用PCR仪(CFX-96 realtime PCR system,美国Bio-Rad公司)完成反应,测定基因mRNA的表达水平。以β-actin为内参,用2-ΔΔCt方法分析基因的相对表达量。引物序列见表 1。
| 基因 | 引物序列(5'→3') |
| NLRP3 | 上游:GCCGTCTACGTCTTCTTCCTTTCC |
| 下游:CATCCGCAGCCAGTGAACAGAG | |
| Caspase-1 | 上游:AGAGGATTTCTTAACGGATGCA |
| 下游:TCACAAGACCAGGCATATTCTT | |
| 上游:ACAATGACTGTGCTTAGAGACA | |
| ASC | 下游:CACAGCTCCAGACTCTTCTTTA |
| 上游:CCCAAGCAATACCCAAAGAA | |
| IL-1β | 下游:TTGTGAGGTGCTGATGTACCA |
| 上游:AGACCTGGAATCAGACAACTTT | |
| IL-18 | 下游:TCAGTCATATCCTCGAACACAG |
| 上游:CTACCTCATGAAGATCCTGACC | |
| β-actin | 下游:CACAGCTTCTCTTTGATGTCAC |
1.9 Western blot检测
腓肠肌样本在4 ℃环境下缓慢解冻后在含有1%的蛋白酶抑制剂的组织裂解缓冲液(美国Sigma-Aldrich公司)中裂解。用BCA试剂盒(碧云天生物技术有限公司)测定蛋白质浓度。而后进行SDS-PAGE凝胶电泳,然后转移到聚偏二氟乙烯膜上。用5%脱脂牛奶封闭膜1 h,然后用抗体(1 ∶1 000)在4 ℃过夜进行孵育。然后,TBST缓冲液清洗膜3次,在室温下用辣根过氧化物酶(碧云天生物技术有限公司)标记的二抗孵育1 h,TBST洗膜3次。免疫染色条带用Fusion FX(法国Vilber Lourmat公司)和Immobilon Western化学发光HRP底物(美国Millipore公司)显示和测定。利用Image J软件分析蛋白表达水平,并根据内参蛋白β-actin计算蛋白相对表达量。
1.10 肝糖原和肌糖原检测肝脏和腓肠肌样本在4 ℃环境下缓慢解冻后,研磨制备匀浆,4 000 r/min离心10 min,收集上清液。采用硫酸蒽酮比色法根据试剂盒说明(北京索莱宝科技有限公司)检测肝脏和肌肉组织糖原的含量。
1.11 氧化应激指标的检测腓肠肌样本在4 ℃环境下缓慢解冻后,研磨制备匀浆,4 000 r/min离心10 min,收集上清液。采用二硫代二硝基苯甲酸法测定GSH-Px活性;采用嘌呤氧化酶法测定SOD活性;采用硫代巴比妥酸法测定MDA水平。测定步骤均按试剂盒说明书标准流程进行。
1.12 HE染色新鲜腓肠肌组织浸于4%多聚甲醛中固定24 h,修剪组织,在自动脱水机中进行以下步骤:流水冲洗2 h、脱水、透明、浸蜡、包埋;切片机连续切片,厚度为4 μm;切片进行HE染色。染色后使用数字切片工作站VS120对切片进行全波片扫描后用Olympus VS-120图像处理软件观察拍照。
1.13 数据处理与分析计量资料用x±s表示,两样本间统计学差异分析用独立样本t检验,三组间用One-way ANOVA检验,若P<0.05,则认为差异具有统计学意义,GraphPad Prism8.0版用于统计分析。
2 结果 2.1 n-3 PUFAs对小鼠骨骼肌组织形态结构的影响HE染色结果显示,EX组腓肠肌相较CON组,肌纤维排列不规则,连接处出现严重炎症浸润,核仁排列杂乱;FA+EX组和FO+EX组比较,EX组腓肠肌的肌纤维排列规则,核仁规则明显,炎症浸润明显减少(图 1)。
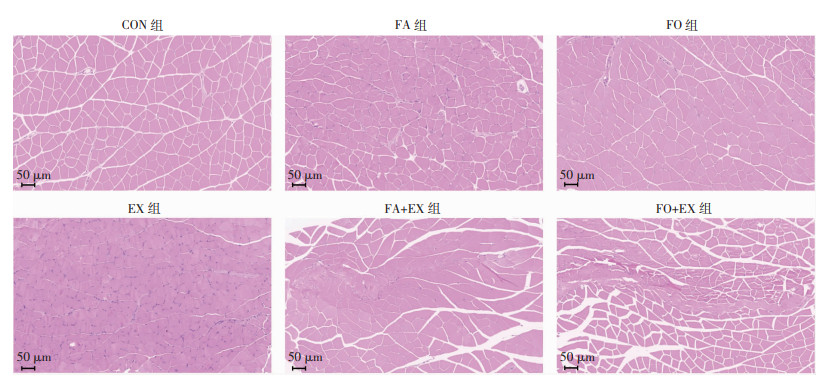
|
| 图 1 n-3 PUFAs对小鼠骨骼肌组织形态结构的影响 |
2.2 n-3 PUFAs对小鼠血清UREA、GLU、CK、LDH水平的影响
由图 2可知,与CON组比较,EX组血清UREA、CK、LDH水平显著升高(P<0.05),GLU水平显著下降(P<0.05);FA+EX组和FO+EX组血清UREA、GLU、CK、LDH水平差异无统计学意义。与EX组比较,FA+EX组和FO+EX组血清UREA、CK、LDH水平明显下降(P<0.05),GLU水平明显上升(P<0.05)。
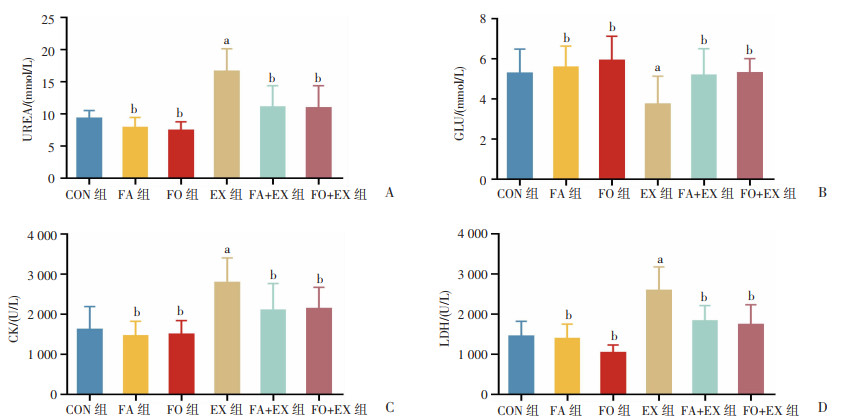
|
|
a: P<0.05,与CON组比较;b:P<0.05,与EX组比较 A:血清尿素含量;B:血清葡萄糖含量;C:血清肌酸激酶含量;D:血清乳酸脱氢酶含量 图 2 n-3 PUFAs对小鼠血清UREA、GLU、CK、LDH水平的影响 |
2.3 n-3 PUFAs对小鼠肝糖原和肌糖原含量的影响
由图 3可知,与CON组比较,EX组肝糖原和肌糖原含量显著下降(P<0.05);FO+EX组肝糖原和肌糖原含量差异无统计学意义。与EX组比较,FA+EX组和FO+EX组肝糖原和肌糖原含量显著升高(P<0.05)。
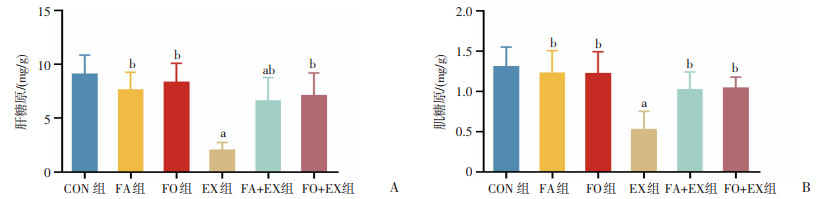
|
| a: P<0.05,与CON组比较;b:P<0.05,与EX组比较 图 3 n-3 PUFAs对小鼠肝糖原(A)和肌糖原(B)含量的影响 |
2.4 n-3 PUFAs对小鼠骨骼肌抗氧化指标的影响
结果显示,与CON组比较,EX组骨骼肌SOD、GSH-Px活性显著降低(P<0.05, 图 4A、C),EX组、FA+EX组和FO+EX组骨骼肌MDA含量显著升高(P<0.05,图 4B),FA+EX组和FO+EX组骨骼肌SOD和GSH-Px活性含量差异无统计学意义。与EX组比较,FA+EX组和FO+EX组骨骼肌SOD、GSH-Px活性显著升高(P<0.05,图 4A、C),MDA含量显著降低(P<0.05,图 4B)。
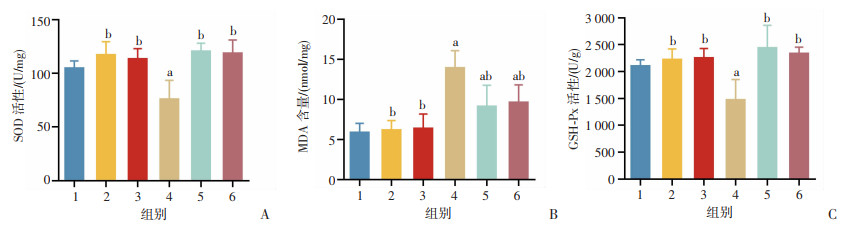
|
|
1: CON组;2:FA组;3:FO组;4:EX组;5:FA+EX组;6:FO+EX组;a: P<0.05,与CON组比较;b:P<0.05,与EX组比较 A:腓肠肌SOD活性水平;B:腓肠肌MDA含量水平;C:腓肠肌GSH-Px活性水平 图 4 n-3 PUFAs对小鼠骨骼肌抗氧化指标的影响 |
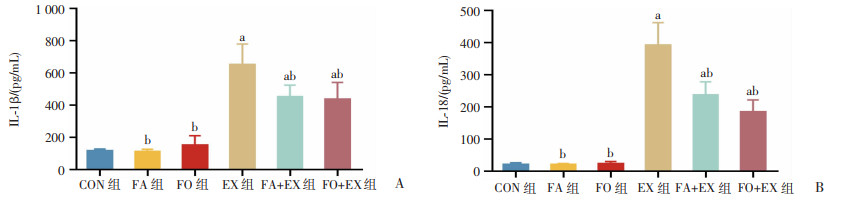
2.5 n-3 PUFAs对小鼠血清IL-1β和IL-18水平的影响
ELISA结果显示(图 5),与CON组比较,EX组、FA+EX组和FO+EX组血清IL-1β和IL-18水平显著升高(P<0.05)。与EX组比较,FA+EX组和FO+EX组血清IL-1β和IL-18水平显著降低(P<0.05)。
|
| a: P<0.05,与CON组比较;b:P<0.05,与EX组比较 图 5 n-3 PUFAs对小鼠血清IL-1β(A)和IL-18(B)水平的影响 |
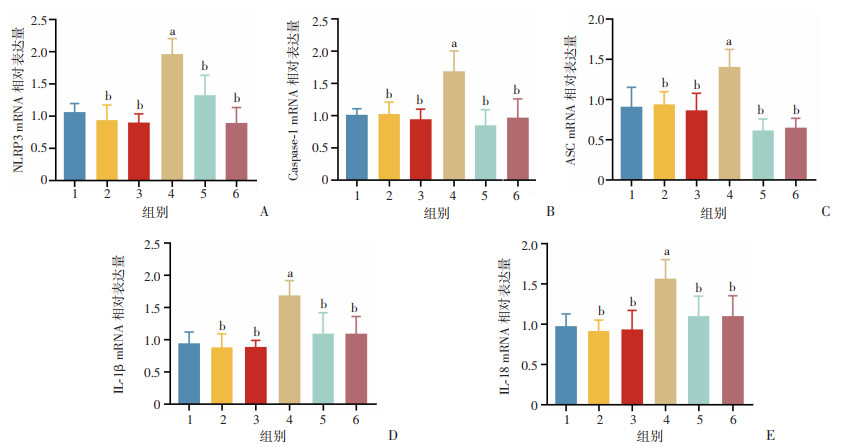
2.6 n-3 PUFAs对小鼠骨骼肌NLRP3炎症小体活化的影响
RT-qPCR结果显示,与CON组比较,EX组骨骼肌NLRP3、Caspase-1、ASC、IL-1β、IL-18的mRNA相对表达量显著升高(P<0.05,图 6);与EX组比较,FA+EX组和FO+EX组骨骼肌NLRP3、Caspase-1、ASC、IL-1β、IL-18的mRNA相对表达量显著下降(P<0.05)。
|
|
1: CON组;2:FA组;3:FO组;4:EX组;5:FA+EX组;6:FO+EX组;a: P<0.05,与CON组比较;b:P<0.05,与EX组比较 A:腓肠肌NLRP3 mRNA相对表达量分析;B:腓肠肌Caspase-1 mRNA相对表达量分析;C:腓肠肌ASC mRNA相对表达量分析;D:腓肠肌IL-1β mRNA相对表达量分析;E:腓肠肌IL-18 mRNA相对表达量分析 图 6 n-3 PUFAs对小鼠骨骼肌NLRP3炎症小体mRNA表达的影响 |
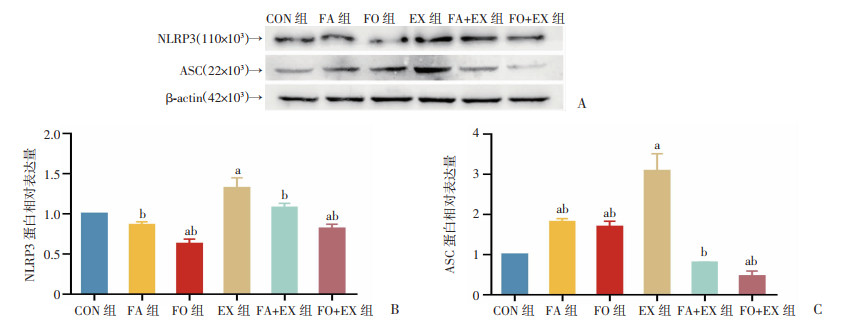
Western blot结果显示,与CON组比较,EX组骨骼肌NLRP3和ASC蛋白表达显著升高(P<0.05);与EX组相比较,FA+EX组和FO+EX组骨骼肌NLRP3和ASC蛋白表达显著降低(P<0.05, 图 7)。
|
|
a: P<0.05,与CON组比较;b:P<0.05,与EX组比较 A:Western blot结果;B:NLRP3蛋白相对表达量;C:ASC蛋白相对表达量 图 7 n-3 PUFAs对小鼠骨骼肌NLRP3炎症小体蛋白表达的影响 |
3 讨论
运动性疲劳是运动训练和竞技活动中普遍存在的现象,其对运动表现和身体健康有着重要的影响。运动性疲劳通常是由于长时间、高强度的运动引起的,可能导致肌肉酸痛、力量下降、反应能力降低、注意力不集中、心率增加、呼吸困难等症状。目前,关于运动性疲劳的机制有能量耗竭假说、代谢物积累假说、氧化应激假说和炎症假说[18]。随着对运动性疲劳的研究不断深入,越来越多的证据表明,炎症反应在运动性疲劳的发生和发展中起着重要的作用。机体在进行急性大强度运动时,抗氧化酶活性受到抑制,氧化和抗氧化水平失去平衡,骨骼肌氧化应激反应加剧,引起骨骼肌微损伤,激活炎症反应。过度的炎症反应可能导致过度的免疫细胞浸润和炎症介质释放,进而加剧骨骼肌损伤,导致运动性疲劳[19-21]。研究发现,n-3 PUFAs具有显著抗氧化和抗炎作用,可以增加抗氧化酶的表达和活性,降低自由基的产生,进而减少氧化应激和炎症的发生[22-23]。这些研究提示n-3 PUFAs可能有助于改善力竭运动诱导氧化应激引起的炎症和疲劳。
3.1 n-3 PUFAs可改善力竭运动诱导的氧化应激水平大量研究表明,超大强度运动诱导细胞产生活性氧(ROS),且超过抗氧化防御系统的能力引起氧化应激,氧化应激过程中产生的活性氧物质如超氧阴离子、过氧化氢等可以通过氧化损伤细胞膜、激活细胞信号通路和蛋白质,导致炎症反应的发生[24-25]。另一方面,炎症反应中产生的炎症细胞(如巨噬细胞、中性粒细胞)释放多种活性物质如一氧化氮、过氧化物酶,可以进一步增强细胞内的氧化应激水平,并导致细胞膜破坏,DNA、蛋白质氧化等[26]。MDA是脂质过氧化产物,运动过程中机体脂质过氧化水平增强,MDA含量增加。SOD能快速催化人体自由基发生歧化反应,从而清除超氧阴离子自由基、羟自由基等自由基。GSH-Px主要催化H2O2等过氧化物的分解,起到细胞保护的作用。MDA、SOD、GSH-Px都是评价氧化应激常用的指标。已发现力竭运动会增加MDA水平,降低SOD和GSH-Px的活性,加剧氧化损伤[27]。本研究结果观察到,EX组小鼠骨骼肌MDA水平与CON组小鼠相比显著升高,骨骼肌SOD和GSH-Px活性与CON组小鼠相比显著降低。而补充n-3 PUFAs的FA+EX组和FO+EX组小鼠骨骼肌MDA与EX组小鼠相比显著下降,骨骼肌SOD和GSH-Px活性与EX组小鼠相比显著增强。提示补充n-3 PUFAs能够增加机体的抗氧化水平和抗氧化酶活性,在一定程度上减轻力竭运动诱导的氧化应激水平。
3.2 n-3 PUFAs可抑制力竭运动诱导小鼠骨骼肌NLRP3炎症小体活化炎症小体是由核苷酸结合域和富含亮氨酸重复序列的蛋白质或AIM2、ASC和Caspase-1组成的胞质蛋白复合物,是先天免疫和炎症的中央调节因子[28]。其中NLRP3作为感受分子的一种被研究较多,其效应分子主要是含半胱氨酸的天冬氨酸蛋白水解酶1前体(pro-Caspase-1),剪切其形成具有生物活性Caspase-1,而Caspase-1再继续剪切pro-IL-1β、pro-IL-18,生成成熟的IL-1β、IL-18。研究发现,氧化应激反应可激活NLRP3炎症小体产生的炎症反应[29],力竭运动可能通过诱导氧化应激进而激活NLRP3炎症小体,导致骨骼肌炎症和疲劳的发生。李方等[30]的研究发现力竭运动会导致大鼠肾脏组织NLRP3炎症小体的过度激活,IL-1β和IL-18过度表达。本研究在骨骼肌中也发现相同趋势,Western blot结果显示,力竭运动能显著上调小鼠骨骼肌NLRP3和ASC的蛋白表达,而补充n-3 PUFAs可下调其蛋白表达,RT-qPCR分析也表明,力竭运动能显著上调小鼠骨骼肌NLRP3、ASC、Caspase-1、IL-1β和IL-18的mRNA表达,而补充n-3 PUFAs可下调其mRNA表达。表明n-3 PUFAs可抑制力竭运动诱导小鼠骨骼肌中NLRP3炎症小体的活化、减少IL-1β和IL-18的表达。
3.3 n-3 PUFAs可缓解力竭运动诱导小鼠运动性疲劳运动可引起体内的糖类物质大量消耗,导致血糖浓度降低,糖原含量下降。长期超大强度运动后导致糖酵解增强,乳酸生成增加; 蛋白降解,血液中氨基酸的代谢产物尿素氮含量上升。因此机体在运动过程中,乳酸、尿素氮等代谢产物大量堆积,而血糖水平下降,肌/肝糖原含量降低,引起机体产生疲劳。机体中的LDH可以加速分解过量的乳酸,以此抑制疲劳的产生,缓解疲劳后身体机能的恢复。血清中CK的含量是反映机体过度劳累及间接反映肌肉损伤的重要指标,另外,CK在能量转移、肌肉收缩和ATP生成中起重要作用。因此在运动机体代谢过程中,LDH、UREA、CK、GLU、肌糖原和肝糖原是常见的评价机体是否出现运动性疲劳的几个重要指标。在本研究中,EX组小鼠血清GLU、肝糖原和肌糖原含量与CON组小鼠相比显著降低,血清UREA、LDH水平和CK水平与CON组小鼠相比显著升高,说明力竭运动可引起机体疲劳,本研究结果与相关研究结果一致[31]。而补充n-3 PUFAs的FA+EX组和FO+EX组小鼠血清GLU和肝糖原水平与EX组小鼠相比显著上升,血清UREA、LDH水平和CK水平与EX组小鼠相比显著下降,证明补充n-3 PUFAs具有缓解运动性疲劳的作用。
综上所述,本研究通过7 d力竭跑台诱导小鼠运动性疲劳模型,证明外源补充和内源合成n-3 PUFAs均可提高小鼠抗氧化能力,改善力竭运动诱导的小鼠骨骼肌炎症,发现NLRP3炎症小体在介导n-3 PUFAs改善运动性疲劳的过程中可能发挥重要作用。但n-3 PUFAs改善运动性疲劳的确切分子机制还需要进一步深入研究。本研究为改善运动性疲劳提供了新的干预靶点,同时为通过膳食营养途径利用n-3 PUFAs改善运动性疲劳提供了新的科学依据。
| [1] |
MORA S, COOK N, BURING J E, et al. Physical activity and reduced risk of cardiovascular events: potential mediating mechanisms[J]. Circulation, 2007, 116(19): 2110-2118. |
| [2] |
WEI C B, ZHAO S N, ZHANG Y T, et al. Effect of multiple-nutrient supplement on muscle damage, liver, and kidney function after exercising under heat: based on a pilot study and a randomised controlled trial[J]. Front Nutr, 2021, 8: 740741. |
| [3] |
SMITH L L. Tissue trauma: the underlying cause of overtraining syndrome?[J]. J Strength Cond Res, 2004, 18(1): 185-193. |
| [4] |
SMITH L L. Cytokine hypothesis of overtraining: a physiological adaptation to excessive stress?[J]. Med Sci Sports Exerc, 2000, 32(2): 317-331. |
| [5] |
ROBSON-ANSLEY P J, MILANDER L D, COLLINS M, et al. Acute interleukin-6 administration impairs athletic performance in healthy, trained male runners[J]. Revue Can De Physiol Appliquee, 2004, 29(4): 411-418. |
| [6] |
冯炜权. 对运动疲劳机理的再认识[J]. 北京体育大学学报, 2003, 26(4): 433-437, 443. FENG W Q. Re-cognition of mechanism of sportsfatigue[J]. J Beijing Sport Univ, 2003, 26(4): 433-437, 443. |
| [7] |
-J APPELL H, SOARES J M C, DUARTE J A R. Exercise, muscle damage and fatigue[J]. Sports Med, 1992, 13(2): 108-115. |
| [8] |
SHAHIDI F, AMBIGAIPALAN P. Omega-3 polyunsaturated fatty acids and their health benefits[J]. Annu Rev Food Sci Technol, 2018, 9: 345-381. |
| [9] |
OCHI E, TSUCHIYA Y. Eicosapentaenoic acid (EPA) and docosahexaenoic acid (DHA) in muscle damage and function[J]. Nutrients, 2018, 10(5): 552. |
| [10] |
PHILPOTT J D, WITARD O C, GALLOWAY S D R. Applications of omega-3 polyunsaturated fatty acid supplementation for sport performance[J]. Res Sports Med, 2019, 27(2): 219-237. |
| [11] |
SUZUKI K. Cytokine response to exercise and its modulation[J]. Antioxidants, 2018, 7(1): 17. |
| [12] |
CERQUEIRA É, MARINHO D A, NEIVA H P, et al. Inflammatory effects of high and moderate intensity exercise—a systematic review[J]. Front Physiol, 2019, 10: 1550. |
| [13] |
LI H Y, MIAO W G, MA J F, et al. Acute exercise—induced mitochondrial stress triggers an inflammatory response in the myocardium via NLRP3 inflammasome activation with mitophagy[J]. Oxid Med Cell Longev, 2016, 2016: 1987149. |
| [14] |
ZHANG L D, TIAN G L, HUANG L, et al. Pterostilbene attenuates intestinal epithelial barrier loss induced by high loading intensity of exercise[J]. Front Nutr, 2022, 9: 965180. |
| [15] |
HOU P F, WANG D W, LANG H D, et al. Dihydromyricetin attenuates high-intensity exercise-induced intestinal barrier dysfunction associated with the modulation of the phenotype of intestinal intraepithelial lymphocytes[J]. Int J Mol Sci, 2022, 24(1): 221. |
| [16] |
BEDFORD T G, TIPTON C M, WILSON N C, et al. Maximum oxygen consumption of rats and its changes with various experimental procedures[J]. J Appl Physiol Respir Environ Exerc Physiol, 1979, 47(6): 1278-1283. |
| [17] |
LEZI L Z, LU J H, SELFRIDGE J E, et al. Lactate administration reproduces specific brain and liver exercise-related changes[J]. J Neurochem, 2013, 127(1): 91-100. |
| [18] |
LIU Y Z, LI C Y, SHEN X F, et al. The use of traditional Chinese medicines in relieving exercise-induced fatigue[J]. Front Pharmacol, 2022, 13: 969827. |
| [19] |
STEENSBERG A, VAN HALL G, OSADA T, et al. Production of interleukin-6 in contracting human skeletal muscles can account for the exercise-induced increase in plasma interleukin-6[J]. J Physiol, 2000, 529(Pt 1): 237-242. |
| [20] |
CANNON J G, FIELDING R A, FIATARONE M A, et al. Increased interleukin 1 beta in human skeletal muscle after exercise[J]. Am J Physiol, 1989, 257(2 Pt 2)): R451-R455. |
| [21] |
ROERINK M E, VAN DER SCHAAF M E, DINARELLO C A, et al. Interleukin-1 as a mediator of fatigue in disease: a narrative review[J]. J Neuroinflamm, 2017, 14(1): 16. |
| [22] |
LI G L, LI Y Y, XIAO B P, et al. Antioxidant activity of docosahexaenoic acid (DHA) and its regulatory roles in mitochondria[J]. J Agric Food Chem, 2021, 69(5): 1647-1655. |
| [23] |
BUONOCORE D, VERRI M, GIOLITTO A, et al. Effect of 8-week n-3 fatty-acid supplementation on oxidative stress and inflammation in middle- and long-distance running athletes: a pilot study[J]. J Int Soc Sports Nutr, 2020, 17(1): 55. |
| [24] |
POWERS S K, NELSON W B, HUDSON M B. Exercise-induced oxidative stress in humans: cause and consequences[J]. Free Radic Biol Med, 2011, 51(5): 942-950. |
| [25] |
MALAGUTI M, ANGELONI C, HRELIA S. Polyphenols in exercise performance and prevention of exercise-induced muscle damage[J]. Oxid Med Cell Longev, 2013, 2013: 825928. |
| [26] |
WU C, ZHOU S Y, MA S H, et al. Effect of genistein supplementation on exercise-induced inflammation and oxidative stress in mice liver and skeletal muscle[J]. Medicina (Kaunas), 2021, 57(10): 1028. |
| [27] |
黄小兰, 黄少波, 邵丽. 银耳多糖对力竭运动小鼠氧化性损伤所致疲劳的缓解作用[J]. 食品工业科技, 2023, 44(24): 1-15. HUANG X L, HUANG S B, SHAO L. Effect of Tremella fuciformis Polysaccharides on Fatigue Induced by Oxidative Damage in Exhaustive Exercise Mice[J]. Sci Technol Food Ind, 2023, 44(24): 1-15. |
| [28] |
MARTINON F, MAYOR A, TSCHOPP J. The inflammasomes: guardians of the body[J]. Annu Rev Immunol, 2009, 27: 229-265. |
| [29] |
SHEN S C, HE F, CHENG C, et al. Uric acid aggravates myocardial ischemia-reperfusion injury via ROS/NLRP3 pyroptosis pathway[J]. Biomedecine Pharmacother, 2021, 133: 110990. |
| [30] |
李方, 曹建民, 翟鹏飞, 等. 白藜芦醇调节NLRP3炎性小体改善力竭运动大鼠肾组织炎症损伤[J]. 陆军军医大学学报, 2022, 44(12): 1229-1236. LI F, CAO J M, ZHAI P F, et al. Resveratrol improves renal inflammatory injury in exhaustive exercise rats by regulating NOD-like receptor protein 3 inflammasome[J]. J Army Med Univ, 2022, 44(12): 1229-1236. |
| [31] |
程耀明. 姜黄提取物对运动小鼠生理疲劳和生理机能的影响[J]. 基因组学与应用生物学, 2019, 38(12): 5738-5743. CHENG Y M. Effects of turmeric extract on physiological fatigue and physiological function of exercisemice[J]. Genom Appl Biol, 2019, 38(12): 5738-5743. |




