2. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院呼吸内科研究所,全军呼吸病研究重点实验室
2. Institute of Respiratory Diseases, Key Laboratory of Respiratory Disease of PLA, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037, China
肺癌作为发病率及病死率均居全球前列的恶性肿瘤之一,其全国新发病例人数及新增死亡病例人数均居我国癌症首位[1-3]。肺癌根据病理组织类型不同可分为小细胞肺癌(small cell lung cancer, SCLC)和非小细胞肺癌(non-small cell lung cancer, NSCLC)。其中,NSCLC最为常见(>85%),而肺鳞状细胞癌,即肺鳞癌,则是NSCLC第二常见的亚型[1, 4]。据统计,全世界约有2/3的肺癌死亡归因于吸烟,而吸烟则是肺鳞癌致病的主要因素之一[5]。2017年全球疾病负担研究显示[6],吸烟还是我国导致死亡的前四大风险因素之一。因此,在我国开展肺癌,尤其是肺鳞癌相关研究刻不容缓。
长链非编码RNA(long non-coding RNA, lncRNA) 是一种包含200个以上核苷酸的RNA,这类RNA大多没有蛋白编码能力,少部分可编码功能性小肽,具有较高的组织特异性和疾病特征性,在肿瘤中具有极其重要的作用[7-8]。近年来,大量研究表明,lncRNA可在表观遗传、转录及转录后翻译层面对基因进行调控[9-10],影响肿瘤细胞的增殖、迁移、侵袭、凋亡和血管生成、上皮间质转化以及抗肿瘤药物的耐药性等多种功能[11-15]。
本课题组前期运用基因表达谱芯片筛选出了肺癌中差异表达的lncRNAs并重点关注了表面活性剂相关1假基因(surfactant associated 1 pseudogene,SFTA1P)。SFTA1P位于10p14染色体区域,是一种由假基因衍生而来的lncRNA,全长693 bp[16]。有研究表明,SFTA1P在肿瘤发生发展中具有重要作用[17-18],然而目前关于lncRNA SFTA1P在肺鳞癌中的作用及机制相关研究仍鲜有报道。因此,本研究将探讨SFTA1P对肺鳞癌细胞生物学功能的影响,以期为lncRNA SFTA1P在肺鳞癌中的作用及机制相关研究提供理论依据。
1 材料与方法 1.1 材料 1.1.1 细胞株肺鳞癌细胞系SK-MES-1购自美国模式培养物集成库(American type culture collection, ATCC),肺鳞癌细胞系H520及人正常肺上皮细胞系BEAS-2B购自中国科学院上海细胞生物学研究所细胞库。
1.1.2 主要试剂及耗材1640培养基及胎牛血清(Gibco公司,美国),高糖培养基及胰酶(Hyclone公司,美国),青霉素与链霉素溶液、PBS缓冲液、lipo8000、结晶紫染色液、Cell Counting Kit-8试剂盒(碧云天公司,中国),RNA提取试剂盒(Foregene公司,中国),逆转录试剂盒及PCR检测试剂盒(abclonal公司,中国),基质胶(BD Biosciences公司,美国),Transwell小室(康宁公司,美国),引物及SFTA1P过表达质粒(上海生工生物有限公司,中国),SFTA1P小干扰RNA(吉玛基因,中国)。
1.2 实验方法 1.2.1 SFTA1P的生物信息学分析肺鳞癌患者RNA-seq数据及临床相关数据均来源于癌症基因组图谱(the cancer genome atlas, TCGA)数据库(https://gdc-portal.nci.nih.gov/),下载并提取肺鳞癌组织及其配对正常肺组织中SFTA1P表达量数据,探究SFTA1P在肺鳞癌组织及其配对正常肺组织之间的表达差异。根据SFTA1P表达量的中位数将TCGA肺鳞癌患者分为SFTA1P高表达组和低表达组,采用R软件包DESeq2分析两组间的差异表达基因(different expressed gene, DEG),调整P<0.05,设置|log2FC|>1为DEG的阈值。采用ggplot2、clusterProfiler、goplot、igraph和ggraph等R软件包对DEGs进行相关性分析;采用基因本体(gene ontology,GO)、京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes, KEGG)和基因集富集分析(gene set enrichment analysis, GSEA)对DEGs进行功能富集分析。
1.2.2 细胞培养用含有10%胎牛血清及1%青霉素链霉素溶液的1640培养基培养H520细胞株,用含10%胎牛血清及1%青霉素链霉素溶液的高糖培养基培养SK-MES-1及BEAS-2B细胞株。以上所有细胞培养于37 ℃的CO2细胞培养箱内。待细胞生长至适宜密度,用0.25%的胰酶进行消化传代培养。
1.2.3 qRT-PCR检测细胞中SFTA1P表达水平待细胞生长至80%的细胞密度后对其进行消化、离心并收集沉淀,提取总RNA后进行逆转录PCR。逆转录程序为37 ℃ 2 min,55 ℃ 15 min,85 ℃ 5 min,4 ℃保持不变。PCR程序为95 ℃ 3 min,95 ℃ 5 s,60 ℃ 30 s,共40个循环。以上每个样本重复3次,得到的数据使用2-ΔΔCt法进行分析处理。其中,内参基因为β-actin,其上游引物为5′-GCAGAGAAGCTGGTGCTCCGTA-3′,下游引物为5′-CAGCATGTTGGACTCGATGCAG-3′;SFTA1P为目的基因,其上游引物为5′-CAGCATTCC-AGGTGGGCTTT-3′,下游引物为5′-TTGTTTGGCTTAC-TCGTGCC-3′。本课题组前期已检测过以上引物的效果及特异性[19]。此外,在SFTA1P相关下游靶基因的qRT-PCR验证过程中,所用靶基因引物序列均来自PrimerBank(https://pga.mgh.harvard.edu/primerbank/)。其中,MYC上游引物为5′-GGCTCCTGGCAAAAGGT-CA-3′,下游引物为5′-CTGCGTAGTTGTGCTGATGT-3′;E2F1上游引物为5′-ACGCTATGAGACCTCACTGAA-3′,下游引物为5′-TCCTGGGTCAACCCCTCAAG-3′。
1.2.4 转染并构建过表达和干扰细胞模型将肺鳞癌细胞接种于6孔板中,待生长至适宜密度即可对其进行转染。转染前2 h将6孔板中培养基更换为含10%血清但不含青霉素链霉素溶液的培养基。按lipo8000说明书配制包含过表达质粒或小干扰RNA、Opti-MEM和lipo8000的转染混合液,配制完成后即可将混合液加入至6孔板中,4~6 h后再更换为完全培养基继续培养。24 h后收集细胞,提取总RNA,进行逆转录PCR验证目的基因的转染效果。其中,过表达细胞模型构建过表达组转染SFTA1P过表达质粒(pcDNA3.1-SFTA1P),对照组转染空质粒(pcDNA3.1);干扰细胞模型构建敲低组转染SFTA1P小干扰RNA(si-SFTA1P-1和si-SFTA1P-2),对照组转染对照小干扰RNA(si-NC)。
1.2.5 细胞增殖实验收集转染后的细胞,测定并调整细胞悬液浓度,于96孔板中每孔接种200 μL细胞悬液(含3 000个细胞),然后继续在细胞培养箱内培养5 d。每天设3个复孔,分别在第1、2、3、4、5天加入110 μL CCK-8工作液,在培养箱中继续培养1.5 h后用酶标仪检测450 nm处光密度值。
1.2.6 细胞迁移和侵袭实验迁移实验:向24孔板内加入500 μL含血清的培养基,然后将Transwell小室放置其中。收集细胞,用不含血清不含青霉素链霉素溶液的培养基重悬并测定细胞浓度。向小室内加入100 μL细胞悬液(含30 000个细胞),继续培养12 h。12 h后取出并擦净小室内侧,用甲醇固定后取出风干,用结晶紫染色后清洗晾干,最后于显微镜下进行拍照计数。
侵袭实验:实验前需将-20 ℃保存的基质胶置于4 ℃冰箱过夜融化并用提前预冷的无血清培养基按1∶10的比例对基质胶进行稀释,将稀释后的基质胶加入24孔板中的小室内,再放入培养箱静置1 h使其凝固成型,其余步骤与迁移实验大致相同。
1.3 统计学分析采用GraphPad Prism 9进行全部统计分析。数据展示为x±s,通过Shapiro-Wilk normality test对数据进行正态性检验,对于符合正态分布的数据,采用t检验进行2组间比较;对于不符合正态分布的数据,采用非参数检验进行2组间比较。P<0.05表示差异有统计学意义。
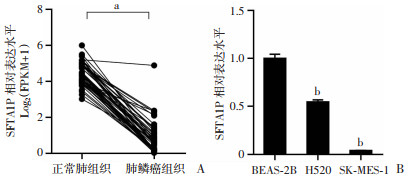
2 结果 2.1 SFTA1P在肺鳞癌组织及其配对正常肺组织以及肺鳞癌细胞中的表达将TCGA数据库中51例肺鳞癌组织和51例与其配对的正常肺组织SFTA1P表达量数据(FPKM数据)进行log2(FPKM+1)对数转化处理后,采用配对t检验对其进行比较分析,结果显示相对正常肺组织,SFTA1P在肺鳞癌组织中低表达(P<0.05,图 1A);在细胞株中对SFTA1P进行定量分析,结果显示相比于BEAS-2B细胞株,SFTA1P在SK-MES-1及H520细胞株中相对低表达(P<0.01,图 1B)。
|
| A:SFTA1P在肺鳞癌组织及其配对正常肺组织中的表达 a:P<0.05;B:SFTA1P在人正常肺上皮细胞及肺鳞癌细胞中的表达 b:P<0.01,与BEAS-2B细胞株比较 图 1 SFTA1P在肺鳞癌组织及其配对正常肺组织以及人正常肺上皮细胞及肺鳞癌细胞中的表达 |
2.2 SFTA1P过表达和干扰细胞模型的构建
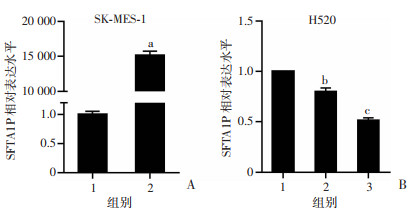
在SK-MES-1细胞中转染SFTA1P过表达质粒,在H520细胞中转染小干扰RNA并在37 ℃细胞培养箱中培养24 h后提取总RNA进行逆转录PCR,结果显示,在SK-MES-1细胞系中,与转染空质粒(pcDNA3.1)的对照组相比,转染SFTA1P过表达质粒(pcDNA3.1-SFTA1P)组的SFTA1P表达水平显著升高(P<0.05,图 2A);在H520细胞系中,与转染对照小干扰RNA(si-NC)的对照组相比,转染SFTA1P小干扰RNA(si-SFTA1P-1和si-SFTA1P-2)组的SFTA1P表达水平显著下降(P<0.05,图 2B)。以上结果表明,SFTA1P过表达及干扰细胞模型构建成功。
|
| A:过表达细胞模型中SFTA1P过表达效果 1:pcDNA3.1;2:pcDNA3.1-SFTA1P;a: P<0.05,与pcDNA3.1比较;B:干扰细胞模型中SFTA1P干扰效果 1:si-NC;2:si-SFTA1P-1;3:si-SFTA1P-2;b: P<0.05,与si-NC比较;c:P<0.01,与si-NC比较 图 2 SFTA1P过表达和干扰细胞模型的构建 |
2.3 SFTA1P对肺鳞癌细胞增殖能力的影响
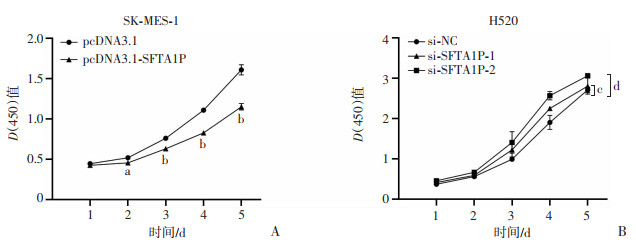
在SK-MES-1和H520细胞系中,分别过表达和敲低SFTA1P并在第1、2、3、4、5天对细胞增殖能力进行检测。结果发现在SK-MES-1细胞系中,过表达SFTA1P组较对照组细胞的增殖能力显著降低(P<0.05,图 3A);在H520细胞系中,敲低SFTA1P组较对照组,细胞的增殖能力明显上升(P<0.05,图 3B)。CCK-8实验结果表明,SFTA1P或可抑制肺鳞癌细胞的增殖能力。
|
| A:SFTA1P过表达对SK-MES-1细胞增殖能力的影响 a:P<0.05,b:P<0.01,与pcDNA3.1比较;B:SFTA1P敲低对H520细胞增殖能力的影响 c:P<0.05,d:P <0.01 图 3 过表达和干扰SFTA1P对肺鳞癌细胞增殖的影响 |
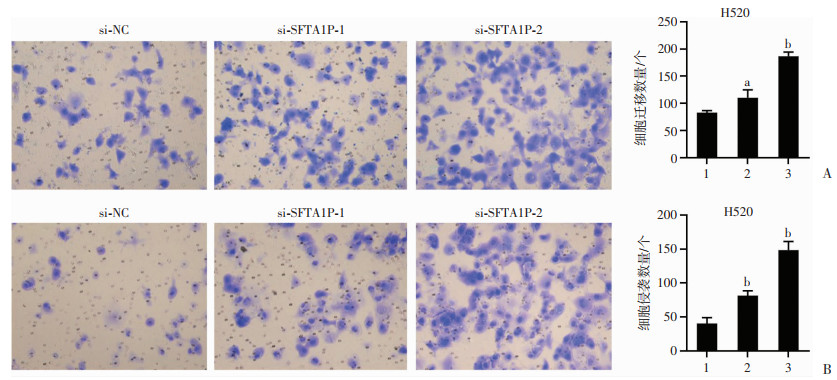
2.4 SFTA1P对肺鳞癌细胞迁移和侵袭能力的影响
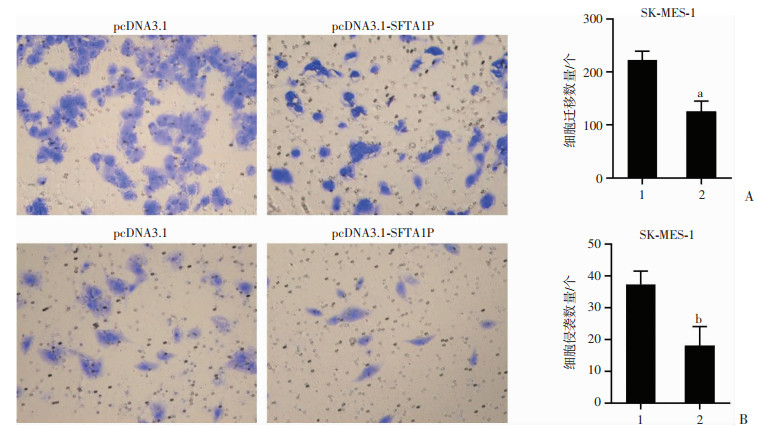
Transwell迁移实验结果显示,SFTA1P过表达组的细胞迁移能力较对照组降低(P<0.05,图 4A),SFTA1P敲低组的细胞迁移能力较对照组增加(P<0.05,图 5A);Transwell侵袭实验结果也显示SFTA1P过表达组的细胞侵袭能力较对照组降低(P<0.01,图 4B),SFTA1P敲低组的细胞侵袭能力较对照组增加(P<0.01,图 5B)。Transwell实验结果表明,SFTA1P或可降低肺鳞癌细胞的迁移和侵袭能力。
|
|
1:pcDNA3.1;2:pcDNA3.1-SFTA1P A:SFTA1P过表达对SK-MES-1细胞迁移能力的影响(×100) a: P<0.05,与pcDNA3.1比较;B:SFTA1P过表达对SK-MES-1细胞侵袭能力的影响(×100) b:P<0.01,与pcDNA3.1比较 图 4 过表达SFTA1P对肺鳞癌细胞迁移及侵袭的影响 |
|
|
1:si-NC;2:si-SFTA1P-1;3:si-SFTA1P-2;a:P<0.05,b:P<0.01,与si-NC比较 A:SFTA1P敲低对H520细胞迁移能力的影响(×100);B:SFTA1P敲低对H520细胞侵袭能力的影响(×100) 图 5 干扰SFTA1P对肺鳞癌细胞迁移及侵袭的影响 |
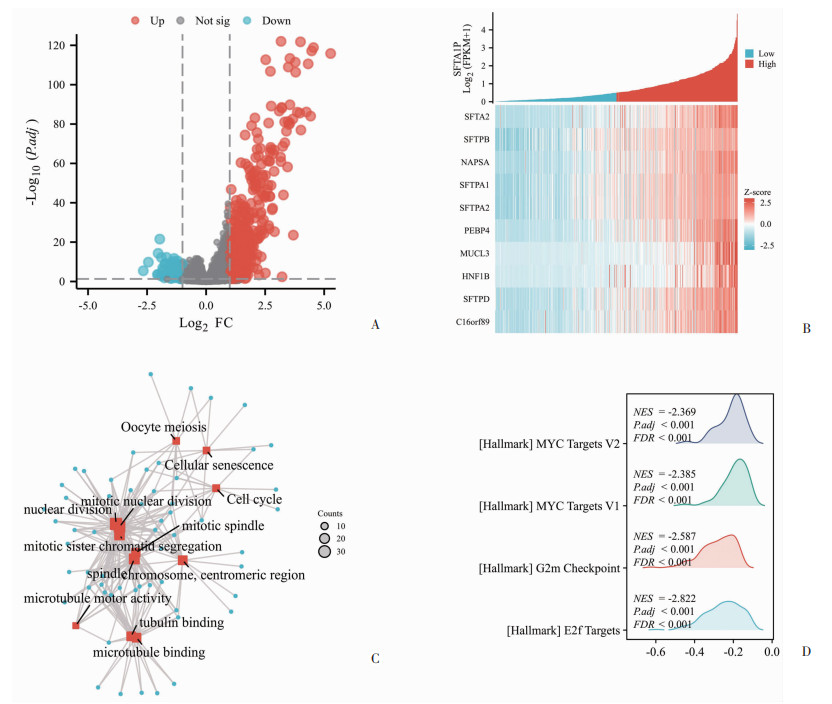
2.5 肺鳞癌中SFTA1P相关差异基因及其功能富集分析
根据SFTA1P表达量的中位数将TCGA肺鳞癌患者分为SFTA1P高表达组和低表达组并进行差异分析,结果显示SFTA1P高表达组和低表达组间共有660个DEGs,其中559个上调,101个下调(图 6A)。采用Spearman相关性分析方法分析差异表达最显著的前10个DEGs与SFTA1P的相关性(图 6B)。接下来进一步对DEGs进行GO和KEGG富集分析,结果显示差异基因主要富集在细胞的有丝分裂、周期和衰老等功能上(图 6C)。对差异基因进行GSEA富集分析,结果显示差异基因主要富集在MYC、G2m检查点和E2f等信号通路上,并在SFTA1P高表达组整体呈现下调趋势(MYC Targets V2 NES=-2.369;MYC Targets V1 NES=-2.385;G2m Checkpoints NES=-2.587;E2f Targets NES=-2.822)(图 6D)。以上结果提示SFTA1P在肺鳞癌中可能通过抑制MYC、G2m检查点和E2f等信号通路影响肺鳞癌细胞的生物学功能,从而在肺鳞癌中发挥抑癌作用。
|
| A:SFTA1P相关DEGs火山图;B:SFTA1P表达与差异表达最显著的前10个DEGs相关性热图;C:SFTA1P相关DEGs的GO和KEGG富集分析网络图;D:SFTA1P相关DEGs的GSEA富集分析山峦图 图 6 肺鳞癌中基于SFTA1P相关差异基因的富集分析 |
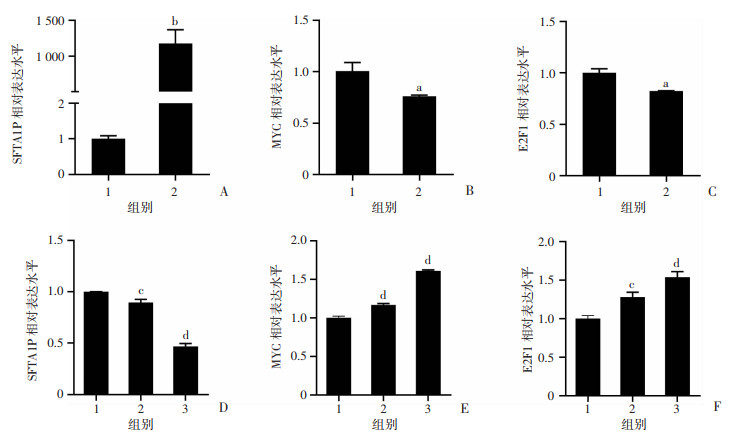
2.6 肺鳞癌中SFTA1P相关下游靶基因的验证
利用SFTA1P过表达和干扰细胞模型,通过qRT-PCR对SFTA1P相关下游靶基因(MYC和E2F1)进行验证,验证结果显示过表达SFTA1P可下调MYC和E2F1的表达(P<0.05,图 7A~C),而敲低SFTA1P可上调MYC和E2F1的表达(P<0.05,图 7D~F)。上述结果进一步提示SFTA1P在肺鳞癌中可能通过抑制MYC和E2F1等癌基因的表达而在肺鳞癌中发挥抑癌作用。
|
| A~C:SK-MES-1细胞过表达SFTA1P后SFTA1P、MYC、E2F1的相对表达水平 1:pcDNA3.1;2:pcDNA3.1-SFTA1P;a:P<0.05,b:P<0.01,与pcDNA3.1比较;D~F:H520细胞敲低SFTA1P后SFTA1P、MYC、E2F1的相对表达水平 1:si-NC;2:si-SFTA1P-1;3:si-SFTA1P-2;c:P<0.05,d:P<0.01,与si-NC比较 图 7 肺鳞癌中SFTA1P相关下游靶基因的qRT-PCR验证 |
3 讨论
本研究通过对TCGA数据库相关数据进行分析,发现SFTA1P在正常肺组织中高表达,在肺鳞癌组织中低表达,这引起了本课题组的极大关注。进而在肺鳞癌细胞中探究SFTA1P表达水平,通过构建SFTA1P过表达及干扰细胞模型并开展相关实验,发现SFTA1P可影响肺鳞癌细胞的增殖、迁移及侵袭。接着,通过生物信息学分析方法对肺鳞癌中SFTA1P相关DEGs进行相关性分析和功能富集分析,发现差异基因主要富集在MYC、G2m检查点和E2f等信号通路上。最后通过qRT-PCR对SFTA1P相关下游靶基因(MYC和E2F1)进行了验证。以上结果表明,SFTA1P在肺鳞癌中可能通过抑制MYC、G2m检查点和E2f信号通路影响肺鳞癌细胞的生物学功能,从而在肺鳞癌中发挥抑癌作用。
越来越多研究证据表明,lncRNAs在肺鳞癌的发生发展中具有重要作用[20-21]。有研究发现,lncRNA HHIP-AS1可通过与HHIP mRNA和RNA结合蛋白HuR相互作用来稳定HHIP mRNA,从而在肺鳞癌中发挥抑癌作用[22];还有研究发现,E2F转录因子7(E2F7)作为lncRNA LINC00649的转录激活剂,可诱导LINC00649在肺鳞癌细胞中高表达,而肺鳞癌细胞中高表达的LINC00649可通过募集TATA-box结合蛋白相关因子15(TAF15)来增强MAPK6的表达从而激活MAPK6信号通路并促进肺鳞癌进展[23];此外,ZHAO等[24]还发现肺鳞癌中高表达的lncRNA DLX6-AS1与肺鳞癌细胞的增殖、凋亡以及肿瘤的局部复发密切相关,并且受H3K4me1激活的DLX6-AS1还可通过miR-181a-5p/miR-382-5p/CELF1轴来诱导肺鳞癌的顺铂继发性耐药。
SFTA1P作为一种新型lncRNA,既往有文献报道其在胃癌[16]、宫颈癌[18]以及肝细胞癌[25]中均具有重要作用,然而SFTA1P在肺癌中的作用及机制却鲜有报道。近年来,有研究表明SFTA1P在肺腺癌中低表达,其高表达可抑制肺腺癌细胞的增殖、迁移及侵袭[26],如ZHANG等[27]发现SFTA1P在肺腺癌中可通过调节缺氧外泌体递送的miR-4766-5p激活激酶大肿瘤抑制因子1 /Yes相关蛋白途径来抑制肿瘤转移。此外,还有文献报道,SFTA1P在肺腺癌中不仅可以作为正反馈调节因子与TAZ mRNA相互作用调控Hippo-YAP/TAZ信号通路[28],还可以通过调节hnRNP-U-GADD45A轴来促进细胞凋亡并增加化疗药物顺铂的敏感性[29]。SFTA1P在肺肿瘤组织中表达较肺正常组织低,肺腺癌和肺鳞癌作为肺肿瘤的2种不同病理类型,SFTA1P在肺鳞癌组织中表达较肺腺癌组织低[17],然而上述研究证据大多聚焦于肺腺癌[27-28],而SFTA1P在肺鳞癌中的具体功能却鲜有研究。因此,本研究以肺鳞癌为研究对象,探讨了SFTA1P对肺鳞癌细胞生物学功能的影响,细胞实验结果提示SFTA1P在肺鳞癌中的功能可能与肺腺癌相一致,即在肺鳞癌中高表达SFTA1P可抑制肺鳞癌细胞的增殖、迁移及侵袭。MYC、G2m检查点和E2f信号通路与肿瘤细胞的增殖、周期和DNA修复密切相关[30-34]。本研究细胞功能实验和生物信息学分析结果也提示SFTA1P在肺鳞癌中或可抑制MYC、G2m检查点和E2f信号通路,从而影响肺鳞癌细胞的生物学功能,进而抑制肺鳞癌的进展。上述研究证据充分表明,SFTA1P在肺癌中具有重要作用,或可成为肺癌靶向治疗的新靶点并为肺癌靶向药物的研发提供新的线索。
然而,本研究也存在一定的局限性,本研究仅在肺鳞癌细胞的生物学功能层面和生物信息学层面进行了初步探索,而尚未在具体的机制层面和动物实验层面展开深入研究,对此本课题组将在后续课题进一步完善。
综上所述,本研究将生物信息学和分子生物学方法相结合,探讨了SFTA1P在肺鳞癌中的表达及其影响肺鳞癌细胞生物学功能的潜在机制,发现SFTA1P在正常肺组织及细胞中高表达,在肺鳞癌组织及细胞中低表达,过表达SFTA1P可抑制肺鳞癌细胞的增殖、迁移及侵袭,提示在肺鳞癌中SFTA1P可能通过MYC、G2m检查点和E2f信号通路影响肺鳞癌细胞的生物学功能,从而在肺鳞癌发生发展中发挥抑癌作用,但其中的具体机制仍有待研究。
| [1] |
LEITER A, VELUSWAMY R R, WISNIVESKY J P. The global burden of lung cancer: current status and future trends[J]. Nat Rev Clin Oncol, 2023, 20(9): 624-639. |
| [2] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. |
| [3] |
DE MARTEL C, GEORGES D, BRAY F, et al. Global burden of cancer attributable to infections in 2018: a worldwide incidence analysis[J]. Lancet Glob Health, 2020, 8(2): e180-e190. |
| [4] |
SCHABATH M B, COTE M L. Cancer progress and priorities: lung cancer[J]. Cancer Epidemiol Biomarkers Pr, 2019, 28(10): 1563-1579. |
| [5] |
GBD Respiratory Tract Cancers Collaborators. Global, regional, and national burden of respiratory tract cancers and associated risk factors from 1990 to 2019: a systematic analysis for the Global Burden of Disease Study 2019[J]. Lancet Respir Med, 2021, 9(9): 1030-1049. |
| [6] |
ZHOU M G, WANG H D, ZENG X Y, et al. Mortality, morbidity, and risk factors in China and its provinces, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2019, 394(10204): 1145-1158. |
| [7] |
BRAICU C, ZIMTA A A, HARANGUS A, et al. The function of non-coding RNAs in lung cancer tumorigenesis[J]. Cancers, 2019, 11(5): 605. |
| [8] |
TAN Y T, LIN J F, LI T, et al. LncRNA-mediated posttranslational modifications and reprogramming of energy metabolism in cancer[J]. Cancer Commun, 2021, 41(2): 109-120. |
| [9] |
DAI J L, QU T Y, YIN D D, et al. LncRNA LINC00969 promotes acquired gefitinib resistance by epigenetically suppressing of NLRP3 at transcriptional and posttranscriptional levels to inhibit pyroptosis in lung cancer[J]. Cell Death Dis, 2023, 14(5): 312. |
| [10] |
DONG H L, ZENG L L, CHEN W W, et al. N6-methyladenine-mediated aberrant activation of the lncRNA SOX2OT-GLI1 loop promotes non-small-cell lung cancer stemness[J]. Cell Death Discov, 2023, 9(1): 149. |
| [11] |
ZHAN T, CHENG X T, ZHU Q X, et al. LncRNA LOC105369504 inhibits tumor proliferation and metastasis in colorectal cancer by regulating PSPC1[J]. Cell Death Discov, 2023, 9(1): 89. |
| [12] |
LI Z J, CHENG J, SONG Y, et al. LncRNA SNHG5 upregulation induced by YY1 contributes to angiogenesis via miR-26b/CTGF/VEGFA axis in acute myelogenous leukemia[J]. Lab Invest, 2021, 101(3): 341-352. |
| [13] |
WANG G B, LI H, HOU Y. LncRNA MAGI2-AS3 inhibits tumor progression and angiogenesis by regulating ACY1 via interacting with transcription factor HEY1 in clear cell renal cell carcinoma[J]. Cancer Gene Ther, 2022, 29(5): 585-596. |
| [14] |
SHI C J, XUE Z H, ZENG W Q, et al. LncRNA-NEF suppressed oxaliplatin resistance and epithelial-mesenchymal transition in colorectal cancer through epigenetically inactivating MEK/ERK signaling[J]. Cancer Gene Ther, 2023, 30(6): 855-865. |
| [15] |
SINGH D, ASSARAF Y G, GACCHE R N. Long non-coding RNA mediated drug resistance in breast cancer[J]. Drug Resist Updat, 2022, 63: 100851. |
| [16] |
MA H W, MA T S, CHEN M, et al. The pseudogene-derived long non-coding RNA SFTA1P suppresses cell proliferation, migration, and invasion in gastric cancer[J]. Biosci Rep, 2018, 38(2): BSR20171193. |
| [17] |
DU D D, SHEN X, ZHANG Y Q, et al. Expression of long non-coding RNA SFTA1P and its function in non-small cell lung cancer[J]. Pathol Res Pract, 2020, 216(9): 153049. |
| [18] |
LUO A R, LAN X X, QIU Q Z, et al. LncRNA SFTA1P promotes cervical cancer progression by interaction with PTBP1 to facilitate TPM4 mRNA degradation[J]. Cell Death Dis, 2022, 13(11): 936. |
| [19] |
陈梦雷, 袁帅, 周玫余, 等. 长链非编码RNA SFTA1P在肺腺癌中的表达及预后预测研究[J]. 第三军医大学学报, 2020, 42(21): 2075-2080, 2115. CHEN M L, YUAN S, ZHOU M Y, et al. Expression of long non-coding RNA SFTA1P in lung adenocarcinoma and its predictive value for prognosis[J]. J Third Mil Med Univ, 2020, 42(21): 2075-2080, 2115. |
| [20] |
YE P, LV X Y, AIZEMAITI R, et al. H3K27ac-activated LINC00519 promotes lung squamous cell carcinoma progression by targeting miR-450b-5p/miR-515-5p/YAP1 axis[J]. Cell Prolif, 2020, 53(5): e12797. |
| [21] |
MA J, QI G B, LI L. LncRNA NNT-AS1 promotes lung squamous cell carcinoma progression by regulating the miR-22/FOXM1 axis[J]. Cell Mol Biol Lett, 2020, 25: 34. |
| [22] |
HU Z Y, LIU Y X, TANG J, et al. LncRNA HHIP-AS1 suppresses lung squamous cell carcinoma by stabilizing HHIP mRNA[J]. Life Sci, 2023, 321: 121578. |
| [23] |
ZHU H Y, LIU Q Y, YANG X B, et al. LncRNA LINC00649 recruits TAF15 and enhances MAPK6 expression to promote the development of lung squamous cell carcinoma via activating MAPK signaling pathway[J]. Cancer Gene Ther, 2022, 29(8/9): 1285-1295. |
| [24] |
ZHAO X, WANG J Z, ZHU R, et al. DLX6-AS1 activated by H3K4me1 enhanced secondary cisplatin resistance of lung squamous cell carcinoma through modulating miR-181a-5p/miR-382-5p/CELF1 axis[J]. Sci Rep, 2021, 11(1): 21014. |
| [25] |
HUANG G H, YANG Y M, LV M X, et al. Novel lncRNA SFTA1P promotes tumor growth by down-regulating miR-4766-5p via PI3K/AKT/mTOR signaling pathway in hepatocellular carcinoma[J]. Onco Targets Ther, 2020, 13: 9759-9770. |
| [26] |
ZHANG H, XIONG Y Q, XIA R, et al. The pseudogene-derived long noncoding RNA SFTA1P is down-regulated and suppresses cell migration and invasion in lung adenocarcinoma[J]. Tumour Biol, 2017, 39(2): 1010428317691418. |
| [27] |
ZHANG W Q, BAI M C, LIU K Q, et al. LncRNA surfactant associated 1 activates large tumor suppressor kinase 1/Yes-associated protein pathway via modulating hypoxic exosome-delivered miR-4766-5p to inhibit lung adenocarcinoma metastasis[J]. Int J Biochem Cell Biol, 2022, 153: 106317. |
| [28] |
ZHU B W, FINCH-EDMONDSON M, LEONG K W, et al. LncRNA SFTA1P mediates positive feedback regulation of the Hippo-YAP/TAZ signaling pathway in non-small cell lung cancer[J]. Cell Death Discov, 2021, 7(1): 369. |
| [29] |
LI L, YIN J Y, HE F Z, et al. Long noncoding RNA SFTA1P promoted apoptosis and increased cisplatin chemosensitivity via regulating the hnRNP-U-GADD45A axis in lung squamous cell carcinoma[J]. Oncotarget, 2017, 8(57): 97476-97489. |
| [30] |
DHANASEKARAN R, DEUTZMANN A, MAHAUAD-FERNANDEZ W D, et al. The MYC oncogene-the grand orchestrator of cancer growth and immune evasion[J]. Nat Rev Clin Oncol, 2022, 19(1): 23-36. |
| [31] |
ZHU Q Q, ZHANG C G, QU T Y, et al. MNX1-AS1 promotes phase separation of IGF2BP1 to drive c-myc-mediated cell-cycle progression and proliferation in lung cancer[J]. Cancer Res, 2022, 82(23): 4340-4358. |
| [32] |
ZHANG L W, HE M, ZHU W J, et al. Identification of a panel of mitotic spindle-related genes as a signature predicting survival in lung adenocarcinoma[J]. J Cell Physiol, 2020, 235(5): 4361-4375. |
| [33] |
MALANEY P, PALUMBO E, SEMIDEY-HURTADO J, et al. PTEN physically interacts with and regulates E2F1-mediated transcription in lung cancer[J]. Cell Cycle, 2018, 17(8): 947-962. |
| [34] |
YAO Y, NG J F, PARK W D, et al. CDK7 controls E2F- and MYC-driven proliferative and metabolic vulnerabilities in multiple myeloma[J]. Blood, 2023, 141(23): 2841-2852. |




