2. 430022 湖北 武汉,华中科技大学同济医学院附属协和医院耳鼻咽喉科
2. Department of Otorhinolaryngology, Affiliated Union Hospital of Tongji Medical College, Huazhong University of Science and Technology, Wuhan, Hubei Province, 430022, China
耳聋是不同程度听力减退的总称,严重影响人类的健康和生活质量[1]。迄今为止,已经鉴定出220多个与听力功能障碍相关的基因[2]。由于50%~70%的先天性听力损失是遗传性的,了解听力损失的遗传基础变得越来越重要。Waardenburg综合征(Waardenburg syndrome,WS)是最常见的遗传性常染色体显性耳聋,其主要特点是听觉系统的感觉障碍,以及在一定比例的病例中表现出色素沉着缺陷。临床上结合其他表型缺陷定义了WS的4种类型: WS1,以内眦外移(两眼眼距较宽,但瞳孔间距离正常)为特征;WS2,其症状与WS1相似,但缺乏内眦外移;WS3,以四肢肌肉骨骼异常为特征;WS4,以先天性巨结肠症(hirschsprung disease,HSCR)为特征[3]。性别决定区盒基因10(SRY-box 10,SOX10)是临床上常见的WS相关基因,此外还有4个主要基因: WS1和WS3中的转录因子配对盒3 (transcription factor paired box 3,PAX3);WS2中的黑素细胞诱导转录因子(melanocyte inducing transcription factor,MITF);WS4中的内皮素3 (endothelin 3,EDN3);WS4和WS2中的内皮素受体B型(endothelin receptor type B,EDNRB)[4-5]。SOX10已被证明可以调节与WS相关的基因并与它们相互作用[3, 6]。SOX10基因属于SOXE家族,在神经嵴细胞的维持、黑色素细胞的迁移和分化中起重要的调控作用,在内耳发育早期广泛表达[7-8]。在人群中,SOX10基因突变会导致WS感音神经性耳聋[7-8]。在SOX10基因突变的病例中,即使是具有相同突变也存在表型的异质性,表明遗传背景对其突变诱发的表型有较大影响[9-10]。
由于临床携带SOX10基因突变的患者存在高度的遗传异质性,且人类的耳蜗难以用于实验研究,动物模型在研究先天性耳聋的遗传基础、发病机制及治疗干预等方面具有不可替代的作用。小鼠和小型猪是目前最常用的遗传性耳聋研究模型,其中小型猪与人类的听觉发育、听功能特征、听觉器官形态和结构等更相近[11]。SOX10突变在临床检测中时有发现,且检测到的SOX10突变与WS综合征有关,可引起SOX10蛋白在细胞质中异位聚集,且临床病例研究报告显示,人SOX10 p.R106W突变有WS4表型[12]。课题组前期获得了呈杂合遗传的人SOX10 p.R106W同源点突变耳聋小型猪模型,发现该突变在小型猪中诱发了全聋且完全白化的WS2表型[13-14],尽管未能完全模拟临床报告中出现的巨结肠等WS4相关症状,但再现了WS的耳聋和色素沉积异常这2个典型临床特征。有研究报道,在小鼠的Sox10双等位基因敲除的胎鼠中,Sox10表达缺失后尽管未形成内耳Mondini畸形,但其耳蜗前体细胞凋亡增加、耳蜗导管显著缩短;然而单等位基因敲除小鼠的胎鼠无明显异常,说明小鼠的Sox10基因突变模型与人和相应小型猪模型可能存在表型差异[8]。
小鼠目前依然是遗传性耳聋研究应用最广泛的模式动物。但已有研究发现,部分导致人类耳聋的基因突变在小鼠模型上未能产生明确的表型[15]。为比较SOX10 p.R106W突变在不同物种中可能存在的表型异同,本研究利用CRISPR/Cas9介导的基因编辑系统构建Sox10 p.R106W的小鼠模型,比较该突变在人、小型猪及小鼠中所诱发的表型差异及其可能的遗传基础,为SOX10突变相关疾病研究选择适合的动物模型提供参考。
1 材料与方法 1.1 实验动物选取48只4~6周龄、性成熟的C57BL/6雌性小鼠(对小鼠体质量无要求)为卵母细胞供体制备Sox10 p.R106W基因编辑小鼠。利用CRISPR/Cas9技术获得的F0代阳性小鼠,与野生型C57BL/6小鼠杂交以获得杂合的F1代小鼠。将杂合F1代小鼠互相交配,得到用于实验的F2代小鼠,以及同窝野生型小鼠为对照。本实验用于卵母细胞供体的48只C57BL/6小鼠和作为卵母细胞受体的7只4~6周龄,性成熟的雌性KM小鼠均来自于陆军军医大学基础医学院实验动物学教研室[使用许可证号:SYXK(渝)2017-0002]。饲养条件:室温(24±1)℃,12 h/12 h光暗循环,每笼3~5只小鼠,小鼠可自由获取食物和水。动物饲养和实验程序严格遵守陆军军医大学实验动物福利伦理规范。
1.2 主要试剂MEGAshortscript T7转录试剂盒、MEGAclear转录纯化试剂盒、mMESSAGE mMACHINE T7 Ultra试剂盒购自美国Invitrogen公司;RNAeasy纯化试剂盒购自美国Qiagen公司;限制性内切酶DraⅠ、BshTⅠ、T4连接酶购自美国ThermoFisher公司;基因组DNA提取试剂盒购自北京天根生化科技有限公司;DH5α感受态细胞、PCR试剂购自北京宝日医生物技术有限公司;M2小鼠胚胎培养基、M16小鼠胚胎培养基购自美国Sigma-Aldrich公司;异氟烷购自深圳瑞沃德生命科技有限公司。
1.3 方法 1.3.1 sgRNA的设计和活性验证首先通过比对人、猪和小鼠SOX10参考编码蛋白的氨基酸序列,找到小鼠突变的同源位点。通过NCBI网站(https://www.ncbi.nlm.nih.gov/)找到相应的突变碱基,在该碱基位点两端通过sgRNA在线设计网站(http://crispr.mit.edu/)找出该位点评分最高、脱靶评估低的3条序列,mSox10-sgRNA1:GACGTGCGGCTTGCTCTTGCTGG;mSox10-sgRNA2:TTCATGGGCCTCTTGACGTGCGG;mSox10-sgRNA3:AGAGCAAGCCGCAC-GTCAAGAGG。合成sgRNA oligos,并将合成的sgRNA oligos双链复性,把复性产物亚克隆至带有红色荧光表达基因的sgRNA体外表达载体U6-sgRNA-mCherry(本实验室构建)。为了验证所设计的sgRNA活性,将sgRNA的体外表达载体与Cas9表达载体通过细胞电转仪共电转染至C57BL/6小鼠来源的细胞系MC38(小鼠结肠癌细胞);48 h后观察荧光表达情况确认转染效率;收集细胞提取基因组DNA,PCR扩增sgRNA识别位点附近序列,对扩增产物直接进行Sanger测序,评估sgRNA的切割活性。引物序列如下:5′-GAGCGACATGGCCGAGGAACAA-3′(上游); 5′- TTG-GTCTCCCCTGAGAGAGAGGCCT-3′(下游)。反应条件:95 ℃ 5 min;(98 ℃ 10 s,55 ℃ 30 s,72 ℃ 20 s)×30个循环;72 ℃ 2 min;12 ℃ 30 min。
根据目标突变位点,设计和合成在小鼠Sox10基因中导入Sox10 c.316A>T突变的单链寡聚核苷酸(single-stranded oligo DNA,ssODN)作为同源引导修复(homology-directed repair, HDR)模板,通过DNA同源重组实现突变导入。
1.3.2 sgRNA和Cas9 mRNA的体外转录将最优的sgRNA亚克隆至pUC57kan-T7-gRNA体外转录载体(本实验室保存)。经DraⅠ酶线性化后作为体外转录模板,利用MEGAshortscript T7转录试剂盒和MEGAclear转录纯化试剂盒完成sgRNA的转录及纯化。Cas9体外转录模板质粒经BshTⅠ酶线性化后,利用mMESSAGE mMACHINE T7 Ultra试剂盒和RNAeasy纯化试剂盒,获得加尾纯化的Cas9 mRNA。上述实验操作详见试剂盒说明书。
1.3.3 通过原核注射制备Sox10 c.316A>T点突变小鼠为了制备精准突变的基因编辑小鼠,本实验通过胚胎细胞原核显微注射技术将体外转录的Cas9 mRNA(20 ng/μL)、sgRNA(10 ng/μL)和合成的模板(10 ng/μL)混合注入小鼠受精卵原核内,注射后的受精卵过夜培养,将发育成2细胞期的受精卵移植于同期发情的受体小鼠输卵管内,获得首建小鼠。
1.3.4 Sox10 c.316A>T点突变小鼠基因型鉴定剪取小鼠尾部组织提取DNA,设计引物扩增突变位点, 引物序列如下:5′-CATGGCCGAGGAACAAGACCTATC-3′(上游);5′-GGGTTCTGAGTTCCAGAGTGGGC-3′(下游);扩增片段大小645 bp。将扩增产物直接送测序或者将扩增产物经TA克隆后送测序筛选,鉴定基因编辑小鼠的基因型。
1.3.5 听觉脑干反应(auditory brainstem response, ABR)测试取断奶后的同窝小鼠作为测听对象,用小动物呼吸麻醉机麻醉。采用美国TDT公司TDT Ⅲ设备和SigGen RP系统软件给声并采集信号。刺激声音为短声(click),强度范围为10~90 dB,衰减间隔为10 dB,在接近阈值时,声音衰减间隔为5 dB SPL。Click波形判读:声音从高到低依次进行刺激,待波形经过512次叠加之后,观察各个波的出现率,依据出现率最高的判断阈值。
1.3.6 耳蜗组织切片断奶后的小鼠麻醉,使用颈椎脱臼法将其处死,快速剖开颅骨找到颞骨听泡,取出耳蜗,置于1%磷酸盐缓冲液中清洗3次;用4%多聚甲醛室温固定3~4 h后,转至4 ℃冰箱;之后1%磷酸盐缓冲液清洗,置于8% EDTA中脱钙5~6 h。乙醇分级脱水,耳蜗包埋,冷冻显微切片机将耳蜗切成4 μm的薄片,并用苏木精-伊红(hematoxylin-eosin staining,HE)染色。最后在显微镜下观察。
1.3.7 耳蜗转录组测序取断奶后同窝的6只小鼠耳蜗进行转录组测序,其中3只Sox10 c.316A>T杂合突变小鼠为实验组、3只野生型小鼠为对照组。用TRIzol试剂提取野生型小鼠和突变小鼠耳蜗组织总RNA。通过Oligo(dT)磁珠富集总RNA中带有polyA结构的mRNA,采用离子打断的方式,将RNA打断到长度300 bp左右的片段。以300 bp片段的RNA为模板合成cDNA的。采用PCR扩增进行文库片段富集。通过Agilent 2100 Bioanalyzer对文库进行质检。采用第二代测序技术(next-generation sequencing,NGS),基于Illumina测序平台,对这些文库进行双末端测序。
1.3.8 数据分析使用HISAT2软件将测序数据对比小鼠参考基因组(GRCm38),获得每个基因的相对表达水平。使用DESeq软件对实验组和对照组样本进行基因表达差异分析,表达差异倍数|log2 FoldChange|>1,P-value<0.05的即为差异显著表达基因。利用R包ggplots2进行差异表达基因火山图的绘制。实验组和对照组各样品之间的基因表达水平的相关性采用Pearson相关分析,通过热图的方式可将其可视化处理。在Dr.Tom系统上对差异表达的基因进行基因本体(gene ontology, GO)富集分析,伪发现率(false discovery rate, FDR)<0.01即为显著富集。利用网站在线绘制韦恩图,寻找集合之间的关系。最后借助String数据库分析差异表达基因与Sox10之间的关联性。
2 结果 2.1 sgRNA活性验证及HDR模板的设计通过比对蛋白的氨基酸序列找到小鼠与人SOX10 p.R106W、小型猪SOX10 p.R109W突变的同源位点Sox10 p.R106W(图 1A)。再通过NCBI网站找到相应的突变碱基Sox10 c.316A>T,设计出sgRNA位点(图 1B)。用细胞电转仪将sgRNA体外表达载体和Cas9表达载体共转染至MC38细胞,荧光观察发现部分细胞呈强红色荧光(图 1C),提示细胞转染成功。提取细胞基因组DNA, PCR扩增靶基因位点,扩增产物Sanger测序,结果显示,mSox10-sgRNA2的识别位点在原间隔基相邻基序(protospacer adjacent motif,PAM)后出现套峰(图 1D),表明mSox10-sgRNA2在目标位点发生特异性切割,套峰峰值较低与细胞转染效率有关。由于MC38细胞转染效率低,阳性细胞比例低,造成发生切割的等位基因相对较少,从而导致PCR产物测序套峰的峰值偏低。重复实验后也表现出切割效率稳定。因此,本实验选择mSox10-sgRNA2用于后续基因编辑小鼠的制备。
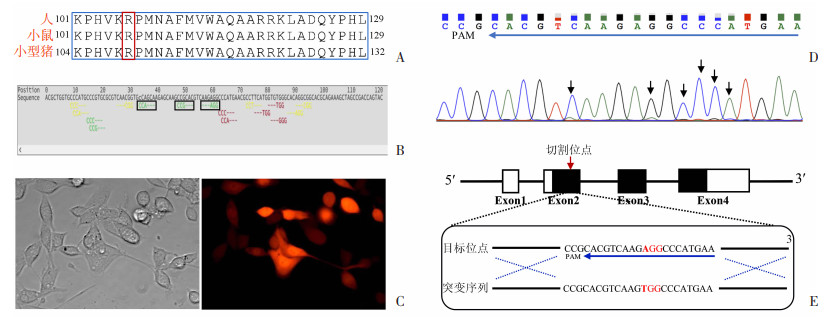
|
| A:人、猪和小鼠SOX10编码蛋白的氨基酸序列比对 红色方框:目标突变氨基酸; B: 小鼠目标突变位点附近sgRNA位点设计示意图 黑色方框:评分较高的候选sgRNA位点;C:mSox10-sgRNA2和Cas9共转染MC38细胞的红色荧光表达情况;D:提取转染细胞基因组DNA目标位点PCR产物的测序峰图 黑色箭头:套峰;E:CRISPR/Cas9编辑小鼠Sox10基因示意图 方框:Sox10基因外显子位置; 黑色区域:Sox10编码区; 红色箭头:sgRNA切割位点; 红色碱基:目标突变氨基酸(AGG突变为TGG) 图 1 sgRNA的设计及活性验证 |
根据目标突变位点,在小鼠Sox10基因第2外显子上设计和合成携带Sox10 c.316A>T突变的ssODN模板,通过HDR修复,将目标突变位点引入小鼠Sox10基因的相应位点,导致小鼠Sox10编码区第316位的腺嘌呤(A)突变为胸腺嘧啶(T),最终引起SOX10蛋白序列第106位的精氨酸(密码子AGG)突变为色氨酸(密码子TGG),见图 1E。
2.2 获得Sox10 c.316A>T杂合突变小鼠通过胚胎细胞原核显微注射技术获得29只首建鼠,部分小鼠腹部呈现白斑(图 2A)。提取首建小鼠基因组DNA,利用PCR扩增突变位点并进行Sanger测序,成功获得2只Sox10 c.316A>T基因编辑小鼠。通过繁育建立种群,可以得到稳定遗传的突变小鼠,测序峰图在该位点呈现双峰,表明基因型鉴定结果为杂合子序列(图 2B),但未发现纯合小鼠出生。与野生型小鼠比较,Sox10 c.316A>T点突变小鼠腹部有明显白斑,表明该突变在小鼠中导致了部分白化表型。由于未有纯合小鼠出生,后续研究均采用Sox10 c.316A>T杂合突变小鼠。
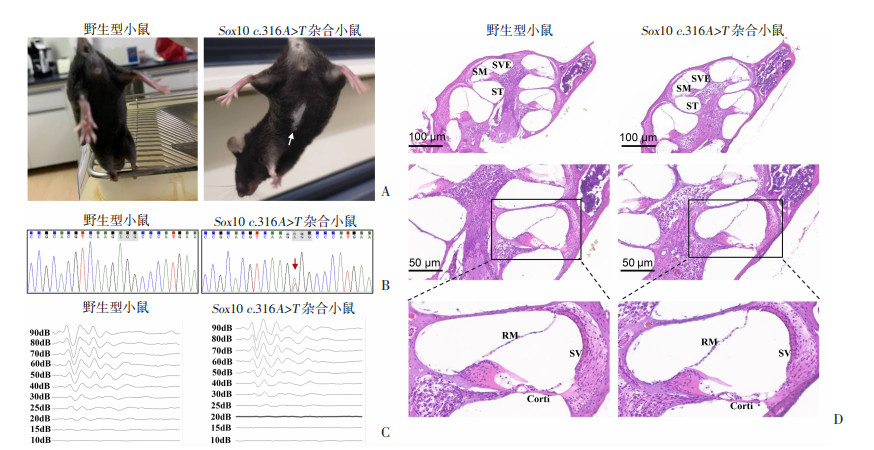
|
| A:皮肤表型差异比较 白色箭头:示突变小鼠白斑;B:基因组DNA测序峰图比较 红色箭头:示杂合序列套峰;C:Click刺激的ABR波形比较;D:耳蜗组织切片比较 图 2 Sox10 c.316A>T杂合小鼠与野生型小鼠表型比较 |
2.3 Sox10 c.316A>T杂合突变小鼠未呈现听力损失
由于小鼠听力晚熟,断奶前后内耳功能才发育完全,所以本实验用于ABR检测的小鼠均是断奶后的杂合突变小鼠;且为了排除外部环境对测听的影响,选择同窝野生型小鼠作为对照与同窝突变小鼠比较。68只小鼠测听结果分析发现:突变小鼠对不同强度的声音刺激都能产生反应,且与同窝野生型小鼠的测听阈值没有差异。表明突变小鼠听力没有损失(图 2C)。
2.4 Sox10 c.316A>T杂合突变小鼠内耳形态无改变为了检测该突变在小鼠内耳是否引起形态改变,取同窝断奶后的突变小鼠和野生型小鼠耳蜗做切片,用HE染色观察内耳组织形态。通过对比发现:突变小鼠耳蜗由基底到顶部绕蜗轴螺旋盘绕不到两圈,前庭膜(reissner’s membranes,RM)和基底膜(basilar membrane,BM)将前庭阶(scala vestibule,SVE)、鼓阶(scala tympan,ST)和中阶(scala midia,SM)相互分开,结构完整;螺旋器(corti)位于基底膜上;血管纹(stria vascularis,SV)、盖膜、内外毛细胞结构均正常。上述结构特征与野生型小鼠的内耳形态没有差异(图 2D)。表明Sox10 c.316A>T杂合突变不影响小鼠内耳形态,这与ABR测听结果相符合。
2.5 Sox10 c.316A>T杂合突变小鼠内耳转录组学分析基于小鼠耳蜗mRNA转录组测序数据,实验组和对照组样品间的基因表达水平相关性检验显示:实验组和对照组的组内相关系数大于组间相关系数(图 3A),说明小鼠SOX10蛋白第106位的精氨酸(R)突变为色氨酸(W)引起了小鼠耳蜗基因转录组的明显改变。基因差异表达分析发现突变小鼠耳蜗中共鉴定出606个差异表达基因(P<0.05),其中323个表达上调,283个表达下调,但绝大部分基因的表达差异都较小,|log2 FoldChange|略>1,表达差异相对比较大的基因的最高差异倍数仅为4倍,且与耳聋无关(图 3B)。
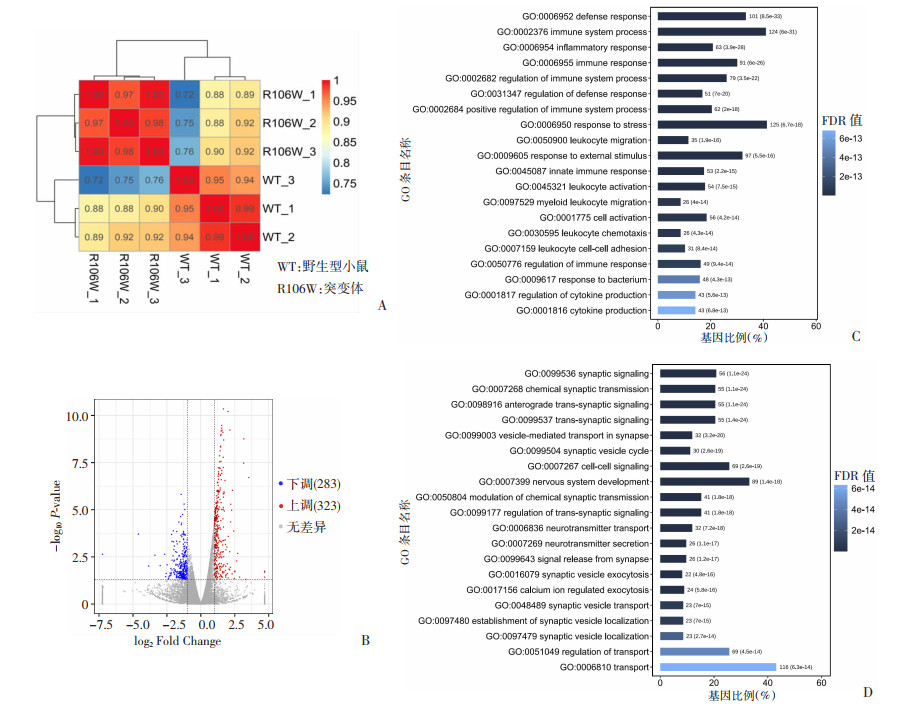
|
| A:样品间相关性检验 红色:示相关性强;B:差异基因火山图 虚线:示差异基因筛选标准的阈值线;C:上调表达基因的GO富集分析;D:下调表达基因的GO富集分析 图 3 Sox10 c.316A>T杂合突变小鼠耳蜗转录组学分析 |
进一步对差异表达基因进行GO富集分析,发现323个上调表达基因共获得717个显著富集的GO类别(FDR<0.01),大部分与免疫相关(图 3C);283个下调表达基因获得384个显著富集的GO类别(FDR<0.01),大部分与神经功能有关(图 3D)。借助String数据库,获得与Sox10关联的261个基因,韦恩图分析结果显示,这261个基因与上调表达基因并不重叠,而与下调表达基因有5个共同基因,分别是Nefh、Fa2h、Gjb1、Ngfr、Zfp536,均与神经功能相关,与内耳发育或功能无关(图 4)。可能是Sox10 c.316A>T杂合突变小鼠未呈现出耳聋表型的原因之一。
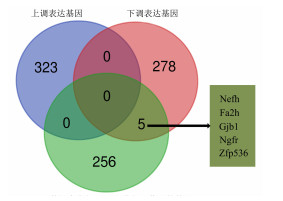
|
| 图 4 Sox10 c.316A>T杂合小鼠耳蜗差异表达基因与string数据库中Sox10互作基因韦恩图 |
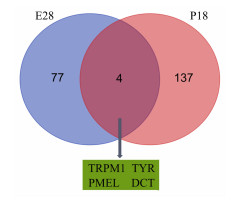
本研究还将Sox10 c.316A>T杂合突变小鼠耳蜗转录组数据与其同源突变的SOX10 p.R109W巴马小型猪耳蜗转录组数据进行比较,结果表明:把同源突变的小型猪在胚胎期28 d耳蜗刚出现异常时的81个差异表达基因与出生后18 d耳蜗发育完全时的141个差异表达基因关联,有4个基因在这2个时间节点的表达均显著下调(P<0.05),分别是瞬时受体电位M亚型1 (transient receptor potential melastatin 1, TRPM1)、酪氨酸酶(tyrosinase,TYR)、前黑色素小体蛋白(pre-melanosomal protein, PMEL)和多巴色素异构酶(dopachrome isomerase,DCT)(图 5),上述基因均与色素代谢、黑色素细胞发育相关。这4个基因在突变小鼠耳蜗中的表达与正常小鼠比较均无显著变化(P>0.05,表 1)。
|
| 图 5 同源突变位点的小型猪模型胚胎期28 d(E28)与出生后18 d(P18)耳蜗差异表达基因的韦恩图 |
| 基因 | Sox10 p. R106W小鼠 | 基因 | SOX10 p. R109W小型猪a | SOX10 p. R109W小型猪b | |||||
| 差异倍数c | P | 差异倍数c | P | 差异倍数c | P | ||||
| Trpm1 | -0.91 | 0.57 | TRPM1 | -5.15 | 2.27E-10 | -4.6 | 2.24E-4 | ||
| Tyr | -0.17 | 1.00 | TYR | -16.38 | 7.27E-17 | -5.51 | 1.35E-7 | ||
| Pmel | -0.17 | 1.00 | PMEL | -5.82 | 6.88E-3 | -2.75 | 1.04E-2 | ||
| Dct | 0.29 | 1.00 | DCT | -3.59 | 7.55E-20 | -3.54 | 7.94E-3 | ||
| a:胚胎期28 d;b:出生后18 d;c:差异倍数为负,表明实验组表达量低于对照组,基因下调 | |||||||||
3 讨论 3.1 应用CRISPR/Cas9系统成功制备携带人WS综合征点突变SOX10 p.R106W的小鼠模型
本研究中,以ssODN为模板,利用CRISPR/Cas9介导的基因编辑技术,成功制备了携带人类WS相关突变SOX10 c.316A>T(SOX10 p.R106W)的精准基因编辑小鼠模型。但是突变小鼠在繁育过程中,未发现纯合小鼠出生,提示该点突变纯合后可能具有胚胎致死毒性。在WS的临床病例中发现的SOX10突变患者均是呈杂合突变。Dom小鼠模型(Sox10移码突变)和Sox10 LacZ小鼠模型(Sox10敲除)都没有纯合子出生。前期课题组建立的该同源突变的小型猪模型也未得到纯合动物。Sox10被定义为神经嵴发育的重要调节因子,Sox10纯合胚胎致死的原因可能是缺失或者严重缺乏几种神经嵴衍生物,致使神经嵴发育缺陷,从而导致心脏自主神经调节异常[16]。不同的SOX10突变动物模型,纯合突变体具有胚胎致死性,而杂合突变体则具有不同的表型。
3.2 Sox10 p.R106W杂合突变小鼠与该突变在人和小型猪中诱发的疾病表型差异较大内耳组织结构复杂而精细,受多种基因的精确调控[17]。Sox10在内耳发育早期的神经嵴源性细胞中广泛表达[18]。临床上,由SOX10突变引起的人类WS病例中,发生内耳畸形的概率明显高于其他基因突变的病例[19]。同时,SOX10突变动物模型也证实其突变与内耳发育异常有关[20]。本研究获得的人WS点突变SOX10 p.R106W小鼠模型与野生型小鼠相比,无论是听力检测结果还是内耳形态结构都没产生明显差异。这既与该位点同源突变小型猪模型呈现先天性全聋的表型完全不同,也与该突变在人体中所导致的WS4表型不同,进一步表明Sox10 c.316A>T突变在小鼠中所导致的病理生理表型与人或小型猪存在明显的种属差异。提示小鼠不是模拟该突变位点诱发人听力表型的适宜模式动物。基因编辑小鼠Sox10 p.Q377X的突变蛋白在内耳也没有发挥显性作用[21],但是其转基因小鼠Sox10 c.1400del12却表现出耳聋表型[22],这表明SOX10突变蛋白的致病性可能具有剂量依赖性,这与本课题组前期基于人SOX10 p.R106W同源突变小型猪模型的研究结果一致[23]。此外,不同种属的动物(包括人类)对相同基因的剂量需求可能不一致。在Mitf突变的WS2小鼠模型中,来自一个正常等位基因的一半剂量(与野生型小鼠相比)的MITF蛋白对小鼠色素细胞的正常分化没有影响,而对人则导致WS2表型[16]。小鼠模型Slc26a4 p.H723R也被证实单个突变等位基因足以维持杂合小鼠的正常内耳生理功能[15]。这都表明小鼠和人类内耳听功能的发育对基因表达剂量的需求可能存在固有的种属差异,可能是部分人类耳聋基因不能在小鼠模型上产生明确表型的原因之一。
3.3 人的SOX10 p.R106W同源突变蛋白对小鼠和小型猪耳蜗基因表达的影响不同本研究制备的Sox10 p.R106W突变小鼠的耳蜗mRNA转录组数据分析显示,差异表达基因仅与免疫和神经相关。课题组将前期获得的同源突变SOX10 p.R109W小型猪模型的耳蜗不同时期的转录组数据重新进行分析比较,绘制韦恩图[24-25]。通过寻找集合之间的联系发现:无论在胚胎期28 d(耳蜗处于发育期),还是出生后18 d(内耳已发育完全),有4个差异表达基因TRPM1、TYR、PMEL和DCT均差异显著,且均与色素代谢、黑色素细胞发育相关。提示Sox10 c.316A>T突变小鼠所呈现的与小型猪的听力表型种属差异的遗传基础不同。色素沉积异常和听力损失是WS的典型症状。由于黑色素细胞不但决定着动物毛色,还分化发育为内耳血管纹中间细胞,与内耳发育及功能形成密切相关。这表明,与小鼠比较,含有相同突变的SOX10蛋白在小型猪体内显著影响了黑色素细胞的分化与发育,进而导致耳蜗发育缺陷及全身完全白化。上述结果为人SOX10 p.R106W突变在小型猪和小鼠中所诱发的巨大表型差异提供了直接的解释。因此,Sox10 p.R106W突变小鼠模型的制备为研究该突变在不同种属动物中所导致的表型异同奠定了基础,同时表明:动物实验是开展医学研究的基本途径,选择何种动物来模拟人类疾病是动物实验的首要问题。针对不同的疾病或相同疾病的不同致病突变基因,需要选择适宜的模型动物种属才能准确模拟人类疾病表型。
综上所述,遗传背景是导致SOX10突变表型多变的重要影响因素。SOX10作为WS主要致病基因之一,已在外周神经系统和黑色素细胞等方面进行了深入研究,但在内耳的作用仍需进一步探索。由于内耳组织的特殊性,临床上无法获取人体耳蜗进行直接实验,所以动物模型在内耳致病基因的发现、功能验证、诊断治疗等研究中的作用不可替代。本研究制备了Sox10 p.R106W突变小鼠模型,直观地展现了同一基因的相同突变对不同物种影响的种属差异,为后续针对该基因或该类疾病研究选择适宜的动物模型提供了参考。
| [1] |
ALZHRANI F, ALHUSSINI R, HUDEIB R, et al. The outcome of cochlear implantation among children with genetic syndromes[J]. Eur Arch Otorhinolaryngol, 2018, 275(2): 365-369. |
| [2] |
TROPITZSCH A, SCHADE-MANN T, GAMERDINGER P. Hereditary hearing loss[J]. HNO, 2023, 71(2): 131-142. |
| [3] |
PINGAULT V, ENTE D, DASTOT-LE MOAL F, et al. Review and update of mutations causing Waardenburg syndrome[J]. Hum Mutat, 2010, 31(4): 391-406. |
| [4] |
BONDURAND N, DUFOUR S, PINGAULT V. News from the endothelin-3/EDNRB signaling pathway: role during enteric nervous system development and involvement in neural crest-associated disorders[J]. Dev Biol, 2018, 444 Suppl 1: S156-S169. |
| [5] |
GODING C R, ARNHEITER H. MITF—the first 25years[J]. Genes Dev, 2019, 33(15/16): 983-1007. |
| [6] |
WATANABE Y, STANCHINA L, LECERF L, et al. Differentiation of mouse enteric nervous system progenitor cells is controlled by endothelin 3 and requires regulation of EDNRB by SOX10 and ZEB2[J]. Gastroenterology, 2017, 152(5): 1139-1150. |
| [7] |
ANGELOZZI M, LEFEBVRE V. SOXopathies: growing family of developmental disorders due to SOX mutations[J]. Trends Genet, 2019, 35(9): 658-671. |
| [8] |
BREUSKIN I, BODSON M, THELEN N, et al. Sox10 promotes the survival of cochlear progenitors during the establishment of the organ of Corti[J]. Dev Biol, 2009, 335(2): 327-339. |
| [9] |
EMISON E S, GARCIA-BARCELO M, GRICE E A, et al. Differential contributions of rare and common, coding and noncoding Ret mutations to multifactorial Hirschsprung disease liability[J]. Am J Hum Genet, 2010, 87(1): 60-74. |
| [10] |
PINGAULT V, PIERRE-LOUIS L, CHAOUI A, et al. Phenotypic similarities and differences in patients with a p.Met112Ile mutation in SOX10[J]. Am J Med Genet A, 2014, 164A(9): 2344-2350. |
| [11] |
GUO W W, YI H J, REN L L, et al. The morphology and electrophysiology of the cochlea of the miniature pig[J]. Anat Rec (Hoboken), 2015, 298(3): 494-500. |
| [12] |
CHAOUI A, WATANABE Y, TOURAINE R, et al. Identification and functional analysis of SOX10 missense mutations in different subtypes of Waardenburg syndrome[J]. Hum Mutat, 2011, 32(12): 1436-1449. |
| [13] |
HAI T, CAO C W, SHANG H T, et al. Pilot study of large-scale production of mutant pigs by ENU mutagenesis[J]. Elife, 2017, 6: e26248. |
| [14] |
ZHOU X Y, WANG L L, DU Y N, et al. Efficient generation of gene-modified pigs harboring precise orthologous human mutation via CRISPR/Cas9-induced homology-directed repair in zygotes[J]. Hum Mutat, 2016, 37(1): 110-118. |
| [15] |
LU Y C, WU CC, YANG T H, et al. Differences in the pathogenicity of the p.H723R mutation of the common deafness-associated SLC26A4 gene in humans and mice[J]. PLoS One, 2014, 8(6): e64906. |
| [16] |
TACHIBANA M, KOBAYASHI Y, MATSUSHIMA Y. Mouse models for four types of Waardenburg syndrome[J]. Pigment Cell Res, 2003, 16(5): 448-454. |
| [17] |
LOCHER H, FRIJNS J H, VAN IPEREN L, et al. Neuro -sensory development and cell fate determination in the human cochlea[J]. Neural Dev, 2013, 8: 20. |
| [18] |
DUTTON K, ABBAS L, SPENCER J, et al. A zebrafish model for Waardenburg syndrome type Ⅳ reveals diverse roles for Sox10 in the otic vesicle[J]. Dis Model Mech, 2009, 2(1-2): 68-83. |
| [19] |
PINGAULT V, BODEREAU V, BARAL V, et al. Loss-of-function mutations in SOX10 cause Kallmann syndrome with deafness[J]. Am J Hum Genet, 2013, 92(5): 707-724. |
| [20] |
PINGAULT V, FAUBERT E, BARAL V, et al. SOX10 mutations mimic isolated hearing loss[J]. Clin Genet, 2015, 88(4): 352-359. |
| [21] |
TRUCH K, ARTER J, TURNESCU T, et al. Analysis of the human SOX10 mutation Q377X in mice and its implications for genotype-phenotype correlation in SOX10-related human disease[J]. Hum Mol Genet, 2018, 27(6): 1078-1092. |
| [22] |
ITO Y, INOUE N, INOUE Y U, et al. Additive dominant effect of a SOX10 mutation underlies a complex phenotype of PCWH[J]. Neurobiol Dis, 2015, 80: 1-14. |
| [23] |
LIN T T, LUO L H, GUO W W, et al. Phenotypic similarities in pigs with SOX10c.321dupC and SOX10c.325A > T mutations implied the correlation of SOX10 haploinsufficiency with Waardenburg syndrome[J]. J Genet Genomics, 2020, 47(12): 770-780. |
| [24] |
HAO Q Q, LI L, CHEN W, et al. Key genes and pathways associated with inner ear malformation in SOX10p.R109W mutation pigs[J]. Front Mol Neurosci, 2018, 11: 181. |
| [25] |
WANG Q H, ZHANG Y, GUO W W, et al. Transcription analysis of cochlear development in minipigs[J]. Acta Otolaryngol, 2017, 137(11): 1166-1173. |




