2. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院:输血科
2. Department of Blood Transfusion, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037, China
结直肠癌(colorectal cancer,CRC)是起源于原癌基因和抑癌基因突变的肠道干细胞或干样细胞的恶性肿瘤[1],是常见的消化道肿瘤,也是导致癌症死亡的第二大原因。国际癌症研究机构(IARC)统计数据显示:2020年有190多万例CRC新发病例和93万死亡病例,预计到2040年,这一数据将进一步增加,且大多数将发生在人类发展指数(HDI)较高的国家[2-3]。随着我国社会经济的发展,CRC也逐渐成为威胁国内居民健康、增加社会负担的重要因素之一。
随着医疗技术不断进步,放疗等新辅助治疗手段已被证明有确切的疗效[4-5],但仍有部分患者未从中获益,其原因与结直肠癌放疗敏感性密切相关。调控CRC放射敏感性靶点是放疗成功的关键因素[6-7]。谷氨酰胺(glutamine,Gln)是人体内最丰富的非必需氨基酸,生理状态下,大约30%的游离Gln在肠道中被消耗,是维持肠道再生和完整性的首选燃料来源[8]。Gln可显著改善CRC患者围术期的应激状态,促进患者肠道功能恢复,被推荐用于结直肠癌患者的肠内、肠外营养治疗[9-10]。临床推荐丙氨酰谷氨酰胺的每日剂量为0.3~0.4 g/kg,体质量70 kg患者补充20 g丙氨酰谷氨酰胺后,其血药浓度增加范围为1.8~4.8 mmol/L。研究发现,在癌症发展过程中,Gln参与癌细胞的氧化还原平衡、大分子合成和信号传导等过程,对癌细胞具有保护作用[11-12],这提示放疗期间Gln用于CRC患者的营养治疗,可能会降低癌细胞的放射敏感性,不利于放疗对残余癌细胞的杀伤作用。因此,如何平衡CRC患者营养治疗应用与癌症治疗之间获益是目前CRC放疗期间的热点话题,如CRC患者放疗期间增加Gln的摄入是否降低放疗的疗效、CRC患者何时应用Gln肠外营养治疗等值得深入探讨。
为了探究增加Gln摄入是否降低放疗的疗效,本研究以结直肠癌HT-29细胞构建体外模型,观察不同浓度Gln对HT-29细胞放射敏感性的影响,并初步探究其相关机制,旨在提供放疗期间肿瘤细胞Gln代谢的基础实验数据,为结直肠癌患者放疗期间的精准营养管理提供理论依据。
1 材料与方法 1.1 试剂与器材仪器:微量台式低温离心机(Thermo Scientific),Olympus倒置荧光显微镜(Olympus),超灵敏凝胶成像系统(Acuronbio),全波长多功能酶标仪(Thermo Scientific),Bio-Rad高流电泳仪(Bio-Rad),超声破碎仪(鄞州双嘉),细胞计数板(湖南比克曼)。试剂:L-谷氨酰胺、McCoy’s 5A培养基(不含Gln)、青-链双抗混合液、FBS、胰蛋白酶-EDTA溶液(武汉普诺赛),细胞凋亡检测试剂盒(武汉塞维尔),PAGE凝胶快速配成试剂盒(西安米鼠生物),CCK-8试剂盒、BCA蛋白定量试剂盒、RIPA裂解液、蛋白上样缓冲液、ECL化学发光试剂盒(上海碧云天),活性氧检测试剂盒(北京Biosharp),cleaved-Caspase3一抗(上海艾比玛特),Nrf2一抗、HO-1一抗、兔GAPDH抗体、过氧化物酶偶联的二抗(上海生工)。
1.2 实验细胞结直肠癌HT-29细胞购于武汉普诺赛生命科技有限公司。
1.3 细胞培养复苏HT-29细胞,培养在含10% FBS、1%双抗的McCoy’s 5A培养基,置于5% CO2、37 ℃培养箱孵育。当细胞融合度达80%时,0.125%胰酶消化2 min,调整细胞浓度为5×104/mL,按1∶3传代。
1.4 细胞分组及干预根据参考文献[13-14],将对数生长期的HT-29细胞按照培养基含Gln浓度2(培养基基础浓度)、4、6、8 mmol/L分为对照组、实验组Ⅰ、实验组Ⅱ、实验组Ⅲ。细胞接种、传代,待细胞贴壁12 h后,按实验分组更换含不同浓度Gln的生长培养基,预处理2 h后给予8 Gy[15-16](Co 60,0.487 Gy/min)剂量放射1次,继续培养进行下一步实验。
1.5 Gln对未放射HT-29细胞活力的影响将生长至80%的HT-29细胞以1×104/mL的密度接种于96孔板,每孔100 μL,置于细胞培养箱培养,待细胞贴壁12 h后,按实验分组更换含不同浓度Gln的生长培养基,分别于3、6、9、12、24 h,使用CCK-8试剂检测各组细胞活力。
1.6 Gln对放射后HT-29细胞活力的影响将生长至80%的HT-29细胞以1×104/mL的密度接种于96孔板,每孔100 μL,置于细胞培养箱培养。待细胞贴壁12 h后,按实验分组更换含不同浓度Gln的生长培养基预处理2 h,于放射后3、6、9、12、24 h,使用CCK-8试剂检测各组细胞活力。
1.7 HT-29细胞克隆形成实验T25培养瓶孵育细胞,各组细胞放射后继续培养24 h。胰酶消化细胞,重悬后显微镜下计数并调整细胞浓度,于6孔板中接种各组细胞600个/孔,继续培养至14 d,中途每隔3 d更换各组相应培养基并观察细胞状态。克隆完成后,PBS洗涤2次,每孔加入1 mL 4%多聚甲醛固定30 min,PBS洗涤2次;每孔添加结晶紫染液1 mL,浸染20 min;PBS洗涤细胞3次,晾干拍照。在显微镜下对包含≥10个细胞的克隆进行计数,克隆形成率为克隆数与每孔接种的细胞数的比值。
1.8 活性氧(ROS)检测12孔板孵育细胞,检测各组细胞放射后24 h ROS水平。按1∶1 000的比例用无血清培养液稀释DCFH-DA,终浓度为10 μmol/L。去除细胞培养液,加入适当体积稀释后的DCFH-DA,37 ℃培养箱继续孵育20 min,无血清细胞培养基洗涤3次,充分去除细胞外DCFH-DA,Olympus倒置荧光显微镜观察并拍照记录。用Image J软件对荧光强度进行分析。
1.9 细胞凋亡实验T25培养瓶孵育细胞,各组细胞放射后继续培养48 h。收集细胞培养液到离心管内,胰酶消化细胞,加入收集的细胞培养液,吹打所有贴壁细胞,再次收集到离心管内,500 g离心5 min,沉淀细胞。小心去除上清,用预冷的PBS清洗细胞2次,每次500 g,4 ℃离心5 min;收集细胞,用预冷的1 × Binding Buffer重悬细胞,调整细胞浓度至3× 106/mL;取100 μL细胞悬液,加入Annexin V-FITC和PI各5 μL,轻柔混匀,室温避光10 min。加入预冷的1×Binding Buffer 400 μL,轻轻摇匀,上机用流式细胞仪进行检测。
1.10 蛋白印迹法(Western blot)T25培养瓶孵育细胞,各组细胞放射后继续培养24 h。将各组细胞收集于1.5 mL离心管中,裂解细胞提取全蛋白,使用BCA蛋白定量试剂盒进行蛋白定量,加入蛋白上样缓冲液,95 ℃金属浴10 min。Western blot检测各组Nrf2、HO-1、cleaved-Caspase3的蛋白表达水平。用Image J软件对条带进行分析。
1.11 统计学分析统计分析通过SPSS 20.0软件进行,使用GraphPad Prism 8软件做图,计量资料以x±s表示,所有数据进行正态性检验和方差齐性检验。若符合则两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。P<0.05认为差异有统计学意义。
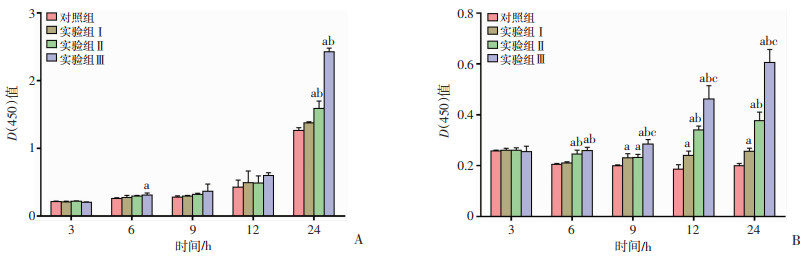
2 结果 2.1 不同浓度Gln对细胞活力影响的比较未放射HT-29细胞在Gln干预24 h实验组Ⅱ、实验组Ⅲ细胞活力明显高于对照组,差异具有统计学意义(P<0.05),见图 1A。HT-29细胞放射后6 h,实验组Ⅱ、Ⅲ细胞活力明显高于对照组,差异具有统计学意义(P<0.05);放射后9、12和24 h,各实验组细胞活力明显高于对照组,差异具有统计学意义(P<0.05)。见图 1B。
|
|
a:P<0.05,与对照组比较;b:P<0.05,与实验组Ⅰ比较;c:P<0.05,与实验组Ⅱ比较 A:未放射条件下Gln对HT-29细胞活力影响;B:放射条件下Gln对HT-29细胞活力影响 图 1 不同浓度Gln对细胞活力影响的比较(n=5) |
2.2 放射后14 d不同浓度Gln对HT-29细胞克隆形成数目的比较
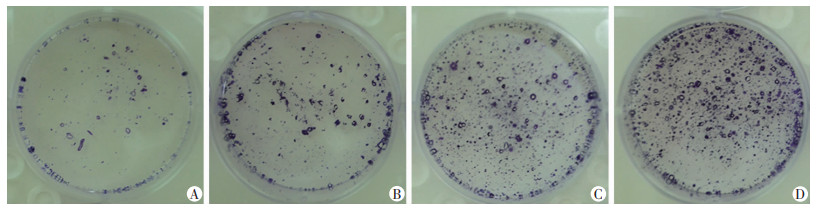
各组细胞克隆形成结晶紫染色情况见图 2。计数结果显示实验组Ⅰ、Ⅱ、Ⅲ细胞克隆形成数较对照组明显增加(P<0.05);实验组Ⅱ、Ⅲ细胞克隆形成数较实验组Ⅰ明显增加(P<0.05);实验Ⅲ组细胞克隆形成数较实验组Ⅱ明显增加(P<0.05)。见表 1。
|
| A:对照组;B:实验组Ⅰ;C:实验组Ⅱ;D:实验组Ⅲ 图 2 各组HT-29细胞在放射后的单克隆形成情况 |
| 组别 | 单克隆形成数 | 克隆形成率(%) |
| 对照组 | 148.0±17.7 | 24.7±2.9 |
| 实验组Ⅰ | 246.7±9.2 | 41.1±1.5a |
| 实验组Ⅱ | 407.3±35.9 | 67.9±6.0ab |
| 实验组Ⅲ | 685.3±38.1 | 114.2±6.3abc |
| a:P<0.05,与对照组比较;b:P<0.05,与实验组Ⅰ比较;c:P<0.05,与实验组Ⅱ比较 | ||
2.3 放射24 h各组HT-29细胞活性氧的比较
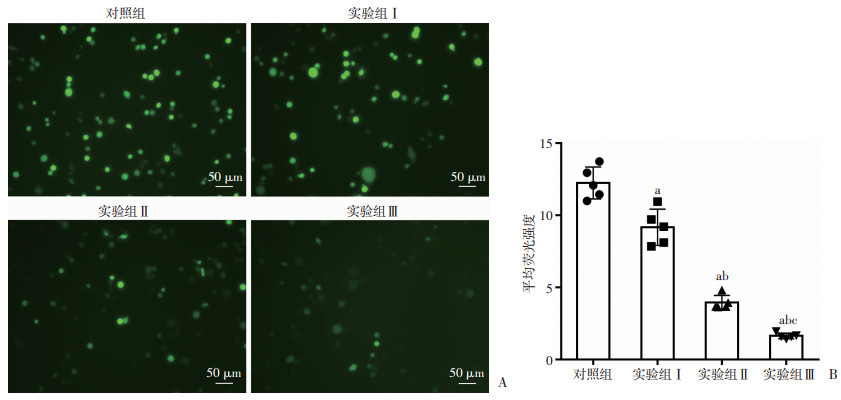
活性氧荧光图像结果显示,实验组Ⅰ、Ⅱ、Ⅲ细胞活性氧水平均较对照组下降(P<0.05);实验组Ⅱ、Ⅲ细胞活性氧水平较实验组Ⅰ下降(P<0.05);实验组Ⅲ细胞活性氧水平较实验组Ⅱ下降(P<0.05)。见图 3。
|
|
a:P<0.05,与对照组比较;b:P<0.05,与实验组Ⅰ比较;c:P<0.05,与实验组Ⅱ比较 A:各组ROS探针荧光染色;B:各组细胞平均荧光强度对比 图 3 放射后24 h各组HT-29细胞ROS荧光探针染色结果(n=5) |
2.4 放射后48 h不同浓度Gln对HT-29细胞凋亡的影响
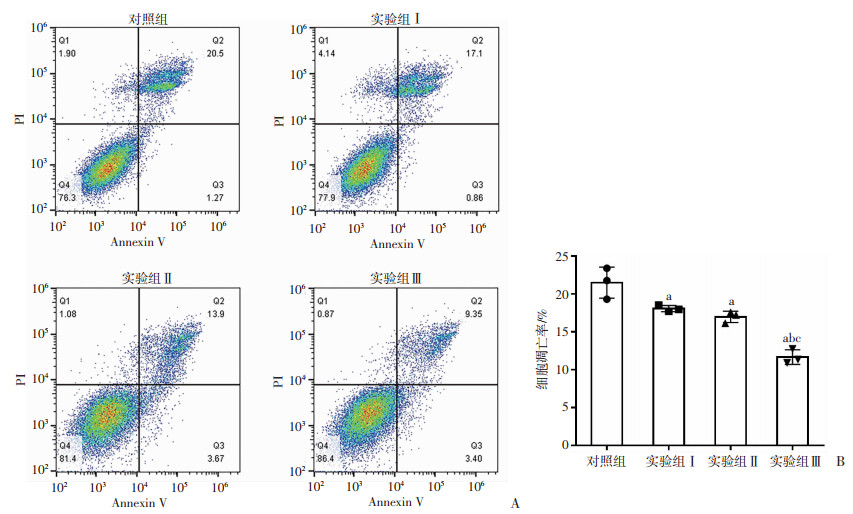
流式细胞术结果显示实验组Ⅰ、Ⅱ、Ⅲ细胞凋亡率较对照组下降(P<0.05);实验组Ⅱ细胞凋亡率较实验组Ⅰ无明显变化;实验组Ⅲ细胞凋亡率较实验组Ⅰ、Ⅱ明显下降(P<0.05)。见图 4。
|
|
a:P<0.05,与对照组比较;b:P<0.05,与实验组Ⅰ比较;c:P<0.05,与实验组Ⅱ比较 A:各组Annexin-V和PI双染色检测;B:各组细胞凋亡率对比 图 4 流式细胞术检测各组HT-29细胞在放射48 h后的凋亡率(n=3) |
2.5 放射后24 h各组HT-29细胞Nrf2、HO-1、cleaved-Caspase3的蛋白表达
Western blot结果表明实验组ⅠNrf2蛋白较对照组表达增加(P<0.05);实验组Ⅱ、Ⅲ Nrf2蛋白和HO-1蛋白较对照组和实验组Ⅰ表达明显增加(P<0.05),cleaved-Caspase3蛋白较对照组和实验组Ⅰ表达明显下降(P<0.05),实验组Ⅲ cleaved-Caspase3蛋白较实验组Ⅱ表达明显下降(P<0.05)。见图 5。
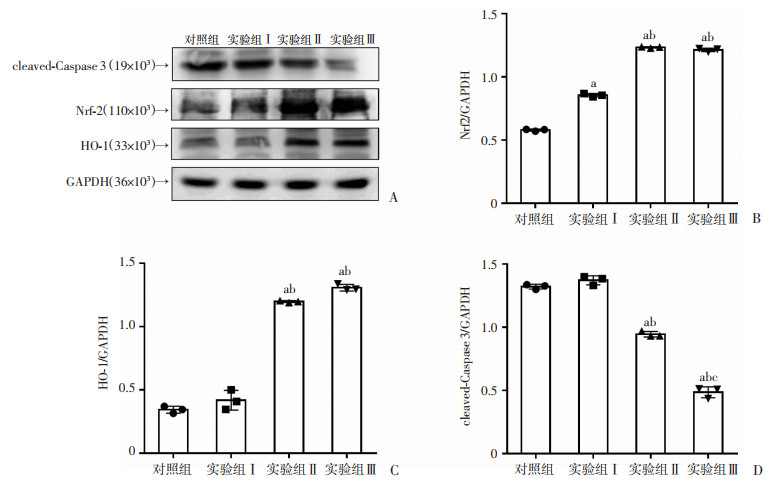
|
|
a:P<0.05,与对照组比较;b:P<0.05,与实验组Ⅰ比较;c:P<0.05,与实验组Ⅱ比较 A:Western blot检测结果;B~D:分别为Nrf2、HO-1、cleaved-Caspase3半定量分析 图 5 各组细胞Nrf2、HO-1、cleaved-Caspase3蛋白表达水平比较(n=3) |
3 讨论
肿瘤的发生和发展依赖于机体原本微环境生态平衡的改变,其中代谢重编程发挥着重要作用。作为肿瘤代谢重编程的重要组成部分,Gln代谢重编程被认为对肿瘤细胞功能具有多效性作用。Gln分解产生合成肿瘤细胞所需的氨基酸、核苷酸、脂肪酸和己糖胺等大分子物质的原料[17],其代谢物在进入三羧酸循环后为肿瘤进展提供能量[11]。Gln在多种癌症形式中显著促进细胞增殖,Gln剥夺会抑制肿瘤细胞生长,显著促进细胞凋亡,使细胞周期停滞在G1期[18]。本研究也证实,在2~8 mmol/L的浓度范围内,HT-29细胞活力随Gln浓度增加而升高,表明在该浓度范围内,Gln能增加HT-29细胞对放射的抵抗力,同时流式细胞术结果表明,Gln浓度增加能明显降低放射后HT-29细胞凋亡。细胞克隆实验进一步证实,Gln以剂量依赖性的方式增加了HT-29细胞克隆形成数。这些结果表明在2~8 mmol/L的浓度范围内,随着Gln浓度增加,HT-29细胞的放射敏感性降低。
研究表明,放疗可以通过增加肿瘤细胞ROS水平从而诱导肿瘤细胞凋亡[19]。细胞凋亡与ROS密切相关,一定水平的ROS可维持细胞稳态,当ROS水平超过阈值,细胞会触发凋亡信号,诱导细胞走向凋亡[20-22]。研究证实,Gln代谢途径中合成的谷胱甘肽(GSH)和烟酰胺腺嘌呤二核苷酸磷酸(NADPH)可以调节肿瘤细胞的ROS水平,以维持其氧化还原稳态,保证肿瘤细胞的生存[23]。Nrf2是一种调节抗氧化作用转录因子,正常情况下,Nrf2低表达并定位于细胞质,在氧化应激条件下,Nrf2表达水平上升,并移位到细胞核,参与编码抗氧化酶的基因启动子结合,共同清除ROS[22, 24]。血红素加氧酶-1(HO-1)是一种诱导蛋白,体外和体内实验证实HO-1的表达水平可由Nrf2直接调控[25-26],而HO-1可抑制细胞中ROS的产生,从而调控细胞凋亡[27]。此外,细胞凋亡程序依赖于蛋白水解Caspase级联的激活,其中cleaved-Caspase3被认为是细胞凋亡的关键介质[28]。本研究表明,低Gln浓度组HT-29细胞在放射后胞内ROS水平明显上升,且细胞凋亡维持在较高水平,而提升Gln浓度能以剂量依赖性的方式降低放射后HT-29细胞的ROS水平和凋亡水平。进一步研究发现放射后低Gln浓度组HT-29细胞Nrf2、HO-1的表达相对较低,cleaved-Caspase3的表达相对较高;而增加Gln浓度能明显上调Nrf2、HO-1的表达、下调cleaved-Caspase3的表达。这表明增加HT-29细胞生长环境中的Gln可以通过降低ROS水平来增强HT-29抗氧化应激损伤的能力,减少细胞凋亡,这与HT-29细胞的放射敏感性密切相关。
综上所述,本研究表明在2~8 mmol/L的范围内,随着Gln浓度的提高,HT-29细胞的放射敏感性明显降低,Gln对放射后的HT-29细胞具有保护作用,其机制可能与降低ROS水平,减轻氧化应激损伤,减少放射后HT-29细胞的凋亡有关。这提示额外补充Gln虽然可以改善放疗引起的肠道反应,但可能降低CRC患者的放疗效果,降低CRC患者临床治疗的整体获益。综上,本研究为临床上CRC患者在放疗期间是否补充Gln,以及患者的个性化营养管理提供了参考依据。然而Gln是如何调控氧化应激、减少细胞凋亡,Gln在何时使用及剂量在何种范围内能使CRC放疗患者受益最大化,还需要进行深入的实验探究和人群队列研究。
| [1] |
SEDLAK J C, YILMAZ Ö H, ROPER J. Metabolism and colorectal cancer[J]. Annu Rev Pathol, 2023, 18: 467-492. |
| [2] |
MORGAN E, ARNOLD M, GINI A, et al. Global burden of colorectal cancer in 2020 and 2040: incidence and mortality estimates from GLOBOCAN[J]. Gut, 2023, 72(2): 338-344. |
| [3] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. |
| [4] |
DOSSA F, CHESNEY T R, ACUNA S A, et al. A watch-and-wait approach for locally advanced rectal cancer after a clinical complete response following neoadjuvant chemoradiation: a systematic review and meta-analysis[J]. Lancet Gastroenterol Hepatol, 2017, 2(7): 501-513. |
| [5] |
CAI S J, YANG L F. Present situation and prospect of neoadjuvant therapy for locally advanced rectal cancer[J]. China Ind Econ, 2018, 25(11): 1281-1285. |
| [6] |
LEE H H, CHEN C H, HUANG Y H, et al. Biomarkers of favorable vs. unfavorable responses in locally advanced rectal cancer patients receiving neoadjuvant concurrent chemoradiotherapy[J]. Cells, 2022, 11(10): 1611. |
| [7] |
WANIGASOORIYA K, TYLER R, BARROS-SILVA J D, et al. Radiosensitising cancer using phosphatidylinositol-3-kinase (PI3K), protein kinase B (AKT) or mammalian target of rapamycin (mTOR) inhibitors[J]. Cancers, 2020, 12(5): 1278. |
| [8] |
KIM M H, KIM H. The roles of glutamine in the intestine and its implication in intestinal diseases[J]. Int J Mol Sci, 2017, 18(5): 1051. |
| [9] |
WEI X L, ZHAO T Y, LIU J N, et al. Effect of glutamine-enhanced parenteral nutrition on intestinal function and stress state in elderly patients with colorectal cancer[J]. Food Nutr China, 2022, 28(4): 83-86. |
| [10] |
DE L, GU P F, DOU Q, et al. Effect of glutamate-enhanced enteral nutrition on nutrition, immunity and inflammatory response in patients with colon cancer[J]. Chin J Clin Oncol Rehabil, 2020, 27(8): 925-928. |
| [11] |
ALTMAN B J, STINE Z E, DANG C V. From Krebs to clinic: glutamine metabolism to cancer therapy[J]. Nat Rev Cancer, 2016, 16(10): 619-634. |
| [12] |
SHARMA S, AGNIHOTRI N, KUMAR S. Targeting fuel pocket of cancer cell metabolism: a focus on glutaminolysis[J]. Biochem Pharmacol, 2022, 198: 114943. |
| [13] |
GENZEL Y, RITTER J B, KÖNIG S, et al. Substitution of glutamine by pyruvate to reduce ammonia formation and growth inhibition of mammalian cells[J]. Biotechnol Prog, 2005, 21(1): 58-69. |
| [14] |
TANG M S, QIN Y Z, DAI G, et al. Different concentrations of glutamine in rat adipose tissue-derived messenchymal stem cell cultured in vitro[J]. N Med, 2012, 43(5): 322-326, 351. |
| [15] |
SHAGHAGHI Z, POLGARDANI N Z, ABBASI S, et al. Etodolac enhances the radiosensitivity of irradiated HT-29 human colorectal cancer cells[J]. Curr Radiopharm, 2022, 15(3): 242-248. |
| [16] |
SCHONEWOLF C A, MEHTA M, SCHIFF D, et al. Autophagy inhibition by chloroquine sensitizes HT-29 colorectal cancer cells to concurrent chemoradiation[J]. World J Gastrointest Oncol, 2014, 6(3): 74-82. |
| [17] |
DAYE D, WELLEN K E. Metabolic reprogramming in cancer: unraveling the role of glutamine in tumorigenesis[J]. Semin Cell Dev Biol, 2012, 23(4): 362-369. |
| [18] |
GUO J, SATOH K, TABATA S, et al. Reprogramming of glutamine metabolism via glutamine synthetase silencing induces cisplatin resistance in A2780 ovarian cancer cells[J]. BMC Cancer, 2021, 21(1): 174. |
| [19] |
LEE S Y, JEONG E K, JU M K, et al. Induction of metastasis, cancer stem cell phenotype, and oncogenic metabolism in cancer cells by ionizing radiation[J]. Mol Cancer, 2017, 16(1): 10. |
| [20] |
B DOMÈNECH E, MARFANY G. The relevance of oxidative stress in the pathogenesis and therapy of retinal dystrophies[J]. Antioxidants, 2020, 9(4): 347. |
| [21] |
REN X Y, LÉVEILLARD T. Modulating antioxidant systems as a therapeutic approach to retinal degeneration[J]. Redox Biol, 2022, 57: 102510. |
| [22] |
SIES H, JONES D P. Reactive oxygen species (ROS) as pleiotropic physiological signalling agents[J]. Nat Rev Mol Cell Biol, 2020, 21(7): 363-383. |
| [23] |
MA G F, ZHANG Z L, LI P, et al. Reprogramming of glutamine metabolism and its impact on immune response in the tumor microenvironment[J]. Cell Commun Signal, 2022, 20(1): 114. |
| [24] |
BENHAR M. Oxidants, antioxidants and thiol redox switches in the control of regulated cell death pathways[J]. Antioxidants, 2020, 9(4): 309. |
| [25] |
KIM W, KIM H U, LEE H N, et al. Taurine chloramine stimulates efferocytosis through upregulation of Nrf2-mediated heme oxygenase-1 expression in murine macrophages: possible involvement of carbon monoxide[J]. Antioxid Redox Signal, 2015, 23(2): 163-177. |
| [26] |
LUO J F, SHEN X Y, LIO C K, et al. Activation of Nrf2/HO-1 pathway by nardochinoid C inhibits inflammation and oxidative stress in lipopolysaccharide-stimulated macrophages[J]. Front Pharmacol, 2018, 9: 911. |
| [27] |
SAHA S, BUTTARI B, PANIERI E, et al. An overview of Nrf2 signaling pathway and its role in inflammation[J]. Molecules, 2020, 25(22): 5474. |
| [28] |
ASADI M, TAGHIZADEH S, KAVIANI E, et al. Caspase-3: structure, function, and biotechnological aspects[J]. Biotechnol Appl Biochem, 2022, 69(4): 1633-1645. |




