宫颈癌是女性下生殖道最常见的妇科恶性肿瘤,每年约有60万新发病例和34万病死病例[1]。高危型HPV病毒持续感染是宫颈癌发生发展的根本原因,其中,最常见的高危型HPV病毒类型是HPV16(50%)。在建立持续感染后,宫颈癌发生的关键步骤是HPV基因组整合到宿主染色体中,80%的HPV16阳性宫颈癌显示出病毒整合[2]。HPV基因组早期区域(E)内含不同类型的前体蛋白(包括早期感染阶段所需的E1、E2、E4、E5、E6和E7),与病毒DNA复制、细胞周期控制和肿瘤发生相关[3]。E6和E7是高危型HPV介导的宫颈癌进展的主要原因[4]。既往研究已证实E6和E7可分别通过P53的降解和视网膜母细胞瘤(pRb)肿瘤抑制蛋白的失活来介导恶性转化,负责驱动和维持宫颈癌恶性表型[5-7]。近年来,针对HPV的E6基因疗法及治疗性疫苗的研究显示了初步成效。本研究聚焦HPV16 E6基因,旨在筛选相关通路及生物靶点,进一步探索该基因在宫颈癌前病变及宫颈癌的进程中的作用。
已知高危型HPV16 E6可参与多个信号通路(如NF-KB、RAS、ERK、MEK、STAT等),介导细胞增殖、代谢及免疫相关通路等,进而促进宫颈癌的发生和发展。宫颈恶性细胞中的E6蛋白可介导宫颈细胞侵袭和转移行为,具有很重要的作用。此外,有研究报道E6与活性氧(reactive oxygen species, ROS)的产生有关[8],与氧化还原过程通路具有相关性。ROS通过消耗抗氧化酶(包括过氧化氢酶PDZ结构域蛋白)的水平诱导DNA损伤或分解,过氧化氢酶PDZ结构域蛋白与高危HPV E6蛋白相互作用,通过调节细胞极性诱导肿瘤细胞的正常侵袭和转移分化[9],具体相关基因及分子机制尚未深入解析。有关HPV E6的作用及机制还未阐明,尤其是在HPV感染初期,除了P53及HPV E6AP泛素化作用外,与致癌转化相关的其他基因信号通路及代谢改变仍不明确。鉴于此,为探索HPV16 E6基因对宫颈上皮细胞的影响,本研究构建HPV16 E6过表达正常人宫颈上皮细胞(HUCEC)稳转株,通过转录组学筛选HPV16 E6感染后差异表达基因(differentially expressed genes, DEGs),并通过RT-qPCR、Western blot及分子对接预测分析等方法进行验证,筛选相关生物标志物及靶点,为进一步探索相关分子致病机制奠定基础。
1 材料与方法 1.1 实验材料与试剂HUCEC细胞购自美国ATCC细胞库;细胞培养基、胎牛血清及双抗购于重庆衍庆生物技术有限公司;RNA提取TRIzol、实时荧光定量PCR试剂盒及逆转录试剂盒购自日本TaKaRa公司;无水乙醇由重庆西南医院中心实验室提供;研究中所用转染试剂LipofectamineTM 3000购自美国invitrogen公司;倒置荧光显微镜购自日本奥林巴斯公司;实时荧光定量PCR仪、梯度PCR仪、垂直电泳电转设备及凝胶成像系统购自美国伯乐公司(Bio-Rad);SDS、甘氨酸、Tris、异丙醇购于北京索莱宝公司;PVDF膜购自美国Milipore公司;一抗稀释液购于上海碧云天生物科技有限公司;二抗购于美国CST公司;抗HPV16 E6抗体购自美国Abcam公司;抗DHRS2抗体、抗ETV5抗体、抗GAPDH抗体购自中国武汉三鹰生物技术有限公司;抗P53抗体购自上海碧云天生物科技有限公司;HPV16 E6过表达慢病毒由广州赛业生物有限公司构建。
1.2 方法 1.2.1 细胞培养以及稳转株构建HUCEC、SiHa、CaSki细胞株用含有10%胎牛血清的DMEM培养基于37 ℃、5% CO2的培养箱培养。HUCEC细胞于6孔板中培养24 h,细胞密度约60%时,将HPV16 E6过表达慢病毒(LV-EFS>HPV16-E6-CMV>EGFP/T2A/Puro)与对照组(LV-CMV>EGFP/T2A/Puro)以感染复数(multiplicity of infection, MOI)>10加入6孔板中,加入polybrene 2 μg/mL。十字水平方向摇动6孔板混匀其中的培养基,放入培养箱中,37 ℃、5%CO2条件下培养48 h,探索药物致死浓度后,在新鲜培养基中加入2 μg/mL嘌呤霉素进行药筛。经过1周的药筛,存活的细胞数目开始增加,经过10~14 d,稳转株建成。倒置荧光显微镜下观察发现稳转株荧光阳性率>90%。扩大培养实验组(LV-HPV16 E6组)细胞和对照组(LV-NC组)细胞,留取部分细胞验证HPV16 E6过表达情况。同时留取细胞稳转株冻存保种。其中,HPV16 E6过表达载体如图 1所示,包含E6全基因片段,除了构建EGFP荧光筛选外,还加入药物筛选基因。

|
| 图 1 HPV16 E6过表达载体 |
1.2.2 RNA测序和筛选
从约10 μg的总RNA中获得mRNA,通过RNA质量检测、片段化及逆转录生成cDNA,末端补平,加A尾,加接头后进行PCR扩增。将双链PCR产物热变性和环化。单链环状DNA被格式化为最终文库。于illumina平台上机测序。数据分析筛选了HPV16 E6慢病毒及空载转染的HUCEC细胞株之间差异表达基因,使用DESeq(2012)R package的estimateSizeFactors函数对数据进行标准化,并使用nbinomTest函数计算差异比较的P值和差异倍数(Fold Change)值。挑选出P < 0.05,|FC|>2的差异转录本,并进行差异转录本的基因本体(Gene Ontology, GO)和京都基因和基因组(Kyoto Encyclopedia of Genes and Genomes,KEGG) 富集分析,以判定差异转录本主要影响的生物学功能或者通路。同时对差异转录本进行非监督层次聚类,利用热图展示差异转录本在不同样本间的表达模式。其中,GO功能分类的结果显示在生物过程、细胞成分和分子功能3个领域。此外,通过使用KEGG注释,定义了DEG所涉及的生物学过程。使用修正后的P < 0.05以证明GO基因集的显著丰富。阈值Q值≤0.25的KEGG通路被认为在DEG中显著富集。
1.2.3 RT-qPCR检测吸出T25细胞培养瓶中旧的培养基,使用PBS润洗细胞2次,加入1 mL TRIzol提取总RNA,用TaKaRa反转录试剂盒逆转录生成cDNA(20 μL体系),使用无酶无菌水将逆转录产物稀释至100 μL。取正向及反向引物各0.5 μL,cDNA取1 μL,ddH2O取3 μL,以及TB Green Premix(TaKaRa)5 μL进行RT-qPCR。验证HPV16 E6过表达以及差异表达基因的转录水平变化,引物由擎科生物公司合成,引物序列如表 1所示。
| 基因名称 | 引物序列(5'→3') | 碱基数 |
| HPV16 E6 | 上游:GAGCGACCCAGAAAGTTACCA | 21 |
| 下游:AAATCCCGAAAAGCAAAGTCA | 21 | |
| GAPDH | 上游:AGCCACATCGCTCAGACAC | 19 |
| 下游:TTAAAAGCAGCCCTGGTGAC | 20 | |
| GDF15 | 上游:GACCCTCAGAGTTGCACTCC | 20 |
| 下游:GCCTGGTTAGCAGGTCCTC | 19 | |
| STEAP4 | 上游:CCTCAGCCCTTCAAATCTCAG | 21 |
| 下游:ACATGGCATGATTAGGACAAACT | 23 | |
| BDKRB2 | 上游:GTCTGTTCGTGAGGACTCCG | 20 |
| 下游:AAAGGTCCCGTTAAGAGTGGG | 21 | |
| DHRS2 | 上游:ATGGGAATGAGTCTCTCTGGAA | 22 |
| 下游:CGTTGACGTAGCTGGCATC | 19 | |
| ETV5 | 上游:CAGTCAACTTCAAGAGGCTTGG | 22 |
| 下游:TGCTCATGGCTACAAGACGAC | 21 | |
| MAN1A1 | 上游:AAAGCAGTGGAACTTGGGGT | 20 |
| 下游:CAGGGCCAGTTCCTTCCAAT | 20 | |
| PRG4 | 上游:TTCATCTCAAGAGCTTTCCTGT | 22 |
| 下游:CAACTGGTGGTTTGGGGGTA | 20 | |
| ETV1 | 上游:TGCATATGACTCAGGCTGTATGT | 23 |
| 下游:TGAAGTGATCCTCGCCGTTG | 20 | |
| FAM83A | 上游:GGAGCTGTTTGACGAGGAGT | 20 |
| 下游:CAGCCGTCAGTTCGGGTA | 18 | |
| CGA | 上游:TGTGCAGGATTGCCCAGAAT | 20 |
| 下游:TGGACCTTAGTGGAGTGGGA | 20 |
1.2.4 Western blot实验
镜下观察细胞无特殊,使用预冷的PBS溶液洗涤细胞后加入适量含蛋白酶抑制剂、磷酸酶抑制剂的裂解液,吹打混匀后放置冰上裂解30 min。离心所得上清(即蛋白质提取物)与上样缓冲液按比例混合,金属浴变性后进行SDS-PAGE凝胶电泳,电转移到PVDF膜上,将膜封闭并与一抗孵育过夜。TBST洗涤后与二抗孵育,再次予以TBST洗涤。使用凝胶成像仪检测并捕获蛋白质条带。用于此时Western blot的一抗如下:抗HPV16 E6、抗DHRS2、抗ETV5、抗P53、抗GAPDH。GAPDH用作上样对照。
1.2.5 分子对接预测分析VE6(6SIV)的X射线晶体结构来自蛋白质数据库。DHRS2预测结构由Alphafold生成。为保证对接结果准确性,使用AutoDockTools-1.5.7对2个蛋白结构手动进行去水、加氢等优化操作,之后使用对接服务器(GRAMM)进行蛋白-蛋白对接,再将得到的蛋白-蛋白复合物同样使用AutoDockTools-1.5.7手动进行去水、加氢等优化操作,最后使用Pymol进行蛋白相互作用预测并生成蛋白相互作用图。在Pymol中,DHRS2被表示为深蓝色的卡通模型,VE6被显示为青色的卡通模型,它们的结合点被显示为相应颜色的棍棒结构。当聚焦于结合区域时,结合位点则会以所属蛋白的展示。
1.3 统计学分析采用SPSS 22.0软件进行统计学分析,使用非配对t检验比较2组样品均值,P < 0.05为差异有统计学意义。
2 结果 2.1 HPV16 E6过表达细胞株构建宫颈癌细胞中有多种癌基因存在(如E5、E6、E7),为单独检测HPV16 E6基因对宫颈上皮细胞的影响,故构建HPV16 E6基因过表达稳转HUCEC模型。经荧光及药物筛选,实验组细胞稳转株中荧光阳性率>90%。与对照组比较,实验组HUCEC细胞稳转株可见明显HPV16 E6的mRNA表达。依据显微镜下观察细胞稳转株荧光率以及RT-qPCR实验检测结果,显示成功构建HPV16 E6过表达HUCEC细胞稳转株(图 2)。
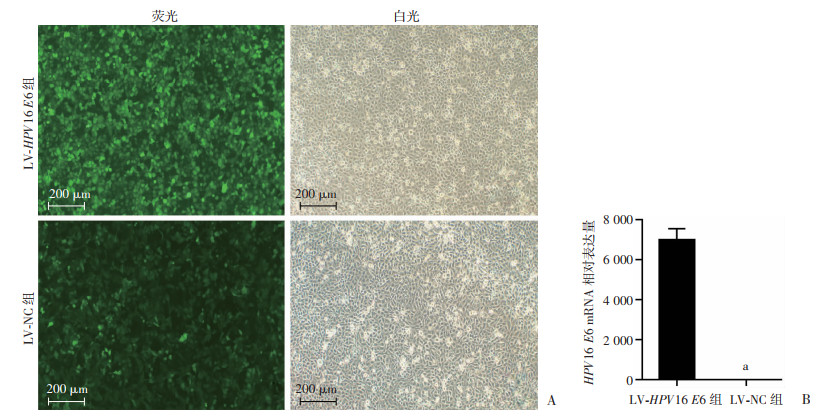
|
| A:LV-HPV16 E6细胞稳转株及对照组细胞株的电镜观察;B:RT-qPCR实验检测结果a: P < 0.001,与LV-HPV16 E6组比较 图 2 LV-HPV16 E6细胞稳转株荧光图及RT-qPCR结果 |
2.2 差异表达基因分析
根据差异倍数及差异显著性检验结果,筛选过表达HPV16 E6的HUCEC细胞的差异表达基因。默认筛选差异的条件为P < 0.05且FC>2。结果发现HPV16 E6过表达宫颈上皮细胞HUCEC引起55个基因发生显著变化。其中35个基因表达上升,20个基因表达下降(图 3)。

|
| A:差异表达基因统计柱状图; B:差异表达基因聚类热图; C:差异表达基因火山图 图 3 DEG筛选结果 |
2.3 GO功能富集
本研究主要聚焦下调DEGs。生物信息学分析结果提示,HPV16 E6负调控的差异基因富集于氧化还原过程、信号转导、G蛋白偶联受体信号通路、RNA聚合酶对转录的正向调控、RNA聚合酶Ⅱ对转录的调控等生物过程。细胞组成上参与细胞外的外泌体、浆膜的组成部分、细胞外空间、高尔基体、细胞外区域、膜的组成部分等的形成,并参与蛋白质结合等分子功能(图 4)。

|
| 图 4 差异基因GO富集分析 |
2.4 KEGG功能富集
HPV16 E6过表达HUCEC细胞调控的差异基因通过KEGG功能富集分析,发现在环境信息处理方面,参与了信号分子相互作用和信号转导过程;代谢方面参与碳水化合物代谢;有机体系统方面涉及免疫系统、内分泌系统、消化系统、神经退行性疾病以及与人类癌症相关(图 5)。
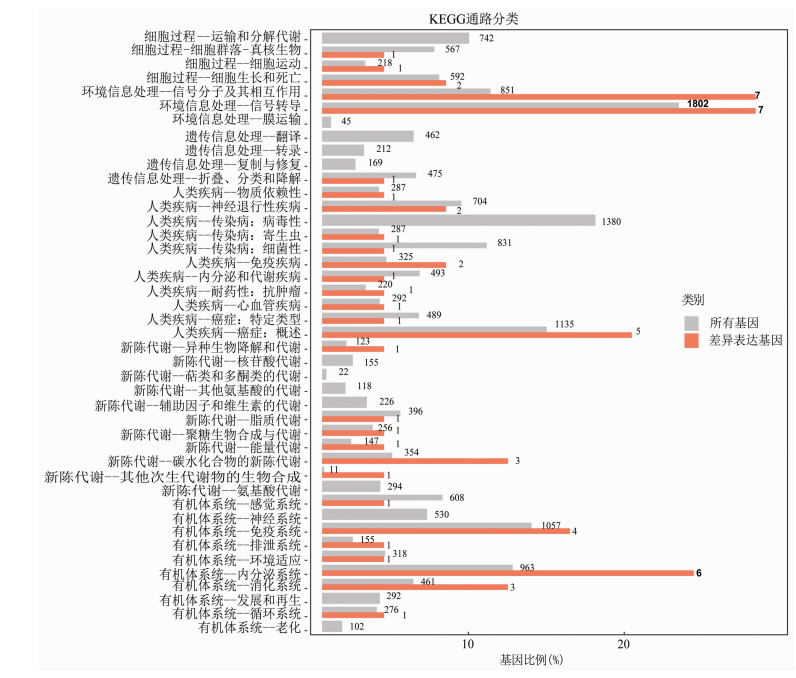
|
| 橙色柱子: 注释到各Level2通路的差异表达基因数量; 灰色柱子: 所有注释到KEGG通路的差异表达基因总数 图 5 差异表达基因及所有基因在KEGG Level2水平分布比较 |
2.5 RT-qPCR验证转录组测序结果
GO功能分析表明差异基因富集最明显的是氧化还原过程。采用RT-qPCR验证实验组与对照组过表达HUCEC细胞转录组测序结果,观察表达下调显著的基因GDF15、STEAP4、BDKRB2、DHRS2、ETV5、MAN1A1、PRG4、ETV1、FAM83A、CGA是否被HPV16 E6调控。结果显示,与测序结果趋势一致,HPV16 E6过表达可引起GDF15、STEAP4、DHRS2、MAN1A1、FAM83A等基因下调,大部分基因参与氧化还原过程(图 6),其中,DHRS2基因表达下调最多(P < 0.001)。结合GO功能分析,推测HPV16 E6还可能影响宫颈上皮细胞的氧化还原过程进而可能引起细胞的表型变化。

|
|
a: P < 0.001, b: P < 0.01, c: P < 0.05,与LV-NC组比较 A: 转录组测序分析结果中下调的前10差异表达基因;B: RT-qPCR实验验证HPV16 E6过表达后HUCEC细胞稳转株的差异基因mRNA表达 图 6 转录组测序分析以及RT-qPCR验证差异表达基因 |
2.6 分子对接预测分析
为了进一步探索HPV16 E6和DHRS2蛋白是否存在相互作用,通过Pymol中蛋白-蛋白相互作用分析发现其所有的功能残基,并根据它们的相互作用进行了分类。其中,在氢键相互作用中,DHRS2与HPV16 E6之间存在多组用于形成氢键的残基,DHRS2可与HPV16 E6编码蛋白的活性位点Ser-1138、Arg-1047、Thr-1017、Gln-1116形成氢键。在这些相互作用力的作用下,DHRS2-HPV16 E6的分值为-481,表现较好(图 7)。由此,可以认为HPV16 E6和DHRS2基因的蛋白结构存在相互作用(HPV16 E6与DHRS2分子间相互作用,默认氢键距离为2.5 Å,但是当二者作用力较弱时,设置距离为3.0 Å,当二者作用力较强时,设置距离为2.0 Å)。

|
| 图 7 HPV16 E6和DHRS2蛋白相互作用分析 |
2.7 HPV16 E6过表达宫颈上皮细胞中DHRS2、ETV5的蛋白表达变化
为进一步确定验证实验组是否存在蛋白表达差异,继而采用Western blot检测实验组细胞与对照组细胞中DHRS2、ETV5的蛋白表达变化。其中,ETV5是DHRS2的伴侣蛋白。实验结果提示,实验组DHRS2(P < 0.05)、ETV5(P < 0.01)蛋白表达均减少,与对照组比较,差异具有统计学意义(图 8)。证实HPV16 E6蛋白可同时下调DHRS2、ETV5蛋白表达。
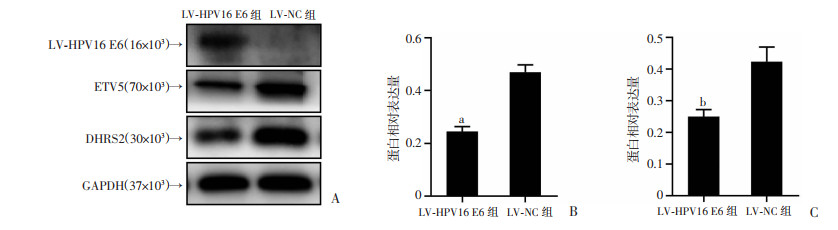
|
|
a:P < 0.01,b: P < 0.05,与LV-NC组比较 A:Western blot检测实验组和对照组差异表达基因蛋白表达;B:ETV5蛋白表达统计分析;C:DHRS2蛋白表达统计分析 图 8 HPV16 E6对DHRS2、ETV5蛋白表达的影响 |
2.8 宫颈癌细胞系DHRS2及P53表达变化
为检测DHRS2是否与宫颈上皮细胞致癌转化存在相关性,本研究进一步通过RT-qPCR及Western blot检测宫颈正常细胞与宫颈癌细胞之间DHRS2的mRNA、蛋白表达变化,以及P53蛋白表达趋势。已知DHRS2作为抑癌基因,可减弱MDM2介导的P53降解,稳定P53蛋白表达,参与维持细胞稳态。String数据库显示,DHRS2蛋白与P53蛋白存在相互作用(图 9C)。探究DHRS2下调是否与致癌转化相关,可观察其与P53降解是否存在一致性。研究结果表明:与宫颈正常细胞比较,CaSki及SiHa宫颈癌细胞中的DHRS2 mRNA表达均明显减少(P < 0.05,图 9B);此外,DHRS2及P53蛋白同时明显下降,可见DHRS2蛋白与P53蛋白表达趋势成正相关(图 9A)。由此,推测HPV16 E6通过调控DHRS2的表达可能参与宫颈癌的致癌转化过程,进而协同促进宫颈癌的发生。

|
| A: Western blot检测宫颈正常细胞与宫颈癌细胞DHRS2和P53蛋白表达;B: RT-qPCR检测宫颈正常细胞与宫颈癌细胞DHRS2的mRNA表达a: P < 0.05,与宫颈正常细胞比较;C: String数据库中DHRS2、P53间接蛋白的相互作用 图 9 宫颈癌细胞中DHRS2与P53蛋白的表达及相互作用 |
3 讨论
宫颈癌是目前病因明确的妇科恶性肿瘤,与高危型HPV的持续感染有关。HPV感染每年可造成全世界约5%的新发癌症[10-12]。根据不同的致瘤潜能,HPV分为高风险型和低风险型,其中,高风险型可能导致高级别鳞状上皮内病变和癌症的发生发展。全世界范围内,HPV16和HPV18导致71%的宫颈癌[13-14]。其中,超过50%的宫颈癌是由HPV16引起的[15]。HPV病毒编码两大致癌基因E6和E7[16],这两种致癌基因不仅编码主要的致癌蛋白,也是宫颈癌免疫抑制微环境和免疫逃逸的关键分子[17]。过表达的E6癌蛋白可通过激活致癌基因、抑制抑癌基因、干扰有丝分裂、调节miRNA的表达量以及增加宿主细胞体细胞的突变等途径导致宫颈癌的发生[18]。因此,研究E6的分子机制具有重要的临床价值。
HPV E6肿瘤蛋白与许多基因或蛋白相互作用,引起细胞表型变化,从而导致恶性肿瘤的产生。E6的主要目标是P53,主要通过与E6AP的相互作用将其靶向蛋白酶体降解;其次是与参与细胞凋亡过程、细胞增殖、细胞迁移、抗病毒反应、DNA修复和基因组不稳定性等细胞的关键蛋白相互作用[19]。本研究成功构建了HPV16 E6过表达宫颈上皮细胞后进行转录组高通量测序,获得HPV16 E6感染状态下的所有转录本的集合及细胞中调控的所有转录信息,从而用于研究基因结构和基因功能、可变剪接和新转录本预测等。通过对差异基因进行GO和KEGG富集,获取了HPV16 E6在宫颈上皮细胞中调控的生物功能和代谢过程。GO功能富集表明HPV16 E6负调控的差异基因富集于氧化还原过程。KEGG富集发现差异表达基因主要参与了信号分子相互作用和信号转导过程,与碳水化合物代谢、免疫系统疾病及癌症相关。进而,进行了细胞的RT-qPCR实验验证,下调比例前10的基因与测序结果基本一致,转录组测序结果可信。其中差异表达最明显的是DHRS2基因。进行分子对接分析预测发现DHRS2与HPV16 E6之间存在蛋白相互作用。抑癌基因DHRS2下调可参与癌症的发生[20-21],但在宫颈癌前病变及癌症中的作用及数据库的数据匮乏。已知DHRS2可通过MDM2-P53参与P53蛋白的降解及功能失活,String数据库也提示与其他蛋白相互作用影响P53蛋白表达。进一步验证发现,HPV16 E6可下调DHRS2、ETV5的mRNA及蛋白表达。结合GO功能分析,推测HPV16 E6极可能通过DHRS2影响宫颈上皮细胞的氧化还原过程,参与细胞的致癌转化。迄今,该通路在宫颈癌的发生发展的分子机制尚未被阐释。既往研究表明,正常细胞的生理功能在氧化还原平衡条件下进行,ROS是氧化还原的代谢物,而正常细胞中的额外ROS会引起肿瘤[22]。DNA损伤和DNA损伤修复不当是肿瘤发生的主要原因之一,涉及恶性改变的体细胞[23],过量的ROS会导致氧化性DNA损伤、基因组不稳定性和突变[24]。这种影响主要表现在原癌基因和抑制肿瘤基因上,在这些基因中,未修复的突变可促进肿瘤发生[24]。氧化还原平衡是正常细胞和癌细胞的生理需要,肿瘤也可由氧化还原异常导致,且肿瘤的发生和形成均需要产生和清除ROS[25]。因此,氧化还原平衡的紊乱会导致癌症的发生和进展。DHRS2是抑癌基因,是一种还原的烟酰胺腺嘌呤二核苷酸磷酸(NADPH)依赖性羰基还原酶,可保护细胞免受羰基细胞毒性损伤[26]。DHRS2作为线粒体基质蛋白,可通过N端线粒体靶向信号导入线粒体。线粒体是细胞内代谢氧化还原改变的调控中心。DHRS2的线粒体定位提示其可能与氧化应激的生理功能相关。在氧化应激条件下,细胞活性氧水平大幅增加[21]。相应地,增强的DHRS2可以消除超氧化物,防止细胞氧化损伤[21]。此外,DHRS2被认为是E3泛素连接酶鼠双微体同源基因2(MDM2)的抑制剂,它可以转移到细胞核并与MDM2结合,稳定P53[26-27]。由此,我们推测HPV16 E6可能通过下调DHRS2表达造成宫颈上皮细胞的致癌转化。
本研究通过宫颈癌细胞系SiHa(HPV16 E6+)、CaSki(HPV16 E6+)及正常宫颈上皮细胞HUCEC之间DHRS2及P53的蛋白表达差异,发现宫颈癌细胞DHRS2与P53蛋白表达明显下调,两者成正相关。由此,考虑HPV16 E6下调DHRS2的表达介导宫颈细胞的致癌转化,促进宫颈癌的发生。本研究的局限在于缺乏体内研究的模型,未来尚需深入探索HPV16 E6下调DHRS2参与驱动和维持宫颈癌恶性表型的分子机制。聚焦HPV16 E6对相关通路及生物靶点的作用机制,有助于宫颈癌的防治及HPV治疗性疫苗的研发。
| [1] |
BURMEISTER C A, KHAN S F, SCHÄFER G, et al. Cervical cancer therapies: current challenges and future perspectives[J]. Tumour Virus Res, 2022, 13: 200238. |
| [2] |
PONIEWIERZA P, PANEK G. Cervical cancer prophylaxis—state-of-the-art and perspectives[J]. Healthcare, 2022, 10(7): 1325. |
| [3] |
KIM R H, KANG M K, SHIN K H, et al. Bmi-1 cooperates with human papillomavirus type 16 E6 to immortalize normal human oral keratinocytes[J]. Exp Cell Res, 2007, 313(3): 462-472. |
| [4] |
BHATTACHARJEE R, DAS S S, BISWAL S S, et al. Mechanistic role of HPV-associated early proteins in cervical cancer: molecular pathways and targeted therapeutic strategies[J]. Crit Rev Oncol Hematol, 2022, 174: 103675. |
| [5] |
YEO-TEH N S L, ITO Y, JHA S. High-risk human papillomaviral oncogenes E6 and E7 target key cellular pathways to achieve oncogenesis[J]. Int J Mol Sci, 2018, 19(6): 1706. |
| [6] |
GUPTA S, KUMAR P, DAS B C. HPV: molecular pathways and targets[J]. Curr Probl Cancer, 2018, 42(2): 161-174. |
| [7] |
PAL A, KUNDU. Human papillomavirus E6 and E7: the cervical cancer hallmarks and targets for therapy[J]. Front Microbiol, 2019, 10: 3116. |
| [8] |
LIU S, CHANG W, JIN Y, et al. The function of histone acetylation in cervical cancer development[J]. Biosci Rep, 2019, 39(4): BSR20190527. |
| [9] |
WANG Q Q, SONG R, ZHAO C J, et al. HPV16 E6 promotes cervical cancer cell migration and invasion by downregulation of NHERF1[J]. Int J Cancer, 2019, 144(7): 1619-1632. |
| [10] |
GROVES I J, DRANE E L A, MICHALSKI M, et al. Short- and long-range cis interactions between integrated HPV genomes and cellular chromatin dysregulate host gene expression in early cervical carcinogenesis[J]. PLoS Pathog, 2021, 17(8): e1009875. |
| [11] |
KI E Y, PARK J S. Natural history of human papillomavirus infection[J]. Curr Obstet Gynecol Rep, 2014, 3(2): 123-127. |
| [12] |
MARTEL C D, GEORGES D, BRAY F, et al. Global burden of cancer attributable to infections in 2018: a worldwide incidence analysis[J]. Lancet Glob Health, 2020, 8(2): e180-e190. |
| [13] |
ZUR HAUSEN H. Papillomaviruses in the causation of human cancers - a brief historical account[J]. Virology, 2009, 384(2): 260-265. |
| [14] |
DE SANJOSE S, QUINT W G, ALEMANY L, et al. Human papillomavirus genotype attribution in invasive cervical cancer: a retrospective cross-sectional worldwide study[J]. Lancet Oncol, 2010, 11(11): 1048-1056. |
| [15] |
CLIFFORD G M, SMITH J S, PLUMMER M, et al. Human papillomavirus types in invasive cervical cancer worldwide: a meta-analysis[J]. Br J Cancer, 2003, 88(1): 63-73. |
| [16] |
BIENKOWSKA-HABA M, LUSZCZEK W, MYERS J E, et al. A new cell culture model to genetically dissect the complete human papillomavirus life cycle[J]. PLoS Pathog, 2018, 14(3): e1006846. |
| [17] |
WANG R J, PAN W, JIN L, et al. Human papillomavirus vaccine against cervical cancer: opportunity and challenge[J]. Cancer Lett, 2020, 471: 88-102. |
| [18] |
于艳芳, 魏芳. 人乳头瘤病毒致宫颈癌变机制研究进展[J]. 中国生育健康杂志, 2021, 32(3): 298-301. YU Y F, WEI F. Research progress on the mechanism of cervical carcinogenesis caused by human papillomavirus[J]. Chin J Reproduc Health, 2021, 32(3): 298-301. |
| [19] |
HOPPE-SEYLER K, BOSSLER F, BRAUN J A, et al. The HPV E6/E7 oncogenes: key factors for viral carcinogenesis and therapeutic targets[J]. Trends Microbiol, 2018, 26(2): 158-168. |
| [20] |
LUO X J, LI N M, ZHAO X, et al. DHRS2 mediates cell growth inhibition induced by Trichothecin in nasopharyngeal carcinoma[J]. J Exp Clin Cancer Res, 2019, 38(1): 300. |
| [21] |
ZHOU Y, WANG L, BAN X, et al. DHRS2 inhibits cell growth and motility in esophageal squamous cell carcinoma[J]. Oncogene, 2018, 37(8): 1086-1094. |
| [22] |
SIES H, BELOUSOV V V, CHANDEL N S, et al. Defining roles of specific reactive oxygen species (ROS) in cell biology and physiology[J]. Nat Rev Mol Cell Biol, 2022, 23(7): 499-515. |
| [23] |
CLARKE T L, MOSTOSLAVSKY R. DNA repair as a shared hallmark in cancer and ageing[J]. Mol Oncol, 2022, 16(18): 3352-3379. |
| [24] |
ZHANG Y, GUO R, WANG S S, et al. Autophagy-related proteins in genome stability: autophagy-dependent and independent actions[J]. Int J Biol Sci, 2022, 18(14): 5329-5344. |
| [25] |
BAYıR H, MAGUIRE J J, CADENAS E. Redox pioneer: professor valerian Kagan[J]. Antioxid Redox Signal, 2022, 36(13/14/15): 813-823. |
| [26] |
GABRIELLI F, TOFANELLI S. Molecular and functional evolution of human DHRS2 and DHRS4 duplicated genes[J]. Gene, 2012, 511(2): 461-469. |
| [27] |
ODA T, SEKIMOTO T, KURASHIMA K, et al. Acute HSF1 depletion induces cellular senescence through the MDM2-p53-p21 pathway in human diploid fibroblasts[J]. J Cell Sci, 2018, 131(9): jcs210724. |




