2. 730000 兰州,兰州大学第一医院麻醉科
2. Department of Anesthesiology, the First Hospital of Lanzhou University, Lanzhou University, Lanzhou, Gansu Province, 730000, China
随着现代社会高速发展,各行业科技进步日新月异。但科技的进步和工作效率的提高并没有让凯恩斯预言的“闲暇社会”如期出现,人们反而更加忙碌,这使过度劳累(过劳)成为严重的人类健康问题和社会问题。2019年WHO将“过劳”列入《国际疾病分类》,明确过劳是指由于工作时间过长、劳动强度过大、心理压力过重导致精疲力竭的亚健康状态。研究表明,过劳是引发心脑血管疾病、精神障碍等一系列直接或间接致死的危险因素[1]。
近年来,国内外过劳死案例频发,心脑血管疾病如脑出血、脑梗死、心肌梗死等被认为是过劳死的主要原因[2]。已有研究探索过劳造成的心脏、大血管损伤如心肌梗死相关病理机制[3-5]。众所周知,慢性疲劳会降低机体免疫功能,导致机体对病原体易感[6],而过劳死是慢性疲劳综合征发展、恶化的结果[7]。在成年个体中脾脏主要发挥免疫功能,同时还具有吞噬病原体和衰老细胞、滤血、储血、造血等多方面的功能[8]。研究表明,感染和心肌梗死均会诱发脾脏髓外造血[9],出现造血功能代偿性增强或病理性增生。过劳是否会诱发脾脏髓外造血,目前尚不清楚。本研究建立小鼠过劳模型,研究过劳对小鼠外周血细胞计数、脾脏病理、造血相关指标的影响,探究过劳对小鼠脾脏造血功能的影响及过劳死的相关发病机制。
1 材料与方法 1.1 主要实验试剂与仪器ELISA检测试剂盒购自武汉尤尔生商贸有限公司,兔抗间隙连接蛋白45(connexin 45,Cx45)抗体购自武汉博士德生物工程有限公司,山羊抗兔二抗购自上海萨博生物技术有限公司,PCR引物、HE染色试剂盒购自武汉赛维尔生物科技有限公司,电子天平购自梅特勒-托利多仪器有限公司,台式高速冷冻型微量离心机购自中国大龙兴创实验仪器股份公司,酶标检测仪购自美国伯腾仪器有限公司,病理切片机购自上海徕卡仪器有限公司,光学显微镜购自尼康株式会社,全自动动物血液细胞分析仪购自迈瑞医疗国际有限公司,荧光定量PCR仪购自北京东胜创新生物科技有限公司。
1.2 实验动物与分组SPF级雄性C57BL/6J小鼠18只,9周龄,体质量20~23 g,由兰州大学实验动物中心提供。采用随机数字表法将18只小鼠分为3组(n=6):对照(C)组、过劳15 d(W1)组、过劳30 d(W2)组。实验于兰州大学GLP实验室进行,实验前小鼠适应性喂养1周,饲养环境为室温(24±1) ℃、湿度45%±10%,喂食标准饲料,自由饮水。本研究经兰州大学第一医院伦理委员会批准(LDYYLL2023-401)。
1.3 过劳模型的建立每天将W1组和W2组小鼠放入水盒强迫水中站立8 h,水盒内径长41.5 cm、宽29.5 cm、高16.7 cm,水深(1±0.2) cm,水温(25±1)℃。再将小鼠装进专用束缚筒束缚3 h,结束后放回笼中,自由活动及饮食。W1组、W2组分别连续造模15、30 d,C组正常饲养,不做特殊处理。每天造模前测量每只小鼠的体质量及进食量。
1.4 取材造模完成后,小鼠采用丙泊酚腹腔注射(100 mg/kg)麻醉后摘眼球取血至EDTA抗凝管中,过量丙泊酚致小鼠安乐死,分离其心脏、脾脏,用无菌PBS缓冲液清洗,称取脾脏质量,计算脾脏指数[脾脏指数=脾脏质量/小鼠体质量(mg/g)]。部分脾脏、心脏组织置于多聚甲醛溶液中固定,其余脾脏、心脏组织置于-80 ℃保存备用。W1组动物仅观察到15 d,其余两组观察到30 d,之后取材,故结果中W1组的数据均截止到15 d。
1.5 血常规检测取血0.5 mL置于EDTA抗凝管,检测全血白细胞(white blood cell, WBC)、红细胞(red blood cell, RBC)、血小板(platelet count, PLT)数目及血红蛋白(hemoglobin, HGB)浓度。小鼠血液样品在4 ℃冰箱保存,7 d内完成检测。
1.6 HE染色行病理形态学观察取多聚甲醛溶液固定脾脏组织,PBS冲洗多聚甲醛固定液,乙醇脱水,石蜡包埋。将石蜡组织块以2 μm厚度连续切片并置于载玻片上,37 ℃培养箱过夜,然后65 ℃保持2 h,石蜡切片用水脱蜡。将切片置于苏木精染液染3~5 min,乙酸及氨水分色各数秒,流水冲洗1 h后入蒸馏水数秒。切片依次放入85%、95%的梯度酒精脱水各5 min,入伊红染液中染色5 min。无水乙醇脱水,经二甲苯使切片透明,中性树胶封片。切片置于光学显微镜下观察,采集图像进行分析。
1.7 免疫组化染色取心脏组织石蜡包埋,心肌横切面连续切片,每片厚约4 μm;60 ℃烤片过夜;脱蜡水化;微波抗原修复;冷却至室温后每张切片滴加一抗(兔抗Cx45抗体)孵育过夜,PBS洗涤脱色,滴加二抗(兔抗,HRP标记);PBS洗涤后二氨基联苯胺显色,苏木精复染细胞核,脱水与透明后封片。置于显微镜下观察,采集图像分析。
1.8 RT-qPCR检测mRNA表达根据试剂盒说明书要求,取出保存于-80 ℃的心脏、脾脏标本,提取各组小鼠心脏和脾脏组织中总RNA,对浓度过高的RNA进行适当比例的稀释,使其终浓度为200 ng/μL;配置反转录体系对RNA进行反转录,获得cDNA;而后配制RT-qPCR反应体系,于荧光定量PCR仪上完成扩增;2-ΔΔCt法对结果进行分析处理。小鼠脾脏趋化因子CXC配体12(C-X-C motif chemokin ligand 12, CXCL12)、干细胞因子(stem cell factor, SCF)、Cx45基因的引物序列见表 1。
| 基因 | 引物序列(5′→3′) | 片段大小/bp |
| SCF | ATAACCCTCAACTATGTCGCCG | 186 |
| GCATAACACGAGGTCATCCACT | ||
| CXCL12 | AGTGACGGTAAACCAGTCAGCC | 116 |
| AGGGCACAGTTTGGAGTGTTGA | ||
| Cx45 | AGCTCGGAGCAAACCCTATG | 172 |
| AATTCGTCGTCGGCCATCAT |
1.9 ELISA定量检测
将脾脏组织充分研磨、离心,取上清液。加样(标准品及样本)100 μL,37 ℃孵育1 h;吸弃,加检测溶液A 100 μL,37 ℃孵育1 h;洗板3次;加检测溶液B 100 μL,37 ℃孵育30 min;洗板5次;加TMB底物90 μL,37 ℃孵育10~20 min;每孔加入50 μL终止液,使用酶标仪在450 nm波长测定光密度值,并通过标准曲线测定各组样品中SCF、CXCL12浓度。
1.10 统计学分析选用SPSS 26.0统计软件对实验数据进行分析,将所有数据进行正态性检验,满足正态分布的计量资料数据以x±s表示。小鼠体质量与进食量同一组内采用成对样本t检验;体质量、进食量、脾脏指数、血常规、PCR、ELISA、免疫组化计量资料组间比较采用ANOVA单因素方差分析,进一步两两比较采用Bonferroni检验校准,P<0.05为差异有统计学意义。
2 结果 2.1 小鼠一般情况、体质量、进食量及脾脏指数比较与C组相比,W1组、W2组小鼠处理后皮毛灰暗欠光泽,活跃程度先增加后下降,全身毛发随着造模时间的增加逐渐出现浸湿现象,扎堆,精神状态变差。
小鼠体质量组内比较:C组第5、10、15、20、25、30天体质量高于第0天,差异具有统计学意义(P均<0.05),W1、W2组内比较差异无统计意义(P均>0.05)。W1、W2组第5、10、15、20、25、30天的体质量与C组比较差异均无统计学意义(P均>0.05),见表 2。
| 时间 | C组 | W1组 | W2组 |
| 第0天 | 21.63±1.38 | 22.05±0.49 | 23.78±1.32b |
| 第5天 | 22.80±1.79a | 22.73±0.41a | 23.68±1.09 |
| 第10天 | 23.20±1.43a | 22.43±0.76a | 23.25±0.86 |
| 第15天 | 23.50±1.22a | 22.27±0.66 | 23.52±1.22 |
| 第20天 | 22.97±1.50a | - | 23.48±1.18 |
| 第25天 | 23.78±1.37a | - | 23.42±0.93 |
| 第30天 | 23.37±1.63a | - | 23.90±0.82 |
| a:P<0.05,与本组第0天比较;b:P<0.05,与C组同一时间点比较 | |||
小鼠进食量:与第0天比较,C组、W2组第5、10、15、20、25、30天和W1组第5、10天进食量差异无统计学意义(P均>0.05)。W1组第15天,W2组第0、15、25天的进食量明显高于C组,差异具有统计学意义(P均<0.05),见表 3。
| 时间 | C组 | W1组 | W2组 |
| 第0天 | 3.15±0.33 | 3.23±0.26 | 3.59±0.16b |
| 第5天 | 2.83±0.30 | 3.15±0.57 | 3.40±0.55 |
| 第10天 | 2.90±0.20 | 3.18±0.35 | 3.21±0.24 |
| 第15天 | 2.84±0.43 | 3.58±0.33ab | 3.37±0.20b |
| 第20天 | 2.89±0.19 | - | 3.34±0.48 |
| 第25天 | 3.02±0.20 | - | 3.42±0.22b |
| 第30天 | 3.17±0.21 | - | 3.46±0.22 |
| a:P<0.05,与本组第0天比较;b:P<0.05,与C组同一时间点比较 | |||
与C组相比,W2组脾脏指数下降,且差异具有统计学意义(P=0.001),其余组两两对比差异均无统计学意义(P均>0.05),见图 1。
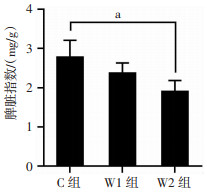
|
| a: P<0.05 图 1 各组小鼠脾脏指数 |
2.2 血常规检测
各组小鼠白细胞、红细胞、血红蛋白和血小板结果见表 4。与C组相比,W2组白细胞、红细胞数目,HGB浓度升高(P<0.05),其余组两两比较差异无统计学意义(P均>0.05);W1组、W2组PLT数目明显增加(P均<0.05),W1组与W2组相比差异无统计学意义(P>0.05)。
| 组别 | RBC/(1012/L) | WBC/(109/L) | PLT/(109/L) | HGB/(g/L) |
| C组 | 8.95±0.55 | 7.08±2.01 | 489.33±273.57 | 139.33±10.39 |
| W1组 | 10.29±0.48 | 8.33±1.50 | 939.00±336.34a | 154.17±8.16 |
| W2组 | 11.09±1.70a | 9.60±0.89a | 874.83±97.04a | 167.00±19.89a |
| a:P<0.05,与C组比较 | ||||
2.3 HE染色分析
小鼠脾脏病理切片见图 2,与C组和W1组相比,W2组小鼠脾脏HE染色红髓与白髓分界欠清,红髓比例增大。
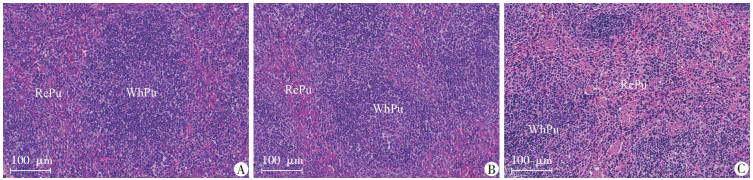
|
|
WhPu:白髓;RePu:红髓 A:C组;B:W1组;C:W2组 图 2 各组小鼠脾脏病理学变化 |
2.4 Cx45、SCF、CXCL12基因表达水平
RT-qPCR检测各组小鼠心脏组织中Cx45,脾脏组织中SCF、CXCL12的mRNA表达水平(表 5),与C组相比,W2组心脏组织中Cx45表达明显增加(P<0.05),其余各组两两比较差异无统计学意义(P均>0.05);W2组SCF表达较C组及W1组明显增加(P<0.05),其余组间比较差异无统计学意义(P>0.05);3组小鼠CXCL12的表达差异无统计学意义(P均>0.05)。
| 组别 | Cx45 | SCF | CXCL12 |
| C组 | 1.02±0.22 | 1.04±0.35 | 1.01±0.15 |
| W1组 | 1.29±0.18 | 1.44±0.52 b | 1.02±0.09 |
| W2组 | 1.78±0.17a | 2.57±0.23a | 0.89±0.07 |
| a:P<0.05,与C组比较;b:P<0.05,与W2组比较 | |||
2.5 免疫组织化学法定量分析心脏Cx45蛋白表达
W1组、W2组黄棕色颗粒增多。使用Image J软件对图像进行测量分析,用平均光密度值表示Cx45蛋白含量,结果示:W1组和W2组小鼠心尖的Cx45蛋白含量明显高于C组(P<0.05),W1组与W2组间差异无统计学意义(P>0.05,图 3、4)。
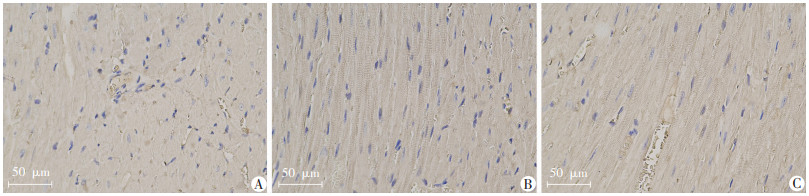
|
| A:C组;B:W1组;C:W2组 图 3 免疫组化检测各组小鼠心肌组织中Cx45蛋白含量 |
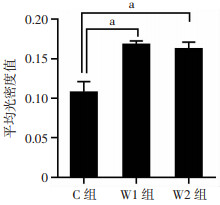
|
| a: P<0.05 图 4 各组小鼠心肌组织中Cx45蛋白含量分析 |
2.6 ELISA检测SCF、CXCL12表达
W2组脾脏组织中SCF蛋白表达量较C组及W1组明显增加(P<0.05),W1组较C组SCF蛋白表达增加,但差异无统计学意义(P>0.05);3组小鼠脾脏组织中CXCL12的蛋白表达组间两两比较差异均无统计学意义(P均>0.05,表 6)。
| 组别 | SCF | CXCL12 |
| C组 | 162.67±54.18 | 1 145.61±320.49 |
| W1组 | 193.47±17.60 | 1 255.35±140.84 |
| W2组 | 378.56±7.83ab | 1 397.57±116.27 |
| a:P<0.05,与C组比较;b:P<0.05,与W1组比较 | ||
3 讨论 3.1 过劳可破坏心肌细胞间的紧密连接
过劳是指工作时间过长、劳动强度过大、心理压力过重导致精疲力竭的亚健康状态。本实验参考疲劳型亚健康小鼠模型的建立方法[10],选用强迫水中站立结合束缚实验建立过劳模型,实现在生理和心理方面对小鼠双重负荷干预,构建了重复性较高且符合人类过劳特点的动物模型。
Cx45是心肌细胞间的一种缝隙连接蛋白,介导了动作电位在心肌细胞间的传播,是心脏电信号的主要通道[11]。已观察到在心肌梗死和终末期心力衰竭后,心肌Cx45蛋白水平的增加[12]。有研究证明,过劳后大鼠心肌Cx45的表达增加[5],同样,在小鼠发生心肌梗死时,也检测到心脏Cx45蛋白上调[13]。本研究未采用以往过劳模型中的负重力竭游泳实验法,而是通过强迫水中站立结合束缚实验造模,旨在避免实验动物因负重力竭游泳而呛水感染对实验结果的干扰。为了验证过劳模型的有效性,本实验通过RT-qPCR和免疫组化检测了心脏Cx45 mRNA及蛋白的表达,结果显示:过劳小鼠心脏Cx45 mRNA及蛋白的表达量显著增加,与已往过劳研究结果一致[5]。本实验小鼠一般情况显示:过劳小鼠精神倦怠、活动量下降、扎堆、全身皮毛随着造模时间的增加逐渐出现浸湿、灰暗欠光泽的现象。小鼠进食量测量结果表明,过劳小鼠进食量明显较高,但小鼠体质量结果显示仅对照小鼠体质量随喂养时间增加而增加,过劳小鼠体质量并无明显增长。综上,说明本实验过劳模型建立有效。
3.2 过劳使脾脏合成的SCF增加诱发脾脏髓外造血干细胞因子(stem cell factor, SCF),又称Kitl,它主要是作为配体通过与c-kit结合而发挥生物学作用,对造血干细胞(hematopoietic stem cell, HSC)等多种组织细胞具有广泛的生物学活性,是维持HSC、c-kit+祖细胞以及红系发育所必需的生长因子,成年小鼠脾脏红髓区血窦周围内皮细胞及间质细胞会合成SCF[14]。脾脏为成体小鼠造血的次级器官,在生理状态稳定的情况下,SCF对小鼠脾脏造血功能无明显影响,而在骨髓纤维化、贫血、怀孕、感染和心肌梗死等应激条件下,SCF表达水平升高,进一步会诱发脾脏髓外造血。所以,SCF水平升高可作为脾脏造血活跃的标志。本实验结果显示:过劳小鼠脾脏SCF在基因和蛋白水平均显著升高,说明过劳使脾脏合成的SCF增加,诱发了脾脏造血。
CXCL12属于趋化因子家族,是许多细胞系统包括造血系统的主要调节因子,与其配体CXCR4特异性结合发挥作用。INRA等[15]研究表明,在怀孕、失血等诱导的小鼠髓外造血中,CXCL12表达显著增加。本实验中过劳小鼠脾脏中CXCL12基因和蛋白表达量无明显变化,其原因可能是过劳造成的损伤比较轻微,未达到与怀孕、失血等类似的损伤程度,尚不足以引起脾脏CXCL12的显著变化。
3.3 过劳诱发脾脏髓外造血使全血细胞数目过度增加形成血液高凝状态血常规检测结果示:过劳能增加小鼠外周血中WBC、RBC、PLT数目,升高HGB浓度,并于30 d后超过正常值高限,表明过劳使小鼠全血细胞数目过度增加。小鼠脾脏HE染色结果表明,过劳小鼠脾脏造血区域红髓区比例增大,而红髓区是脾脏发挥造血功能的主要区域,说明过劳可能通过应激反应诱发小鼠脾脏髓外造血。髓外造血是通常被定义为在骨髓外产生成熟的红系和髓系祖细胞,这种情况几乎发生在任何导致骨髓渗透或无效造血的疾病中,是多种疾病的病理状态,髓外造血是否需要治疗或者能否作为疾病预后的标志并未明确[16]。
OTSUI等[17]研究表明,过度劳累会缩短闭塞性血栓形成时间,从而加速血栓形成,但其机制仍有待阐明,长时间(≥每周55 h)工作者比标准时间(每周35~40 h)工作者卒中的风险更高[18]。结合本实验研究结果,过劳会造成脾脏髓外造血,使全血细胞增加,特别是过劳15 d即可显著升高外周血血小板计数,促进形成血液高凝状态,可能是上述研究中诱发血栓性疾病的根本原因。
本实验的局限性在于只研究了过劳15、30 d的全血细胞及相关造血因子的变化,未对更严重的过劳进行研究。但过劳至过劳死是一个慢性的疾病发展过程,在过劳30 d之后,小鼠脾脏造血功能变化还有待进一步探索。
综上所述,过劳可破坏心肌细胞间的紧密连接,增强脾脏造血功能,使全血细胞数目特别是血小板数目过度增加,形成血液高凝状态,这可能是过劳死相关心血管疾病的诱发因素之一。
| [1] |
KIM I, KOO M J, LEE H E, et al. Overwork-related disorders and recent improvement of national policy in South Korea[J]. J Occup Health, 2019, 61(4): 288-296. |
| [2] |
MIAO Q, LI J, PAN Y P, et al. Three cases of karoshi without the typical pathomorphological features of cardiovascular/cerebrovascular disease[J]. Am J Forensic Med Pathol, 2020, 41(4): 305-308. |
| [3] |
陈苏衡, 甘露, 庄苗, 等. 过度劳累对大鼠动脉血管壁细胞外基质的影响[J]. 中国医学科学院学报, 2022, 44(2): 262-269. CHEN S H, GAN L, ZHUANG M, et al. Overwork affects extracellular matrix of arterial vessel wall in rats[J]. Acta Acad Med Sin, 2022, 44(2): 262-269. |
| [4] |
甘露, 陈苏衡, 庄苗, 等. 不同程度的过劳对大鼠动脉血管平滑肌细胞的影响[J]. 陆军军医大学学报, 2022(5): 461-468. GAN L, CHEN S H, ZHUANG M, et al. Effects of different levels of overworking on rat arterial smooth muscle cells[J]. J Army Med Univ, 2022(5): 461-468. |
| [5] |
杨博帆, 史婧卓, 李晶, 等. 大鼠过劳模型心脏Cx43和Cx45的表达[J]. 法医学杂志, 2019, 35(5): 567-571. YANG B F, SHI J Z, LI J, et al. Expression of Cx43 and Cx45 in cardiomyocytes of an overworked rat model[J]. Fa Yi Xue Za Zhi, 2019, 35(5): 567-571. |
| [6] |
FLUGE Ø, TRONSTAD K J, MELLA O. Pathomechanisms and possible interventions in myalgic encephalomyelitis/chronic fatigue syndrome (ME/CFS)[J]. J Clin Invest, 2021, 131(14): 150377. |
| [7] |
杨菊贤, 卓杨. 过劳死的发生和预防[J]. 中国行为医学科学, 2006(07): 577-579. YANG J X, ZHUO Y. The occurrence and prevention of Karoshi[J]. Chin J Behav Med Sci, 2006(07): 577-579. |
| [8] |
MEBIUS R E, KRAAL G. Structure and function of the spleen[J]. Nat Rev Immunol, 2005, 5(8): 606-616. |
| [9] |
吕慧珍, 艾玎. 心肌梗死后造血系统的变化[J]. 自然杂志, 2022, 44(2): 96-102. LYU H Z, AI D. Changes in hematopoietic system after myocardial infarction[J]. Chin J Nat, 2022, 44(2): 96-102. |
| [10] |
刘艳艳, 程静茹, 余克强, 等. 疲劳型亚健康小鼠模型的研制[J]. 广东医学, 2012, 33(1): 21-24. LIU Y Y, CHENG J R, YU K Q, et al. Construction of fatigue-type sub-health mouse model[J]. Guangdong Med J, 2012, 33(1): 21-24. |
| [11] |
MACIUNAS K, SNIPAS M, KRAUJALIS T, et al. The role of the Cx43/Cx45 gap junction voltage gating on wave propagation and arrhythmogenic activity in cardiac tissue[J]. Sci Rep, 2023, 13: 14863. |
| [12] |
KOPANIC J, AL-MUGOTIR M, KIEKEN F, et al. Characterization of the Connexin45 carboxyl-terminal domain structure and interactions with molecular partners[J]. Biophys J, 2014, 106(10): 2184-2195. |
| [13] |
LI J Y, KE H H, HE Y, et al. Transplantation of mesenchymal stem cells modulated Cx43 and Cx45 expression in rats with myocardial infarction[J]. Cytotechnology, 2018, 70(1): 225-234. |
| [14] |
COMAZZETTO S, MURPHY M M, BERTO S, et al. Restricted hematopoietic progenitors and erythropoiesis require SCF from leptin receptor+ niche cells in the bone marrow[J]. Cell Stem Cell, 2019, 24(3): 477-486. |
| [15] |
INRA C N, ZHOU B O, ACAR M, et al. A perisinusoidal niche for extramedullary haematopoiesis in the spleen[J]. Nature, 2015, 527(7579): 466-471. |
| [16] |
CHERNAK B J, RAMPAL R K. Chapter Three—Extramedullary hematopoiesis in myeloproliferative neoplasms: Pathophysiology and treatment strategies. International Review of Cell and Molecular Biology: volume 365[M]. United States: Academic Press, 2021: 97-116.
|
| [17] |
OTSUI K, YAMAMOTO J, INOUE N. Overwork accelerates thrombotic reaction: implications for the pathogenesis of karoshi[J]. J Thromb Thrombolysis, 2018, 45(2): 222-224. |
| [18] |
KIVIMÄKI M, JOKELA M, NYBERG S T, et al. Long working hours and risk of coronary heart disease and stroke: a systematic review and meta-analysis of published and unpublished data for 603 838 individuals[J]. Lancet, 2015, 386(10005): 1739-1746. |




