2. 857000 西藏自治区 日喀则,陆军第九五三医院检验病理科;
3. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院:神经外科;
4. 400039 重庆,金凤实验室,渝粤病理科学研究中心
2. Department of Laboratory and Pathology, No. 953 Hospital of PLA Army, Shigatse, Xizang Autonomous Region, 857000;
3. Department of Neurosurgery, First Affiliated Hospital, Army Medical University(Third Military Medical University), Chongqing, 400038;
4. Yu-Yue Pathology Scientific Research Center, Jinfeng Laboratory, Chongqing, 400039, China
胶质瘤是中枢神经系统最常见的原发恶性肿瘤,起病隐匿。最大安全范围的手术切除联合术后同步放疗和化疗是胶质瘤的标准治疗方案。尽管如此,胶质瘤患者的中位生存期仅为14~16个月,5年生存率低于5%[1]。胶质瘤细胞快速增殖、高度侵袭和抵抗治疗是导致患者预后差的重要原因。越来越多的研究已证实,胶质瘤细胞具有高度异质性,细胞分化程度存在差异。胶质瘤干细胞(glioma stem cells, GSCs)是一群具有干细胞表型特征(干性特征)的细胞亚群,表现为更强的自我更新、多向分化和成瘤特性。与分化的胶质瘤细胞相比,GSCs数量虽少,却是始动肿瘤发生和促进治疗后肿瘤复发的“种子”细胞。GSCs选择性高表达特定干性标志物,可用于GSCs特异性识别、鉴定和分选[2-3]。此外,GSCs干性特征的维持高度依赖微环境中各类细胞因子介导的干性通路活化[4]。高效阻断GSCs生存所需的旁分泌通路,有望特异性抑制GSCs干性通路激活而清除GSCs,具有重要的治疗转化价值。
蛋白酪氨酸磷酸酶受体Z 1型(protein tyrosine phosphatase receptor-type Z polypeptide 1, PTPRZ 1)是一种跨膜受体蛋白酪氨酸磷酸酶,具有磷酸水解酶功能。PTPRZ 1由碳酸酐酶结构域、纤维连接蛋白Ⅲ结构域、跨膜区、磷酸水解酶功能区组成。前期课题组研究发现,PTPRZ 1是GSCs特异性标记物,特异性高表达于GSCs,能被肿瘤微环境中其他细胞分泌的多效生长因子(pleiotrophin, PTN)激活,形成PTN-PTPRZ 1旁分泌通路,促进GSCs干性表型[5-6]。PTN可与PTPRZ 1的糖胺聚糖结构通过配受体作用而结合,PTN介导的PTPRZ 1二聚化导致PTPRZ 1磷酸酶活性抑制,激活下游酪氨酸激酶通路,进而调控细胞多种生物学功能。然而,目前尚缺乏可靶向阻断PTN-PTPRZ 1的抗体,限制了GSCs靶向治疗策略的研发。本研究研发可特异性结合PTPRZ 1并有效阻断其功能活性的抗体,或可靶向抑制GSCs介导的GBM生长和演进,对提高患者生存期具有重要临床意义。
1 材料与方法 1.1 细胞、质粒、菌株和实验动物HEK293来源于中国科学院细胞库。SgRNA-PTPRZ 1慢病毒由本实验室前期构建。胶质瘤干细胞来源于本院神经外科接受手术治疗、病理诊断为胶质瘤(WHO 4级)的脑肿瘤组织样本。雌性BALB/c和免疫缺陷小鼠各5只,8~10周龄,体质量20~23 g,购自北京维通利华生物科技有限公司,饲养于SPF房间,生活环境为12 h黑夜和12 h白天,室温22~25 ℃。本研究获得本院伦理委员会批准(KY2022138)。
1.2 主要试剂木瓜蛋白酶解离试剂盒购自美国Worthington公司;DMEM培养基、胎牛血清、神经干细胞专用培养基Neurobasal medium和B27补充剂购自美国Gibco公司;CD15抗体购自美国BD Biosciences公司;CD133抗体购自德国Miltenyi公司;木瓜蛋白酶购自美国Millipore公司;表皮生长因子和碱性成纤维细胞生长因子购自美国PeproTech公司;PTN购自北京义翘神州公司;P44/42 MAPK(ERK1/2)、p-P44/42 MAPK(ERK1/2)、GAPDH一抗和IgG(H+L)二抗购自德国Cell Signaling公司;RNA提取试剂盒购自上海飞捷公司;反转录试剂盒和TB Green Premix Ex Taq Ⅱ购自日本TaKaRa公司; PBS购自北京中杉金桥;5%脱脂奶粉购自武汉博士德公司;BCA蛋白浓度测定试剂盒和ECL化学发光底物购自美国Pierce公司;PVDF膜和SDS-PAGE配胶试剂盒购自美国BIO-RAD公司;Transwell小室购自美国FALCON公司;Matrigel购自美国BD biocoat公司;结晶紫购自上海碧云天公司;4%组织固定液、HEPES和甘氨酸购自北京索莱宝公司;SBA Clonotyping System-HRP试剂盒购自美国Southern Biothech公司。
1.3 实验方法 1.3.1 GSCs培养取新鲜胶质瘤组织样本,使用木瓜蛋白酶解离试剂盒对肿瘤组织进行处理,获得单个细胞。用异硫氰酸荧光素(fluorescein isothiocyanate, FITC)缀合的抗人CD15抗体和别藻青蛋白(allophycocyanin,APC) 缀合的抗人CD133抗体在4 ℃避光孵育30 min后,用BD FAcsARriaⅡ流式细胞仪分离GSCs(CD15+/CD133+)。将分选的GSCs种植在免疫缺陷小鼠颅内,待成瘤后收取肿瘤,消化后继续体内传代。在需要体外细胞实验检测时,在干细胞专用培养基中培养。干细胞专用培养基以NeurobasalTM无酚红培养基作为基础成分,再加入B27补充剂、表皮生长因子(10 ng/mL) 和碱性成纤维细胞生长因子(10 ng/mL),培养6 h后可用于细胞实验。
1.3.2 抗体制备 1.3.2.1 鼠抗PTPRZ 1抗体的制备将人PTPRZ 1基因(UniProtKBP23471)的氨基酸26~300的区域克隆至真核表达载体pSIN-EF-1α-puro获得真核表达质粒。将表达质粒转染HEK293细胞后培养5 d,以2 000×g离心5 min, 收集细胞上清。通过镍柱纯化和阴离子交换纯化得到重组的PTPRZ 1蛋白。将弗氏完全佐剂与重组PTPRZ 1蛋白按等体积混合并乳化,对BALB/c小鼠进行免疫。2周以后通过尾静脉采血,离心收集上清,并用ELISA检测血清效价。筛选高效价抗体进行B细胞融合及阳性杂交瘤细胞的筛选,筛选后进行抗体纯化及抗体亚型鉴定,采用SBA Clonotyping System-HRP试剂盒,按照说明书的操作鉴定单克隆抗体重链和轻链的亚型。
1.3.2.2 亲和力测定使用HEPES运行缓冲液将配体及分析物稀释至所需浓度。将配体及分析物装入EP管,置于试剂架上;将再生液10 mmol/L甘氨酸(pH=1.7)装入EP管,置于试剂架上。将试剂架放入Biacore T200样品仓,打开亲和力测定程序,芯片流路选择“2-1、3-1、4-1”通道,采用多循环动力学方法(设置参数:捕获通道2/3/4,流速10 μL/min,捕获45 s;分析物1、2、3、4通道,流速30 μL/min,进样120 s,解离900 s;再生液流速30 μL/min,再生时间90 s)。芯片仓与样品仓温度选择25 ℃,测定分析物与配体亲和力。
1.3.3 构建PTPRZ 1敲除细胞将GSCs消化后接种到6孔培养板中,用干细胞培养基培养4 h,条件37 ℃恒温,5%CO2加入sgRNA-PTPRZ 1慢病毒感染48 h,通过BD FAcsARriaⅡ流式细胞仪分选阳性细胞。
1.3.4 RT-qPCR使用RNA提取试剂盒, 按照说明书要求从细胞中提取总RNA,然后使用反转录试剂盒,将0.5 μg RNA逆转录为cDNA,利用TB Green Premix Ex Taq Ⅱ进行实时荧光定量PCR,每组设4个复孔。mRNA相对表达量使用2-△△Ct方法计算。
1.3.5 Western blot对GSCs进行饥饿处理过夜,第2天使用1 μg/mL鼠抗PTPRZ 1抗体(2F10)与GSCs共孵育1 h封闭其表达PTPRZ 1受体位点,再加入10 ng/mL人重组PTN蛋白刺激20 min后收集细胞,提取全蛋白,各组蛋白使用BCA蛋白浓度测定试剂盒定量后进行SDS-PAGE电泳,250 mA恒流转膜120 min。5%脱脂奶粉室温封闭1 h,用PBST轻柔洗去封闭液,加入抗体稀释液稀释的一抗溶液,4 ℃过夜震荡孵育。第2天PBST室温漂洗3次,每次5 min,二抗室温震荡孵育60 min;将PVDF膜用PBST室温震荡洗3次,每次5 min;用ECL化学发光底物进行显影。
1.3.6 成球率实验收集GSCs,细胞消化后计数并调整细胞数至4×102个/mL,96孔板每孔加入细胞悬液100 μL,对应加入10 ng/mL重组人PTN、1 μg/mL鼠抗PTPRZ 1抗体(2F10),每组细胞设置24个复孔,37 ℃培养。每隔3 d,每孔加入新鲜培养基50 μL。15 d后观察细胞克隆形成情况(超过50个细胞的细胞球被纳入统计),并拍照记录。成球率=形成的细胞球÷接种细胞数×100%。
1.3.7 细胞迁移实验消化对数生长期GSCs,终止消化后离心弃去培养液,用培养基重悬。调整细胞数至1×105/mL。取200 μL细胞到1.5 mL EP管中,对应加入10 ng/mL人重组PTN、1 μg/mL鼠抗PTPRZ 1抗体(2F10)。取上述细胞悬液200 μL加入Transwell小室上室中,下室加入600 μL含2% FBS的DMEM培养基。放入二氧化碳培养箱中,培养8 h。取出Transwell小室,PBS洗3次,4%组织固定液室温固定15 min,结晶紫染色20 min,ddH2O洗3次。用棉签擦去Transwell上室内的细胞,37 ℃晾干后拍照。
1.3.8 细胞侵袭实验Matrigel与DMEM培养基进行1 ∶1稀释,吸取稀释液均匀涂抹在Transwell小室底部膜的上室面,37 ℃晾干。消化细胞,用干细胞培养基重悬,调整细胞数至1×105/mL。取200 μL细胞到1.5 mL EP管中,对应加入10 ng/mL人重组PTN、1 μg/mL鼠抗PTPRZ 1抗体(2F10)。取上述细胞悬液200 μL加入Transwell小室上室中,下室加入600 μL含2% FBS的DMEM培养基,37 ℃培养24 h。取出Transwell小室,PBS洗3次,4%组织固定液室温固定15 min,结晶紫染色20 min,ddH2O洗3次。用棉签擦去Transwell上室内的细胞,37 ℃晾干后拍照。
1.4 统计学分析使用GraphPadPrism9.0软件进行统计及绘图。3次重复进行的实验数据以x±s表示。两组之间比较采用t检验。P<0.05表示差异具有统计学意义。
2 结果 2.1 获得PTPRZ 1抗体并成功筛选亲和力最强克隆株针对PTPRZ 1的胞外段结构域,构建载体并合成重组蛋白,对纯化的PTPRZ 1蛋白进行电泳检测。共进行了2个批次的纯化,电泳完成后使用考马斯亮蓝染色液对蛋白胶进行染色,如图 1所示。获得的高纯度PTPRZ 1蛋白用于后续实验。使用该蛋白免疫BALB/c小鼠,采用未免疫的雌性BALB/c小鼠制备饲养细胞,成功制备5株PTPRZ 1抗体。利用SPR亲和力测定实验检测上述5株PTPRZ 1抗体的亲和力,如表 1所示,上述5株PTPRZ 1的解离常数(KD)范围为3.31×10-8~5.31×10-8;其中,克隆株2F10的鼠抗PTPRZ 1抗体KD值最低,提示此株抗体的亲和力最强。据此,本研究使用该株抗体用于后续细胞水平的功能实验。
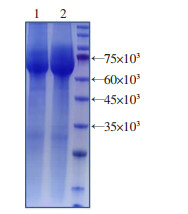
|
| 1:第1批次的PTPRZ 1片段; 2:第2批次的PTPRZ 1片段 图 1 纯化后PTPRZ 1蛋白电泳结果 |
| 克隆号 | KD/(mol/L) |
| 2F10 | 3.31×10-8 |
| 17D9 | 3.70×10-8 |
| 21G5 | 3.78×10-8 |
| 3G5 | 4.56×10-8 |
| 6D5 | 5.31×10-8 |
2.2 鼠抗PTPRZ 1抗体(2F10)特异性识别胶质瘤干细胞和胶质瘤肿瘤组织中PTPRZ 1蛋白
构建CRISPR-Cas9敲除PTPRZ 1的胶质瘤干细胞模型,检测上述鼠抗PTPRZ 1抗体(2F10)能否用于识别并检测GSCs中PTPRZ 1的表达。利用CRISPR-Cas9系统检测敲除胶质瘤干细胞中PTPRZ 1基因mRNA表达,差异具有统计学意义(P<0.01,图 2A)。鼠抗PTPRZ 1抗体(2F10)能够用于Western blot实验,检测到对照组胶质瘤干细胞中PTPRZ 1表达,条带所示蛋白大小与PTPRZ 1蛋白大小一致,条带单一,CRISPR-Cas9介导的PTPRZ 1敲除细胞中检测不到PTPRZ 1蛋白表达,且无非特异性条带(图 2B)。结果提示,上述鼠抗PTPRZ 1抗体(2F10)可识别胶质瘤干细胞中PTPRZ 1蛋白的表达,并可用于Western blot检测。

|
| A: PTPRZ 1敲除后mRNA表达水平变化情况 a:P<0.01,与对照组比较; B: PTPRZ 1敲除后蛋白表达情况 1:对照组;2:PTPRZ 1-KO组 图 2 RT-qPCR及Western blot检测PTPRZ 1在胶质瘤干细胞的表达情况 |
2.3 抗PTPRZ 1抗体有效抑制胶质瘤干细胞内PTPRZ 1下游细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)通路活化
为了检测鼠抗PTPRZ 1抗体(2F10)是否能阻断PTN介导的PTPRZ 1信号通路活化,检测PTN处理联合鼠抗PTPRZ 1抗体(2F10)封闭对GSCs内ERK信号通路活化的影响。如图 3所示,人重组PTN蛋白处理组GSCs内ERK磷酸化水平显著增高,人重组PTN蛋白活化联合鼠抗PTPRZ 1抗体(2F10)处理组GSCs内ERK磷酸化水平显著受到抑制,提示鼠抗PTPRZ 1抗体(2F10)能有效阻断PTN介导下游ERK信号通路活化。

|
| 1:对照组;2:人重组PTN蛋白处理组;3:鼠抗PTPRZ 1抗体(2F10)处理组;4:人重组PTN蛋白+鼠抗PTPRZ 1抗体(2F10)处理组 图 3 Western blot检测ERK信号通路活化 |
2.4 抗PTPRZ 1抗体可有效抑制PTN对GSCs自我更新的促进作用
为了阐明鼠抗PTPRZ 1抗体(2F10)介导的PTN-PTPRZ 1阻断效应对GSCs生物行为的影响,通过成球率实验检测GSCs的自我更新能力。如图 4A所示,人PTN重组蛋白显著促进GSCs成球能力,GSCs成球数量和成球大小较对照组显著增加,人PTN重组蛋白活化联合鼠抗PTPRZ 1抗体(2F10)处理组GSCs成球数量和成球大小被有效回复,差异具有统计学意义(P<0.01,图 4B)。以上结果提示鼠抗PTPRZ 1抗体(2F10)能有效抑制PTN对GSCs自我更新的促进作用。
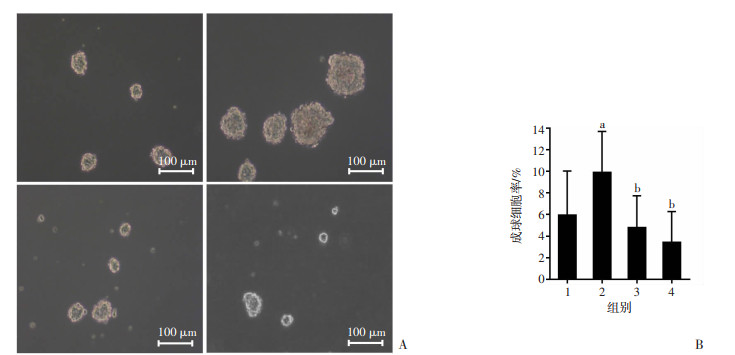
|
| A: 成球实验检测重组人PTN和鼠抗PTPRZ 1抗体(2F10)对胶质瘤干细胞自我更新的影响;B:各组成球细胞率统计分析 1:对照组;2:人重组PTN蛋白处理组;3:鼠抗PTPRZ 1抗体(2F10)处理组;4:人重组PTN蛋白+鼠抗PTPRZ 1抗体(2F10)处理组;a:P<0.01,与对照组比较;b:P<0.01,与人重组PTN蛋白处理组比较 图 4 成球率实验检测胶质瘤自我更新能力 |
2.5 抗PTPRZ 1抗体可有效抑制PTN对胶质瘤干细胞迁移和侵袭的促进作用
进一步检测鼠抗PTPRZ 1抗体(2F10)对GSCs迁移和侵袭的影响。Transwell迁移实验结果显示,加入人重组PTN蛋白处理组穿膜数明显多于对照组(P<0.01);而加入人重组PTN蛋白+鼠抗PTPRZ 1抗体(2F10)处理组的穿膜数明显少于人重组PTN蛋白处理组(P<0.01,图 5A、B)。侵袭实验结果显示,加入人重组PTN蛋白处理组穿膜数明显多于对照组(P<0.05);而加入人重组PTN蛋白+鼠抗PTPRZ 1抗体(2F10)处理组的穿膜数明显少于人重组PTN蛋白处理组(P<0.01,图 5C、D)。以上结果表明鼠抗PTPRZ 1抗体(2F10)显著抑制PTN-PTPRZ 1信号轴对GSC迁移及侵袭能力的促进作用。
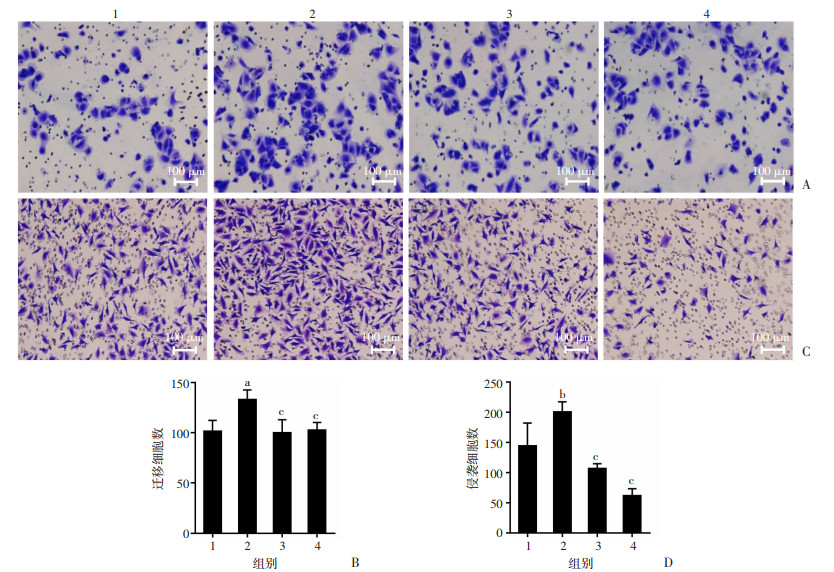
|
| A:Transwell迁移实验检测PTN和鼠抗PTPRZ 1抗体(2F10)处理胶质瘤干细胞的影响;B:各组迁移细胞数量的统计分析;C:Transwell侵袭实验检测PTN和鼠抗PTPRZ 1抗体(2F10)处理胶质瘤干细胞侵袭的影响;D:各组侵袭细胞数量的统计分析(n=4) 1:对照组;2:人重组PTN蛋白处理组;3:鼠抗PTPRZ 1抗体(2F10)处理组;4:人重组PTN蛋白+鼠抗PTPRZ 1抗体(2F10)处理组;a:P<0.01,b:P<0.05,与对照组比较;c: P<0.01,与人重组PTN蛋白处理组比较 图 5 Transwell实验检测胶质瘤干细胞迁移能力和侵袭能力 |
3 讨论
具有始动肿瘤生长和促进治疗抵抗能力的肿瘤干细胞是血液肿瘤和实体肿瘤发生和演进的重要种子细胞。大量研究证实,除胶质瘤外,肿瘤干细胞在多种实体肿瘤内存在,广泛调控包括肿瘤生长与休眠、侵袭与转移、血管生成与塑造、免疫逃逸与免疫抑制等多种恶性生物学行为[7-8]。利用肿瘤干细胞特异性高表达的标记分子特异性识别和分离该亚群细胞,已用于肿瘤干细胞的表型鉴定、功能评价、临床诊断和预后评价[9-10]。我们前期研究中已证实,PTPRZ 1是胶质瘤干细胞特异性功能标记分子[11]。相较于PTPRZ 1阴性或低表达的胶质瘤细胞,高表达PTPRZ 1的胶质瘤干细胞具有更强的始动成瘤能力和自我更新能力。此外,在乳腺癌等肿瘤中,高表达PTPRZ 1与患者预后不良相关[12]。在此基础上,本研究针对PTPRZ 1蛋白结构设计并成功制备出具有高亲和力的抗PTPRZ 1抗体,能特异性识别表达PTPRZ 1的胶质瘤干细胞,可拓展用于检测PTPRZ 1的表达水平和分布特征,为开发基于肿瘤干细胞的分子病理诊断系统提供检测方法和实验模型。
目前,靶向肿瘤干细胞治疗尚处于临床前研发阶段。既往研究多聚焦小分子靶向抑制剂的研发,针对肿瘤干细胞内高度激活的Notch、WNT、YAP等信号通路关键分子进行靶向干预,以期达到抑制肿瘤干细胞生长的目的。然而,由于正常组织干细胞或分化肿瘤细胞内上述通路也存在一定程度的激活,上述策略难以特异性靶向杀伤对肿瘤干细胞,且存在较高的毒副作用,难以实现临床转化。本研究发现,胶质瘤干细胞的干性特征维持高度依赖微环境中PTN旁分泌激活。已有研究表明,肿瘤微环境中的肿瘤相关巨噬细胞、内皮细胞和肿瘤细胞均可大量分泌PTN[13-14]。PTN与胶质瘤干细胞上的受体PTPRZ 1结合后,能特异性激活下游磷酸激酶B(protein kinase B, AKT)和细胞外调节蛋白激酶(extracellular signal-regulated kinase, ERK)等酪氨酸激酶通路促进乳腺癌、小细胞肺癌等多种肿瘤内的肿瘤细胞生长和血管生成。同时,部分胶质瘤患者的胶质瘤干细胞PTPRZ 1与酪氨酸激酶受体间质表皮转化因子(mesenchymal epithelial transition factor, MET)基因可发生融合,持续性活化MET下游信号通路,导致胶质瘤演进和快速复发[15-16]。采用小干扰RNA干预PTPRZ 1基因表达,能在细胞和动物水平抑制移植瘤生长。尽管PTPRZ 1有望成为胶质瘤重要治疗靶标,但目前尚无有效阻断PTPRZ 1通路的治疗方法。
本研究制备的小鼠抗人PTPRZ 1的单克隆抗体,能在细胞层面有效阻断PTN-PTPRZ 1旁分泌通路活化,阻断下游ERK信号通路,进一步抑制GSCs迁移和侵袭,具有潜在治疗转化价值及临床应用前景。本课题组未来拟在动物模型中评价上述抗体能否有效通过血肿瘤屏障进而发挥瘤内阻断效应,系统评价该抗体治疗的递送效果和抗瘤效果。此外,针对本抗体进一步设计人源化抗体,并优化抗体的亲和力,是降低抗体免疫源性,实现临床转化的关键步骤,尚需进一步深入。
| [1] |
GIMPLE R C, BHARGAVA S, DIXIT D, et al. Glioblastoma stem cells: lessons from the tumor hierarchy in a lethal cancer[J]. Genes Dev, 2019, 33(11/12): 591-609. |
| [2] |
BATLLE E, CLEVERS H. Cancer stem cells revisited[J]. Nat Med, 2017, 23(10): 1124-1134. |
| [3] |
GIMPLE R C, YANG K L, HALBERT M E, et al. Brain cancer stem cells: resilience through adaptive plasticity and hierarchical heterogeneity[J]. Nat Rev Cancer, 2022, 22(9): 497-514. |
| [4] |
YANG L Q, SHI P F, ZHAO G C, et al. Targeting cancer stem cell pathways for cancer therapy[J]. Signal Transduct Target Ther, 2020, 5(1): 8. |
| [5] |
XIA Z K, OUYANG D J, LI Q Y, et al. The expression, functions, interactions and prognostic values of PTPRZ 1: a review and bioinformatic analysis[J]. J Cancer, 2019, 10(7): 1663-1674. |
| [6] |
YANG M, WANG B Y, YIN Y, et al. PTN-PTPRZ 1 signaling axis blocking mediates tumor microenvironment remodeling for enhanced glioblastoma treatment[J]. J Control Release, 2023, 353: 63-76. |
| [7] |
CLARA J A, MONGE C, YANG Y Z, et al. Targeting signalling pathways and the immune microenvironment of cancer stem cells—a clinical update[J]. Nat Rev Clin Oncol, 2020, 17(4): 204-232. |
| [8] |
BAYIK D, LATHIA J D. Cancer stem cell-immune cell crosstalk in tumour progression[J]. Nat Rev Cancer, 2021, 21(8): 526-536. |
| [9] |
LATHIA J D, MACK S C, MULKEARNS-HUBERT E E, et al. Cancer stem cells in glioblastoma[J]. Genes Dev, 2015, 29(12): 1203-1217. |
| [10] |
BISEROVA K, JAKOVLEVS A, ULJANOVS R, et al. Cancer stem cells: significance in origin, pathogenesis and treatment of glioblastoma[J]. Cells, 2021, 10(3): 621. |
| [11] |
SHI Y, PING Y F, ZHOU W C, et al. Tumour-associated macrophages secrete pleiotrophin to promote PTPRZ 1 signalling in glioblastoma stem cells for tumour growth[J]. Nat Commun, 2017, 8(1): 1-17. |
| [12] |
FU F F, XIAO X I, ZHANG T, et al. Expression of receptor protein tyrosine phosphatase ζ is a risk factor for triple negative breast cancer relapse[J]. Biomed Rep, 2016, 4(2): 167-172. |
| [13] |
WEI X, YANG S N, PU X, et al. Tumor-associated macrophages increase the proportion of cancer stem cells in lymphoma by secreting pleiotrophin[J]. Am J Transl Res, 2019, 11(10): 6393-6402. |
| [14] |
WANG X. Pleiotrophin: activity and mechanism[J]. Adv Clin Chem, 2020, 98: 51-89. |
| [15] |
CHEN B S, WANG K Y, YU S Q, et al. Whole-transcriptome sequencing profiling identifies functional and prognostic signatures in patients with PTPRZ 1-MET fusion-negative secondary glioblastoma multiforme[J]. Oncol Lett, 2020, 20(5): 1. |
| [16] |
BAO Z S, CHEN H M, YANG M Y, et al. RNA-seq of 272 gliomas revealed a novel, recurrent PTPRZ 1-MET fusion transcript in secondary glioblastomas[J]. Genome Res, 2014, 24(11): 1765-1773. |




