慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是40岁及以上人群主要的公共卫生问题之一。有学者指出,COPD是导致慢性病患者发病率和病死率上升的主要原因之一,并预计在2030年,COPD将成为全球疾病负担排名第7的疾病[1]。在老年群体中,COPD经常与慢性心力衰竭(heart failure,HF)共存,严重降低患者的生活质量,并在很大程度上增加了患者心血管疾病的病死率[2]。一项基于心脏磁共振(cardiac magnetic resonance,CMR)检查结果的队列研究发现,COPD与心肌纤维化独立相关,而心肌纤维化与主要结局(HF再住院、全因死亡)独立相关[3]。荟萃分析发现,在住院HF或慢性HF患者中,COPD可增加其全因死亡的风险[4]。COPD与HF具有相近的危险因素、病理生理过程、体征和症状,并且它们共同作为不良预后因素对患者产生协同作用。
在当前医疗背景下,对于合并COPD和HF患者的管理重点在于降低这类患者的再住院率,推荐预防要优先于治疗,及早预测HF恶化风险并即时干预相应危险因素,对于改善其预后非常重要[5]。风险预测一直以来都是指导临床决策的重要手段之一。然而,目前鲜见针对COPD合并HF患者的心衰恶化风险的预测模型相关研究。本研究旨在构建COPD患者HF恶化的风险预测模型,对高风险人群做出合乎逻辑的预测评估,以达到早期识别高危患者、改善疾病预后的目标。
1 资料与方法 1.1 一般资料本试验是一项单中心、回顾性队列研究,研究对象为2016年1月至2022年5月于本院就诊、既往确诊COPD首次因HF住院的481例患者。取患者基线时间作为观察开始时间,最长观察结束时间为2023年5月31日。应用计算机算法随机抽取总样本的约70%(345例)患者作为预测模型训练集,剩余约30%(136例)患者为测试集。本研究经陆军军医大学第一附属医院伦理委员会批准[(B)KY2022113]。
纳入标准为:①年龄≥18岁,诊断COPD,肺功能检查见:FEV1降低且FEV1/FVC < 70%(严格地吸入支气管扩张剂后);②合并诊断HF,纽约心脏协会(New York Heart Association,NYHA)心功能Ⅱ~Ⅳ级,N末端脑型利钠肽前体(N-terminal pro-B-type natriuretic peptide,NT-proBNP)高于临界值(根据临床实际情况选择临界值范围),根据左心室射血分数(left ventricular ejection fraction,LVEF)区分心力衰竭类型。排除标准为:未长期至我院就诊,不能获取真实的观察资料,就诊记录保存不完整,或变量信息缺失超过20%。
1.2 样本量估算与结局事件基于真实世界中产生的诊疗记录,采集患者就诊资料的最初时间时的特征信息,包含人口统计学信息、一般情况、合并的基础疾病、血液及尿液检验、心血管相关手术情况、心脏彩超结果、心电图结果、用药情况等在内的共计129个变量。根据预测模型常用的简化样本量估算方法——10 events per variable(10 EPV)[6],即针对所需样本量的既定经验法则是确保事件发生数为预测变量个数的10倍。结合既往预测模型研究结果,针对HF患者以Logistic回归和Cox回归为例,模型的预测因子数目一般为7~9个[7-9]。最终计算构建预测模型需要的发生事件的样本量不少于90例。
结局事件定义为:HF恶化(HF再住院或需要静脉注射治疗的HF紧急就诊)或心血管(CV)死亡,以先发生者为准。在观察结束时间前通过医疗记录、实验室检查、影像学评估或患者自报等方式评估结局事件的发生。中位及四分位观察时间为356(132,546)d,最长观察时间为2 068 d。观察期间发生结局事件患者279例(58.0%),其中死亡患者16例(3.3%),满足上述样本量需求。
1.3 统计学分析与模型构建研究数据分析应用R语言软件(版本4.3.1)进行。使用mice软件包中基于随机森林的多重插补算法,对数据集中包含的缺失数据进行填补。为降低特征维度并筛选最相关的变量,研究采用Lasso回归算法进行数据降维。数据降维前对连续型变量进行Z值标准化、多分类变量创建虚拟变量等处理。使用5折交叉验证来选择最佳的正则化参数。因研究纳入变量较多,故在对比训练集和测试集基线时变量均衡性时,仅观察Lasso回归保留的变量组间差异情况。其中非正态分布的连续资料均以M(Q1,Q3)表示,分类资料以例(百分比)表示。视变量类型应用方差分析、卡方检验或Fisher精确检验比较基线特征。以双侧的P < 0.05认为差异具有统计学意义。
以训练集数据为基础,将Lasso回归保留的变量纳入并构建Cox比例风险(Cox proportional hazards,CoxPH)模型,采用赤池信息量准则(akaike information criterion,AIC)向后法,并根据临床实际应用情况进行变量筛选和模型优化。以测试集数据为基础,计算模型总体C-index、绘制模型校准曲线和接受者操作特征(receiver operating characteristic,ROC)曲线对模型预测性能进行评价,使用决策曲线分析法(decision curve analysis,DCA)评估预测模型潜在临床价值并绘制DCA曲线。进一步进行CoxPH模型的可视化处理,模型相应的变量取消标准化处理以便于最终列线图的使用。根据模型计分情况计算阈值,并按照阈值划分结局高或低风险组,并观察2组之间的Kaplan-Meier曲线,直观地展示不同组别之间的生存差异,使用Log-rank检验分析高、低风险组间差异情况。
2 结果 2.1 正则化数据降维和基线资料Lasso回归通过添加L1正则化项来推动部分特征的系数变为0,从而实现特征降维和选择(图 1)。最终保留了15个具有较大系数的变量作为最相关的特征。
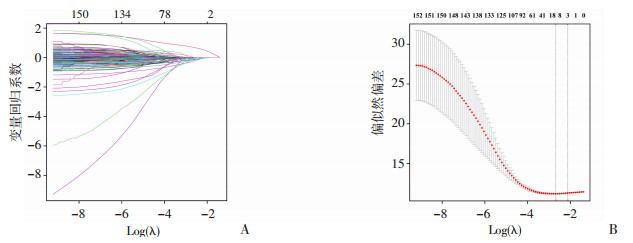
|
| A:回归系数收缩图每条线代表 1个特征变量;横坐标Log(λ)表示正则化系数λ的对数;纵坐标代表各变量特征在不同参数Log(λ)下的系数值;B:Lasso回归的5折交叉验证曲线纵坐标为偏似然偏差用于评估模型的拟合程度,并且帮助选择最佳的正则化参数;左侧虚线对应的参数为偏似然偏差最小值时λ值的对数,此处对应的最上方数值为保留的特征变量系数的个数 图 1 Lasso回归进行特征变量降维和选择过程图 |
观察Lasso回归保留的15个特征变量的基线情况(表 1),训练集和验证集基线时期变量除碱性磷酸酶外,组间均无明显差异,提示研究样本分组后数据均衡。
| 变量 | 训练集(n=345) | 测试集(n=136) | P值 |
| 随访期间结局事件 | 203(58.8) | 76(55.9) | 0.625 |
| 年龄/岁 | 80(73,86) | 79(73,83) | 0.227 |
| β受体阻滞剂 | 0.148 | ||
| 否 | 223(64.6) | 98(72.1) | |
| 是 | 122(35.4) | 38(27.9) | |
| 利尿剂 | 0.453 | ||
| 未服用 | 215(62.3) | 84(61.8) | |
| 袢利尿剂 | 102(29.6) | 45(33.1) | |
| 噻嗪类利尿剂 | 28(8.1) | 7(5.1) | |
| 心电图提示LVH | 0.854 | ||
| 无 | 323(93.6) | 126(92.6) | |
| 有 | 22(6.4) | 10(7.4) | |
| 心脏彩超提示左室增大 | 0.519 | ||
| 否 | 243(70.4) | 91(66.9) | |
| 是 | 102(29.6) | 45(33.1) | |
| 肺部感染 | 0.426 | ||
| 否 | 85(24.6) | 39(28.7) | |
| 是 | 260(75.4) | 97(71.3) | 0.426 |
| 中或重度贫血 | 0.470 | ||
| 否 | 295(85.5) | 112(82.4) | |
| 是 | 50(14.5) | 24(17.6) | |
| CIED | 0.856 | ||
| CRT | 4(1.16) | 2(1.47) | |
| DDD | 6(1.74) | 3(2.21) | |
| VVI | 4(1.16) | 0(0.00) | |
| 临时起搏器 | 8(2.32) | 3(2.21) | |
| 心脏射频消融术 | 0.358 | ||
| 否 | 342(99.1) | 133(97.8) | |
| 是 | 3(0.9) | 3(2.2) | |
| PLT/(109/L) | 170 (133,217) | 174(129,217) | 0.831 |
| Hct/% | 38.0(32.9,41.8) | 38.8(33.9,42.4) | 0.380 |
| P-LCR/% | 34.6(28.3,42.4) | 35.2(29.0,43.4) | 0.341 |
| AST/(U/L) | 26.6(20.7,37.0) | 26.2(20.2,33.3) | 0.389 |
| ALP/(U/L) | 89.0(71.0,111.0) | 82.5(68.2,96.2) | 0.011* |
| LVEF/% | 54(46,62) | 57(48,62) | 0.362 |
| *: 差异具有统计学意义;LVH:左心室肥厚(left ventricular hypertrophy);CRT:心脏再同步化治疗(cardiac resynchronization therapy);Hct:血细胞比容测定(hematocrit);P-LCR:大血小板比例(platelet large cell ratio) | |||
2.2 CoxPH模型构建与列线图绘制
模型根据AIC向后法纳入10个变量,包括:使用β受体阻滞剂、利尿剂情况,诊断肺部感染、中度或重度贫血,心电图左室肥厚、彩超左室增大表现,心脏植入式电子装置(cardiac implantable electronic device,CIED),血小板计数(platelet count,PLT),天冬氨酸氨基转移酶(aspartate aminotransferase,AST)和左室射血分数(left ventricular ejection fraction,LVEF)。其对应模型参数如表 2。此时的模型命名为模型1,计算其总C-index为0.720。为简化模型进一步选择最显著的4个变量(P < 0.01)拟合CoxPH模型命名为模型2,计算其总C-index为0.694。
| 变量 | 模型1 | 模型2 | ||||
| OR | SE | P值 | OR | SE | P值 | |
| β受体阻滞剂 | 0.77 | 0.16 | 0.104 | - | - | - |
| 利尿剂: | ||||||
| 袢利尿剂 | 0.55 | 0.18 | <0.001* | 0.48 | 0.18 | <0.001* |
| 噻嗪类利尿剂 | 0.65 | 0.26 | 0.098 | 0.70 | 0.25 | 0.160 |
| 心电图提示LVH | 0.43 | 0.41 | 0.037* | - | - | - |
| 心脏彩超提示左室增大 | 0.63 | 0.19 | 0.015* | - | - | - |
| 肺部感染 | 2.78 | 0.23 | <0.001* | 2.96 | 0.22 | <0.001* |
| 中或重度贫血 | 1.73 | 0.19 | 0.004* | 1.79 | 0.19 | 0.002* |
| CIED: | ||||||
| CRT | 1.17 | 0.75 | 0.837 | - | - | - |
| DDD | 0.88 | 0.51 | 0.799 | - | - | - |
| VVI | 0.33 | 0.60 | 0.063 | - | - | - |
| 临时起搏器 | <0.01 | 2 170 | 0.994 | - | - | - |
| PLT | 1.00 | <0.01 | 0.117 | - | - | - |
| AST | 1.00 | <0.01 | 0.231 | - | - | - |
| LVEF | 0.96 | 0.01 | <0.001* | 0.97 | 0.01 | <0.001* |
| *: 差异具有统计学意义 | ||||||
本研究结合上述4个预测变量构建模型绘制列线图(图 2)。通过读取每个预测因子的刻度值,并将其累加到总体预测得分上,可以在列线图上找到对应的总体预测概率。
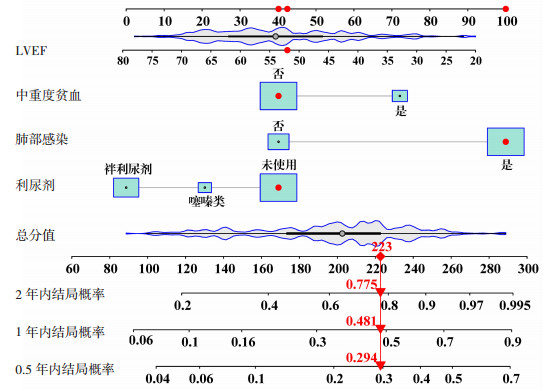
|
| 在实际使用时读取患者的临床诊疗资料中对应的模型协变量信息,根据图中所处点对应的单项分值计算模型总评分,评分越高表明临床结局事件发生的可能性越高 图 2 COPD合并HF患者0.5、1年和2年心衰恶化风险列线图 |
2.3 预测性能评价
基于测试集数据绘制模型2的校准曲线和ROC曲线(图 3),用以评价模型预测性能。在0.5、1、2年内,校准曲线预测值与实际值拟合情况较好,3个时间点AUC分别为0.699、0.742和0.662,即模型能够良好地预测测试集样本的结局事件。
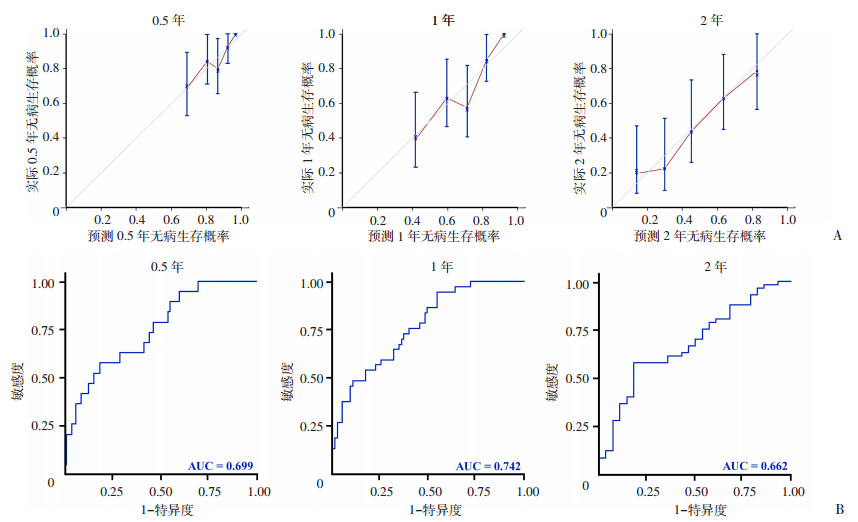
|
| A:不同时间点对应的模型校准曲线虚线表示理想的预测模型;红色实线表示观察到的模型;B:不同时间点对应的ROC曲线 图 3 不同时间模型预测的校准曲线和ROC曲线 |
2.4 模型效用评价
基于测试集样本绘制DCA曲线分析显示(图 4),本研究构建的预测模型分别在0.5、1、2年时在不同的风险阈值范围内表现出较高的临床效用。且在预测2年生存率时模型的净收益更高,根据DCA曲线的形态,当阈概率在0.3~0.8时,模型具有更高净临床效益。且通过对比模型1和2的净收益情况,发现精简后(保留4个变量)的模型性能并无明显减低。表明研究构建的预测模型2在该阈值范围内能够提供最佳的患者管理决策支持。
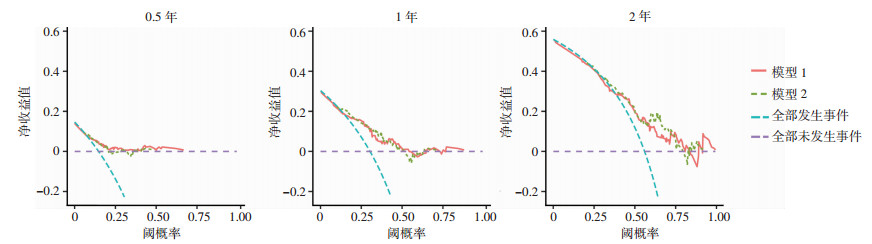
|
| 横轴为阈概率及风险概率的阈值;纵轴为应用模型产生的净收益值 图 4 不同时间节点的模型预测DCA曲线 |
进一步计算得到的列线图评分的截断值(Cut-off)为151分(保留整数位),根据截断值将患者分为高风险组(≥151分)和低风险组(< 151分),绘制2组间Kaplan-Meier曲线(图 5),直观展示不同组别间生存差异。Log-rank检验结果提示高、低风险组的生存率存在显著差异(P < 0.001)。表明本研究构建的模型能够有效地区分出不同风险组别,并对患者的生存预后(即不发生复合终点事件)进行准确预测。
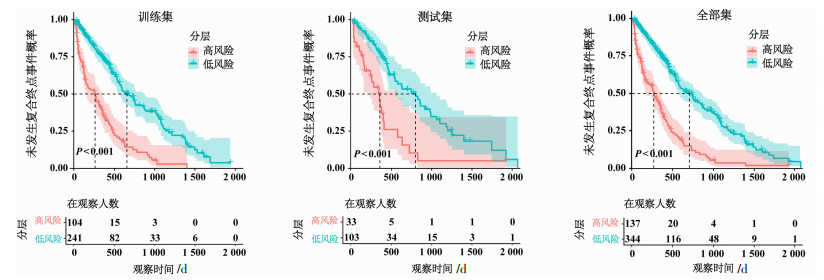
|
| 从左至右分别使用训练集、测试集及全部集作为样本基础;下方风险表含义为在对应时间点,仍然处于观察状态的个体数量(在观察人数) 图 5 高、低风险组患者Kaplan-Meier曲线 |
3 讨论
从流行病学的角度来看,COPD患者特别容易合并HF。事实上,中度COPD患者因心衰导致的死亡率高于因呼吸衰竭相关的死亡率。然而,在当前的临床研究背景下,积极治疗同时患有COPD和HF的患者是否能够带来真正的生存益处仍未得到明确的答案[10]。通过预测模型有效预测COPD合并HF患者心衰恶化的风险,并对相关风险因素进行积极干预,是当前医疗情况下有效的手段之一[5]。然而,这两种疾病通常具有重叠的症状和相似的临床进程,同时拥有相近的错综复杂的影响因素。目前并没有针对合并COPD和HF患者的、能够提供准确的预后信息的预测模型。本研究基于真实世界数据,根据临床实践中产生的常见诊疗资料,纳入大量预测变量,通过合理的统计学算法,建立了一个准确、方便的列线图预测模型。
模型最终保留的4个重要变量(LVEF、肺部感染、中重度贫血及利尿剂使用情况)具有良好的临床可解释性,且考虑应当被重点关注或干预。当前医疗背景下,HF被定义为一种临床综合征,其症状和体征由结构和功能性心脏异常引起,并由升高的BNP水平和(或)肺或全身充血的客观证据证实[11]。在心力衰竭的诊断和预测中,LVEF常被用来衡量心脏功能的受损程度和心衰的预后,且始终作为HF患者管理的基础[12]。肺部感染是心力衰竭和降低射血分数导致住院的常见原因,反复感染是导致再住院的重要原因[13]。与感染反应相关的急性全身炎症可直接抑制心肌功能,并改变氧需求和供应的微妙平衡[14],以及可能导致心肌的机械、电和血管舒缩功能障碍[3]。贫血在HF患者中常见,在病情稳定患者中约占30%[15]。贫血可增加心肌负荷以补偿组织氧输送减少并恶化不利的心脏重构,并且与更差的长期结局相关[16]。以上文献支持本研究中的相应的结果。此外,尽管利尿剂在抗心衰治疗中并非基石药物,但在临床实践中,利尿剂被广泛用于减轻液体潴留和心脏负荷,以改善心衰症状[17],在COPD和心力衰竭合并症的管理中利尿剂也是常用的药物之一[18]。在本研究中,基线时期未使用利尿剂者对应的心衰恶化风险更高,分析其原因,还可能因为出现全心衰竭后,相应的左心、右心衰竭症状反而减轻。即在这些未使用利尿剂的患者中,可能存在全心衰竭患者,因而其预后相对更差。提示临床医生在评估心力衰竭情况以及考虑利尿剂使用时不应忽略这种情况。
本研究也发现了一个矛盾结果。已知LVH的发展与左心室舒张功能障碍相关,而持续或进展的舒张功能障碍是老年人HF的危险因素[19]。用左心室质量指数升高所证实的LVH,与COPD患者死亡风险显著增加相关[20]。本研究中心电图上LVH表现,是COPD合并HF心衰恶化的保护因素,这与以往的观点不符。分析原因可能在于:①COPD患者LVH可能是一种代偿或适应性机制[21],相比于发生扩张型心室重构的HF患者,LVH可能预示着左心功能储备相对更好。②心电图作为一种测量方法,其检测LVH的敏感性低于超声心动图,因此可能会导致心电图上显示的LVH与实际情况不一致。
在评价模型预测性能结果中,校准曲线显示本研究所构建的列线图预测在0.5、1、2年总生存率(未发生复合终点事件率)与实际值相当一致。DCA曲线显示模型即便简化为只有4个预测变量仍然具有优异的临床使用获益。最后根据模型评分截断值分组,进行了模型应用,结果提示模型可以良好地区分训练集、验证集或全部数据集样本的结局风险。但研究仍存在一定的局限性:数据来源于单中心,模型采用内部验证,样本量小,有必要扩大样本量并采取外部验证进一步优化模型。由于基线时期的肺功能指标存在较多缺失值,相应特征变量没有被用于模型开发。本研究删除了变量信息缺失超过20%以上的患者,可能会对研究结果产生影响,如删除缺失数据较多的患者可能导致样本的选择偏倚,导致研究结果的外部有效性受到限制;删除缺失数据较多的患者可能导致对研究结果的偏误,造成模型变量与结局关联程度的错误估计。此外,CoxPH模型在时间上假设风险呈等比例变化,但实际世界中风险往往不满足这个假设,需考虑进一步开发基于随机生存森林或XGBoost算法的生存模型。
综上所述,本研究构建了用以预测COPD合并HF患者心衰恶化风险的模型,该模型在不同观测时间点上表现出良好的预测准确性,且在临床上合理的风险阈值范围内应用本模型可能产生正的净收益,可为临床医师提供有益的指导。
| [1] |
VOGELMEIER C F, CRINER G J, MARTINEZ F J, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 report. GOLD executive summary[J]. Am J Respir Crit Care Med, 2017, 195(5): 557-582. |
| [2] |
BERNOCCHI P, VITACCA M, LA ROVERE M T, et al. Home-based telerehabilitation in older patients with chronic obstructive pulmonary disease and heart failure: a randomised controlled trial[J]. Age Ageing, 2018, 47(1): 82-88. |
| [3] |
LAGAN J, SCHELBERT E B, NAISH J H, et al. Mechanisms underlying the association of chronic obstructive pulmonary disease with HeartFailure[J]. JACC Cardiovasc Imaging, 2021, 14(10): 1963-1973. |
| [4] |
XU S, YE Z, MA J, et al. The impact of chronic obstructive pulmonary disease on hospitalization and mortality in patients with heart failure[J]. Eur J Clin Invest, 2021, 51(1): e13402. |
| [5] |
KALHAN R, MUTHARASAN R K. Reducing readmissions in patients with both heart failure and COPD[J]. Chest, 2018, 154(5): 1230-1238. |
| [6] |
RILEY R D, ENSOR J, SNELL K I E, et al. Calculating the sample size required for developing a clinical prediction model[J]. BMJ, 2020, 368: m441. |
| [7] |
SHEN L, JHUND P S, ANAND I S, et al. Developing and validating models to predict sudden death and pump failure death in patients with heart failure and preserved ejection fraction[J]. Clin Res Cardiol, 2021, 110(8): 1234-1248. |
| [8] |
BHAMBHANI V, KIZER J R, LIMA J A C, et al. Predictors and outcomes of heart failure with mid-range ejection fraction[J]. Eur J Heart Fail, 2018, 20(4): 651-659. |
| [9] |
LUND L H, CLAGGETT B, LIU J K, et al. Heart failure with mid-range ejection fraction in CHARM: characteristics, outcomes and effect of candesartan across the entire ejection fraction spectrum[J]. Eur J Heart Fail, 2018, 20(8): 1230-1239. |
| [10] |
ANDRÉ S, CONDE B, FRAGOSO E, et al. COPD and cardiovascular disease[J]. Pulmonology, 2019, 25(3): 168-176. |
| [11] |
BOZKURT B, COATS A J S, TSUTSUI H, et al. Universal definition and classification of heart failure: a report of the Heart Failure Society of America, Heart Failure Association of the European Society of Cardiology, Japanese Heart Failure Society and Writing Committee of the Universal Definition of Heart Failure[J]. Eur J Heart Fail, 2021, 23(3): 352-380. |
| [12] |
CIKES M, SOLOMON S D. Walking the line between failure and remission[J]. JACC Heart Fail, 2022, 10(1): 38-40. |
| [13] |
DROZD M, GARLAND E, WALKER A M N, et al. Infection-related hospitalization in heart failure with reduced ejection fraction: a prospective observational cohort study[J]. Circ Heart Fail, 2020, 13(5): e006746. |
| [14] |
ALON D, STEIN G Y, KORENFELD R, et al. Predictors and outcomes of infection-related hospital admissions of heart failure patients[J]. PLoS One, 2013, 8(8): e72476. |
| [15] |
ANAND I S, GUPTA P. Anemia and iron deficiency in heart failure: current concepts and emerging therapies[J]. Circulation, 2018, 138(1): 80-98. |
| [16] |
ANAND I, GUPTA P. How I treat anemia in heart failure[J]. Blood, 2020, 136(7): 790-800. |
| [17] |
TSUTSUI H. Recent advances in the pharmacological therapy of chronic heart failure: evidence and guidelines[J]. Pharmacol Ther, 2022, 238: 108185. |
| [18] |
CANEPA M, FRANSSEN F M E, OLSCHEWSKI H, et al. Diagnostic and therapeutic gaps in patients with heart failure and chronic obstructive pulmonary disease[J]. JACC Heart Fail, 2019, 7(10): 823-833. |
| [19] |
VAN OMMEN A M L N, CANTO E D, CRAMER M J, et al. Diastolic dysfunction and sex-specific progression to HFpEF: current gaps in knowledge and future directions[J]. BMC Med, 2022, 20(1): 496. |
| [20] |
SHORT P M, ANDERSON W J, ELDER D H, et al. Impact of left ventricular hypertrophy on survival in chronic obstructive pulmonary disease[J]. Lung, 2015, 193(4): 487-495. |
| [21] |
HEUBEL A D, ROSCANI M G, KABBACH E Z, et al. Left ventricular geometry in copd patients: are there associations with airflow limitation, functional capacity, and grip strength?[J]. J Cardiopulm Rehabil Prev, 2020, 40(5): 341-344. |




