糖异生是将非糖化合物转变为葡萄糖或糖原的过程,是机体内源性葡萄糖的主要来源,对维持血糖平衡有着重要作用。越来越多的研究证实,除了肝脏,在饥饿或糖尿病状态下,小肠能利用谷氨酰胺、甘油合成葡萄糖,如链脲佐菌素(streptozotocin, STZ)诱导的糖尿病小鼠处于饥饿状态时,小肠组织的葡萄糖-6-磷酸酶(glucose-6-phosphatase, catalytic, G6PC)基因表达可上调6~8倍[1]。肠上皮细胞通过糖异生产生的葡萄糖,通过门静脉的葡萄糖感受器,将信号经迷走神经传入并激活下丘脑相应功能区域,抑制食欲,减少肝脏糖异生,提高肝脏对胰岛素的敏感性[2]。近年研究发现肠道菌群可通过影响宿主肠道基因表达[3],以及肠道代谢物水平[4],调控肠道糖异生,从而影响宿主糖代谢稳态。
固醇调节元件结合蛋白1c(sterol regulatory element binding protein 1c, SREBP1c)是细胞内脂质合成代谢的关键调控基因。FOXO1是糖异生途径限速酶磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase 1, PCK1)和G6PC的重要转录调控因子之一 [5],有研究发现SREBP1c-CRY1可通过促进FOXO1降解,从而抑制肝脏内葡萄糖生成[6]。此外,在原代肝细胞中,过表达SREBP1c可导致PCK1的转录缺失 [7]。鉴于SREBP1c在肝脏糖异生中的调控作用,课题组在之前的研究中还发现SREBP1c基因缺失可影响小鼠肠道菌群组成 [8],而肠道菌群已被发现参与机体的糖脂代谢调控 [9],因此,本研究拟通过对C57BL/6小鼠和SREBP1c基因缺失小鼠进行饥饿处理,分析SREBP1c与肠道糖异生的关系;同时还通过在肠上皮细胞CaCo-2中过表达或敲低SREBP1c的表达,初步探索SREBP1c在肠道糖异生中的调控作用。
1 材料与方法 1.1 实验小鼠与鉴定C57BL/6雄性小鼠(n=10)购买于江苏集萃药康生物科技有限公司,8~9周龄,体质量19.0~22.0 g。SREBP1c杂合缺失型小鼠(SREBP1c+/-)受赠于重庆医科大学第二附属医院杨刚毅教授 [10]。小鼠饲养于SPF级动物房,动物房温度25 ℃,湿度40%~60%,12 h昼夜更替。SREBP1c+/-小鼠通过杂交后获得SREBP1c野生型(SREBP1c+/+, SREBP1c-WT)、杂合型(SREBP1c+/-, SREBP1c-Het)和纯合敲除型(SREBP1c-/-, SREBP1c-KO),小鼠基因鉴定参考课题组之前的研究 [8]。
1.2 小鼠饥饿处理与组织样本收集8~9周龄的C57BL/6雄性小鼠适应性喂养1周,匹配体质量后分为2组,对照组和饥饿处理组,每组各5只。对照组正常进食,饥饿组禁食处理48 h。11~12周龄的SREBP1c-KO和同窝SREBP1c-WT雄鼠各5只,饥饿处理48 h。各组小鼠处理结束后,行安乐死,收集血清、肝脏及小肠组织,于液氮中速冻后再冻存于-80 ℃冰箱,用于后续实验。
本研究经陆军军医大学实验动物福利伦理审理委员会审核,符合动物伦理和动物福利要求(AMUWEC 20211425)。
1.3 细胞培养肠癌细胞Caco-2(# CL0050)购自武汉普诺赛生命科技有限公司,用含10%胎牛血清(FBS,LONSERA, # S711-001S)、1%青霉素-链霉素(Hyclone,# SV30010)的MEM(上海源培生物科技有限公司,# L550JK)完全培养基,培养于37 ℃、5% CO2的培养箱内。
细胞处理:Caco-2细胞铺于6孔板中,饥饿处理(1%、2%FBS)24 h后,直接收集细胞,提取总RNA和蛋白;或转染SREBP1c过表达质粒或干扰片段24 h后,再饥饿处理(1%FBS)24 h,收集细胞,提取总RNA和蛋白。
1.4 载体构建与转染PCR扩增SREBP1c基因编码区3 534 bp(NM_001005291),并通过核酸内切酶酶切位点AscI和MluI克隆到过表达载体pENTER(山东维真生物科技有限公司,# CH800593)。构建的过表达载体pENTER-SREBP1c通过酶切、核酸电泳筛选阳性克隆后,再采用Sanger测序鉴定。SREBP1c干扰片段购自广州锐博生物技术有限公司,片段1:5′-CCACTCCATTGAA-GATGTA-3′;片段2:5′-CGGAGAAGCTGCCTATCAA-3′;片段3:5′-CAGCCCTGGTCTACCATAA-3′。利用试剂Lipofectamin 3000(Thermo Fisher Scientific, # 2533476)和RNAiMAX(Thermo Fisher Scientific, # 2320815)分别转染过表达质粒和siRNA片段。
1.5 荧光定量PCR检测组织与细胞RNA提取采用RNAiso Plus试剂(TaKaRa, # 9109),RNA逆转录为cDNA(PrimeScriptTM RT reagent Kit,TaKaRa, # RR047A)后,采用荧光定量PCR(TB Green Premix Ex Taq, TaKaRa, # RR820A)检测靶基因表达量,检测基因表达的引物序列见表 1。
| 基因 | 引物序列(5′→3′) |
| m-SREBP1c | 上游:CACTTCTGGAGACATCGCAAAC |
| 下游:ATGGTAGACAACAGCCGCATC | |
| m-G6PC | 上游:GCGCTTGGATTCTACCTGCT |
| 下游:GAGGCTGGCAAAGGGTGTAG | |
| m-PCK1 | 上游:GGGTGGAAGGTCGAATGTGT |
| 下游:TCTTCACTGAGGTGCCAGGA | |
| m-GAPDH | 上游:TGAACGGGAAGCTCACTG |
| 下游:TCCACCACCCTGTTGCTG | |
| h-SREBP1c | 上游:CAGGACAGGCAGAGGAAGAC |
| 下游:TGAGGACAGCAAGGCAAAG | |
| h-G6PC | 上游:AGCGTCCATACTGGTGGGTTT |
| 下游:GGTCGGCTTTATCTTTCCCTG | |
| h-PCK1 | 上游:TTGAGAAAGCGTTCAATGCCA |
| 下游:GATGACGTACATGGTGCGAC | |
| h-GAPDH | 上游:CTCCTCCTGTTCGACAGTCAGC |
| 下游:CCCAATACGACCAAATCCGTT |
1.6 Western blot检测
Caco-2细胞处理结束后,使用裂解液RIPA(上海碧云天生物技术有限公司,# P0013B)于冰上裂解细胞,BCA法测定蛋白浓度。用于Western blot的一抗信息如下:anti-G6PC(Proteintech,# 66860-1-Ig,1∶1 000),anti-PCK1(abcam,# ab28455,1∶1 000);anti-SREBP1(Santa Cruz,# sc-365513,1∶1 000)。
1.7 细胞内葡萄糖水平检测Caco-2细胞转染SREBP1c过表达质粒或siRNA 24 h后,再饥饿处理(1%FBS)24 h,细胞内葡萄糖含量检测采用氧化酶法测定试剂盒(北京普利莱基因技术有限公司,# E1011)。利用标准曲线计算裂解液中葡萄糖摩尔浓度,并以每克蛋白浓度校正葡萄糖含量。
1.8 统计学分析采用SPSS 16.0软件进行统计分析,计量资料以x±s表示,2组比较采用Student’s t检验,P<0.05为差异有统计学意义。
2 结果 2.1 饥饿状态下,小鼠肠道糖异生增加,小肠中SREBP1c的表达水平增加为了检测小鼠糖异生水平,将9~10周龄的C57BL/6雄性小鼠禁食48 h,检测小鼠肝脏糖异生途径关键基因表达变化。如图 1A所示,与对照组相比,饥饿处理组小鼠肝脏中糖异生途径关键限速酶G6PC和PCK1表达水平明显上调,而SREBP1c表达显著降低(P<0.01)。与此同时,饥饿组小鼠空肠组织中G6PC和PCK1基因mRNA表达水平显著上调(P<0.01,图 1B),其蛋白表达量也明显增加(图 1C),回肠组织中也观察到相似结果(图 1D、E)。与肝脏组织中不同的是,空肠、回肠组织中SREBP1c的mRNA和蛋白表达水平明显增加(P<0.05,图 1B~E),与糖异生水平变化趋势一致,表明饥饿状态下,SREBP1c表达水平可能和肠道糖异生调控有关。

|
|
a:P<0.05,b:P<0.01,c:P<0.001,与对照组比较 A:饥饿处理组和对照组小鼠肝脏组织中糖异生调控基因G6PC、PCK1和SREBP1c表达水平检测;B、C:小鼠空肠组织中G6PC、PCK1和SREBP1c的mRNA和蛋白表达水平检测;D、E:小鼠回肠组织中G6PC、PCK1和SREBP1c的mRNA和蛋白表达水平检测 图 1 饥饿处理诱导小鼠肝脏和肠道糖异生增加(n=5,x±s) |
2.2 敲除基因SREBP1c可抑制小鼠肠道糖异生途径关键酶的表达
如图 2A、B所示,SREBP1c+/-小鼠通过配对繁殖获得SREBP1c野生型和纯合敲除型,即SREBP1c-WT和SREBP1c-KO。在常规饮食喂养下,SREBP1c-KO小鼠的体质量、空腹血糖与同窝野生型小鼠无明显差异(图 2C、D)。为了检测SREBP1c敲除后对小鼠肠道糖异生水平的影响,将11~12周龄的SREBP1c-WT和SREBP1c-KO雄性小鼠禁食48 h,检测小鼠肠道中糖异生途径关键限速酶的表达变化。如图 2E~H所示,与野生型小鼠相比,SREBP1c-KO组小鼠小肠组织中SREBP1c的mRNA和蛋白表达水平显著降低;与此一致的是,空肠、回肠中糖异生关键调控基因G6PC和PCK1 mRNA表达水平显著降低(P<0.05),其蛋白表达量也明显减少,表明敲除SREBP1c基因可抑制小鼠肠道糖异生。以上结果表明,SREBP1c可能参与肠道糖异生的调控。

|
|
a:P<0.05,b:P<0.01,c:P<0.001,与SREBP1c-WT组比较 A:小鼠鉴定电泳图M:DNA marker;1~3:SREBP1c-WT小鼠基因组DNA扩增产物电泳条带(530 bp);4~6:SREBP1c-Het小鼠基因组DNA扩增产物电泳条带(530、170 bp);7~9:SREBP1c-KO小鼠基因组DNA扩增产物电泳条带(170 bp);B:SREBP1c-WT和SREBP1c-KO 2组小鼠肝脏中SREBP1c表达水平检测;C:2组小鼠体质量比较;D:2组小鼠过夜饥饿(12 h)后的空腹血糖比较;E、F:饥饿处理48 h后,2组小鼠空肠组织中SREBP1c、G6PC和PCK1表达水平检测;G、H:饥饿处理后,2组小鼠回肠组织中SREBP1c、G6PC和PCK1表达水平检测 图 2 敲除基因SREBP1c可抑制小鼠肠道糖异生关键酶的表达(n=5, x±s) |
2.3 过表达SREBP1c可上调糖异生关键酶的表达,促进细胞内葡萄糖的产生
为了在体外细胞模型中检测SREBP1c对肠道糖异生的调控作用,首先饥饿处理肠上皮细胞CaCo-2。结果显示,饥饿处理48 h后,CaCo-2细胞中糖异生关键酶G6PC和PCK1,以及SREBP1c表达均显著增加(P<0.05,图 3A、B)。利用过表达质粒pENTER-SREBP1c转染CaCo-2细胞24 h后,再饥饿处理24 h,收集细胞检测各目的基因表达水平。如图 3C、D所示,过表达SREBP1c后,CaCo-2细胞中糖异生关键酶G6PC和PCK1表达均显著上调(P<0.05),同时细胞内葡萄糖含量也明显增加(P<0.05,图 3E),表明饥饿状态下,过表达SREBP1c可促进肠上皮细胞的糖异生水平。
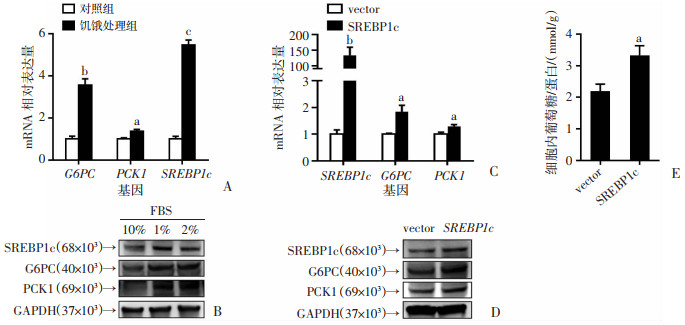
|
|
a:P<0.05,b:P<0.01,c:P<0.001,与对照组或vector组比较 A、B:饥饿处理CaCo-2后,细胞内糖异生调控基因及SREBP1c表达水平检测;C、D:细胞CaCo-2过表达SREBP1c后,饥饿诱导下糖异生调控基因表达水平检测vector:空载体;E:细胞CaCo-2过表达SREBP1c后,饥饿诱导下细胞内葡萄糖含量检测 图 3 过表达SREBP1c可促进肠上皮细胞内的糖异生水平(n=3, x±s) |
2.4 敲低Caco-2细胞中SREBP1c的表达可下调糖异生关键酶表达水平,减少细胞内葡萄糖的产生
CaCo-2细胞转染靶向基因SREBP1c合成的3条siRNA片段,24 h后收集细胞,检测SREBP1c表达水平。如图 4A所示,3号干扰片段敲低效率最高,因此后续实验均采用3号干扰片段。CaCo-2细胞转染si-SREBP1c 24 h后,再饥饿处理24 h,收集细胞检测各目的基因表达水平。结果显示,敲低SREBP1c,CaCo-2细胞中糖异生关键酶G6PC和PCK1表达均显著下调(P<0.05,图 4B、C),同时细胞内葡萄糖含量也明显降低(P<0.01,图 4D),表明饥饿状态下,敲低SREBP1c可抑制肠上皮细胞的糖异生。以上结果表明,SREBP1c参与肠道上皮细胞的糖异生调控。
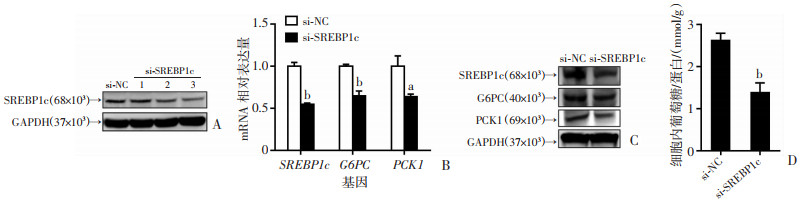
|
|
a:P<0.05,b:P<0.01,与si-NC组比较 A:SREBP1c干扰片段的敲低效率检测;B、C:细胞CaCo-2敲低SREBP1c后,饥饿诱导下糖异生调控基因表达水平检测;D:细胞CaCo-2敲低SREBP1c后,饥饿诱导下细胞内葡萄糖含量检测 图 4 敲低SREBP1c可抑制肠上皮细胞内的糖异生水平(n=3, x±s) |
3 讨论
糖异生主要用于维持血糖稳定,满足组织、细胞对葡萄糖的需求 [11]。在禁食前期(6~24 h),内源性葡萄糖生成主要来源于肝脏,肠道和肾脏生成的葡萄糖占比很少,对平衡血糖的贡献作用不大 [12];但在长期禁食状态下,肝脏糖异生作用逐渐减弱,肠道和肾脏糖异生作用逐渐增强,对机体血糖调节有着非常重要的作用 [12-13]。与肾脏糖异生不同的是,小肠产生的葡萄糖释放到门静脉不仅参与维持长时间禁食的血糖平衡,还可通过门静脉感受器传导中枢信号,抑制肝脏糖异生,提高肝脏的胰岛素敏感性,改善机体的糖稳态[14]。
有研究发现,通过重组腺病毒在STZ诱导的糖尿病小鼠肝脏中过表达SREBP1c,可诱导葡萄糖激酶、脂肪生成酶基因的表达,并抑制PCK1表达,以致糖尿病小鼠血糖降低 [15]。在小鼠原代肝细胞中过表达SREBP1c,可促进FOXO1的泛素化降解,抑制G6PC和PCK1表达,从而减少肝细胞内糖异生,以改善糖尿病小鼠的糖稳态 [6]。总而言之,在肝细胞中,SREBP1c可能直接抑制糖异生关键酶PCK1的转录表达,也可能通过CRY1-FOXO1信号轴抑制G6PC和PCK1的表达,从而抑制肝糖异生。本研究报道了SREBP1c参与肠道糖异生的调控:饥饿状态下,过表达SREBP1c可促进肠上皮细胞内葡萄糖的生成,这与其在肝细胞中对糖异生的调控作用相反。课题组在之前的研究中发现,相较于野生型小鼠,SREBP1c-KO小鼠肠道的厚壁菌门(Firmicutes)与拟杆菌门(Bacteroidetes)比值上升,理研菌属(Rikenella)相对丰度显著减少[8]。据报道,厚壁菌门和拟杆菌门可发酵膳食纤维产生短链脂肪酸(short chain fatty acids, SCFAs)[16],而理研菌属也是SCFAs产生菌[17]。SCFAs可促进肠道糖异生,通过肠-脑轴途径抑制肝脏内源性葡萄糖产生,改善小鼠糖耐量和胰岛素抵抗[18]。因此,我们推测肠道中SREBP1c的表达变化,可能通过影响肠道菌群组成及其代谢物水平,从而调控肠道糖异生,这也可能是SREBP1c在肠道与肝脏中作用的不同之处。另一方面,SREBP1c作为转录因子,也可能通过转录调控直接影响肠道中糖异生途径相关基因的表达。因此,在后续的研究中,可考虑利用肠特异性敲除SREBP1c的小鼠模型,结合代谢组检测与转录组检测,深入探索SREBP1c调控肠道糖异生的具体分子机制。
饥饿处理时,肝脏中SREBP1c的表达水平明显降低。有研究显示,C57BL/6小鼠饥饿24 h后再进食,肝脏中SREBP1c的表达水平明显增加;用胰岛素处理小鼠原代肝细胞,细胞中SREBP1c表达也显著增加,表明肝细胞中SREBP1c的表达可能受胰岛素调控[6]。在饥饿时,空肠、回肠中SREBP1c的表达却升高,表明肠道中SREBP1c的表达可能受其他因素的调控,比如肠道菌群或其衍生代谢物(如丙酸盐)[19]。此外,肠道菌群组成变化也能影响SREBP1c的表达。抗生素处理高脂喂养小鼠,导致肝脏中SREBP1c表达降低,脂合成减少[20]。然而,无菌(germ-free, GF)小鼠接受菌群移植后,肝脏中SREBP1c表达增加,促进肝脏中脂质沉积 [21]。由此说明,肠道菌群与SREBP1c的表达可能存在相互影响的关系,而肠道菌群和SREBP1c可能都参与肠道糖异生的调控,其具体调控关系与机制,值得进一步深入探索。
此外,SREBP1c-KO与SREBP1c-WT小鼠的空腹血糖没有显著差异,其原因可能包括:①检测小鼠空腹血糖时,采取的是过夜禁食,时长大约12 h,而检测SREBP1c缺失对小鼠肠道糖异生的影响时,采取的是48 h饥饿处理;②在本研究中,实验小鼠除了饥饿处理外,并未构建病理模型,比如STZ诱导糖尿病,或高脂喂养(high fat diet, HFD)诱导糖脂代谢紊乱。因此,在后续研究中,可考虑构建STZ小鼠或HFD小鼠,结合特异性敲除肠上皮细胞中SREBP1c,深入探索SREBP1c通过调控肠道糖异生对机体糖稳态的影响,探讨其成为糖代谢紊乱干预靶点的可能性。
综上所述,饥饿状态下,SREBP1c可调控肠上皮细胞中糖异生限速酶G6PC和PCK1的表达,进而影响葡萄糖的生成,表明SREBP1c可能参与肠道糖异生的调控,具体机制有待进一步探索。
| [1] |
MITHIEUX G, BADY I, GAUTIER A, et al. Induction of control genes in intestinal gluconeogenesis is sequential during fasting and maximal in diabetes[J]. Am J Physiol Endocrinol Metab, 2004, 286(3): E370-E375. |
| [2] |
SOTY M, GAUTIER-STEIN A, RAJAS F, et al. Gut-brain glucose signaling in energy homeostasis[J]. Cell Metab, 2017, 25(6): 1231-1242. |
| [3] |
PLAZA-DÍAZ J, ROBLES-SÁNCHEZ C, ABADÍA-MOLINA F, et al. Gene expression profiling in the intestinal mucosa of obese rats administered probiotic bacteria[J]. Sci Data, 2017, 4: 170186. |
| [4] |
LIAO X Y, SONG L Y, ZENG B H, et al. Alteration of gut microbiota induced by DPP-4i treatment improves glucose homeostasis[J]. EBioMedicine, 2019, 44: 665-674. |
| [5] |
MOUCHIROUD L, EICHNER L J, SHAW R J, et al. Transcriptional coregulators: fine-tuning metabolism[J]. Cell Metab, 2014, 20(1): 26-40. |
| [6] |
JANG H, LEE G Y, SELBY C P, et al. SREBP1c-CRY1 signalling represses hepatic glucose production by promoting FOXO1 degradation during refeeding[J]. Nat Commun, 2016, 7: 12180. |
| [7] |
CHAKRAVARTY K, LEAHY P, BECARD D, et al. Sterol regulatory element-binding protein-1c mimics the negative effect of insulin on phosphoenolpyruvate carboxykinase (GTP) gene transcription[J]. J Biol Chem, 2001, 276(37): 34816-34823. |
| [8] |
刘冰瑶, 杨航, 郑宏庭, 等. SREBP1c缺失对小鼠肠道菌群的影响[J]. 陆军军医大学学报, 2022, 44(23): 2384-2391. LIU B Y, YANG H, ZHENG H T, et al. Effects of sterol regulatory element binding protein 1c deficiency on gut microbial composition in mice[J]. J Army Med Univ, 2022, 44(23): 2384-2391. |
| [9] |
ZHAO L P, ZHANG F, DING X Y, et al. Gut bacteria selectively promoted by dietary fibers alleviate type 2 diabetes[J]. Science, 2018, 359(6380): 1151-1156. |
| [10] |
WEI Q, ZHOU B Y, YANG G Y, et al. JAZF1 ameliorates age and diet-associated hepatic steatosis through SREBP-1c-dependent mechanism[J]. Cell Death Dis, 2018, 9(9): 859. |
| [11] |
ZHANG X P, YANG S S, CHEN J L, et al. Unraveling the regulation of hepatic gluconeogenesis[J]. Front Endocrinol (Lausanne), 2019, 9: 802. |
| [12] |
MUTEL E, GAUTIER-STEIN A, ABDUL-WAHED A, et al. Control of blood glucose in the absence of hepatic glucose production during prolonged fasting in mice: induction of renal and intestinal gluconeogenesis by glucagon[J]. Diabetes, 2011, 60(12): 3121-3131. |
| [13] |
GAUTIER-STEIN A, MITHIEUX G. Intestinal gluconeogenesis: metabolic benefits make sense in the light of evolution[J]. Nat Rev Gastroenterol Hepatol, 2023, 20(3): 183-194. |
| [14] |
PENHOAT A, FAYARD L, STEFANUTTI A, et al. Intestinal gluconeogenesis is crucial to maintain a physiological fasting glycemia in the absence of hepatic glucose production in mice[J]. Metabolism, 2014, 63(1): 104-111. |
| [15] |
BÉCARD D, HAINAULT I, AZZOUT-MARNICHE D, et al. Adenovirus-mediated overexpression of sterol regulatory element binding protein-1c mimics insulin effects on hepatic gene expression and glucose homeostasis in diabetic mice[J]. Diabetes, 2001, 50(11): 2425-2430. |
| [16] |
FAN Y, PEDERSEN O. Gut microbiota in human metabolic health and disease[J]. Nat Rev Microbiol, 2021, 19(1): 55-71. |
| [17] |
SHI H J, CHANG Y G, GAO Y, et al. Dietary fucoidan of Acaudina molpadioides alters gut microbiota and mitigates intestinal mucosal injury induced by cyclophosphamide[J]. Food Funct, 2017, 8(9): 3383-3393. |
| [18] |
VADDER F D, KOVATCHEVA-DATCHARY P, GONCALVES D, et al. Microbiota-generated metabolites promote metabolic benefits via gut-brain neural circuits[J]. Cell, 2014, 156(1/2): 84-96. |
| [19] |
HUANG J F, ZHAO Q, DAI M Y, et al. Gut microbiota protects from triptolide-induced hepatotoxicity: key role of propionate and its downstream signalling events[J]. Pharmacol Res, 2020, 155: 104752. |
| [20] |
JIANG C T, XIE C, LI F, et al. Intestinal farnesoid X receptor signaling promotes nonalcoholic fatty liver disease[J]. J Clin Invest, 2015, 125(1): 386-402. |
| [21] |
BÄCKHED F, DING H, WANG T, et al. The gut microbiota as an environmental factor that regulates fat storage[J]. Proc Natl Acad Sci USA, 2004, 101(44): 15718-15723. |




